
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
BORTEZOMIB ARROW contient la substance active bortézomib, aussi appelé « inhibiteur du protéasome ». Les protéasomes jouent un rôle important en contrôlant le fonctionnement et la croissance cellulaire. En interagissant avec leur fonction, le bortézomib peut tuer les cellules cancéreuses.
BORTEZOMIB ARROW est utilisé pour le traitement du myélome multiple (un cancer de la moelle osseuse) chez les patients âgés de plus de 18 ans :
· seul ou en association à la doxorubicine liposomale pégylée ou à la dexaméthasone chez les patients dont la maladie s’aggrave (progression) après avoir reçu au moins un traitement antérieur et chez qui une greffe de cellules souches du sang n’a pas réussi ou n’est pas indiquée ;
· en association au melphalan et à la prednisone, chez les patients dont la maladie n’a pas été traitée au préalable et n’étant pas candidats à une chimiothérapie intensive accompagnée d’une greffe de cellules souches du sang ;
· en association à la dexaméthasone ou à la dexaméthasone associée au thalidomide, chez les patients dont la maladie n’a pas été traitée au préalable avant de recevoir une chimiothérapie intensive accompagnée d’une greffe de cellules souches du sang (traitement d’induction).
BORTEZOMIB ARROW est utilisé pour le traitement du lymphome à cellules du manteau (un type de cancer affectant les ganglions lymphatiques), en association au rituximab, cyclophosphamide, doxorubicine et prednisone, chez les patients âgés de 18 ans ou plus pour lesquels la maladie n’a pas été traitée au préalable et pour qui une greffe de cellules souches du sang est inadaptée.
Ce médicament appartient au(x) groupe(s) générique(s) suivants :
 Poudre (Composition pour un flacon)
Poudre (Composition pour un flacon)
 3,5 mg
3,5 mg
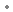 sous forme de : ester boronique de mannitol
sous forme de : ester boronique de mannitol Ce médicament étant un générique, le SMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |