
ANSM - Mis à jour le : 20/03/2023
DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution
Dorzolamide/timolol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution ?
3. Comment prendre DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution ?
6. Contenu de l’emballage et autres informations.

Dorzolamide/Timolol Viatris contient deux médicaments : dorzolamide et timolol.
· Le dorzolamide appartient à une classe de médicaments appelés « inhibiteurs de l'anhydrase carbonique ».
· Le timolol appartient à une classe de médicaments appelés « bêta-bloquants ».
Ces médicaments diminuent la pression oculaire par des mécanismes d’action différents.
Dorzolamide/Timolol Viatris est prescrit pour faire baisser la pression intra-oculaire élevée (PIO) chez les patients présentant un glaucome lorsqu'un collyre bêta- bloquant administré seul est insuffisant.

N’utilisez pas DORZOLAMIDE/TIMOLOL VIATRIS :
· si vous êtes allergique au dorzolamide, au timolol, ou à l’un des autres composants de ce médicament mentionnés dans la rubrique 6 ;
· si vous avez maintenant ou ou avez eu dans le passé des problèmes respiratoires tels que l’asthme ou une bronchite chronique obstructive sévère (, maladie sévère des poumons pouvant entraîner des sifflements, une difficulté à respirer et/ou une toux persistante) ;
· si vous avez un rythme cardiaque lent, une insuffisance cardiaque ou des troubles du rythme cardiaque (battements du cœur irréguliers) ;
· si vous avez une maladie rénale sévère ou des antécédents de calculs rénaux ;
· si vous avez une acidité sanguine élevée, causée par une accumulation de chlorure dans le sang (acidose hyperchlorémique).
Si vous n'êtes pas sûr de pouvoir utiliser ce médicament, contactez votre médecin ou votre pharmacien.
Avertissements et précautions :
Adressez-vous à votre médecin ou votre pharmacien avant d’utiliser Dorzolamide/Timolol Viatris si vous avez :
· une maladie coronarienne (les symptômes peuvent inclure douleur ou oppression thoracique, essoufflement, suffocation), insuffisance cardiaque, hypotension artérielle ;
· troubles du rythme cardiaque tels qu’un ralentissement des battements du cœur,
· problèmes de respiration, asthme ou maladie pulmonaire chronique obstructive,
· troublesde la circulation sanguine, tels qu’une maladie de Raynaud ou un syndrome de Raynaud ;
· un diabète ou une hypoglycémie (faible quantité de sucre dans le sang), car le timolol peut masquer les signes et symptômes d’une hypoglycémie ;
· une hyperactivité de la thyroïde, car le timolol peut en masquer les signes et symptômes ;
Informez votre médecin avant d'être opéré que vous prenez Dorzolamide/Timolol Viatris car le timolol peut modifier l'action de certains médicaments utilisés pour l'anesthésie.
Informez également votre médecin de toute allergie ou réaction allergique y compris urticaire, gonflement du visage, des lèvres, de la langue, et/ou de la gorge, qui peut entraîner une difficulté à respirer ou à avaler.
Informez votre médecin si vous avez des faiblesses musculaires ou si une myasthénie a été diagnostiquée.
Si vous développez une irritation ou tout nouveau problème oculaire tel que rougeur de l'œil ou des yeux , contactez votre médecin immédiatement.
Si vous pensez que Dorzolamide/Timolol Viatris est à l’origine d’une réaction allergique ou d’une hypersensibilité (par exemple, éruption de la peau, éruption cutanée sévère ou rougeur de l'œil et démangeaison oculaire), arrêtez le traitement et contactez votre médecin immédiatement.
Informez votre médecin si vous développez une infection oculaire, avez une blessure à l'œil, avez une intervention chirurgicale oculaire, développez d'autres réactions ou si les symptômes s'aggravent.
Quand Dorzolamide/Timolol Viatris est instillé dans l’œil, il peut avoir un effet sur l’ensemble de l’organisme.
Enfants
Chez le nourrissonet l'enfant, l'expérience avec Dorzolamide/Timolol Viatris est limitée
Personnes âgées
Dans les études avec ce médicament, les effets ont été similaires chez les patients âgés et les patients plus jeunes.
Utilisation chez l’insuffisant hépatique
Informez votre médecin de tous problèmes hépatiques que vous avez ou avez eus par le passé.
Autres médicaments et DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution
Dorzolamide/Timolol Viatris peut modifier les effets d’autres médicaments que vous prenez ou être modifié par eux, y compris par d’autres collyres utilisés pour le traitement du glaucome. Informez votre médecin que vous prenez ou avez l’intention de prendre des médicaments antihypertenseurs ou pour le traitement de troubles cardiaques ou du diabète. Si vous utilisez ou avez utilisé récemment ou pourriez utiliser un autre médicament, y compris un médicament délivré sans ordonnance, parlez-en à votre médecin ou à votre pharmacien. Ceci est particulièrement important si l’un des points ci-dessous s’applique à vous :
· vous prenez des médicaments pour diminuer la pression artérielle ou pour traiter une maladie cardiaque (tels qu'un inhibiteur calcique, un bêta-bloquant ou de la digoxine)
· vous utilisez un autre collyre qui contient un bêta-bloquant,
· vous prenez un autre inhibiteur de l’anhydrase carbonique tel que l’acétazolamide,
· vous prenez un médicament de la famille des inhibiteurs de la monoamine oxydase (IMAO), utilisés pour traiter la dépression,
· vous prenez un médicament parasympathomimétique qui vous a été prescrit pour vous aider à uriner. Les parasympathomimétiques appartiennent à une famille de médicaments qui sont parfois également utilisés pour aider à la restauration d’un transit intestinal normal,
· vous prenez des narcotiques tels que la morphine utilisée pour traiter des douleurs modérées à fortes,
· vous prenez un médicament pour traiter le diabète,
· vous prenez un médicament antidépresseur tel que fluoxétine ou paroxétine,
· vous prenez un médicament de la classe des sulfamides,
· vous prenez de la quinidine (médicament utilisé dans le traitement des maladies cardiaques et certains types de malaria).
DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution avec des aliments et boissons
Sans objet.
Grossesse et allaitement
Si vous être enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez d’avoir un bébé, demandez conseil à votre médecin ou à votre pharmacien avant de prendre ce médicament.
N’utilisez pas Dorzolamide/Timolol Viatris si vous êtes enceinte, sauf si votre médecin l’estime nécessaire. N’utilisez pas Dorzolamide/Timolol Viatris si vous allaitez. Le timolol peut passer dans votre lait.
Demandez conseil à votre médecin avant de prendre un médicament pendant que vous allaitez.
Conduite de véhicules et utilisation de machines
Aucune étude sur la capacité à conduire ou à utiliser des machines n’a été menée. Il existe des effets indésirables associés à DORZOLAMIDE/TIMOLOL VIATRIS tels qu’une vision trouble qui peuvent altérer l'aptitude à conduire ou à utiliser des machines. Ne conduisez pas et n’utilisez pas de machines avant que vous ne vous sentiez bien ou que votre vision soit claire.
DORZOLAMIDE/TIMOLOL VIATRIS contient du chlorure de benzalkonium :
Ce médicament contient 0,15 mg de chlorure de benzalkonium dans chaque millilitre de collyre en solution.
Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changer leur couleur. Retirer les lentilles de contact avant application et attendre au moins 15 minutes avant de les remettre.
Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si vous souffrez du syndrome de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’œil). En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, contactez votre médecin.

La posologie adéquate et la durée du traitement seront établies par votre médecin.
La dose recommandée est d'une goutte dans l'œil (les yeux) atteint(s), deux fois par jour, par exemple le matin et le soir.
En cas d'utilisation concomitante de ce médicament avec un autre collyre : les instillations successives de chaque collyre doivent être espacées d'au moins 10 minutes.
Ne modifiez pas la posologie de ce médicament sans en avertir votre médecin. Si vous devez arrêter votre traitement, contactez votre médecin immédiatement.
Evitez tout contact de l'extrémité du flacon avec l'œil ou les parties avoisinantes. Il pourrait, en effet, être contaminé par des bactéries qui peuvent entraîner des lésions graves de l'œil, voire même la perte de la vision. Pour éviter toute contamination possible du flacon, lavez-vous les mains avant utilisation de ce collyre et empêchez tout contact de l'embout du flacon avec son environnement. Si vous pensez que votre médicament a pu être contaminé ou si vous présentez une infection oculaire, contactez immédiatement votre médecin afin de savoir si vous pouvez réutiliser ce flacon.
Pour garantir la délivrance d'une dose conforme, l'embout ne doit pas être élargi.
Mode d'emploi :
Ne pas utiliser le flacon si la languette de sécurité en plastique n’est pas présente ou est endommagée. Lorsque vous ouvrez le flacon pour la première fois, déchirez la languette de sécurité en plastique.
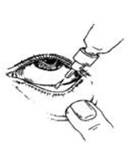
Chaque fois que vous utilisez Dorzolamide/Timolol Viatris :
1. Lavez-vous les mains.
2. Ouvrez le flacon. Faites attention de ne pas toucher votre œil, la peau autour de votre œil ou vos doigts avec l’embout du flacon.
3. Inclinez votre tête en arrière et tenez le flacon à l’envers au-dessus de votre œil.
4. Tirez la paupière inférieure vers le bas et regardez vers le haut. Tenez le flacon par les côtés aplatis et pressez doucement pour laisser tomber une goutte dans l’espace entre la paupière inférieure et l’œil.
5. Fermez votre œil et appuyez sur le coin intérieur de l’œil avec votre doigt pendant environ deux minutes. Cela aide à stopper la propagation du médicament dans le reste du corps.
6. Répétez les étapes 3 à 5 pour l’autre œil si votre médecin vous l’a prescrit.
7. Remettez le bouchon et fermez soigneusement le flacon.

Si vous avez utilisé plus de DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution que vous n’auriez dû :
Il est important de respecter la dose prescrite par votre médecin. Si vous instillez trop de gouttes dans votre œil ou si vous avalez le contenu du flacon, vous pouvez vous sentir mal. Par exemple, vous pouvez avoir mal à la tête ou être fatigué, être étourdi ou avoir des vertiges, des difficultés à respirer, un essoufflement ou sentir que votre rythme cardiaque ralentit. Contactez immédiatement votre médecin.
Si vous oubliez d’utiliser DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution :
Il est important de prendre ce médicament comme votre médecin vous l'a prescrit. Si vous oubliez d'instiller une goutte à l'heure prévue, instillez-la le plus tôt possible après l'oubli.
Cependant, s'il est presque l'heure de l'instillation suivante, reprenez votre médicament normalement à l'heure habituelle suivante. Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution :
Si vous voulez arrêter ce médicament, parlez-en d'abord à votre médecin.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez conseil à votre médecin ou à votre pharmacien.

Effets indésirables graves :
Si vous ressentez l’un des effets indésirables suivants, arrêtez d’utiliser ce médicament et consulter immédiatement votre médecin car cela pourrait être un signe de réaction au médicament.
Des réactions allergiques généralisées incluant des gonflements sous la peau peuvent se produire à des endroits tels que la figure ou les membres, et peuvent obstruer les voies aériennes, ce qui peut provoquer une difficulté à avaler, une difficulté respiratoire, de l'urticaire ou une éruption qui démange, une éruption locale et généralisée, des démangeaisons, une réaction allergique soudaine menaçant le pronostic vital.
Il est généralement possible de continuer à utiliser le collyre, à moins que les effets ne soient sévères. Si vous êtes inquiet, parlez-en à votre médecin ou à votre pharmacien. N’arrêtez pas d’utiliser Dorzolamide/Timolol sans en avoir parlé à votre médecin.
Les effets indésirables suivants ont été rapportés avec Dorzolamide/Timolol Viatris ou l’un de ses composants pendant les études cliniques ou depuis la commercialisation :
Très fréquent (peut affecter plus d’1 personne sur 10) :
· Brûlures et picotements des yeux, altération du goût.
Fréquent (peuvent affecter jusqu’à 1 personne sur 10) :
· Rougeur de/et autour de l’œil (des yeux),larmoiement ou démangeaisons de l’œil (des yeux),
· érosion de la cornée (dommage de la couche superficielle du globe oculaire),
· gonflement et/ou irritation de/et autour de l’œil (des yeux),
· sensation d'avoir quelque chose dans l'œil,
· baisse de la sensibilité cornéenne (ne pas se rendre compte de la présence d'un corps étranger dans l'œil et absence de sensation de douleur),
· douleur oculaire,
· yeux secs,
· vision trouble,
· maux de tête,
· sinusite (sensation de tension dans le nez ou de nez plein),
· nausées,
· faiblesse/lassitude et fatigue.
Peu fréquent (peuvent affecter jusqu’à 1 personne sur 100) :
· Etourdissement
· dépression,
· inflammation de l’iris,
· troubles visuels dont changement de la réfraction (dû dans certains cas à l’interruption d’un traitement pour traiter la contraction excessive de la pupille),
· rythme cardiaque lent,
· évanouissement,
· difficulté respiratoire,
· indigestion
· calculs rénaux (souvent marquées par une apparition soudaine de douleurs atroces et crampes dans le bas du dos et/ou les côtés, l'aine ou l'abdomen).
Rare (peuvent affecter jusqu’à 1 personne sur 1000) :
· Lupus érythémateux disséminé (une maladie immunitaire qui peut entraîner une inflammation des organes internes)
· fourmillement ou engourdissement des mains ou des pieds,
· insomnies,
· cauchemars,
· perte de mémoire,
· augmentation des signes et symptômes de myasthénie (trouble des muscles),
· diminution de la libido,
· accident vasculaire cérébral,
· myopie transitoire qui peut cesser à l’arrêt du traitement,
· détachement de la couche située sous la rétine qui contient des vaisseaux sanguins, après chirurgie filtrante, qui peut occasionner des troubles visuels,
· chute de la paupière (l'œil reste à moitié fermé),
· vision double,
· lésions croûteuses de la paupière,
· œdème de la cornée (avec des symptômes de troubles visuels),
· pression oculaire basse,
· bourdonnements dans les oreilles,
· pression artérielle basse,
· modification du rythme ou de la vitesse des battements du cœur,
· insuffisance cardiaque congestive (maladie du cœur avec essoufflement et gonflement des pieds et des jambes dû à l'accumulation de liquide),
· œdème (accumulation de liquide),
· ischémie cérébrale (diminution de la circulation sanguine du cerveau),
· douleur thoracique,
· battements du cœur puissants pouvant être rapides ou irréguliers (palpitations),
· crise cardiaque,
· syndrome de Raynaud,
· gonflement ou froideur des mains et des pieds et mauvaise circulation des bras et des jambes,
· crampes et/ou douleur des jambes pendant la marche (claudication),
· nez bouché ou qui coule,
· saignement de nez,
· constriction des voies aériennes au niveau des poumons entraînant des difficultés respiratoires,
· toux,
· irritation de la gorge,
· sécheresse buccale,
· diarrhée,
· dermite de contact,
· perte de cheveux,
· éruption cutanée d'apparence blanc argenté (éruption psoriasiforme),
· maladie de La Peyronie (pouvant causer une courbure du pénis),
· réactions de type allergique telles que éruption, urticaire, démangeaisons, en de rares cas gonflement possible des lèvres, des yeux et de la bouche, respiration sifflante ou réactions cutanées sévères (syndrome de Stevens-Johnson, nécrolyse épidermique toxique).
Comme d'autres médicaments instillés dans l'œil, le timolol passe dans le sang. Ceci peut provoquer des effets indésirables similaires à ceux observés avec des médicaments bêta-bloquants administrés par voie orale. L'incidence de ces effets indésirables après une instillation dans l'œil est moins importante que si le médicament est pris par exemple par voie orale ou par injection. Les effets indésirables additionnels listés incluent les réactions observées dans la classe des bêta-bloquants lors de leur utilisation dans le traitement des maladies oculaires.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· Taux bas de glucose dans le sang,
· insuffisance cardiaque,
· un type de trouble des battements du cœur,
· douleur abdominale,
· vomissements,
· douleur musculaire non induite par l'exercice,
· dysfonctionnement sexuel,
· hallucination
· sensation de corps étranger dans l’œil (impression d’avoir quelque chose dans l’œil).
· augmentation de la fréquence cardiaque
· augmentation de la pression artérielle
·
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.

Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette, la boîte après {EXP}. La date de péremption fait référence au dernier jour de ce mois.
Pas de précautions particulières de température de conservation. Conserver dans l’emballage extérieur d’origine pour protéger de la lumière et de l’humidité.
Dorzolamide/Timolol Viatris doit être utilisé dans les 28 jours qui suivent l'ouverture du flacon. Vous devez donc jeter le flacon 4 semaines après l'avoir ouvert même s'il reste un peu de solution. Pour vous aider à vous en rappeler, inscrivez la date à laquelle vous avez ouvert le flacon dans le cadre prévu à cet effet sur la boîte.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.

Ce que contient DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution 
· Les substances actives sont : le dorzolamide et le timolol.
Chaque millilitre contient 20 mg de dorzolamide (sous forme de chlorhydrate de dorzolamide) et 5 mg de timolol (sous forme de maléate de timolol).
· Les autres composants sont :
Le mannitol, l'hydroxyéthylcellulose, le chlorure de benzalkonium (comme conservateur) (voir rubrique 2 « Dorzolamide/Timolol Viatris contient un conservateur »), le citrate de sodium, l'hydroxyde de sodium et l'eau pour préparations injectables.
Qu’est-ce que DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution et contenu de l’emballage extérieur 
DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution est une solution stérile, incolore, claire et légèrement visqueuse.
Flacon à usage ophtalmique blanc opaque (PE de densité intermédiaire), muni d'un embout compte-gouttes scellé (PEBD) et avec un bouchon à vis (PEHD) et une bague d'inviolabilité au niveau du col, contenant 5 ml de collyre en solution.
Boîte de 1, 3 ou 6 flacons de 5 ml.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché 
VIATRIS SANTE
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché 
1 RUE DE TURIN
69007 LYON
6, DERVENAKION STR.,
15351 PALLINI, ATTIKI
GRECE
ou
FAMAR SA, PLANT A
63 AGIOU DIMITRIOU STREET,
174 56 ALIMOS
GRECE
ou
VIATRIS SANTE
1 RUE DE TURIN
69007 LYON
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen 
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est : 
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |