
PEMETREXED ZENTIVA 25 mg/ml, solution à diluer pour perfusion - Résumé des caractéristiques du produit |
 |
|
ANSM - Mis à jour le : 09/02/2023
PEMETREXED ZENTIVA 25 mg/ml, solution à diluer pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Pour 1 mL de solution à diluer pour perfusion.
Chaque flacon de 4 ml de solution à diluer contient 100 mg de pémétrexed (sous forme de pémétrexed diarginine).
Chaque flacon de 20 ml de solution à diluer contient 500 mg de pémétrexed (sous forme de pémétrexed diarginine).
Chaque flacon de 40 ml de solution à diluer contient 1 000 mg de pémétrexed (sous forme de pémétrexed diarginine).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution à diluer pour perfusion.
Solution claire, incolore à légèrement jaune pouvant tirer sur le brun, jaune brunâtre ou jaune verdâtre.
Le pH de la solution à diluer se situe entre 8,3 et 9,0.
4.1. Indications thérapeutiques 
PEMETREXED ZENTIVA, en association avec le cisplatine, est indiqué dans le traitement des patients atteints de mésothéliome pleural malin non résécable et qui n’ont pas reçu de chimiothérapie antérieure.
Cancer bronchique non à petites cellules
PEMETREXED ZENTIVA, en association avec le cisplatine, est indiqué dans le traitement en première ligne des patients atteints de cancer bronchique non à petites cellules localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde (voir rubrique 5.1).
PEMETREXED ZENTIVA est indiqué en monothérapie dans le traitement de maintenance du cancer bronchique non à petites cellules, localement avancé ou métastatique, immédiatement à la suite d’une chimiothérapie à base de sel de platine, dès lors que l’histologie n’est pas à prédominance épidermoïde chez les patients dont la maladie n’a pas progressé (voir rubrique 5.1).
PEMETREXED ZENTIVA est indiqué en monothérapie dans le traitement en seconde ligne des patients atteints de cancer bronchique non à petites cellules, localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde (voir rubrique 5.1).
4.2. Posologie et mode d'administration 
PEMETREXED ZENTIVA doit être administré uniquement sous le contrôle d’un médecin qualifié dans l’utilisation des chimiothérapies anticancéreuses.
PEMETREXED ZENTIVA en association avec le cisplatine
La posologie recommandée de PEMETREXED ZENTIVA est de 500 mg/m2 de surface corporelle, en perfusion intraveineuse de 10 minutes, le premier jour de chaque cycle de 21 jours.
La posologie recommandée de cisplatine est de 75 mg/m2 de surface corporelle en perfusion de 2 heures, débutée environ 30 minutes après la fin de la perfusion de pémétrexed, le premier jour de chaque cycle de 21 jours. Les patients doivent recevoir un traitement antiémétique adéquat et une hydratation appropriée, avant et/ou après la perfusion de cisplatine (se référer au Résumé des caractéristiques du produit du cisplatine pour des recommandations posologiques spécifiques).
PEMETREXED ZENTIVA en monothérapie
Chez les patients traités pour cancer bronchique non à petites cellules et qui ont reçu une chimiothérapie antérieure, la posologie recommandée de PEMETREXED ZENTIVA est de 500 mg/m2 de surface corporelle, en perfusion intraveineuse de 10 minutes, le premier jour de chaque cycle de 21 jours.
Prémédication
Afin de réduire la survenue et la sévérité des réactions cutanées, une corticothérapie devra être administrée la veille, le jour même et le lendemain de l’administration du pémétrexed. La posologie doit être équivalente à 4 mg de dexaméthasone par voie orale, deux fois par jour (voir rubrique 4.4).
Afin de réduire la toxicité du pémétrexed, les patients traités doivent également recevoir une supplémentation en vitamines (voir rubrique 4.4). Les patients doivent prendre par voie orale de l’acide folique ou une association polyvitaminique contenant de l’acide folique (350 à 1 000 microgrammes) quotidiennement. Au moins 5 doses d’acide folique doivent être prises dans les 7 jours qui précèdent la première dose de pémétrexed, et les patients doivent continuer cette supplémentation pendant toute la durée du traitement et pendant 21 jours après la dernière dose de pémétrexed. Les patients doivent également recevoir une injection intramusculaire de vitamine B12 (1 000 microgrammes) dans la semaine précédant la première dose de pémétrexed puis une fois tous les 3 cycles. Les injections ultérieures de vitamine B12 peuvent avoir lieu le même jour que l’administration de pémétrexed.
Surveillance
Avant chaque administration de pémétrexed, une numération formule sanguine complète (NFS), avec mesure du taux de plaquettes et mesure du taux de globules blancs, doit être réalisée. Un bilan biochimique sera réalisé avant chaque administration de la chimiothérapie pour évaluer les fonctions hépatique et rénale. Avant le début de chaque cycle de chimiothérapie, le nombre absolu de polynucléaires neutrophiles (PNN) doit être supérieur ou égal à 1 500 cellules/mm3 et le nombre de plaquettes supérieur ou égal à 100 000 cellules/mm3. La clairance de la créatinine doit être supérieure ou égale à 45 ml/min.
Le taux de bilirubine totale doit être inférieur ou égal à 1,5 fois la limite supérieure de la normale. Les taux de phosphatases alcalines (PA), d’aspartate aminotransférase (ASAT ou SGOT) et d’alanine aminotransférase (ALAT ou SGPT) doivent être inférieurs ou égaux à 3 fois la limite supérieure de la normale. Des taux de phosphatases alcalines, d’ASAT et d’ALAT inférieurs ou égaux à 5 fois la limite supérieure de la normale sont acceptables en cas de métastases hépatiques.
Ajustements de la dose
Au début d’un nouveau cycle, les ajustements de dose s’appuieront sur la numération formule sanguine au nadir et la toxicité non-hématologique maximale observée au cours du cycle précédent. Le traitement peut être différé le temps nécessaire à la récupération. Dès récupération, les patients doivent être à nouveau traités selon les recommandations des tableaux 1, 2 et 3, qui concernent PEMETREXED ZENTIVA utilisé en monothérapie et en association avec le cisplatine.
|
Tableau 1 – Tableau de modification des doses de pémétrexed (en monothérapie ou en association) et de cisplatine - Toxicités hématologiques |
|
|
Au nadir : PNN < 500/mm3 et plaquettes ≥ 50 000/mm3 |
75 % de la dose précédente (pour le pémétrexed et le cisplatine) |
|
Au nadir : plaquettes < 50 000/mm3 quel que soit le taux de PNN |
75 % de la dose précédente (pour le pémétrexed et le cisplatine) |
|
Au nadir : plaquettes < 50 000/mm3 avec saignementa, quel que soit le taux de PNN |
50 % de la dose précédente (pour le pémétrexed et le cisplatine) |
a Ces critères répondent à la définition des saignements ≥ grade 2 selon les critères communs de terminologie (CTC) du National Cancer Institute (v2.0 ; NCI 1998).
En cas de toxicités non-hématologiques ≥ grade 3 (à l’exclusion d’une neurotoxicité), le traitement par PEMETREXED ZENTIVA doit être suspendu jusqu’à résolution à un niveau inférieur ou égal au niveau initial du patient avant traitement. Le traitement doit être poursuivi selon les recommandations du tableau 2.
|
Tableau 2 – Tableau de modification des doses de pémétrexed (en monothérapie ou en association) et de cisplatine - Toxicités non-hématologiquesa,b |
||
|
|
Dose de pémétrexed (mg/m2) |
Dose de cisplatine (mg/m2) |
|
Toute toxicité de grade 3 ou 4, excepté mucite |
75 % de la dose précédente |
75 % de la dose précédente |
|
Toute diarrhée nécessitant une hospitalisation (quel que soit le grade) ou diarrhée de grade 3 ou 4 |
75 % de la dose précédente |
75 % de la dose précédente |
|
Mucite de grade 3 ou 4 |
50 % de la dose précédente |
100 % de la dose précédente |
a Critères communs de terminologie (CTC) du National Cancer Institute (v2.0 ; NCI 1998).
b À l’exclusion d’une neurotoxicité.
En cas de neurotoxicité, il est recommandé d’ajuster les doses de pémétrexed et de cisplatine comme précisé dans le tableau 3. Les patients doivent arrêter le traitement si une neurotoxicité de grade 3 ou 4 est observée.
|
Tableau 3 – Tableau de modification des doses de pémétrexed (en monothérapie ou en association) et de cisplatine - Neurotoxicité |
||
|
Grade CTCa |
Dose de pémétrexed (mg/m2) |
Dose de cisplatine (mg/m2) |
|
0 – 1 |
100 % de la dose précédente |
100 % de la dose précédente |
|
2 |
100 % de la dose précédente |
50 % de la dose précédente |
a Critères communs de terminologie (CTC) du National Cancer Institute (v2.0 ; NCI 1998).
Le traitement par PEMETREXED ZENTIVA doit être arrêté si le patient présente une toxicité hématologique ou non-hématologique de grade 3 ou 4 après 2 réductions de dose ou immédiatement si une neurotoxicité de grade 3 ou 4 est observée.
Populations spéciales :
Sujets âgés
Au cours des essais cliniques, il n’a pas été mis en évidence de risque plus élevé d’effets indésirables chez les patients de 65 ans et plus comparativement aux patients de moins de 65 ans. Des réductions de doses autres que celles recommandées pour l’ensemble des patients ne sont pas nécessaires.
Population pédiatrique
Il n’existe pas d’utilisation justifiée de PEMETREXED ZENTIVA dans la population pédiatrique dans le mésothéliome pleural malin et le cancer bronchique non à petites cellules.
Insuffisants rénaux
(Formule standard de Cockcroft et Gault ou taux de filtration glomérulaire mesuré par la méthode de clairance plasmatique Tc99m-DTPA) : le pémétrexed est essentiellement éliminé sous forme inchangée dans les urines. Dans les études cliniques, des ajustements de doses autres que ceux préconisés pour l’ensemble des patients n’ont pas été nécessaires chez les patients dont la clairance de la créatinine était ≥ 45 ml/min. Chez les patients ayant une clairance de la créatinine < 45 ml/min, les données sont insuffisantes ; l’utilisation du pémétrexed n’est donc pas recommandée chez ces patients (voir rubrique 4.4).
Insuffisants hépatiques
Aucune relation entre le taux d’ASAT (SGOT), d’ALAT (SGPT) ou de bilirubine totale et la pharmacocinétique du pémétrexed n’a été identifiée. Toutefois, il n’a pas été conduit d’étude spécifique chez des patients ayant une atteinte hépatique avec un taux de bilirubine supérieur à 1,5 fois la limite supérieure de la normale et/ou un taux d’aminotransférases supérieur à 3 fois la limite supérieure de la normale (en l’absence de métastases hépatiques) ou supérieur à 5 fois la limite supérieure de la normale (en cas de métastases hépatiques).
Mode d’administration
PEMETREXED ZENTIVA doit être administré par voie intraveineuse.
PEMETREXED ZENTIVA doit être administré en perfusion intraveineuse de 10 minutes, le premier jour de chaque cycle de 21 jours.
Pour les précautions à prendre avant la manipulation ou l’administration de PEMETREXED ZENTIVA et les instructions concernant la dilution de PEMETREXED ZENTIVA avant administration, voir la rubrique 6.6.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Allaitement (voir rubrique 4.6).
Association concomitante avec le vaccin contre la fièvre jaune (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi 
Une moindre toxicité et une réduction des toxicités hématologiques et non-hématologiques de grade 3/4 telles que neutropénie, neutropénie fébrile et infections avec neutropénies de grade 3/4 ont été rapportées lorsqu’une prémédication par acide folique et vitamine B12 était administrée. Tous les patients traités par le pémétrexed doivent donc être informés de la nécessité de prendre de l’acide folique et de la vitamine B12 comme mesure prophylactique afin de réduire la toxicité liée au traitement (voir rubrique 4.2).
Des réactions cutanées ont été rapportées chez des patients n’ayant pas reçu de corticothérapie préalable. Une prémédication par dexaméthasone (ou équivalent) peut réduire l’incidence et la sévérité des réactions cutanées (voir rubrique 4.2).
Un nombre insuffisant de patients présentant une clairance de la créatinine < 45 ml/min a été étudié. Par conséquent, l’utilisation du pémétrexed chez les patients présentant une clairance de la créatinine inférieure à 45 ml/min n’est pas recommandée (voir rubrique 4.2).
Les patients atteints d’une insuffisance rénale faible à modérée (clairance de la créatinine comprise entre 45 ml/min et 79 ml/min) doivent éviter de prendre des anti-inflammatoires non stéroïdiens (AINS) tels que l’ibuprofène et l’acide acétylsalicylique (> 1,3 g par jour) les deux jours avant, le jour même et les deux jours suivant l’administration de pémétrexed (voir rubrique 4.5).
Chez les patients atteints d’insuffisance rénale légère à modérée susceptibles de recevoir un traitement par le pémétrexed, les AINS à demi-vie longue doivent être interrompus au moins cinq jours avant, le jour même, et au moins les deux jours suivant l’administration de pémétrexed (voir rubrique 4.5).
Des effets rénaux graves, y compris une insuffisance rénale aiguë, ont été rapportés avec le pémétrexed en monothérapie ou en association avec d’autres agents cytotoxiques. La plupart des patients chez lesquels ces évènements sont survenus présentaient des facteurs de risque rénaux, incluant une déshydratation, une hypertension ou un diabète préexistants. Des cas de diabète insipide néphrogénique et de nécrose tubulaire rénale ont également été rapportés après commercialisation en cas d’utilisation du pémétrexed en monothérapie ou en association avec d’autres agents cytotoxiques. La plupart de ces événements ont disparu après l’arrêt du pémétrexed. Les patients doivent être régulièrement surveillés pour détecter une nécrose tubulaire aiguë, une diminution de la fonction rénale ainsi que les signes et symptômes du diabète insipide néphrogénique (dont l’hypernatrémie, par exemple).
L’effet d’un troisième secteur liquidien, tel qu’un épanchement pleural ou une ascite, sur le pémétrexed n’est pas entièrement défini. Une étude de phase 2 du pémétrexed conduite chez 31 patients atteints de tumeurs solides et ayant un troisième secteur liquidien stable a démontré qu’il n’y avait pas de différence en termes de concentrations plasmatiques normalisées et de clairance du pémétrexed, comparés aux patients n’ayant pas de troisième secteur liquidien. Ainsi, une ponction évacuatrice d’une collection dans le troisième secteur liquidien avant l’administration de pémétrexed devrait être envisagée, mais peut ne pas être nécessaire.
En raison de la toxicité gastro-intestinale du pémétrexed administré en association avec le cisplatine, une déshydratation sévère a été observée. En conséquence, les patients doivent recevoir un traitement antiémétique adéquat et une hydratation appropriée, avant et/ou après l’administration du traitement.
Des effets cardiovasculaires graves, y compris infarctus du myocarde, et des effets cérébro-vasculaires ont été peu fréquemment rapportés pendant les études cliniques avec le pémétrexed, habituellement lorsque celui-ci est administré en association avec un autre agent cytotoxique. La plupart des patients chez lesquels ces évènements ont été observés avaient des facteurs de risque cardiovasculaire préexistants (voir rubrique 4.8).
L’immunodépression est fréquente chez les patients cancéreux. En conséquence, l’utilisation concomitante de vaccins vivants atténués n’est pas recommandée (voir rubriques 4.3 et 4.5).
Le pémétrexed peut entraîner des anomalies du matériel génétique. Il doit être conseillé aux hommes de ne pas concevoir d’enfant durant leur traitement et dans les 3 mois qui suivent son arrêt. Des mesures contraceptives ou l’abstinence sont recommandées. Une conservation de sperme peut être conseillée aux hommes avant de débuter le traitement en raison du risque de stérilité irréversible.
Les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement par pémétrexed et pendant 6 mois après la fin du traitement (voir rubrique 4.6).
Des cas de pneumopathie radique ont été rapportés chez des patients traités par radiothérapie, soit avant, pendant ou après une chimiothérapie par pémétrexed. Une attention particulière devra être portée à ces patients et il conviendra d’agir avec précaution lors de l’utilisation d’autres agents radiosensibilisants.
Des cas de réactivation de zone antérieurement irradiée ont été rapportés chez des patients préalablement traités par radiothérapie des semaines ou des années auparavant.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Le pémétrexed est principalement éliminé sous forme inchangée dans les urines par sécrétion tubulaire et dans une moindre mesure par filtration glomérulaire. L’administration concomitante de médicaments néphrotoxiques (par exemple : les aminosides, les diurétiques de l’anse, les dérivés du platine, la ciclosporine) peut potentiellement diminuer la clairance du pémétrexed. Ces associations doivent être utilisées avec prudence. Si nécessaire, la clairance de la créatinine sera étroitement surveillée.
L’administration concomitante de substances également sécrétées au niveau tubulaire (par exemple : le probénécide, la pénicilline) pourrait diminuer la clairance du pémétrexed. Des précautions doivent être prises lorsque ces médicaments sont associés au pémétrexed. Si nécessaire, la clairance de la créatinine devra être étroitement surveillée.
Chez les patients ayant une fonction rénale normale (clairance de la créatinine ≥ 80 ml/min), de fortes doses d’anti-inflammatoires non stéroïdiens (AINS, tel que l’ibuprofène > 1 600 mg/jour) et d’acide acétylsalicylique à dose plus élevée (≥ 1,3 g par jour) peuvent diminuer l’élimination du pémétrexed et, par conséquent, augmenter la survenue d’effets indésirables dus au pémétrexed.
Des précautions doivent donc être prises lors de l’administration concomitante de fortes doses d’AINS ou d’acide acétylsalicylique et de pémétrexed chez les patients ayant une fonction rénale normale (clairance de la créatinine ≥ 80 ml/min).
Chez les patients atteints d’une insuffisance rénale faible à modérée (clairance de la créatinine comprise entre 45 ml/min et 79 ml/min), l’administration concomitante de pémétrexed et d’AINS (par exemple l’ibuprofène) ou d’acide acétylsalicylique à dose plus élevée doit être évitée les deux jours avant, le jour même et les deux jours suivant l’administration de pémétrexed (voir rubrique 4.4).
En l’absence de données concernant les éventuelles interactions avec les AINS à demi-vie longue, tels que le piroxicam ou le rofécoxib, leur administration concomitante avec le pémétrexed chez les patients ayant une insuffisance rénale faible à modérée doit être interrompue pendant au moins cinq jours avant, le jour même, et au moins les deux jours suivant l’administration de pémétrexed (voir rubrique 4.4). Si l’administration concomitante d’AINS est nécessaire, les patients doivent faire l’objet d’une surveillance étroite de la toxicité, en particulier gastro-intestinale, et de la myélosuppression.
Le pémétrexed fait l’objet d’un métabolisme hépatique limité. Les résultats d’études in vitro sur microsomes hépatiques humains suggèrent que le pémétrexed n’inhiberait pas de manière cliniquement significative la clairance métabolique des médicaments métabolisés par les isoenzymes CYP3A, CYP2D6, CYP2C9 et CYP1A2.
Interactions communes à tous les cytotoxiques
En raison de l’augmentation du risque thrombotique chez les patients cancéreux, le recours à un traitement anticoagulant est fréquent. La grande variabilité intra-individuelle de la coagulabilité au cours des maladies, à laquelle s’ajoute l’éventualité d’une interaction entre les anticoagulants oraux et les cytotoxiques, imposent, s’il est décidé de traiter le patient par anticoagulants oraux, d’augmenter la fréquence des contrôles de l’INR (International Normalised Ratio).
Associations contre-indiquées
Vaccin contre la fièvre jaune : risque de maladie vaccinale généralisée mortelle (voir rubrique 4.3).
Associations déconseillées
Vaccins vivants atténués (excepté le vaccin contre la fièvre jaune, pour lequel l’association est contre-indiquée) : risque de maladie vaccinale généralisée éventuellement mortelle. Ce risque est majoré chez les sujets déjà immunodéprimés par leur maladie sous-jacente. Utiliser un vaccin inactivé lorsqu’il existe (poliomyélite) (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement 
Femmes en âge de procréer / Contraception chez les hommes et les femmes
Le pémétrexed peut entraîner des anomalies du matériel génétique. Les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement par pémétrexed et pendant 6 mois après la fin du traitement. Il doit être conseillé aux hommes d’utiliser des méthodes de contraception efficaces et de ne pas concevoir d’enfant durant leur traitement et dans les 3 mois qui suivent son arrêt.
Grossesse
Il n’existe pas de données sur l’utilisation du pémétrexed chez la femme enceinte, cependant le pémétrexed, comme d’autres antimétabolites, est suspecté d’entraîner des malformations lorsqu’il est administré pendant la grossesse. Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3). Le pémétrexed ne doit pas être utilisé pendant la grossesse, sauf cas de nécessité absolue, après avoir évalué le bénéfice pour la mère et le risque pour le fœtus (voir rubrique 4.4).
Allaitement
On ne sait pas si le pémétrexed est excrété dans le lait maternel. Le risque d’effets indésirables chez le nouveau-né allaité ne pouvant être exclu, l’allaitement doit être interrompu au cours du traitement avec le pémétrexed (voir rubrique 4.3).
Fertilité
Une conservation de sperme peut être conseillée aux hommes avant de débuter le traitement en raison du risque de stérilité irréversible.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment rapportés chez les patients traités par pémétrexed en monothérapie ou en association ont été une dépression médullaire à type d’anémie, neutropénie, leucopénie, thrombopénie ; ainsi que des toxicités gastro-intestinales à type d’anorexie, nausées, vomissements, diarrhées, constipation, pharyngite, mucite et stomatite. D’autres effets indésirables incluent : toxicités rénales, élévation des aminotransférases, alopécie, fatigue, déshydratation, éruption cutanée, infection/sepsis et neuropathie. Des effets rarement observés incluent : syndrome de Stevens-Johnson et syndrome de Lyell.
Liste tabulée des effets indésirables
Le tableau 4 présente les événements indésirables, quel que soit le lien de causalité, associés au pémétrexed utilisé soit en monothérapie soit en association avec le cisplatine, issus des études pivotales d’enregistrement (JMCH, JMEI, JMBD, JMEN et PARAMOUNT) et de la notification spontanée post-commercialisation.
Les événements indésirables sont listés par classe de système d’organes selon la classification MedDRA. La convention suivante a été utilisée pour la classification par fréquence : Très fréquent (≥ 1/10), Fréquent (≥ 1/100, < 1/10), Peu fréquent (≥ 1/1 000, < 1/100), Rare (≥ 1/10 000, < 1/1 000), Très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 4 - Fréquences des événements indésirables de tout grade, quel que soit le lien de causalité, issus des études pivotales d’enregistrement : JMEI (pemetrexed versus docétaxel), JMDB (pemetrexed et cisplatine versus GEMZAR et cisplatine), JMCH (pemetrexed plus cisplatine versus cisplatine), JMEN et PARAMOUNT (pémétrexed plus le meilleur traitement symptomatique versus placebo plus le meilleur traitement symptomatique) et de la notification spontanée post-commercialisation.
|
Classe de système d’organes (MedDRA) |
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Très rare |
Fréquence indéterminée |
|
Infections et infestations |
Infectiona Pharyngite |
Sepsisb |
|
|
Dermo-hypodermite |
|
|
Affections hématologiques et du système lymphatique |
Neutropénie Leucopénie Diminution de l’hémoglobine |
Neutropénie fébrile Diminution du nombre de plaquettes |
Pancytopénie Pancytopénie |
Anémie hémolytique auto-immune |
|
|
|
Affections du système immunitaire |
|
Hypersensibilité |
|
Choc anaphylactique |
|
|
|
Troubles du métabolisme et de la nutrition |
|
Déshydratation |
|
|
|
|
|
Affections du système nerveux |
|
Trouble du goût Neuropathie périphérique motrice Neuropathie périphérique sensorielle Sensations vertigineuses |
Accident vasculaire cérébral Accident vasculaire cérébral ischémique Hémorragie intracrânienne |
|
|
|
|
Affections oculaires |
|
Conjonctivite Sécheresse oculaire Hypersécrétion lacrymale Kératoconjonctivite sèche Œdème palpébral Maladie de la surface oculaire |
|
|
|
|
|
Affections cardiaques |
|
Insuffisance cardiaque Arythmie |
Angor Infarctus du myocarde Coronaropathie Arythmie supraventriculaire |
|
|
|
|
Affections vasculaires |
|
|
Ischémie périphériquec |
|
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Embolie pulmonaire Pneumopathie interstitiellebd |
|
|
|
|
Affections gastro- intestinales |
Stomatite Anorexie Vomissement Diarrhée Nausées |
Dyspepsie Constipation Douleur abdominale |
Hémorragie rectale Hémorragie gastro- intestinale Perforation intestinale Œsophagite Colitee |
|
|
|
|
Affections hépatobiliaires |
|
Elévation de l’alanine amino-transférase Elévation de l’aspartate amino-transférase |
|
Hépatite |
|
|
|
Affections de la peau et du tissus sous-cutané |
Eruption cutanée Exfoliation cutanée |
Hyperpigmentation Prurit Erythème polymorphe Alopécie Urticaire |
|
Erythème |
Syndrome de Stevens- Johnsonb Nécrolyse épidermique toxiqueb Pemphigoïde Dermatite bulleuse Epidermolyse bulleuse acquise Œdème érythémateuxf Pseudocellulite Dermatite Eczéma Prurigo |
|
|
Affections du rein et des voies urinaires |
Diminution de la clairance de la créatinine Augmentation de la créatininémiee |
Insuffisance rénale Diminution du débit de filtration glomérulaire |
|
|
|
Diabète insipide néphrogénique Nécrose tubulaire rénale |
|
Troubles généraux et anomalies au site d'administration |
Fatigue |
Pyrexie Douleur Œdème Douleur thoracique Inflammation des muqueuses |
|
|
|
|
|
Investigations |
|
Elévation de la gamma- glutamyl- transférase |
|
|
|
|
|
Lésions, intoxications et complications liées aux procédures |
|
|
Œsophagite radique Pneumopathie radique |
Phénomène de rappel de la zone irradiée |
|
|
a avec et sans neutropénie
b avec des cas d’issue fatale
c conduisant parfois à une nécrose des extrémités
d avec une insuffisance respiratoire
e observé uniquement en association avec le cisplatine
f principalement des membres inférieurs
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Symptômes
Les symptômes rapportés en cas de surdosage incluent neutropénie, anémie, thrombopénie, mucite, polyneuropathie sensitive et éruption cutanée. Les complications prévisibles d’un surdosage incluent la dépression médullaire, se manifestant par une neutropénie, une thrombopénie et une anémie. De plus, une infection avec ou sans fièvre, une diarrhée et/ou une mucite peuvent être rapportées.
Gestion des surdosages
En cas de suspicion de surdosage, la numération formule sanguine des patients doit être surveillée et un traitement symptomatique sera mis en œuvre, selon les cas. L’utilisation d’acide folinique/folinate de calcium dans la prise en charge d’un surdosage de pémétrexed doit être envisagée.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Mécanisme d’action
Le pémétrexed est un agent antinéoplasique antifolate multi-cible qui agit en interrompant des processus métaboliques folate-dépendants essentiels à la réplication cellulaire.
Effets pharmacodynamiques
Des études in vitro ont montré que le pémétrexed se comporte comme un antifolate multi-cible en inhibant la thymidylate synthétase (TS), la dihydrofolate réductase (DHFR) et la glycinamide ribonucléotide formyltransférase (GARFT), qui sont des enzymes folate-dépendantes clés pour la biosynthèse de novo de la thymidine et des nucléotides puriques. Le pémétrexed est transporté dans les cellules à la fois par les systèmes de transport des folates réduits et les protéines membranaires transporteuses de folates. Une fois dans la cellule, le pémétrexed est rapidement et efficacement converti en formes polyglutamates par la folyl-polyglutamate synthétase. Ces formes polyglutamates sont retenues dans les cellules et sont des inhibiteurs encore plus puissants de la TS et de la GARFT. La polyglutamation est un processus temps et concentration-dépendant qui se déroule dans les cellules tumorales et, dans une moindre mesure, dans les tissus normaux. Les métabolites polyglutamatés ont une demi-vie intracellulaire augmentée, prolongeant l’action du produit dans les cellules tumorales.
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec le pémétrexed dans tous les sous-groupes de la population pédiatrique dans les indications autorisées (voir rubrique 4.2).
Efficacité clinique
Mésothéliome
L’étude clinique de phase 3 multicentrique, randomisée, en simple aveugle EMPHACIS comparant pémétrexed +cisplatine vs. cisplatine chez les patients atteints de mésothéliome pleural malin n’ayant pas reçu de chimiothérapie antérieure a montré que les patients traités par pémétrexed et cisplatine avaient un avantage cliniquement significatif en termes de survie globale médiane de 2,8 mois par rapport aux patients traités par cisplatine seul.
Pendant cette étude, une supplémentation en acide folique à faible dose et en vitamine B12 a été introduite dans le traitement des patients afin d’en réduire la toxicité. L’analyse principale de cette étude a été effectuée sur la population de tous les patients randomisés dans un des bras ayant reçu le traitement correspondant (patients randomisés et traités). Une analyse de sous-groupe a été effectuée chez les patients qui ont reçu une supplémentation en acide folique et en vitamine B12 pendant toute la durée de leur traitement (patients totalement supplémentés). Les résultats d’efficacité de ces analyses sont résumés dans le tableau suivant :
Tableau 5 - Résultats d’efficacité de pémétrexed + cisplatine vs. cisplatine dans le mésothéliome pleural malin
|
|
|
Patients randomisés et traités |
Patients totalement supplémentés |
|
|||
|
Paramètre d’efficacité |
|
Pémétrexed/ cisplatine (N = 226) |
Cisplatine (N = 222) |
Pémétrexed/ Cisplatine (N = 168) |
|
Cisplatine (N = 163) |
|
|
Survie globale médiane (mois) |
|
12,1 |
9,3 |
13,3 |
|
10,0 |
|
|
(IC 95 %) |
|
(10,0 - 14,4) |
(7,8 - 10,7) |
(11,4 - 14,9) |
|
(8,4 - 11,9) |
|
|
Test du log-rank (pa) |
|
0,020 |
0,051 |
|
|||
|
Temps médian jusqu’à progression tumorale (mois) |
|
5,7 |
3,9 |
6,1 |
|
3,9 |
|
|
(IC 95 %) |
|
(4,9 - 6,5) |
(2,8 - 4,4) |
(5,3 - 7,0) |
|
(2,8 - 4,5) |
|
|
Test du log-rank (pa) |
|
0,001 |
0,008 |
|
|||
|
Temps jusqu’à échec du traitement (mois) |
|
4,5 |
2,7 |
4,7 |
|
2,7 |
|
|
(IC 95 %) |
|
(3,9 - 4,9) |
(2,1 - 2,9) |
(4,3 - 5,6) |
|
(2,2 - 3,1) |
|
|
Test du log-rank (pa) |
|
0,001 |
0,001 |
|
|||
|
Taux de réponse globaleb |
|
41,3 % |
16,7 % |
45,5 % |
|
19,6 % |
|
|
(IC 95 %) |
|
(34,8 - 48,1) |
(12,0 - 22,2) |
(37,8 - 53,4) |
|
(13,8 - 26,6) |
|
|
Test exact de Fisher (pa) |
|
< 0,001 |
< 0,001 |
|
|||
Abréviation : IC = intervalle de confiance.
a La valeur de p s’applique à la comparaison entre les bras.
b Dans le bras pémétrexed/cisplatine : patients randomisés et traités (N = 225) et patients supplémentés totalement (N = 167).
Une amélioration statistiquement significative des symptômes cliniquement importants (douleur et dyspnée) associés au mésothéliome pleural malin dans le bras pémétrexed/cisplatine (212 patients) comparé au bras cisplatine seul (218 patients) a été démontrée en utilisant l’échelle des symptômes du cancer du poumon « Lung Cancer Symptom Scale ». Des différences statistiquement significatives dans le bilan de la fonction pulmonaire ont également été observées. La différence entre les deux bras a été démontrée par l’amélioration de la fonction pulmonaire dans le bras pémétrexed/cisplatine et la détérioration de celle-ci au cours du temps dans le bras contrôle.
Les données chez les patients atteints de mésothéliome pleural malin traités par pémétrexed seul sont limitées. Le pémétrexed a été étudié à la dose de 500 mg/m2 en monothérapie chez 64 patients atteints de mésothéliome pleural malin n’ayant jamais reçu de chimiothérapie. Le taux de réponse globale était de 14,1 %.
CBNPC, traitement en seconde ligne
Une étude clinique de phase 3 multicentrique, randomisée, en ouvert comparant pémétrexed versus docétaxel chez des patients atteints de cancer bronchique non à petites cellules (CBNPC), localement avancé ou métastatique, ayant reçu une chimiothérapie antérieure a montré des temps de survie globale médiane de 8,3 mois pour les patients traités par pémétrexed (population en intention de traiter n = 283) et de 7,9 mois pour les patients traités par docétaxel (population en intention de traiter n = 288). La chimiothérapie antérieure n’incluait pas de pémétrexed. Une analyse de l’impact de l’histologie du CBNPC sur l’effet du traitement en termes de survie globale a été réalisée. Les résultats étaient en faveur du pémétrexed comparé au docétaxel dès lors que l’histologie n’était pas à prédominance épidermoïde (n = 399, 9,3 versus 8,0 mois, risque relatif ajusté = 0,78 ; IC 95 % = 0,61-1,00, p = 0,047) et en faveur du docétaxel dès lors que l’histologie était de type carcinome à cellules épidermoïdes (n = 172, 6,2 versus 7,4 mois, risque relatif ajusté = 1,56 ; IC 95% = 1,08-2,26, p = 0,018). Aucune différence cliniquement significative n’était observée entre les sous-groupes histologiques concernant le profil de sécurité du pémétrexed.
Des données cliniques limitées d’une étude à part de phase 3, randomisée, contrôlée, suggèrent que les données d’efficacité (survie globale, survie sans progression) du pémétrexed sont similaires entre les patients précédemment prétraités par docétaxel (n = 41) et les patients n’ayant pas reçu de traitement antérieur par docétaxel (n = 540).
Tableau 6 - Résultats d’efficacité du pémétrexed versus docétaxel dans le CBNPC - Population en ITT
|
|
Pémétrexed |
Docétaxel |
|
Survie (mois) |
(n = 283) |
(n = 288) |
|
Médiane (mois)
|
8,3 |
7,9 |
|
IC 95 % pour la médiane |
(7,0 - 9,4) |
(6,3 - 9,2) |
|
Risque relatif
|
0,99 |
|
|
IC 95 % pour le risque relatif
|
(0,82 - 1,20) |
|
|
Test de non-infériorité (risque relatif) valeur du p |
0,226 |
|
|
Survie sans progression (mois) |
(n = 283) |
(n = 288) |
|
Médiane |
2,9 |
2,9 |
|
Risque relatif (IC 95 %) |
0,97 (0,82 - 1,16) |
|
|
Temps jusqu’à échec du traitement (mois) |
(n = 283) |
(n = 288) |
|
Médian
|
2,3 |
2,1 |
|
Risque relatif (IC 95 %) |
0,84 (0,71 - 0,997) |
|
|
Réponse (n : qualifié pour la réponse) |
(n = 264) |
(n = 274) |
|
Taux de réponse (%) (IC 95 %)
|
9,1 (5,9 - 13,2) |
8,8 (5,7 - 12,8) |
|
Maladie stable (%) |
45,8 |
46,4 |
Abréviations : IC = intervalle de confiance; n = population totale.
CBNPC, traitement en première ligne
Une étude clinique de phase 3 multicentrique, randomisée, en ouvert comparant pémétrexed + cisplatine versus gemcitabine + cisplatine chez les patients chimio-naïfs atteints de CBNPC localement avancé ou métastatique (stade IIIb ou IV) a montré que le pémétrexed + cisplatine (population en intention de traiter [ITT] n = 862) avait atteint son objectif principal et montrait une efficacité clinique similaire à la gemcitabine + cisplatine (population en ITT n = 863) en survie globale (risque relatif ajusté 0,94 ; IC 95 % = 0,84-1,05). Tous les patients inclus dans cette étude avaient un Performance Status ECOG de 0 ou 1.
L’analyse primaire d’efficacité était basée sur la population en ITT. Les analyses de sensibilité des principaux critères d’efficacité ont également été évaluées sur la population qualifiée au protocole (QP). Les analyses d’efficacité utilisant la population QP sont en accord avec celles utilisant la population en ITT et soutiennent la non-infériorité de pémétrexed-cisplatine versus gemcitabine-cisplatine.
La survie sans progression (SSP) et le taux de réponse globale étaient similaires entre les bras de traitement : la médiane de la SSP était de 4,8 mois pour PEMETREXED ZENTIVA + cisplatine versus 5,1 mois pour gemcitabine plus cisplatine (risque relatif ajusté 1,04 ; IC 95 % = 0,94-1,15), et le taux de réponse globale était de 30,6 % (IC 95 % = 27,3-33,9) pour pémétrexed +cisplatine versus 28,2 % (IC 95 % = 25,0-31,4) pour gemcitabine + cisplatine. Les données sur la SSP étaient partiellement confirmées par une revue indépendante (400/1 725 patients étaient sélectionnés au hasard pour cette revue).
L’analyse de l’impact de l’histologie du CBNPC sur la survie globale a démontré des différences cliniquement pertinentes en termes de survie en fonction de l’histologie, voir tableau ci-dessous.
Tableau 7 - Résultats d’efficacité de pémétrexed + cisplatine versus gemcitabine + cisplatine en première ligne de traitement du cancer bronchique non à petites cellules – population en ITT et sous-groupes histologiques
|
Population en ITT et sous-groupes histologiques |
Médiane de survie globale en mois (IC 95 %) |
Risque relatif ajusté (IC 95 %) |
Supériorité valeur p |
|||
|
Pémétrexed + cisplatine |
Gemcitabine + cisplatine |
|||||
|
Population en ITT (N = 1725) |
10,3 (9,8 - 11,2) |
N = 862 |
10,3 (9,6 - 10,9) |
N = 863 |
0,94a (0,84 - 1,05) |
0,259 |
|
Adénocarcinome (N = 847) |
12,6 (10,7 - 13,6) |
N = 436 |
10,9 (10,2 - 11,9) |
N = 411 |
0,84 (0,71-0,99) |
0,033 |
|
Grandes cellules (N = 153) |
10,4 (8,6 - 14,1) |
N = 76 |
6,7 (5,5 - 9,0) |
N = 77 |
0,67 (0,48-0,96) |
0,027 |
|
Autre (N = 252) |
8,6 (6,8 - 10,2) |
N = 106 |
9,2 (8,1 - 10,6) |
N = 146 |
1,08 (0,81-1,45) |
0,586 |
|
Cellules squameuses (N = 473) |
9,4 (8,4 - 10,2) |
N = 244 |
10,8 (9,5 - 12,1) |
N = 229 |
1,23 (1,00-1,51) |
0,050 |
Abréviations : IC = intervalle de confiance ; ITT = population en intention de traiter ; N = taille population totale.
a Statistiquement significatif pour la non-infériorité, un intervalle de confiance entier pour le risque relatif bien en-dessous de la marge de non-infériorité de 1,17645 (p < 0,001).
Graphique de Kaplan Meier sur la survie globale par histologie
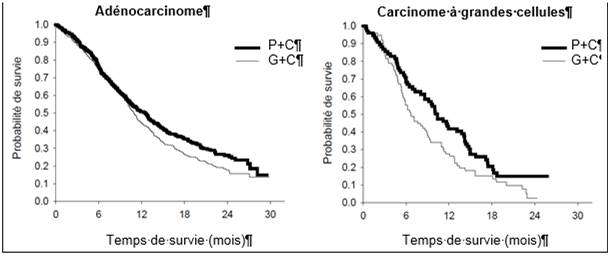
Aucune différence cliniquement significative n’était observée entre les sous-groupes histologiques concernant le profil de sécurité de pémétrexed + cisplatine.
Les patients traités avec pémétrexed et cisplatine nécessitaient moins de transfusions (16,4 % vs. 28,9 %, p < 0,001), de transfusions de globules rouges (16,1 % vs. 27,3 %, p < 0,001) et de transfusions de plaquettes (1,8 % vs. 4,5 %, p = 0,002). Les patients nécessitaient également une administration moindre d’érythropoïétine/darbopoïétine (10,4 % vs. 18,1 %, p < 0,001), G-CSF/ GM-CSF (3,1 % vs. 6,1 %, p = 0,004) et de préparations à base de fer (4,3 % vs. 7,0 %, p = 0,021).
CBNPC, traitement de maintenance
JMEN
Une étude clinique de phase 3 (JMEN) multicentrique, randomisée, en double-aveugle, contrôlée versus placebo, a comparé l’efficacité et la sécurité du traitement de maintenance par pémétrexed + meilleurs soins de support (BSC) (n = 441) par rapport au placebo + meilleurs soins de support (BSC) (n = 222) chez des patients atteints de cancer bronchique non à petites cellules localement avancé (stade IIIB) ou métastatique (stade IV) dont la maladie n’a pas progressé après 4 cycles de traitement en première ligne avec un doublet contenant du cisplatine ou du carboplatine en association avec la gemcitabine, le paclitaxel ou le docétaxel. Le doublet en traitement de première ligne contenant le pémétrexed n’était pas inclus. Tous les patients inclus dans cette étude avaient un Performance Status ECOG de 0 ou 1. Les patients ont reçu le traitement de maintenance jusqu’à progression de la maladie. L’efficacité et la sécurité ont été évaluées dès randomisation après avoir achevé le traitement en première ligne (induction). La médiane du nombre de cycles de traitement de maintenance reçus par les patients a été de 5 cycles dans le bras pémétrexed et de 3,5 dans le bras placebo. Un total de 213 patients (48,3 %) a achevé ≥ 6 cycles de traitement et un total de 103 patients (23,4 %) a achevé ≥ 10 cycles de traitement avec pémétrexed.
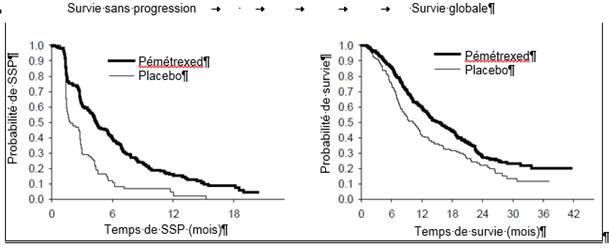
L’étude a atteint son objectif principal et a montré une amélioration statistiquement significative en SSP dans le bras pémétrexed par rapport au bras placebo (n = 581, population revue indépendamment ; médiane de 4,0 mois et 2,0 mois, respectivement) (risque relatif = 0,60, IC 95 % = 0,49-0,73, p < 0,00001). La revue indépendante des scanners des patients a confirmé les conclusions de l’évaluation faite par l’investigateur concernant la SSP. La survie globale médiane pour la population globale (n = 663) était de 13,4 mois pour le bras pémétrexed et 10,6 mois pour le bras placebo, risque relatif = 0,79 (IC 95 % = 0,65-0,95 ; p = 0,01192).
En accord avec les autres études cliniques avec le pémétrexed, une différence en termes d’efficacité en fonction de l’histologie du CBNPC a été observée dans l’étude JMEN. Pour les patients atteints de CBNPC dès lors que l’histologie n’est pas à prédominance épidermoïde (n = 430, population revue indépendamment), la SSP médiane était de 4,4 mois pour le bras pémétrexed et de 1,8 mois pour le bras placebo, risque relatif = 0,47 (IC 95 % = 0,37-0,60, p = 0,00001). La survie globale médiane pour les patients atteints de CBNPC dès lors que l’histologie n’est pas à prédominance épidermoïde (n = 481) était de 15,5 mois pour le bras pémétrexed et 10,3 mois pour le bras placebo, risque relatif = 0,70 (IC 95 % = 0,56-0,88, p = 0,002). En incluant la phase d’induction, la survie globale médiane chez les patients atteints de CBNPC dès lors que l’histologie n’est pas à prédominance épidermoïde était de 18,6 mois pour le bras pémétrexed et 13,6 mois pour le bras placebo, risque relatif = 0,71 (IC 95 % = 0,56-0,88, p = 0,002).
Les résultats sur la SSP et la survie globale chez les patients avec une histologie de type épidermoïde n’ont suggéré aucun avantage pour le pémétrexed par rapport au placebo.
Il n’y a pas eu de différences cliniquement pertinentes observées concernant le profil de sécurité du pémétrexed au sein des sous-groupes histologiques.
JMEN : Graphique de Kaplan Meier sur la survie sans progression (SSP) et la survie globale vs. placebo chez les patients atteints de CBNPC dès lors que l’histologie n’est pas à prédominance épidermoïde
PARAMOUNT
Une étude clinique de phase 3 (PARAMOUNT) multicentrique, randomisée, en double-aveugle, contrôlée versus placebo, a comparé l’efficacité et la sécurité du pémétrexed poursuivi en traitement de maintenance + meilleurs soins de support (BSC) (n = 359) par rapport au placebo + meilleurs soins de support (BSC) (n = 180) chez des patients atteints de CBNPC localement avancé (stade IIIB) ou métastatique (stade IV) dès lors que l’histologie n’est pas à prédominance épidermoïde et dont la maladie n’a pas progressé après 4 cycles de traitement en première ligne avec un doublet de pémétrexed associé au cisplatine. Parmi les 939 patients traités par pémétrexed + cisplatine en induction, 539 patients ont été randomisés pour un traitement de maintenance par pémétrexed ou par placebo. Parmi les patients randomisés, 44,9 % avaient une réponse complète ou partielle et 51,9 % avaient une maladie stable suite au traitement pémétrexed + cisplatine en induction. Les patients randomisés pour le traitement de maintenance devaient avoir un Performance Status ECOG de 0 ou 1. La durée médiane entre le début du traitement pémétrexed + cisplatine en induction et le début du traitement de maintenance était de 2,96 mois pour les deux bras de traitement (bras pémétrexed et bras placebo). Les patients randomisés ont reçu le traitement de maintenance jusqu’à progression de la maladie. L’efficacité et la sécurité ont été évaluées à partir de la randomisation après avoir achevé le traitement en première ligne (induction). Les patients ont reçu une médiane de 4 cycles de traitement de maintenance avec pémétrexed et 4 cycles de placebo. Un total de 169 patients (47,1 %) ont reçu au moins 6 cycles de PEMETREXED ZENTIVA en traitement de maintenance, ce qui représente un total d’au moins 10 cycles de pémétrexed.
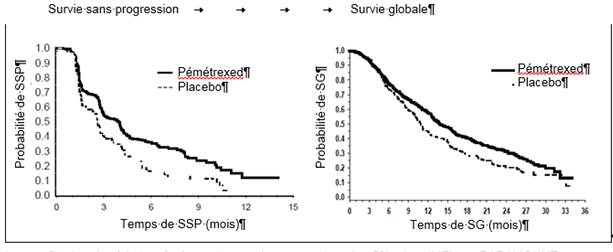
L’étude a atteint son objectif principal et a montré une amélioration statistiquement significative de la survie sans progression (SSP) dans le bras pémétrexed par rapport au bras placebo (n = 472, revue indépendante de la population ; médianes respectives de 3,9 mois et 2,6 mois) (risque relatif = 0,64, IC à 95 % = 0,51-0,81, p = 0,0002). La revue indépendante des scanners des patients a confirmé les conclusions de l’évaluation faite par l’investigateur concernant la SSP. Pour les patients randomisés, la SSP médiane évaluée par l’investigateur, mesurée depuis le début du traitement par pémétrexed plus cisplatine en induction, était de 6,9 mois pour le bras pémétrexed et 5,6 mois pour le bras placebo (risque relatif = 0,59, IC à 95% = 0,47-0,74).
Suite à un traitement d’induction avec pémétrexed + cisplatine (4 cycles), le traitement par pémétrexed était statistiquement supérieur au placebo pour la survie globale (SG) (médiane de 13,9 mois vs. 11,0 mois, HR = 0,78, IC 95 % = 0,64-0,96, p = 0,0195). Au moment de l’analyse finale de la survie, 28,7 % des patients étaient en vie ou perdus de vue dans le bras pémétrexed vs. 21,7 % dans le bras placebo.
L’effet relatif du traitement par pémétrexed était constant au sein des sous-groupes (incluant le stade de la maladie, la réponse à l’induction, le Performance Status ECOG, le statut de fumeur, le sexe, l’histologie et l’âge) et similaire à celui observé dans les analyses de SG et SSP non ajustées. Les taux de survie à 1 an et à 2 ans des patients sous pémétrexed étaient de 58 % et 32 % respectivement, comparés à 45 % et 21 % pour les patients sous placebo. Depuis le début du traitement d’induction de première ligne avec pémétrexed + cisplatine, la SG médiane des patients était de 16,9 mois pour le bras pémétrexed et de 14,0 mois pour le bras placebo (HR = 0,78, IC 95 % = 0,64-0,96). Le pourcentage des patients ayant reçu un traitement après l’étude était de 64,3 % pour le pémétrexed et 71,7 % pour le placebo.
PARAMOUNT : Graphique de Kaplan Meier sur la survie sans progression (SSP) et la survie globale (SG) pour le pémétrexed poursuivi en maintenance vs. placebo chez les patients atteints de CBNPC dès lors que l’histologie n’est pas à prédominance épidermoïde (mesurées depuis la randomisation)
Les profils de sécurité du pémétrexed en maintenance dans les 2 études JMEN et PARAMOUNT étaient similaires.
5.2. Propriétés pharmacocinétiques 
Les paramètres pharmacocinétiques du pémétrexed ne sont pas influencés par l’administration concomitante de cisplatine. La supplémentation en acide folique par voie orale et en vitamine B12 par voie intramusculaire n’affecte pas la pharmacocinétique du pémétrexed.
5.3. Données de sécurité préclinique 
L’administration de pémétrexed chez des souris mâles a eu des effets toxiques sur la reproduction, caractérisés par une réduction de la fertilité et par une atrophie testiculaire.
Dans une étude conduite chez le chien beagle avec injection de bolus intraveineux pendant 9 mois, des effets sur les testicules (dégénérescence/nécrose de l’épithélium séminifère) ont été observés. Cela suggère que le pémétrexed peut altérer la fertilité masculine. La fertilité féminine n’a pas été étudiée.
Le pémétrexed n’a pas montré de potentiel mutagène, que ce soit dans le test d’induction d’aberrations chromosomiques in vitro sur cellules d’ovaire de hamster chinois (CHO) ou dans le test d’Ames. Le pémétrexed s’est montré clastogène dans le test in vivo sur micronoyaux de souris.
Il n’a pas été conduit d’étude sur le potentiel carcinogène du pémétrexed.
L-arginine, L-cystéine, propylène glycol, acide citrique, eau pour préparations injectables
PEMETREXED ZENTIVA contient l’excipient L-arginine. La L-arginine est incompatible avec le cisplatine car elle provoque une dégradation du cisplatine. Ce médicament ne doit pas être mélangé avec d’autres médicaments.
Les voies intraveineuses doivent être rincées après l’administration de PEMETREXED ZENTIVA.
Flacon non entamé
2 ans
Solution diluée – durée et conditions de conservation en cours d’utilisation
La stabilité physique et chimique de la solution de pémétrexed diluée avec une solution de dextrose à 5% dans une poche de perfusion en chlorure de polyvinyle ou en polyoléfine et diluée avec une solution de chlorure de sodium à 0,9% (solution saline) pour perfusion dans une poche en polyvinyle a été démontrée pendant 24 heures dans l’obscurité, à température réfrigérée (2 °- 8 °C).
La stabilité chimique et physique en cours d'utilisation de la solution de pémétrexed diluée avec une solution de chlorure de sodium à 0,9 % (solution saline) pour perfusion dans une poche à perfusion en polyoléfine a été démontrée pendant 3 jours dans l'obscurité à température réfrigérée (2-8 °C).
Seringue à spike pour chimiothérapie – durée et conditions de conservation en cours d’utilisation
La stabilité chimique et physique en cours d'utilisation de la solution à diluer pour perfusion de pémétrexed 25 mg/mL insérée dans le flacon avec une seringue à spike pour chimiothérapie a été démontrée pendant 7 jours dans l'obscurité à température réfrigérée (2-8 °C).
D’un point de vue microbiologique, le produit devrait être utilisé immédiatement. S’il n’est pas utilisé immédiatement, la durée et les conditions de conservation sont sous la responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures entre 2 °C et 8 °C.
À conserver à l’abri de la lumière.
6.4. Précautions particulières de conservation 
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne pas congeler.
Pour les précautions de conservation du médicament après dilution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur 
PEMETREXED ZENTIVA est fourni dans des flacons de verre de type I contenant 4 ml, 20 ml ou 40 ml de solution à diluer. Les flacons sont fermés par un bouchon en caoutchouc (bromobutyle), un capuchon et un opercule.
Chaque flacon de 4 ml de solution à diluer (opercule ivoire) contient 100 mg de pémétrexed (sous forme de pémétrexed diarginine).
Chaque flacon de 20 ml de solution à diluer (opercule bleu) contient 500 mg de pémétrexed (sous forme de pémétrexed diarginine).
Chaque flacon de 40 ml de solution à diluer (opercule vert) contient 1 000 mg de pémétrexed (sous forme de pémétrexed diarginine).
Boîte de 1 flacon.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
1. Utiliser des techniques aseptiques pour la dilution de la solution de pémétrexed pour administration par perfusion intraveineuse.
2. Calculer la dose et le nombre de flacons de pémétrexed nécessaires. Chaque flacon contient un excès de pémétrexed pour faciliter l’administration de la quantité prescrite. Chaque flacon contient une solution contenant 25 mg/ml de pémétrexed.
3. Le volume approprié de la solution de pémétrexed doit être dilué pour atteindre 100 ml, avec une solution de chlorure de sodium à 0,9 % ou une solution de dextrose à 5 % pour préparations injectables, sans conservateur, et administré en perfusion intraveineuse de 10 minutes.
4. Les solutions pour perfusion de pémétrexed préparées comme indiqué ci-dessus sont compatibles avec les poches et les tubulures de perfusion intraveineuse en chlorure de polyvinyle (PVC) et polyoléfine.
5. Les médicaments pour usage parentéral doivent faire l’objet d’une inspection visuelle avant administration, pour détecter la présence éventuelle de particules ou d’une modification de la couleur. Si des particules sont présentes, ne pas administrer.
6. Les solutions de pémétrexed sont à usage unique seulement. Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur relative aux agents cytotoxiques.
Préparation et précautions d’administration : comme pour tout agent anticancéreux potentiellement toxique, des précautions doivent être prises lors de la manipulation et de la préparation des solutions pour perfusion de pémétrexed. L’utilisation de gants est recommandée. En cas de contact de la solution de pémétrexed avec la peau, laver la peau immédiatement et abondamment avec de l’eau et du savon. En cas de contact de la solution de pémétrexed avec les muqueuses, rincer abondamment avec de l’eau. Le pémétrexed n’est pas un agent vésicant. Il n’existe pas d’antidote spécifique en cas d’extravasation de pémétrexed. Quelques cas d’extravasation de pémétrexed ont été rapportés et ont été considérés comme non graves par les investigateurs. Les extravasations devraient être prises en charge selon les pratiques standards locales appliquées aux autres agents non vésicants.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
35 RUE DU VAL DE MARNE
75013 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 550 518 1 7 : Flacon (verre) de 4 mL. Boîte de 1.
· 34009 550 518 3 1 : Flacon (verre) de 20 mL. Boîte de 1.
· 34009 550 518 4 8 : Flacon (verre) de 40 mL. Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I
Médicament soumis à prescription hospitalière. Prescription réservée aux spécialistes en oncologie ou en hématologie ou aux médecins compétents en cancérologie. Médicament nécessitant une surveillance particulière pendant le traitement.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |