
NephroMAG 0,2 mg, trousse pour préparation radiopharmaceutique - Résumé des caractéristiques du produit |
 |
|
ANSM - Mis à jour le : 19/10/2023
NephroMAG 0,2 mg trousse pour préparation radiopharmaceutique
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
La trousse pour préparation radiopharmaceutique renferme deux flacons distincts : (1) et (2).
Le flacon (1) contient 0,2 mg de mercaptoacétyltriglycine (mertiatide).
Le flacon (2) contient 2,5 mL de solution tampon phosphate.
Le radionucléide n'est pas inclus dans la trousse pour préparation radiopharmaceutique. La trousse contient tous les composants non radioactifs nécessaires à la reconstitution de la solution injectable de mertiatide marqué au technétium (99mTc).
Pour la liste complète des excipients, voir rubrique 6.1.
Trousse pour préparation radiopharmaceutique pour injection.
Propriétés du produit après radiomarquage : pH : 7,1 - 7,5.
Solution aqueuse incolore, transparente à légèrement opalescente.
4.1. Indications thérapeutiques 
Ce médicament est à usage diagnostique uniquement.
Après reconstitution et radiomarquage avec la solution de pertechnétate (99mTc) de sodium, l'agent radiopharmaceutique obtenu, le mertiatide marqué au technétium (99mTc) est indiqué pour l'évaluation des affections néphrologiques et urologiques, notamment pour l'étude de la fonction, de la morphologie et de la perfusion rénales et le drainage des voies urinaires.
4.2. Posologie et mode d'administration 
Chez l'adulte et le sujet âgé
Chez l'adulte et le sujet âgé, les activités recommandées se situent entre 40 et 200 MBq, en fonction de la pathologie à étudier et de la méthode à employer.
Chez l'enfant et l'adolescent de moins de 18 ans
Bien que NephroMAG puisse être employé chez des patients pédiatriques, aucune étude n'a formellement été réalisée. L'expérience clinique indique que pour une utilisation pédiatrique l'activité doit être réduite. Compte tenu de la variabilité du rapport entre la taille et le poids corporel de ces patients, il est parfois plus approprié d'ajuster l'activité en fonction de la surface corporelle. Une approche pratique consiste à adopter les recommandations du « Paediatric Task Group of the European Association of Nuclear Medicine » (EANM). Voir le tableau ci-après.
La réduction des doses de radioactivité à moins de 10 % de l'activité adulte conduit généralement à des procédures peu satisfaisantes d'un point de vue technique.
Fraction de l'activité adulte (Paediatric Task Group EANM, 1990).
|
3 kg = 0,10 |
22 kg = 0,50 |
42 kg = 0,78 |
|
4 kg = 0,14 |
24 kg = 0,53 |
44 kg = 0,80 |
|
6 kg = 0,19 |
26 kg = 0,56 |
46 kg = 0,82 |
|
8 kg = 0,23 |
28 kg = 0,58 |
48 kg = 0,85 |
|
10 kg = 0,27 |
30 kg = 0,62 |
50 kg = 0,88 |
|
12 kg = 0,32 |
32 kg = 0,65 |
52 - 54 kg = 0,90 |
|
14 kg = 0,36 |
34 kg = 0,68 |
56 - 58 kg = 0,92 |
|
16 kg = 0,40 |
36 kg = 0,71 |
60 - 62 kg = 0,96 |
|
18 kg = 0,44 |
38 kg = 0,73 |
64 - 66 kg = 0,98 |
|
20 kg = 0,46 |
40 kg = 0,76 |
68 kg = 0,99 |
Mode d’administration
NephroMAG est administré après reconstitution et radiomarquage.
Ce médicament radiopharmaceutique ne peut être administré que par un personnel dûment autorisé.
L'agent radiopharmaceutique est injecté par voie intraveineuse, voir rubrique 4.4 Mises en garde générales.
L'examen scintigraphique débute généralement aussitôt après l'injection.
Pour des instructions détaillées sur les conditions de préparation du patient, voir rubrique 4.4.
Les instructions pour l'administration et l'utilisation de NephroMAG sont données aux rubriques 6.6 et 12.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi 
Les agents radiopharmaceutiques ne doivent être manipulés que par un personnel qualifié, titulaire d'une autorisation gouvernementale appropriée d'utilisation et de manipulation des radionucléides.
Bien que la probabilité de survenue d'effets indésirables à type de réactions anaphylactiques soit très faible (voir rubrique 4.8), les médicaments et matériels nécessaires au traitement de ces rares réactions d'hypersensibilité (par exemple adrénaline, corticostéroïdes et antihistaminiques) doivent être disponibles pour administration immédiate en cas de réactions allergiques au cours de l'administration du médicament radiopharmaceutique.
De faibles quantités d'impuretés technétiées peuvent être présentes et/ou se former au cours du processus de radiomarquage. Certaines de ces impuretés diffusant dans le foie et étant excrétées via la vésicule biliaire, elles peuvent perturber la phase finale (après 30 minutes) d'une scintigraphie rénale dynamique, en raison du chevauchement du rein et du foie dans la région examinée.
L'oubli de l'incorporation de la solution tampon lors de la reconstitution de l'agent radiopharmaceutique entraîne une irritation au point d'injection.
Préparation du patient
Afin de minimiser la dose de radiation absorbée, une hydratation appropriée du patient doit être encouragée avant le début de l'examen afin de permettre des mictions fréquentes pendant les premières heures suivant l'injection.
Mises en garde générales
Cet agent radiopharmaceutique ne peut être réceptionné, utilisé et administré que par des personnes autorisées, dans un service clinique agréé. Sa réception, sa conservation, son utilisation, son transfert et son élimination sont soumis aux réglementations en vigueur et/ou à la possession d'une autorisation des autorités officielles locales compétentes. Les produits radiopharmaceutiques doivent être préparés par l'utilisateur de manière à satisfaire aux normes de radioprotection et de qualité pharmaceutique. Il convient de respecter les précautions d'asepsie appropriées, conformément aux Bonnes Pratiques de Fabrication des spécialités pharmaceutiques.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
4.6. Fertilité, grossesse et allaitement 
L'expérience clinique de l'utilisation du mertiatide marqué au technétium (99mTc) nous fait défaut. Aucune étude animale n'a évalué l'embryotoxicité de ce médicament radiopharmaceutique.
S'il est nécessaire d'administrer un médicament radioactif à une femme en âge de procréer, il est nécessaire de toujours vérifier que celle-ci n'est pas enceinte. Tout retard de cycle chez une femme doit laisser supposer l'éventualité d'une grossesse jusqu'à preuve du contraire.
Les radionucléides utilisés chez la femme enceinte délivrent également des doses de radiation au fœtus. Sur la base d'une fonction rénale normale, l'administration d'une dose de mertiatide marqué avec 200 MBq de technétium (99mTc) se traduit par une dose absorbée par l'utérus de 2,4 mGy.
L'utilisation de techniques alternatives ne faisant pas appel aux radiations ionisantes doit être considérée.
Le mertiatide marqué au technétium (99mTc) ne doit être administré pendant la grossesse qu'en cas d'absolue nécessité. Le bénéfice escompté pour la femme enceinte doit l'emporter sur le risque pour le fœtus.
La plus faible exposition possible aux radiations permettant l'acquisition des données cliniques recherchées doit alors être retenue.
Avant toute administration d'un produit de médecine nucléaire à une femme allaitante, il convient d'envisager, dans la mesure du raisonnable, le report éventuel de l'examen après l'arrêt de l’allaitement ; on accordera également la plus grande attention au choix de l'agent radiopharmaceutique, compte tenu de l'excrétion de la radioactivité dans le lait maternel. Si l'administration d'un radiopharmaceutique s'avère indispensable, l'allaitement doit être interrompu pendant 24 heures et le lait exprimé pendant cette période doit être jeté. En outre, dans le cadre des mesures de radioprotection, il est recommandé que la mère évite tout contact étroit avec l'enfant pendant les 24 premières heures suivant l'injection.
En cas d'incertitude, il est généralement conseillé de reprendre l'allaitement seulement lorsque la radioactivité présente dans le lait n'expose pas l'enfant à une dose de radiation supérieure à 1 mSv.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
De très rares réactions anaphylactoïdes peu sévères ont été rapportées (< 0,01 %), caractérisées par une poussée d'urticaire, un gonflement des paupières et de la toux. Des réactions vasovagales de faible intensité ont parfois été rapportées. Une convulsion cérébrale chez un adolescent de quinze ans sous sédatif a été décrite, mais la relation causale à l'administration de l'agent radiopharmaceutique n'a pas été établie.
L'exposition aux rayonnements ionisants est associée à l'induction de cancers et au développement potentiel d'anomalies congénitales. Dans le cas des examens de médecine nucléaire à visée diagnostique, les connaissances actuelles suggèrent que la fréquence de ces effets indésirables est très faible en raison des faibles doses de radiation utilisées.
Pour la plupart des examens de médecine nucléaire, la dose de radiations délivrée (E : dose efficace) est inférieure à 20 mSv. Le calcul de la dose d'exposition dans le pire des cas donne 2 mSv pour un adulte et 0,76 mSv pour un enfant d'1 an après injection de 200 et 20 MBq respectivement.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Le risque de surdosage de mertiatide marqué au technétium (99mTc) est essentiellement théorique et ne peut très vraisemblablement être lié qu'à une exposition excessive aux radiations.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Aux doses chimiques envisagées, le mertiatide marqué au technétium (99mTc) n'a pas d'action pharmacodynamique connue.
La mesure de l'activité en fonction du temps au niveau des reins permet l'évaluation de la perfusion et de la fonction rénale, ainsi que du drainage des voies urinaires.
5.2. Propriétés pharmacocinétiques 
Après injection intraveineuse, le mertiatide marqué au technétium (99mTc) est rapidement éliminé du sang par les reins. Le mertiatide marqué au technétium (99mTc) se lie aux protéines plasmatiques dans la proportion de 78 à 90 %. Dans le cas d'une fonction rénale normale, 70 % de la dose administrée sont excrétés dans les 30 min, et plus de 95 % dans les 3 heures. Ces taux sont fonction de la pathologie rénale et urogénitale. Le mécanisme d'excrétion repose principalement sur la sécrétion tubulaire. La filtration glomérulaire contribue à 11 % de la clairance totale.
5.3. Données de sécurité préclinique 
Chlorure stanneux dihydraté, tartrate R,R disodique dihydraté, hydroxyde de sodium, acide chlorhydrique.
Flacon (2) :
Monohydrogénophosphate de sodium dihydraté, dihydrogénophosphate de sodium dihydraté, acide chlorhydrique, eau pour préparations injectables.
Les flacons sont exempts d'agent de conservation.
15 mois après la date de fabrication.
Après radiomarquage: 8 heures conservé à une température inférieure à 25°C.
6.4. Précautions particulières de conservation 
Conserver au réfrigérateur à une température comprise entre 2 et 8°C.
Conserver dans le conditionnement d'origine, à l'abri de la lumière.
Pour les conditions de conservation du produit après radiomarquage du médicament, voir la rubrique 6.3.
Le stockage des médicaments radiopharmaceutiques doit être effectué conformément aux réglementations nationales relatives aux produits radioactifs.
6.5. Nature et contenu de l'emballage extérieur 
Le produit est contenu dans un flacon de 10 mL en verre. Les flacons sont fermés par des bouchons en caoutchouc butylé et scellés avec des capsules en aluminium. NephroMAG est présenté en conditionnements de cinq (5) flacons de poudre (substance active : mertiatide) accompagnés de cinq (5) flacons de 2,5 mL de solution tampon phosphate stérile dans une boîte.
6.6. Précautions particulières d’élimination et de manipulation 
L'administration d'agents radiopharmaceutiques génère des risques pour d'autres personnes par irradiation externe ou contaminations par des éclaboussures d'urine, de vomissement, etc. Des mesures de protection contre les rayonnements ionisants conformes aux réglementations nationales en vigueur pour les substances radioactives doivent donc être prises.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
BAUTZNER LANDSTRASSE 400
01328 DRESDEN
ALLEMAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 566 896 1 3 : 10 mL en flacon (verre). Boîte de 5 flacons.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
|
Dose absorbée : |
||||||
|
Dose absorbée par activité administrée (mGy/MBq) |
|
|||||
|
Organes |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
Glandes surrénales |
0,00039 |
0,00051 |
0,00082 |
0,00120 |
0,00250 |
|
|
Vessie |
0,11000 |
0,14000 |
0,17000 |
0,18000 |
0,32000 |
|
|
Surfaces osseuses |
0,00130 |
0,00160 |
0,00210 |
0,00240 |
0,00430 |
|
|
Cerveau |
0,00010 |
0,00013 |
0,00022 |
0,00035 |
0,00061 |
|
|
Glandes mammaires |
0,00010 |
0,00014 |
0,00024 |
0,00039 |
0,00082 |
|
|
Vésicule biliaire |
0,00057 |
0,00087 |
0,00200 |
0,00170 |
0,00280 |
|
|
Appareil digestif |
|
|||||
|
Estomac |
0,00039 |
0,00049 |
0,00097 |
0,00130 |
0,00250 |
|
|
Intestin grêle |
0,00230 |
0,00300 |
0,00420 |
0,00460 |
0,00780 |
|
|
Côlon |
0,00340 |
0,00430 |
0,00590 |
0,00600 |
0,00980 |
|
|
Côlon supérieur (ascendant) |
0,00170 |
0,00230 |
0,00340 |
0,00400 |
0,00670 |
|
|
Côlon inférieur (sigmoïde) |
0,00570 |
0,00700 |
0,00920 |
0,00870 |
0,01400 |
|
|
||||||
|
Cœur |
0,00018 |
0,00024 |
0,00037 |
0,00057 |
0,00120 |
|
|
Reins |
0,00340 |
0,00420 |
0,00590 |
0,00840 |
0,01500 |
|
|
Foie |
0,00031 |
0,00043 |
0,00075 |
0,00110 |
0,00210 |
|
|
Poumons |
0,00015 |
0,00021 |
0,00033 |
0,00050 |
0,00100 |
|
|
Muscles |
0,00140 |
0,00170 |
0,00220 |
0,00240 |
0,00410 |
|
|
||||||
|
Œsophage |
0,00013 |
0,00018 |
0,00028 |
0,00044 |
0,00082 |
|
|
Ovaires |
0,00540 |
0,00690 |
0,00870 |
0,00870 |
0,01400 |
|
|
Pancréas |
0,00040 |
0,00050 |
0,00093 |
0,00130 |
0,00250 |
|
|
Moelle osseuse |
0,00093 |
0,00120 |
0,00160 |
0,00150 |
0,00210 |
|
|
Peau |
0,00046 |
0,00057 |
0,00083 |
0,00097 |
0,00180 |
|
|
||||||
|
Rate |
0,00036 |
0,00049 |
0,00079 |
0,00120 |
0,00230 |
|
|
Testicules |
0,00370 |
0,00530 |
0,00810 |
0,00870 |
0,01600 |
|
|
Thymus |
0,00013 |
0,00018 |
0,00028 |
0,00044 |
0,00082 |
|
|
Thyroïde |
0,00013 |
0,00016 |
0,00027 |
0,00044 |
0,00082 |
|
|
Utérus |
0,01200 |
0,01400 |
0,01900 |
0,01900 |
0,03100 |
|
|
Autres organes |
0,00130 |
0,00160 |
0,00210 |
0,00220 |
0,00360 |
|
|
Dose efficace (mSv/MBq) |
0,00700 |
0,00900 |
0,01200 |
0,01200 |
0,02200 |
|
|
La paroi vésicale peut contribuer jusqu'à 80 % de la dose efficace. |
|
|||||
|
1 heure |
0,00250 |
0,00310 |
0,00450 |
0,00640 |
0,00640 |
|
|
30 minutes |
0,00170 |
0,00210 |
0,00290 |
0,00390 |
0,00680 |
|
|
Dose absorbée : mertiatide marqué au technétium (99mTc) (Fonction rénale anormale) |
||||||
|
Dose absorbée par activité administrée (mGy/MBq) |
|
|||||
|
Organes |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
Glandes surrénales |
0,00160 |
0,00210 |
0,00320 |
0,00480 |
0,00860 |
|
|
Vessie |
0,08300 |
0,11000 |
0,13000 |
0,13000 |
0,23000 |
|
|
Surfaces osseuses |
0,00220 |
0,00270 |
0,00380 |
0,00500 |
0,00910 |
|
|
Cerveau |
0,00061 |
0,00077 |
0,00130 |
0,00200 |
0,00360 |
|
|
Glandes mammaires |
0,00054 |
0,00070 |
0,00110 |
0,00170 |
0,00320 |
|
|
Vésicule biliaire |
0,00160 |
0,00220 |
0,00380 |
0,00460 |
0,00640 |
|
|
Appareil digestif |
|
|||||
|
Estomac |
0,00120 |
0,00150 |
0,00260 |
0,00350 |
0,00610 |
|
|
Intestin grêle |
0,00270 |
0,00350 |
0,00500 |
0,00600 |
0,01000 |
|
|
Côlon |
0,00350 |
0,00440 |
0,00610 |
0,00690 |
0,01100 |
|
|
Côlon supérieur (ascendant) |
0,00220 |
0,00300 |
0,00430 |
0,00560 |
0,00930 |
|
|
Côlon inférieur (sigmoïde) |
0,00510 |
0,00630 |
0,00850 |
0,00860 |
0,01400 |
|
|
||||||
|
Cœur |
0,00091 |
0,00120 |
0,00180 |
0,00270 |
0,00480 |
|
|
Reins |
0,01400 |
0,01700 |
0,02400 |
0,03400 |
0,05900 |
|
|
Foie |
0,00140 |
0,00180 |
0,00270 |
0,00380 |
0,00660 |
|
|
Poumons |
0,00079 |
0,00110 |
0,00160 |
0,00240 |
0,00450 |
|
|
Muscles |
0,00170 |
0,00210 |
0,00290 |
0,00360 |
0,00640 |
|
|
||||||
|
Œsophage |
0,00074 |
0,00097 |
0,00150 |
0,00230 |
0,00410 |
|
|
Ovaires |
0,00490 |
0,00630 |
0,00810 |
0,00870 |
0,01400 |
|
|
Pancréas |
0,00150 |
0,00190 |
0,00290 |
0,00430 |
0,00740 |
|
|
Moelle osseuse |
0,00150 |
0,00190 |
0,26000 |
0,00310 |
0,00500 |
|
|
Peau |
0,00078 |
0,00096 |
0,00150 |
0,00200 |
0,00380 |
|
|
||||||
|
Rate |
0,00150 |
0,00190 |
0,00290 |
0,00430 |
0,00740 |
|
|
Testicules |
0,00340 |
0,00470 |
0,00710 |
0,00780 |
0,01400 |
|
|
Thymus |
0,00074 |
0,00097 |
0,00150 |
0,00230 |
0,00410 |
|
|
Thyroïde |
0,00073 |
0,00095 |
0,00150 |
0,00240 |
0,00440 |
|
|
Utérus |
0,01000 |
0,01200 |
0,01600 |
0,01600 |
0,02700 |
|
|
Autres organes |
0,00170 |
0,00210 |
0,00280 |
0,00340 |
0,00600 |
|
|
Dose efficace |
0,00610 |
0,00780 |
0,01000 |
0,01100 |
0,19000 |
|
|
Dose absorbée : mertiatide marqué au technétium (99mTc) (Obstruction rénale aiguë latéralisée) |
||||||
|
Dose absorbée par activité administrée (mGy/MBq) |
|
|||||
|
Organes |
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
Glandes surrénales |
0,01100 |
0,01400 |
0,02200 |
0,03200 |
0,05500 |
|
|
Vessie |
0,05600 |
0,07100 |
0,09100 |
0,09300 |
0,17000 |
|
|
Surfaces osseuses |
0,00310 |
0,00400 |
0,00580 |
0,00840 |
0,01700 |
|
|
Cerveau |
0,00011 |
0,00014 |
0,00023 |
0,00039 |
0,00075 |
|
|
Glandes mammaires |
0,00038 |
0,00051 |
0,00100 |
0,00160 |
0,00300 |
|
|
Vésicule biliaire |
0,00620 |
0,00730 |
0,01000 |
0,01600 |
0,02300 |
|
|
Appareil digestif |
|
|||||
|
Estomac |
0,00390 |
0,00440 |
0,00700 |
0,00930 |
0,01200 |
|
|
Intestin grêle |
0,00430 |
0,00550 |
0,00850 |
0,01200 |
0,01900 |
|
|
Côlon |
0,00390 |
0,00500 |
0,00720 |
0,00920 |
0,00150 |
|
|
Côlon supérieur (ascendant) |
0,00400 |
0,00510 |
0,00760 |
0,01000 |
0,01600 |
|
|
Côlon inférieur (sigmoïde) |
0,00380 |
0,00480 |
0,00670 |
0,00820 |
0,01300 |
|
|
||||||
|
Cœur |
0,00130 |
0,00160 |
0,00270 |
0,00400 |
0,00610 |
|
|
Reins |
0,20000 |
0,24000 |
0,33000 |
0,47000 |
0,81000 |
|
|
Foie |
0,00440 |
0,00540 |
0,00810 |
0,01100 |
0,01700 |
|
|
Poumons |
0,00110 |
0,00160 |
0,00250 |
0,00390 |
0,00720 |
|
|
Muscles |
0,00220 |
0,00270 |
0,00370 |
0,00510 |
0,00890 |
|
|
||||||
|
Œsophage |
0,00038 |
0,00054 |
0,00085 |
0,00150 |
0,00230 |
|
|
Ovaires |
0,00380 |
0,00510 |
0,00710 |
0,00920 |
0,01500 |
|
|
Pancréas |
0,00740 |
0,00900 |
0,01300 |
0,01800 |
0,02900 |
|
|
Moelle osseuse |
0,00300 |
0,00360 |
0,00500 |
0,00600 |
0,00830 |
|
|
Peau |
0,00082 |
0,00100 |
0,00150 |
0,00220 |
0,00420 |
|
|
||||||
|
Rate |
0,00980 |
0,01200 |
0,01800 |
0,02600 |
0,04000 |
|
|
Testicules |
0,00200 |
0,00290 |
0,00450 |
0,00500 |
0,00980 |
|
|
Thymus |
0,00038 |
0,00054 |
0,00085 |
0,00150 |
0,00230 |
|
|
Thyroïde |
0,00017 |
0,00023 |
0,00045 |
0,00092 |
0,00160 |
|
|
Utérus |
0,00720 |
0,00870 |
0,01200 |
0,01300 |
0,02200 |
|
|
Autres organes |
0,00210 |
0,00260 |
0,00360 |
0,00470 |
0,00800 |
|
|
Dose efficace |
0,01000 |
0,01200 |
0,01700 |
0,02200 |
0,03800 |
|
11.1 Propriétés physiques nucléaires
Le technétium (99mTc) est obtenu à partir d'un générateur stérile de (99Mo)/(99mTc) et se désintègre en technétium-99 par transition isomérique avec émission d'un rayonnement gamma d'énergie 140/142 keV et une demi-vie de 6,02 heures, lui-même se désintégrant en ruthénium (99Ru) stable. Le technétium (99Tc) peut être considéré comme stable en raison de sa longue demi-vie (214 000 ans).
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
12.1 Instructions pour l'utilisation et la manipulation
Le contenu du flacon (1) doit être radiomarqué au moyen de la solution de pertechnétate (99mTc) de sodium à température ambiante, la réaction de marquage sera arrêtée après 15 minutes par addition de la solution tampon.
Le marquage doit être effectué en utilisant un éluat avec une concentration en radioactivité comprise entre 40 et 500 MBq/mL. Seuls doivent être utilisés les éluats obtenus au moyen d'un générateur de (99mTc), qui a été élué une fois dans les 24 heures qui précèdent.
12.2 Instructions pour le radiomarquage
L'agent radiopharmaceutique sera préparé extemporanément conformément aux instructions de radiomarquage suivantes :
La procédure de marquage doit se dérouler en conditions d'asepsie.
· Placer le flacon (1) à l'intérieur d'un blindage de plomb approprié. Nettoyer le septum en caoutchouc avec un désinfectant approprié et laisser sécher.
· Injecter 8 mL de la solution de pertechnétate (99mTc) de sodium dans le flacon (1) à l'aide d'une seringue. Avec la même seringue, prélever alors dans ce flacon un volume égal d'azote afin d'égaliser les pressions.
· Agiter soigneusement le flacon afin d'humidifier la poudre et d'obtenir la dissolution complète de la totalité de la poudre contenue dans le flacon.
Après un temps de réaction de 15 minutes, transférer un volume de 2 mL de solution tampon du flacon (2) dans le flacon (1) à l'aide d'une seringue neuve. Avec cette même seringue, prélever alors dans ce flacon un volume égal d'azote afin d'égaliser les pressions.
Agiter soigneusement afin de bien mélanger. Mesurer la radioactivité totale et calculer le volume à injecter.
Propriétés du produit après radiomarquage : pH : 7,1-7,5
Solution aqueuse incolore, transparente à légèrement opalescente.
12.3 Instructions pour le contrôle de qualité
Les méthodes suivantes peuvent être employées :
Méthode par CLHP (Chromatographie liquide haute performance)
La pureté radiochimique de la substance marquée est évaluée par chromatographe liquide à haute performance (CLHP) muni d'un détecteur de radioactivité adéquat, sur une colonne RP18 de 25 cm, avec un débit de 1,0 mL/min.
La phase mobile A est constituée d'un mélange dans la proportion de 93/7 d'une solution de phosphate (1,36 g de KH2PO4, ajustée avec du NaOH 0,1 M à pH 6) et d'éthanol. La phase mobile B est constituée d'un mélange 1/9 eau/méthanol.
Utiliser un programme d'élution graduée avec les paramètres suivants :
|
Temps (min): |
Débit (mL/min): |
% A |
% B |
|
|
15 |
1 |
100 |
0 |
|
|
5 |
1 |
0 |
100 |
|
|
5 |
2 |
100 |
0 |
|
Le pic de mertiatide marqué au technétium (99mTc) apparaît à la fin du passage de la phase mobile A.
Le volume d'injection est de 5 μL et la radioactivité totale par canal ne doit pas excéder 30 000.
Conditions :
|
t = 0 |
après 8 heures |
|
|
marqué au technétium (99mTc) |
≥ 94 % |
≥ 94 % |
|
impuretés hydrophiles |
≤ 3,0 % |
≤ 3,0 % |
|
impuretés lipophiles |
≤ 4,0 % |
≤ 4,0 % |
Procédure rapide simplifiée
Cette méthode repose sur l'emploi de cartouches, qui sont largement employées pour le prétraitement de solutions aqueuses avant chromatographie. La cartouche (par exemple, un Sep-Pak C18, Waters) est lavée avec 10 mL d'éthanol absolu, puis avec 10 mL d'acide chlorhydrique 0,001 M. Les résidus restants des solutions sont éliminés avec 5 mL d'air. La solution de mertiatide marqué au technétium (99mTc) (à raison de 0,05 mL) est appliquée sur la cartouche. Eluer au moyen de 10 mL de HCl 0,001 M et recueillir le premier éluat (impuretés hydrophiles). Eluer la cartouche avec un mélange éthanol/solution de chlorure de sodium 9 g/l dans la proportion de 1/1. Ce deuxième éluat contient le (99mTc)-mertiatide. La cartouche renferme les impuretés lipophiles.
Mesurer la radioactivité de chaque fraction. Additionner la radioactivité des éluats et de la cartouche et considérer cette somme comme représentant 100 % de la radioactivité et calculer les pourcentages respectifs.
Veiller à éluer lentement (goutte à goutte).
Condition : mertiatide marqué au technétium (99mTc) ≥ 94 %.
Procédure simplifiée de TLC (chromatographie en couche mince)
Cette méthode est utilisée pour :
a) La détermination du niveau de pertechnétate de technétium (99mTc) (impureté A)
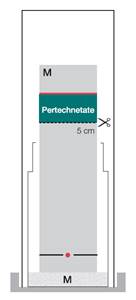
Système chromatographique :
Bandelettes : ITLC-SA
Éluant : méthyléthylcétone
Distance de migration : 6 - 8 cm
Volume : 1 - 2 µl
Détecteur : un détecteur de radiations adapté
Évaluation
Le pertechnétate de technétium (99mTc) migre avec le front de solvant (Rf = 0,8 à 1,0). Si vous ne disposez pas d’un scanner, découpez la bandelette à 5 cm du bord inférieur. Mesurez la radioactivité des deux parties séparément. Calculez l’activité de la partie supérieure par rapport à l’activité totale.
![]()
 Spécification pour le
Spécification pour le ![]() (impureté A) : ≤ 5,0 %
(impureté A) : ≤ 5,0 %
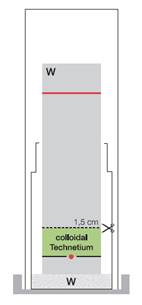
b) La détermination du niveau de technétium (99mTc) sous forme colloïdale (impureté B)
Système chromatographique :
Bandelettes : ITLC-SA
Éluant : eau pour préparations
Distance de migration : 6 - 8 cm
Volume : 1 - 2 µl
Détecteur : un détecteur de radiations adapté
Évaluation
La forme colloïdale de technétium (99mTc) (technétium (99mTc) hydrolysé et réduit) reste au point d’origine (Rf = 0,0 à 0,1). Si vous ne disposez pas d’un scanner, découpez la bandelette à 1,5 cm du bord inférieur. Mesurez la radioactivité des deux parties séparément. Calculez l’activité de la partie inférieure par rapport à l’activité totale.
![]()
Spécification pour la ![]() (impureté B) : ≤ 2,0 %
(impureté B) : ≤ 2,0 %
Calcul de la pureté radiochimique (spécification ≥ 94 %)
Pureté radiochimique = 100 % - (A [%] + B [%])
12.4 Instructions pour l'élimination des déchets
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I
Médicament soumis à prescription médicale.
Les produits radiopharmaceutiques ne doivent être utilisés que par des personnes qualifiées. Ils ne peuvent être délivrés qu'à des praticiens ayant obtenu l'autorisation spéciale prévue à l'article R 1333-24 du Code de la Santé Publique.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |