
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
METVIXIA crème contient 168 mg/g (16,8 %) de substance active (aminolévulinate de méthyle).
METVIXIA est réservé à l’adulte.
METVIXIA crème peut être utilisée dans le traitement de trois maladies différentes. Votre médecin peut vous prescrire METVIXIA pour le traitement de maladies précancéreuses :
· lésions cutanées précancéreuses fines et non pigmentées du visage et du cuir chevelu (kératoses actiniques).
· et pour le traitement de maladies cancéreuses :
o carcinome cutané à croissance lente du tronc, des membres et du cou (carcinome basocellulaire superficiel).
o lésions cancéreuses de la peau non pigmentées (Maladie de Bowen) chez les immunocompétents.
Les lésions doivent être préalablement confirmées par biopsie et un contrôle clinique régulier de la guérison doit être effectué.
Ce médicament n'appartient à aucun groupe générique
 Crème (Composition pour 1 g de crème)
Crème (Composition pour 1 g de crème)
 168 mg
168 mg
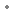 sous forme de : chlorhydrate de méthyl aminolévulinate
sous forme de : chlorhydrate de méthyl aminolévulinate
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 08/02/2017 | Extension d'indication | Le service médical rendu par METVIXIA est modéré dans l’indication de l’AMM « Traitement des kératoses actiniques fines ou non-hyperkératosiques et non pigmentées du visage et du cuir chevelu » dans son utilisation en association à la lumière du jour. |
| Modéré | Avis du 08/02/2017 | Extension d'indication | Le service médical rendu par METVIXIA est modéré dans l’indication de l’AMM « Traitement des kératoses actiniques fines ou non-hyperkératosiques et non pigmentées du visage et du cuir chevelu » dans son utilisation en association à la lumière du jour. |
| Modéré | Avis du 08/02/2017 | Extension d'indication | Le service médical rendu par METVIXIA est modéré dans l’indication de l’AMM « Traitement des kératoses actiniques fines ou non-hyperkératosiques et non pigmentées du visage et du cuir chevelu » dans son utilisation en association à la lumière du jour. |
| Modéré | Avis du 08/02/2017 | Extension d'indication | Le service médical rendu par METVIXIA est modéré dans l’indication de l’AMM « Traitement des kératoses actiniques fines ou non-hyperkératosiques et non pigmentées du visage et du cuir chevelu » dans son utilisation en association à la lumière du jour. |
| Important | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | Le service médical rendu par METVIXIA est important dans le traitement des carcinomes intraépidermiques (maladie de Bowen) non pigmentés, lorsque la chirurgie est impossible, chez les sujets immunocompétents. Le service médical rendu par METVIXIA dans le traitement des carcinomes basocellulaires non récidivants du tronc des membres et du cou est important chez les patients inopérables en cas de lésions étendues, multiples ou de localisation difficilement accessible à la chirurgie. |
| Modéré | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | Le service médical rendu par METVIXIA dans le traitement des carcinomes basocellulaires non récidivants du tronc des membres et du cou est modéré dans les autres cas. Le service médical rendu par METVIXIA est modéré dans le traitement des lésions de kératose actinique multiples fines ou non-hyperkératosiques et non pigmentées du visage et du cuir chevelu. |
| Important | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | Le service médical rendu par METVIXIA est important dans le traitement des carcinomes intraépidermiques (maladie de Bowen) non pigmentés, lorsque la chirurgie est impossible, chez les sujets immunocompétents. Le service médical rendu par METVIXIA dans le traitement des carcinomes basocellulaires non récidivants du tronc des membres et du cou est important chez les patients inopérables en cas de lésions étendues, multiples ou de localisation difficilement accessible à la chirurgie. |
| Modéré | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | Le service médical rendu par METVIXIA dans le traitement des carcinomes basocellulaires non récidivants du tronc des membres et du cou est modéré dans les autres cas. Le service médical rendu par METVIXIA est modéré dans le traitement des lésions de kératose actinique multiples fines ou non-hyperkératosiques et non pigmentées du visage et du cuir chevelu. |
| Important | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | Le service médical rendu par METVIXIA est important dans le traitement des carcinomes intraépidermiques (maladie de Bowen) non pigmentés, lorsque la chirurgie est impossible, chez les sujets immunocompétents. Le service médical rendu par METVIXIA dans le traitement des carcinomes basocellulaires non récidivants du tronc des membres et du cou est important chez les patients inopérables en cas de lésions étendues, multiples ou de localisation difficilement accessible à la chirurgie. |
| Modéré | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | Le service médical rendu par METVIXIA dans le traitement des carcinomes basocellulaires non récidivants du tronc des membres et du cou est modéré dans les autres cas. Le service médical rendu par METVIXIA est modéré dans le traitement des lésions de kératose actinique multiples fines ou non-hyperkératosiques et non pigmentées du visage et du cuir chevelu. |
| Important | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | Le service médical rendu par METVIXIA est important dans le traitement des carcinomes intraépidermiques (maladie de Bowen) non pigmentés, lorsque la chirurgie est impossible, chez les sujets immunocompétents. Le service médical rendu par METVIXIA dans le traitement des carcinomes basocellulaires non récidivants du tronc des membres et du cou est important chez les patients inopérables en cas de lésions étendues, multiples ou de localisation difficilement accessible à la chirurgie. |
| Modéré | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | Le service médical rendu par METVIXIA dans le traitement des carcinomes basocellulaires non récidivants du tronc des membres et du cou est modéré dans les autres cas. Le service médical rendu par METVIXIA est modéré dans le traitement des lésions de kératose actinique multiples fines ou non-hyperkératosiques et non pigmentées du visage et du cuir chevelu. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 08/02/2017 | Extension d'indication | Compte tenu des données disponibles qui mettent en évidence : • la non infériorité de METVIXIA utilisé en lumière du jour par rapport à METVIXIA utilisé en photothérapie dynamique (lumière rouge), en termes de taux de réponse complète à 12 semaines dans 2 études, • une utilisation de METVIXIA avec la lumière du jour qui apparait moins douloureuse que l’utilisation en photothérapie avec lampe . l’absence de réalisation en double-aveugle des 2 études atténuant la portée des résultats observés, la Commission considère que METVIXIA utilisé avec la lumière du jour n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la prise en charge des kératoses actiniques fines ou non hyperkératosiques et non pigmentées du visage et du cuir chevelu qui comprend les comparateurs cliniquement pertinents cités au chapitre 6. |
| V (Inexistant) | Avis du 08/02/2017 | Extension d'indication | Compte tenu des données disponibles qui mettent en évidence : • la non infériorité de METVIXIA utilisé en lumière du jour par rapport à METVIXIA utilisé en photothérapie dynamique (lumière rouge), en termes de taux de réponse complète à 12 semaines dans 2 études, • une utilisation de METVIXIA avec la lumière du jour qui apparait moins douloureuse que l’utilisation en photothérapie avec lampe . l’absence de réalisation en double-aveugle des 2 études atténuant la portée des résultats observés, la Commission considère que METVIXIA utilisé avec la lumière du jour n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la prise en charge des kératoses actiniques fines ou non hyperkératosiques et non pigmentées du visage et du cuir chevelu qui comprend les comparateurs cliniquement pertinents cités au chapitre 6. |
| V (Inexistant) | Avis du 08/02/2017 | Extension d'indication | Compte tenu des données disponibles qui mettent en évidence : • la non infériorité de METVIXIA utilisé en lumière du jour par rapport à METVIXIA utilisé en photothérapie dynamique (lumière rouge), en termes de taux de réponse complète à 12 semaines dans 2 études, • une utilisation de METVIXIA avec la lumière du jour qui apparait moins douloureuse que l’utilisation en photothérapie avec lampe . l’absence de réalisation en double-aveugle des 2 études atténuant la portée des résultats observés, la Commission considère que METVIXIA utilisé avec la lumière du jour n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la prise en charge des kératoses actiniques fines ou non hyperkératosiques et non pigmentées du visage et du cuir chevelu qui comprend les comparateurs cliniquement pertinents cités au chapitre 6. |
| V (Inexistant) | Avis du 08/02/2017 | Extension d'indication | Compte tenu des données disponibles qui mettent en évidence : • la non infériorité de METVIXIA utilisé en lumière du jour par rapport à METVIXIA utilisé en photothérapie dynamique (lumière rouge), en termes de taux de réponse complète à 12 semaines dans 2 études, • une utilisation de METVIXIA avec la lumière du jour qui apparait moins douloureuse que l’utilisation en photothérapie avec lampe . l’absence de réalisation en double-aveugle des 2 études atténuant la portée des résultats observés, la Commission considère que METVIXIA utilisé avec la lumière du jour n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la prise en charge des kératoses actiniques fines ou non hyperkératosiques et non pigmentées du visage et du cuir chevelu qui comprend les comparateurs cliniquement pertinents cités au chapitre 6. |
| IV (Mineur) | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | Dans les carcinomes basocellulaires superficiels non récidivants du tronc des membres et du cou, METVIXIA apporte une amélioration du service médical rendu mineure (ASMR IV) chez les patients inopérables en cas de lésions étendues, multiples ou de localisation difficilement accessible à la chirurgie METVIXIA apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge des carcinomes intraépidermiques (maladie de Bowen) non pigmentés, lorsque la chirurgie est impossible, chez les sujets immunocompétents. |
| V (Inexistant) | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | METVIXIA n’apporte pas d’amélioration du service médical rendu (ASMR V, inexistante) dans la prise en charge des kératoses actiniques fines ou non hyperkératosiques et non pigmentées du visage et du cuir chevelu. Dans les carcinomes basocellulaires superficiels non récidivants du tronc des membres et du cou, METVIXIA n’apporte pas d’amélioration du service médical rendu (ASMR V) dans les autres cas. |
| IV (Mineur) | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | Dans les carcinomes basocellulaires superficiels non récidivants du tronc des membres et du cou, METVIXIA apporte une amélioration du service médical rendu mineure (ASMR IV) chez les patients inopérables en cas de lésions étendues, multiples ou de localisation difficilement accessible à la chirurgie METVIXIA apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge des carcinomes intraépidermiques (maladie de Bowen) non pigmentés, lorsque la chirurgie est impossible, chez les sujets immunocompétents. |
| V (Inexistant) | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | METVIXIA n’apporte pas d’amélioration du service médical rendu (ASMR V, inexistante) dans la prise en charge des kératoses actiniques fines ou non hyperkératosiques et non pigmentées du visage et du cuir chevelu. Dans les carcinomes basocellulaires superficiels non récidivants du tronc des membres et du cou, METVIXIA n’apporte pas d’amélioration du service médical rendu (ASMR V) dans les autres cas. |
| IV (Mineur) | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | Dans les carcinomes basocellulaires superficiels non récidivants du tronc des membres et du cou, METVIXIA apporte une amélioration du service médical rendu mineure (ASMR IV) chez les patients inopérables en cas de lésions étendues, multiples ou de localisation difficilement accessible à la chirurgie METVIXIA apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge des carcinomes intraépidermiques (maladie de Bowen) non pigmentés, lorsque la chirurgie est impossible, chez les sujets immunocompétents. |
| V (Inexistant) | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | METVIXIA n’apporte pas d’amélioration du service médical rendu (ASMR V, inexistante) dans la prise en charge des kératoses actiniques fines ou non hyperkératosiques et non pigmentées du visage et du cuir chevelu. Dans les carcinomes basocellulaires superficiels non récidivants du tronc des membres et du cou, METVIXIA n’apporte pas d’amélioration du service médical rendu (ASMR V) dans les autres cas. |
| V (Inexistant) | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | METVIXIA n’apporte pas d’amélioration du service médical rendu (ASMR V, inexistante) dans la prise en charge des kératoses actiniques fines ou non hyperkératosiques et non pigmentées du visage et du cuir chevelu. Dans les carcinomes basocellulaires superficiels non récidivants du tronc des membres et du cou, METVIXIA n’apporte pas d’amélioration du service médical rendu (ASMR V) dans les autres cas. |
| IV (Mineur) | Avis du 05/03/2014 | Renouvellement d'inscription (CT) | Dans les carcinomes basocellulaires superficiels non récidivants du tronc des membres et du cou, METVIXIA apporte une amélioration du service médical rendu mineure (ASMR IV) chez les patients inopérables en cas de lésions étendues, multiples ou de localisation difficilement accessible à la chirurgie METVIXIA apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge des carcinomes intraépidermiques (maladie de Bowen) non pigmentés, lorsque la chirurgie est impossible, chez les sujets immunocompétents. |
| IV (Mineur) | Avis du 28/03/2007 | Inscription (CT) | Dans le traitement du carcinome basocellulaire superficiel non récidivant du tronc des membres et du cou, METVIXIA apporte une amélioration du service médical rendu mineure (niveau IV) dans la prise en charge thérapeutique des patients ne pouvant être traités par la chirurgie. Dans le traitement des carcinomes intraépidermiques (maladie de Bowen) non pigmentés, chez les sujets immunocompétents METVIXIA apporte une amélioration du service médical rendu mineure (niveau IV) dans la prise en charge thérapeutique des patients ne pouvant être traités par la chirurgie. |
| V (Inexistant) | Avis du 28/03/2007 | Inscription (CT) | METVIXIA n'apporte pas d'amélioration du service médical rendu (niveau V) par rapport à la cryothérapie dans le traitement des kératoses actiniques fines ou non-hyperkératosiques et non pigmentées du visage et du cuir chevelu mais constitue un moyen thérapeutique supplémentaire. |
| IV (Mineur) | Avis du 28/03/2007 | Inscription (CT) | Dans le traitement du carcinome basocellulaire superficiel non récidivant du tronc des membres et du cou, METVIXIA apporte une amélioration du service médical rendu mineure (niveau IV) dans la prise en charge thérapeutique des patients ne pouvant être traités par la chirurgie. Dans le traitement des carcinomes intraépidermiques (maladie de Bowen) non pigmentés, chez les sujets immunocompétents METVIXIA apporte une amélioration du service médical rendu mineure (niveau IV) dans la prise en charge thérapeutique des patients ne pouvant être traités par la chirurgie. |
| V (Inexistant) | Avis du 28/03/2007 | Inscription (CT) | METVIXIA n'apporte pas d'amélioration du service médical rendu (niveau V) par rapport à la cryothérapie dans le traitement des kératoses actiniques fines ou non-hyperkératosiques et non pigmentées du visage et du cuir chevelu mais constitue un moyen thérapeutique supplémentaire. |
| IV (Mineur) | Avis du 28/03/2007 | Inscription (CT) | Dans le traitement du carcinome basocellulaire superficiel non récidivant du tronc des membres et du cou, METVIXIA apporte une amélioration du service médical rendu mineure (niveau IV) dans la prise en charge thérapeutique des patients ne pouvant être traités par la chirurgie. Dans le traitement des carcinomes intraépidermiques (maladie de Bowen) non pigmentés, chez les sujets immunocompétents METVIXIA apporte une amélioration du service médical rendu mineure (niveau IV) dans la prise en charge thérapeutique des patients ne pouvant être traités par la chirurgie. |
| V (Inexistant) | Avis du 28/03/2007 | Inscription (CT) | METVIXIA n'apporte pas d'amélioration du service médical rendu (niveau V) par rapport à la cryothérapie dans le traitement des kératoses actiniques fines ou non-hyperkératosiques et non pigmentées du visage et du cuir chevelu mais constitue un moyen thérapeutique supplémentaire. |
| IV (Mineur) | Avis du 28/03/2007 | Inscription (CT) | Dans le traitement du carcinome basocellulaire superficiel non récidivant du tronc des membres et du cou, METVIXIA apporte une amélioration du service médical rendu mineure (niveau IV) dans la prise en charge thérapeutique des patients ne pouvant être traités par la chirurgie. Dans le traitement des carcinomes intraépidermiques (maladie de Bowen) non pigmentés, chez les sujets immunocompétents METVIXIA apporte une amélioration du service médical rendu mineure (niveau IV) dans la prise en charge thérapeutique des patients ne pouvant être traités par la chirurgie. |
| V (Inexistant) | Avis du 28/03/2007 | Inscription (CT) | METVIXIA n'apporte pas d'amélioration du service médical rendu (niveau V) par rapport à la cryothérapie dans le traitement des kératoses actiniques fines ou non-hyperkératosiques et non pigmentées du visage et du cuir chevelu mais constitue un moyen thérapeutique supplémentaire. |
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |