 Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !Inscrivez-vous ici pour le tester en avant-première, partager vos impressions, et nous aider à l’améliorer !
 Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
Vous trouverez les indications thérapeutiques de ce médicament dans le paragraphe 4.1 du RCP ou dans le paragraphe 1 de la notice. Ces documents sont disponibles en cliquant ici
Ce médicament n'appartient à aucun groupe générique
 Gélule (Composition pour une gélule)
Gélule (Composition pour une gélule)
 100 mg
100 mg
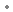 sous forme de : tosylate de niraparib monohydraté
sous forme de : tosylate de niraparib monohydraté
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 03/03/2021 | Extension d'indication | Le service médical rendu par ZEJULA (niraparib) est important dans cette nouvelle indication de l’AMM. |
| Important | Avis du 13/06/2018 | Inscription (CT) | Le service médical rendu par ZEJULA est important dans l’indication de l’AMM « en monothérapie pour le traitement d’entretien de patientes adultes atteintes d’un cancer épithélial séreux de haut grade de l’ovaire, des trompes de Fallope ou péritonéal primitif, sensible au platine et récidivant, qui sont en réponse (réponse complète ou partielle) à une chimiothérapie à base de platine. » |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| IV (Mineur) | Avis du 03/03/2021 | Extension d'indication | Prenant en compte : • la démonstration d’un gain en médiane de survie sans progression (critère de jugement principal) de +5,6 mois en valeur absolue par rapport au placebo en ITT (13,8 mois dans le groupe niraparib versus 8,2 mois dans le groupe placebo]), dans une étude randomisée en double aveugle, malgré : • l’absence de démonstration d’un gain en survie globale, critère secondaire non hiérarchisé (médiane de survie globale: 30,3 mois sous niraparib et non atteinte sous placebo), • l’absence de conclusion formelle pouvant être tirée des résultats de qualité de vie, • le profil de tolérance du niraparib marqué principalement par des événements hématologiques, la Commission considère que ZEJULA (niraparib) apporte comme LYNPARZA (olaparib) une amélioration du service médical rendu mineure (ASMR IV) dans la stratégie thérapeutique. |
| IV (Mineur) | Avis du 13/06/2018 | Inscription (CT) | En prenant en compte à la fois : • la démonstration de la supériorité de niraparib par rapport au placebo sur la survie sans progression avec une quantité d’effet variable selon le statut mutationnel BRCA (+ 5,4 mois dans la cohorte sans mutation germinale du gène BRCA et + 15,5 mois dans la cohorte avec mutation germinale du gène BRCA), • l’absence de gain démontré sur la survie globale à ce jour, • le profil de tolérance marqué par un nombre élevé d’EI de grades = 3, survenus chez environ trois quarts des patientes au cours du traitement, la Commission considère que ZEJULA apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport au placebo, dans le traitement d’entretien des patientes adultes atteintes d’un cancer épithélial séreux de haut grade de l'ovaire, des trompes de Fallope ou péritonéal primitif, récidivant et sensible au platine et qui sont en réponse (réponse complète ou réponse partielle) à une chimiothérapie à base de platine. |
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |