
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
Vous trouverez les indications thérapeutiques de ce médicament dans le paragraphe 4.1 du RCP ou dans le paragraphe 1 de la notice. Ces documents sont disponibles en cliquant ici
Ce médicament n'appartient à aucun groupe générique
 Poudre (Composition pour une gélule)
Poudre (Composition pour une gélule)
 150 microgrammes
150 microgrammes
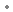 sous forme de : acétate d'indacatérol
sous forme de : acétate d'indacatérol  320 microgrammes
320 microgrammes
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par ATECTURA BREEZHALER est important dans l’indication de l’AMM. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 16/12/2020 | Inscription (CT) | Compte tenu : • de la démonstration de la supériorité de l’association fixe indacatérol / furoate de mométasone (IND/MF) pour les doses de corticostéroïde inhalé faible (150/80 µg), moyenne (150/160 µg) et forte (150/320 µg) comparativement à la monothérapie par le furoate de mométasone sur la fonction pulmonaire (évalué par le VEMS résiduel à 12 et 26 semaines selon les études) . • de l’absence de nouveau risque identifié par rapport ceux connus avec ses deux principes actifs . mais prenant en compte : • l’absence de démonstration d’une différence cliniquement pertinente sur le contrôle de l’asthme (évalué sur l’ACQ-7 à 12 et à 26 semaines selon les études) . • l'absence de démonstration robuste d’efficacité sur les exacerbations et la qualité de vie, critères secondaires non hiérarchisés . • le cadre restrictif des études (ajout d’un LABA à un traitement par CSI seul, évaluation sur un critère fonctionnel à 26 semaines) . la Commission de la Transparence considère qu’ATECTURA BREEZHALER n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux autres associations à base d’un corticoïde inhalé (CSI) et d’un bêta-2-agoniste de longue durée d’action (LABA) dans le traitement continu de l’asthme chez les adultes et adolescents âgés de 12 ans et plus insuffisamment contrôlés par la prise d’un corticoïde inhalé et d’un bêta-2-agoniste de courte durée d’action inhalé. |
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |