
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
Vous trouverez les indications thérapeutiques de ce médicament dans le paragraphe 4.1 du RCP ou dans le paragraphe 1 de la notice. Ces documents sont disponibles en cliquant ici
Ce médicament appartient au(x) groupe(s) générique(s) suivants :
 Solution (Composition pour 1 ml)
Solution (Composition pour 1 ml)
 2 mg
2 mg
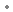 sous forme de : hydrogénotartrate de rivastigmine
sous forme de : hydrogénotartrate de rivastigmine  3,2 mg
3,2 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Insuffisant | Avis du 19/10/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités EXELON est insuffisant pour justifier leur prise en charge par la solidarité nationale dans les indications de l’AMM. |
| Insuffisant | Avis du 19/10/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités EXELON est insuffisant pour justifier leur prise en charge par la solidarité nationale dans les indications de l’AMM. |
| Insuffisant | Avis du 19/10/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités EXELON est insuffisant pour justifier leur prise en charge par la solidarité nationale dans les indications de l’AMM. |
| Insuffisant | Avis du 19/10/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités EXELON est insuffisant pour justifier leur prise en charge par la solidarité nationale dans les indications de l’AMM. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 19/10/2011 | Renouvellement d'inscription (CT) | La Commission de la transparence considère que EXELON n'apporte pas d'amélioration du service médical rendu (ASMR V) dans le traitement symptomatique de la maladie d'Alzheimer dans les indications et aux posologies de l'AMM. Cet avis se fonde sur les données cliniques disponibles d'efficacité montrant une taille d'effet au mieux modeste, établies à court terme principalement sur les troubles cognitifs, le risque de survenue d'effets indésirables et d'interactions médicamenteuses, l'absence de preuve d'un effet structurant de la prise en charge des patients et sur le manque de données établissant un intérêt thérapeutique à long terme. |
| V (Inexistant) | Avis du 19/10/2011 | Renouvellement d'inscription (CT) | La Commission de la transparence considère que EXELON n'apporte pas d'amélioration du service médical rendu (ASMR V) dans le traitement symptomatique de la maladie d'Alzheimer dans les indications et aux posologies de l'AMM. Cet avis se fonde sur les données cliniques disponibles d'efficacité montrant une taille d'effet au mieux modeste, établies à court terme principalement sur les troubles cognitifs, le risque de survenue d'effets indésirables et d'interactions médicamenteuses, l'absence de preuve d'un effet structurant de la prise en charge des patients et sur le manque de données établissant un intérêt thérapeutique à long terme. |
| V (Inexistant) | Avis du 19/10/2011 | Renouvellement d'inscription (CT) | La Commission de la transparence considère que EXELON n'apporte pas d'amélioration du service médical rendu (ASMR V) dans le traitement symptomatique de la maladie d'Alzheimer dans les indications et aux posologies de l'AMM. Cet avis se fonde sur les données cliniques disponibles d'efficacité montrant une taille d'effet au mieux modeste, établies à court terme principalement sur les troubles cognitifs, le risque de survenue d'effets indésirables et d'interactions médicamenteuses, l'absence de preuve d'un effet structurant de la prise en charge des patients et sur le manque de données établissant un intérêt thérapeutique à long terme. |
| V (Inexistant) | Avis du 19/10/2011 | Renouvellement d'inscription (CT) | La Commission de la transparence considère que EXELON n'apporte pas d'amélioration du service médical rendu (ASMR V) dans le traitement symptomatique de la maladie d'Alzheimer dans les indications et aux posologies de l'AMM. Cet avis se fonde sur les données cliniques disponibles d'efficacité montrant une taille d'effet au mieux modeste, établies à court terme principalement sur les troubles cognitifs, le risque de survenue d'effets indésirables et d'interactions médicamenteuses, l'absence de preuve d'un effet structurant de la prise en charge des patients et sur le manque de données établissant un intérêt thérapeutique à long terme. |
| IV (Mineur) | Avis du 20/06/2007 | Renouvellement d'inscription (CT) | La tacrine (COGNEX) n'étant plus commercialisée et sachant qu'elle a constitué en 1998 la référence pour l'attribution d'une ASMR au donépézil (ARICEPT) puis à la rivastigmine (EXELON), la Commission considère en 2007 que la définition de l'apport des médicaments indiqués dans le traitement de la maladie d'Alzheimer ne peut se concevoir que dans le cadre de la prise en charge globale de la maladie. La Commission considère que les données cliniques disponibles et l'expérience en vie réelle de ces médicaments depuis leur commercialisation ne permettent pas de les différencier en termes d'efficacité ni de tolérance. Les « ASMR » rendues par les quatre médicaments indiqués dans le traitement de la maladie d'Alzheimer et réévalués, doivent donc être considérées comme identiques. Compte tenu de ces données, l'amélioration du service médical rendu par EXELON dans le traitement symptomatique de la maladie d'Alzheimer dans ses formes légères à modérément sévères est mineure (ASMR de niveau IV) dans le cadre de la prise en charge globale de la maladie. |
| IV (Mineur) | Avis du 20/06/2007 | Renouvellement d'inscription (CT) | La tacrine (COGNEX) n'étant plus commercialisée et sachant qu'elle a constitué en 1998 la référence pour l'attribution d'une ASMR au donépézil (ARICEPT) puis à la rivastigmine (EXELON), la Commission considère en 2007 que la définition de l'apport des médicaments indiqués dans le traitement de la maladie d'Alzheimer ne peut se concevoir que dans le cadre de la prise en charge globale de la maladie. La Commission considère que les données cliniques disponibles et l'expérience en vie réelle de ces médicaments depuis leur commercialisation ne permettent pas de les différencier en termes d'efficacité ni de tolérance. Les « ASMR » rendues par les quatre médicaments indiqués dans le traitement de la maladie d'Alzheimer et réévalués, doivent donc être considérées comme identiques. Compte tenu de ces données, l'amélioration du service médical rendu par EXELON dans le traitement symptomatique de la maladie d'Alzheimer dans ses formes légères à modérément sévères est mineure (ASMR de niveau IV) dans le cadre de la prise en charge globale de la maladie. |
| IV (Mineur) | Avis du 20/06/2007 | Renouvellement d'inscription (CT) | La tacrine (COGNEX) n'étant plus commercialisée et sachant qu'elle a constitué en 1998 la référence pour l'attribution d'une ASMR au donépézil (ARICEPT) puis à la rivastigmine (EXELON), la Commission considère en 2007 que la définition de l'apport des médicaments indiqués dans le traitement de la maladie d'Alzheimer ne peut se concevoir que dans le cadre de la prise en charge globale de la maladie. La Commission considère que les données cliniques disponibles et l'expérience en vie réelle de ces médicaments depuis leur commercialisation ne permettent pas de les différencier en termes d'efficacité ni de tolérance. Les « ASMR » rendues par les quatre médicaments indiqués dans le traitement de la maladie d'Alzheimer et réévalués, doivent donc être considérées comme identiques. Compte tenu de ces données, l'amélioration du service médical rendu par EXELON dans le traitement symptomatique de la maladie d'Alzheimer dans ses formes légères à modérément sévères est mineure (ASMR de niveau IV) dans le cadre de la prise en charge globale de la maladie. |
| IV (Mineur) | Avis du 20/06/2007 | Renouvellement d'inscription (CT) | La tacrine (COGNEX) n'étant plus commercialisée et sachant qu'elle a constitué en 1998 la référence pour l'attribution d'une ASMR au donépézil (ARICEPT) puis à la rivastigmine (EXELON), la Commission considère en 2007 que la définition de l'apport des médicaments indiqués dans le traitement de la maladie d'Alzheimer ne peut se concevoir que dans le cadre de la prise en charge globale de la maladie. La Commission considère que les données cliniques disponibles et l'expérience en vie réelle de ces médicaments depuis leur commercialisation ne permettent pas de les différencier en termes d'efficacité ni de tolérance. Les « ASMR » rendues par les quatre médicaments indiqués dans le traitement de la maladie d'Alzheimer et réévalués, doivent donc être considérées comme identiques. Compte tenu de ces données, l'amélioration du service médical rendu par EXELON dans le traitement symptomatique de la maladie d'Alzheimer dans ses formes légères à modérément sévères est mineure (ASMR de niveau IV) dans le cadre de la prise en charge globale de la maladie. |
| IV (Mineur) | Avis du 29/11/2006 | Extension d'indication | Compte tenu du bénéfice observé modeste et du risque de survenue d'effets indésirables non négligeables, Exelon apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge des patients atteints de forme légère à modérément sévère de démence associée à la maladie de Parkinson idiopathique. La Commission note que les patients ayant des hallucinations visuelles pourraient plus particulièrement bénéficier de la rivastigmine. |
| IV (Mineur) | Avis du 29/11/2006 | Extension d'indication | Compte tenu du bénéfice observé modeste et du risque de survenue d'effets indésirables non négligeables, Exelon apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge des patients atteints de forme légère à modérément sévère de démence associée à la maladie de Parkinson idiopathique. La Commission note que les patients ayant des hallucinations visuelles pourraient plus particulièrement bénéficier de la rivastigmine. |
| IV (Mineur) | Avis du 29/11/2006 | Extension d'indication | Compte tenu du bénéfice observé modeste et du risque de survenue d'effets indésirables non négligeables, Exelon apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge des patients atteints de forme légère à modérément sévère de démence associée à la maladie de Parkinson idiopathique. La Commission note que les patients ayant des hallucinations visuelles pourraient plus particulièrement bénéficier de la rivastigmine. |
| IV (Mineur) | Avis du 29/11/2006 | Extension d'indication | Compte tenu du bénéfice observé modeste et du risque de survenue d'effets indésirables non négligeables, Exelon apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge des patients atteints de forme légère à modérément sévère de démence associée à la maladie de Parkinson idiopathique. La Commission note que les patients ayant des hallucinations visuelles pourraient plus particulièrement bénéficier de la rivastigmine. |
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |