 Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !Inscrivez-vous ici pour le tester en avant-première, partager vos impressions, et nous aider à l’améliorer !
 Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
Classe pharmacothérapeutique : produit radiopharmaceutique à usage diagnostique.
Adreview contient une substance active appelée « iobenguane ».
Ce médicament est à usage diagnostique uniquement. Il est utilisé pour aider à identifier (diagnostiquer) une maladie.
Adreview est un médicament radiopharmaceutique. Il vous est administré avant une scintigraphie.
· Une fois injecté il est détecté à l'aide d'une caméra spéciale utilisée pour la scintigraphie.
· Dans certains cas, la scintigraphie aide votre médecin spécialiste de médecine nucléaire à localiser certains types de tumeurs et à voir comment une tumeur répond au traitement.
· Dans d’autres cas, la scintigraphie permet d’apprécier le fonctionnement du cœur.
Votre médecin spécialiste de médecine nucléaire vous expliquera quel type de scintigraphie est approprié dans votre cas.
L'examen avec Adreview vous expose à une irradiation. Votre médecin et le médecin spécialiste de médecine nucléaire ont estimé que le bénéfice clinique de cet examen avec le produit radiopharmaceutique est supérieur au risque d’exposition à de faibles quantités de rayonnements. Si vous avez d'autres questions, posez-les au spécialiste de médecine nucléaire qui réalise votre examen.
Ce médicament n'appartient à aucun groupe générique
 Solution (Composition pour un flacon de 1 ml)
Solution (Composition pour un flacon de 1 ml)
 74 MBq/ml à la date et à l'heure de calibration
74 MBq/ml à la date et à l'heure de calibration
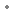 sous forme de : méta-iodobenzylguanidine (sulfate de)
sous forme de : méta-iodobenzylguanidine (sulfate de)  0,15 mg
0,15 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Insuffisant | Avis du 14/12/2011 | Modification des conditions d'inscription (CT) | Le service médical rendu par ADREVIEW dans son extension d'indication est insuffisant pour une prise en charge par la solidarité nationale. |
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide)
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |