
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
 : Ce médicament fait l'objet d'une surveillance renforcée. Pour plus d'informations, cliquez ici
: Ce médicament fait l'objet d'une surveillance renforcée. Pour plus d'informations, cliquez ici
Vous trouverez les indications thérapeutiques de ce médicament dans le paragraphe 4.1 du RCP ou dans le paragraphe 1 de la notice. Ces documents sont disponibles en cliquant ici
Ce médicament n'appartient à aucun groupe générique
 Poudre (Composition pour un flacon)
Poudre (Composition pour un flacon)
 2 mg
2 mg
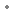 sous forme de : acétate de bulévirtide
sous forme de : acétate de bulévirtide
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par HEPCLUDEX (bulévirtide) est important uniquement dans le traitement de l’infection chronique par le virus de l’hépatite delta (VHD) chez les patients adultes ayant une maladie hépatique compensée testés positifs pour la présence d’ARN du VHD dans le plasma (ou le sérum), en association à un traitement de fond contre le VHB et en cas d’échec ou d’intolérance ou de contre-indication à l’interféron alpha pégylé. |
| Insuffisant | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par HEPCLUDEX (bulévirtide) est insuffisant pour justifier d’une prise en charge par la solidarité nationale dans les autres situations incluant notamment la monothérapie par bulévirtide. |
| Important | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par HEPCLUDEX (bulévirtide) est important uniquement dans le traitement de l’infection chronique par le virus de l’hépatite delta (VHD) chez les patients adultes ayant une maladie hépatique compensée testés positifs pour la présence d’ARN du VHD dans le plasma (ou le sérum), en association à un traitement de fond contre le VHB et en cas d’échec ou d’intolérance ou de contre-indication à l’interféron alpha pégylé. |
| Insuffisant | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par HEPCLUDEX (bulévirtide) est insuffisant pour justifier d’une prise en charge par la solidarité nationale dans les autres situations incluant notamment la monothérapie par bulévirtide. |
| Important | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par HEPCLUDEX (bulévirtide) est important uniquement dans le traitement de l’infection chronique par le virus de l’hépatite delta (VHD) chez les patients adultes ayant une maladie hépatique compensée testés positifs pour la présence d’ARN du VHD dans le plasma (ou le sérum), en association à un traitement de fond contre le VHB et en cas d’échec ou d’intolérance ou de contre-indication à l’interféron alpha pégylé. |
| Insuffisant | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par HEPCLUDEX (bulévirtide) est insuffisant pour justifier d’une prise en charge par la solidarité nationale dans les autres situations incluant notamment la monothérapie par bulévirtide. |
| Important | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par HEPCLUDEX (bulévirtide) est important uniquement dans le traitement de l’infection chronique par le virus de l’hépatite delta (VHD) chez les patients adultes ayant une maladie hépatique compensée testés positifs pour la présence d’ARN du VHD dans le plasma (ou le sérum), en association à un traitement de fond contre le VHB et en cas d’échec ou d’intolérance ou de contre-indication à l’interféron alpha pégylé. |
| Insuffisant | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par HEPCLUDEX (bulévirtide) est insuffisant pour justifier d’une prise en charge par la solidarité nationale dans les autres situations incluant notamment la monothérapie par bulévirtide. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| IV (Mineur) | Avis du 16/12/2020 | Inscription (CT) | Compte tenu : • de la démonstration de son efficacité virologique contre le VHD, en co-administration avec un analogue nucléosidique/nucléotidique actif contre le VHB, chez des patients en échec ou intolérants à l’interféron alpha pégylé (réduction d’au moins 2 log ou négativation de la charge virale chez environ 50% des patients à 24 semaines, mais avec une charge virale indétectable chez seulement 4 %), • de la réponse combinée (réponse virologique et normalisation des ALAT) chez seulement 20 % des patients à 24 semaines, • de l’impact attendu du contrôle virologique sur l’évolution clinique de la maladie, • du profil de tolérance acceptable à court terme, • du besoin médical important chez les patients en échec ou intolérants à l’interféron alpha pégylé et en l’absence d’alternative dans cette situation, et malgré : • des données cliniques préliminaires (2 études de phase II) et, • le faible recul en termes de maintien de l’efficacité, d’impact sur la réduction de la morbi-mortalité et de la tolérance à long terme, la Commission considère que HEPCLUDEX (bulévirtide), en association à un traitement de fond contre le VHB, apporte une amélioration du service médical rendu mineure (ASMR IV) dans la stratégie de prise en charge des patients infectés par le VHD pour lesquels il est impossible d’établir un schéma de traitement antiviral suppressif avec l’interféron alpha pégylé, notamment en cas d’échec, d’intolérance ou de contre-indication. |
| IV (Mineur) | Avis du 16/12/2020 | Inscription (CT) | Compte tenu : • de la démonstration de son efficacité virologique contre le VHD, en co-administration avec un analogue nucléosidique/nucléotidique actif contre le VHB, chez des patients en échec ou intolérants à l’interféron alpha pégylé (réduction d’au moins 2 log ou négativation de la charge virale chez environ 50% des patients à 24 semaines, mais avec une charge virale indétectable chez seulement 4 %), • de la réponse combinée (réponse virologique et normalisation des ALAT) chez seulement 20 % des patients à 24 semaines, • de l’impact attendu du contrôle virologique sur l’évolution clinique de la maladie, • du profil de tolérance acceptable à court terme, • du besoin médical important chez les patients en échec ou intolérants à l’interféron alpha pégylé et en l’absence d’alternative dans cette situation, et malgré : • des données cliniques préliminaires (2 études de phase II) et, • le faible recul en termes de maintien de l’efficacité, d’impact sur la réduction de la morbi-mortalité et de la tolérance à long terme, la Commission considère que HEPCLUDEX (bulévirtide), en association à un traitement de fond contre le VHB, apporte une amélioration du service médical rendu mineure (ASMR IV) dans la stratégie de prise en charge des patients infectés par le VHD pour lesquels il est impossible d’établir un schéma de traitement antiviral suppressif avec l’interféron alpha pégylé, notamment en cas d’échec, d’intolérance ou de contre-indication. |
| IV (Mineur) | Avis du 16/12/2020 | Inscription (CT) | Compte tenu : • de la démonstration de son efficacité virologique contre le VHD, en co-administration avec un analogue nucléosidique/nucléotidique actif contre le VHB, chez des patients en échec ou intolérants à l’interféron alpha pégylé (réduction d’au moins 2 log ou négativation de la charge virale chez environ 50% des patients à 24 semaines, mais avec une charge virale indétectable chez seulement 4 %), • de la réponse combinée (réponse virologique et normalisation des ALAT) chez seulement 20 % des patients à 24 semaines, • de l’impact attendu du contrôle virologique sur l’évolution clinique de la maladie, • du profil de tolérance acceptable à court terme, • du besoin médical important chez les patients en échec ou intolérants à l’interféron alpha pégylé et en l’absence d’alternative dans cette situation, et malgré : • des données cliniques préliminaires (2 études de phase II) et, • le faible recul en termes de maintien de l’efficacité, d’impact sur la réduction de la morbi-mortalité et de la tolérance à long terme, la Commission considère que HEPCLUDEX (bulévirtide), en association à un traitement de fond contre le VHB, apporte une amélioration du service médical rendu mineure (ASMR IV) dans la stratégie de prise en charge des patients infectés par le VHD pour lesquels il est impossible d’établir un schéma de traitement antiviral suppressif avec l’interféron alpha pégylé, notamment en cas d’échec, d’intolérance ou de contre-indication. |
| IV (Mineur) | Avis du 16/12/2020 | Inscription (CT) | Compte tenu : • de la démonstration de son efficacité virologique contre le VHD, en co-administration avec un analogue nucléosidique/nucléotidique actif contre le VHB, chez des patients en échec ou intolérants à l’interféron alpha pégylé (réduction d’au moins 2 log ou négativation de la charge virale chez environ 50% des patients à 24 semaines, mais avec une charge virale indétectable chez seulement 4 %), • de la réponse combinée (réponse virologique et normalisation des ALAT) chez seulement 20 % des patients à 24 semaines, • de l’impact attendu du contrôle virologique sur l’évolution clinique de la maladie, • du profil de tolérance acceptable à court terme, • du besoin médical important chez les patients en échec ou intolérants à l’interféron alpha pégylé et en l’absence d’alternative dans cette situation, et malgré : • des données cliniques préliminaires (2 études de phase II) et, • le faible recul en termes de maintien de l’efficacité, d’impact sur la réduction de la morbi-mortalité et de la tolérance à long terme, la Commission considère que HEPCLUDEX (bulévirtide), en association à un traitement de fond contre le VHB, apporte une amélioration du service médical rendu mineure (ASMR IV) dans la stratégie de prise en charge des patients infectés par le VHD pour lesquels il est impossible d’établir un schéma de traitement antiviral suppressif avec l’interféron alpha pégylé, notamment en cas d’échec, d’intolérance ou de contre-indication. |
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |