
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.

Classe pharmacothérapeutique : ANTAGONISTE DES RECEPTEURS H2 - code ATC : A02BA02
Adultes
Ce médicament est indiqué pour le traitement d'un ulcère de l'estomac (duodénal ou gastrique), d'une oesophagite (inflammation de l’œsophage) liée à un reflux gastro-oesophagien ou d'un syndrome de Zollinger-Ellison (hypersécrétion acide de l'estomac).
Enfants de 3 à 18 ans
AZANTAC est utilisé pour :
· cicatriser les ulcères de l’estomac ou du duodénum (partie de l’intestin dans laquelle se déverse le contenu de l’estomac),
· soulager et calmer les symptômes liés à la présence d’acidité dans l’œsophage ou à un excès d’acidité dans l’estomac. Ceci peut provoquer des douleurs et de l’inconfort qualifiés parfois d’indigestion, de dyspepsie ou de pyrosis.
Ce médicament appartient au(x) groupe(s) générique(s) suivants :
 Comprimé (Composition pour un comprimé)
Comprimé (Composition pour un comprimé)
 150 mg
150 mg
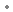 sous forme de : ranitidine (chlorhydrate de)
sous forme de : ranitidine (chlorhydrate de)  168 mg
168 mg
Pas de présentation à afficher
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 19/10/2011 | Renouvellement d'inscription (CT) | Le service médical rendu reste faible dans les indications : traitement symptomatique du reflux gastro-oesophagien lorsque les règles hygiéno-diététiques ne se sont pas montrées efficaces (AZANTAC 75 mg) . ulcère gastrique ou duodénal évolutif (par AZANTAC 150 mg, 300 mg et 50 mg/2 ml) . oesophagite par reflux gastro-oesophagien (par AZANTAC 150 mg et 300 mg) . hémorragies de la maladie ulcéreuse gastro-duodénale (AZANTAC 50 mg/2 ml) . lésions gastro-duodénales liées au stress (AZANTAC 50 mg/2 ml) . en association à une bithérapie antibiotique, éradication de Helicobacter pylori en cas de maladie ulcéreuse gastro-duodénale (après preuve endoscopique de la lésion et de l'infection) (AZANTAC 300 mg). |
| Insuffisant | Avis du 19/10/2011 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités AZANTAC 150 mg, 300 mg et 50mg/2ml reste insuffisant dans l'indication syndrome de Zollinger-Ellison. Pour la spécialité AZANTAC 150 mg, conformément aux avis de la même classe, le service médical rendu est insuffisant dans l'indication traitement d'entretien de l'ulcère duodénal. |
| Faible | Avis du 19/10/2011 | Renouvellement d'inscription (CT) | Le service médical rendu reste faible dans les indications : traitement symptomatique du reflux gastro-oesophagien lorsque les règles hygiéno-diététiques ne se sont pas montrées efficaces (AZANTAC 75 mg) . ulcère gastrique ou duodénal évolutif (par AZANTAC 150 mg, 300 mg et 50 mg/2 ml) . oesophagite par reflux gastro-oesophagien (par AZANTAC 150 mg et 300 mg) . hémorragies de la maladie ulcéreuse gastro-duodénale (AZANTAC 50 mg/2 ml) . lésions gastro-duodénales liées au stress (AZANTAC 50 mg/2 ml) . en association à une bithérapie antibiotique, éradication de Helicobacter pylori en cas de maladie ulcéreuse gastro-duodénale (après preuve endoscopique de la lésion et de l'infection) (AZANTAC 300 mg). |
| Insuffisant | Avis du 19/10/2011 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités AZANTAC 150 mg, 300 mg et 50mg/2ml reste insuffisant dans l'indication syndrome de Zollinger-Ellison. Pour la spécialité AZANTAC 150 mg, conformément aux avis de la même classe, le service médical rendu est insuffisant dans l'indication traitement d'entretien de l'ulcère duodénal. |
| Faible | Avis du 19/10/2011 | Renouvellement d'inscription (CT) | Le service médical rendu reste faible dans les indications : traitement symptomatique du reflux gastro-oesophagien lorsque les règles hygiéno-diététiques ne se sont pas montrées efficaces (AZANTAC 75 mg) . ulcère gastrique ou duodénal évolutif (par AZANTAC 150 mg, 300 mg et 50 mg/2 ml) . oesophagite par reflux gastro-oesophagien (par AZANTAC 150 mg et 300 mg) . hémorragies de la maladie ulcéreuse gastro-duodénale (AZANTAC 50 mg/2 ml) . lésions gastro-duodénales liées au stress (AZANTAC 50 mg/2 ml) . en association à une bithérapie antibiotique, éradication de Helicobacter pylori en cas de maladie ulcéreuse gastro-duodénale (après preuve endoscopique de la lésion et de l'infection) (AZANTAC 300 mg). |
| Insuffisant | Avis du 19/10/2011 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités AZANTAC 150 mg, 300 mg et 50mg/2ml reste insuffisant dans l'indication syndrome de Zollinger-Ellison. Pour la spécialité AZANTAC 150 mg, conformément aux avis de la même classe, le service médical rendu est insuffisant dans l'indication traitement d'entretien de l'ulcère duodénal. |
| Faible | Avis du 19/10/2011 | Renouvellement d'inscription (CT) | Le service médical rendu reste faible dans les indications : traitement symptomatique du reflux gastro-oesophagien lorsque les règles hygiéno-diététiques ne se sont pas montrées efficaces (AZANTAC 75 mg) . ulcère gastrique ou duodénal évolutif (par AZANTAC 150 mg, 300 mg et 50 mg/2 ml) . oesophagite par reflux gastro-oesophagien (par AZANTAC 150 mg et 300 mg) . hémorragies de la maladie ulcéreuse gastro-duodénale (AZANTAC 50 mg/2 ml) . lésions gastro-duodénales liées au stress (AZANTAC 50 mg/2 ml) . en association à une bithérapie antibiotique, éradication de Helicobacter pylori en cas de maladie ulcéreuse gastro-duodénale (après preuve endoscopique de la lésion et de l'infection) (AZANTAC 300 mg). |
| Insuffisant | Avis du 19/10/2011 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités AZANTAC 150 mg, 300 mg et 50mg/2ml reste insuffisant dans l'indication syndrome de Zollinger-Ellison. Pour la spécialité AZANTAC 150 mg, conformément aux avis de la même classe, le service médical rendu est insuffisant dans l'indication traitement d'entretien de l'ulcère duodénal. |
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide)
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |