Dernière mise à jour le 02/03/2026
CETAFEN 10 mg/3 mg par mL, solution pour perfusion
Indications thérapeutiques
Classe pharmacothérapeutique : Autres analgésiques et antipyrétiques, Anilides ; code ATC : N02BE51.
CETAFEN 10 mg/3 mg par mL, solution pour perfusion contient les substances actives paracétamol et ibuprofène. L’ibuprofène appartient à un groupe de médicaments appelés anti-inflammatoires non stéroïdiens (ou AINS). Le paracétamol a un mode d’action différent de l’ibuprofène, mais les deux substances agissent simultanément pour réduire la douleur.
CETAFEN 10 mg/3 mg par mL, solution pour perfusion est utilisé chez l’adulte pour le traitement symptomatique de courte durée de la douleur aiguë d’intensité modérée, lorsque la voie d’administration intraveineuse est nécessaire et/ou lorsque les autres voies d’administration ne sont pas possibles.
Présentations
> 10 flacons en verre de 100 mL
Code CIP : 34009 550 856 2 1
Déclaration de commercialisation : 04/11/2022
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 05/10/2022 | Inscription (CT) | Le service médical rendu par CETAFEN (paracétamol/ibuprofène) 10 mg/3 mg par mL est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 05/10/2022 | Inscription (CT) | Cette spécialité n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la stratégie de prise en charge de courte durée des douleurs aigues modérées, lorsqu’un mode d’administration intraveineux est considéré comme cliniquement nécessaire et/ou lorsque les autres voies d’administration sont impossibles. |
Autres informations
- Titulaire de l'autorisation : EVER VALINJECT GMBH
- Conditions de prescription et de délivrance :
- liste I
- réservé à l'usage HOSPITALIER
- Statut de l'autorisation : Valide
- Type de procédure : Procédure de reconnaissance mutuelle
- Code CIS : 6 424 806 5
ANSM - Mis à jour le : 05/03/2025
CETAFEN 10 mg/3 mg par mL, solution pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un mL contient 10 mg de paracétamol et de l’ibuprofène sodique dihydraté correspondant à 3 mg d’ibuprofène.
Excipient à effet notoire :
Sodium 35 mg pour 100 mL (0,35 mg/mL).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution transparente incolore, exempte de particules visibles, avec un pH de 6,3-7,3 et une osmolalité de 285-320 mOsmol/kg.
4.1. Indications thérapeutiques
CETAFEN 10 mg/3 mg par mL, solution pour perfusion est indiqué chez l’adulte pour le traitement symptomatique de courte durée des douleurs aiguës modérées, lorsqu’un mode d’administration intraveineux est considéré comme cliniquement nécessaire et/ou lorsque les autres voies d’administration sont impossibles.
4.2. Posologie et mode d'administration
Pour une administration intraveineuse et une utilisation de courte durée, limitée à un maximum de deux jours. Les effets indésirables peuvent être minimisés en prenant la dose minimale efficace pendant la plus courte durée nécessaire pour contrôler les symptômes (voir rubrique 4.4).
Adultes (pesant > 50 kg)
Administrer un flacon (100 mL) de CETAFEN 10 mg/3 mg par mL, solution pour perfusion, en perfusion de 15 minutes toutes les 6 heures, à la demande. Ne pas dépasser une dose quotidienne totale de quatre flacons (400 mL), équivalant à 4 000 mg (4 g) de paracétamol et 1 200 mg d’ibuprofène.
Adultes (pesant ≤ 50 kg)
Les adultes pesant 50 kg ou moins doivent être traités en fonction de leur poids corporel, à une posologie de 1,5 mL/kg, en perfusion de 15 minutes toutes les 6 heures, à la demande. Cela équivaut à une dose unique maximale de 75 mL (jeter le reliquat de produit restant dans le flacon) et à une dose quotidienne totale de 3 000 mg (3 g) de paracétamol et 900 mg d’ibuprofène.
Population pédiatrique
CETAFEN 10 mg/3 mg par mL, solution pour perfusion est contre-indiqué pour les patients de moins de 18 ans (voir rubrique 4.3).
Populations particulières
Sujets âgés
Chez les patients âgés, la sélection de la dose doit être prudente, en commençant généralement à la plus faible dose de l’éventail posologique, compte tenu de la plus grande fréquence des insuffisances hépatique, rénale ou cardiaque, ainsi que des comorbidités ou des autres traitements médicamenteux concomitants.
Les personnes âgées sont à risque majoré de conséquences graves des effets indésirables. Si un AINS est considéré nécessaire, la dose minimale efficace doit être administrée pendant la plus courte durée possible. Le traitement doit être revu à intervalles réguliers et arrêté si aucun bénéfice n’est observé ou en cas d’intolérance. Pendant le traitement par AINS, le patient doit être surveillé régulièrement à la recherche de saignements gastro-intestinaux.
Insuffisance rénale
Des précautions doivent être prises avec la posologie d’ibuprofène chez les patients souffrant d'atteinte rénale. Ce médicament est contre-indiqué chez les patients atteints d’insuffisance rénale sévère (voir rubrique 4.3).
La posologie doit être évaluée au cas par cas. La dose initiale doit être réduite chez les patients atteints d’insuffisance rénale légère à modérée. La dose doit être maintenue aussi faible que possible et prise pendant la durée la plus courte possible requise pour contrôler les symptômes. La fonction rénale doit être surveillée (voir rubriques 4.3, 4.4 et 5.2).
Insuffisance hépatique
L’usage de paracétamol à des doses supérieures à celles recommandées peut induire une hépatotoxicité, voire une insuffisance hépatique et le décès. Chez les patients présentant des facteurs de risques additionnels d’hépatotoxicité, comme une insuffisance hépatocellulaire, un alcoolisme chronique, une malnutrition chronique (faibles réserves de glutathion dans le foie), ou une déshydratation, la dose quotidienne totale de 3 000 mg (3 g) de paracétamol ne doit pas être dépassée.
Ce médicament est contre-indiqué chez les patients souffrant d'insuffisance hépatique sévère (voir rubrique 4.3). Un patient présentant des signes et/ou des symptômes suggérant une atteinte hépatique ou ayant des résultats anormaux aux tests hépatiques doit être évalué à la recherche de signes de développement d'une réaction hépatique plus grave pendant le traitement par ibuprofène, et CETAFEN 10 mg/3 mg par mL, solution pour perfusion doit être arrêté. En cas de survenue de signes cliniques et de symptômes évoquant une maladie hépatique, ou de manifestations systémiques (éosinophilie, rash, etc.), CETAFEN 10 mg/3 mg par mL, solution pour perfusion doit être arrêté.
Mode d’administration
CETAFEN 10 mg/3 mg par mL, solution pour perfusion doit être administré en perfusion intraveineuse de 15 minutes.
Pour prélever la solution, utiliser une aiguille de 0,8 mm (aiguille 21 G) et perforer verticalement le bouchon au point indiqué.
Chez les patients pesant moins de 50 kg pour lesquels un flacon complet (100 mL) n’est pas nécessaire, le volume adéquat doit être perfusé et le reliquat de solution éliminé (voir également rubrique 6.6).
Comme avec toutes les solutions pour perfusion délivrées en flacon de verre, il convient de rappeler qu’une étroite surveillance est requise, en particulier en fin de perfusion, indépendamment de la voie d’administration. Cette surveillance en fin de la perfusion s’applique particulièrement pour la perfusion par voie centrale, afin d’éviter une embolie gazeuse.
L’utilisation de ce produit est contre-indiquée dans les cas suivants :
· chez les patients ayant une hypersensibilité connue au paracétamol, à l’ibuprofène, à d’autres AINS ou à l’un des excipients mentionnés à la rubrique 6.1 ;
· chez les patients souffrant d'insuffisance cardiaque sévère (classe IV NYHA) ;
· chez les patients présentant un alcoolisme actif, la consommation excessive chronique d’alcool pouvant prédisposer les patients à une hépatotoxicité (en raison du composant paracétamol) ;
· chez les patients ayant présenté de l’asthme, de l’urticaire ou des réactions allergiques après la prise d’acide acétylsalicylique ou d’autres AINS ;
· chez les patients ayant des antécédents d’hémorragie ou de perforation gastro-intestinale associés à un précédent traitement par AINS ;
· chez les patients souffrant d’ulcères gastro-duodénaux ou d’hémorragies gastro-intestinales actifs ou passés (deux ou plusieurs épisodes distincts confirmés d’ulcère ou de saignement) ;
· chez les patients présentant une insuffisance hépatique sévère ou une insuffisance rénale sévère (voir rubrique 4.4.) ;
· chez les patients présentant une hémorragie cérébrovasculaire ou tout autre type d’hémorragie active ;
· chez les patients présentant des troubles de la coagulation sanguine et des affections impliquant une tendance majorée aux saignements ;
· si vous souffrez d’une déshydratation sévère (causée par des vomissements, une diarrhée ou un apport insuffisant en liquide) ;
· pendant le troisième trimestre de grossesse (voir rubrique 4.6) ;
· chez les patients âgés de moins de 18 ans.
4.4. Mises en garde spéciales et précautions d'emploi
L’utilisation de CETAFEN 10 mg/3 mg par mL, solution pour perfusion avec un AINS concomitant, incluant les inhibiteurs sélectifs de la cyclooxygénase-2, doit être évitée.
Afin d’éviter le risque de surdosage,
· vérifier que les autres médicaments ne contiennent pas de paracétamol,
· respecter les doses maximales recommandées (voir rubrique 4.2).
Événements thrombotiques cardiovasculaires
Les études cliniques suggèrent que l'utilisation d’ibuprofène, en particulier à forte dose (2 400 mg/jour), peut être associée à un risque légèrement majoré d’événements thrombotiques artériels (infarctus du myocarde ou accident vasculaire cérébral, par exemple). Dans l’ensemble, les études épidémiologiques ne suggèrent pas que l’ibuprofène à faible dose (1 200 mg/jour) soit associé à un risque majoré d’événements thrombotiques artériels.
Les patients présentant une hypertension non contrôlée, une insuffisance cardiaque congestive (classe NYHA II-III), une cardiopathie ischémique établie, une artériopathie périphérique, et/ou une maladie cérébrovasculaire ne doivent être traités par ibuprofène qu’après une évaluation approfondie, et les fortes doses (2 400 mg/jour) doivent être évitées.
Une évaluation attentive doit également être effectuée avant l'instauration d'un traitement au long cours chez les patients présentant des facteurs de risque d’événements cardiovasculaires (hypertension, hyperlipidémie, diabète sucré, et tabagisme notamment), en particulier si de fortes doses d’ibuprofène (2 400 mg/jour) sont requises.
Insuffisance hépatique
L’usage de paracétamol à des doses supérieures à celles recommandées peut induire une hépatotoxicité, voire une insuffisance hépatique et le décès. De même, les patients souffrant d'une atteinte hépatique ou ayant un antécédent de maladie hépatique et traités au long cours par ibuprofène ou paracétamol doivent recevoir une surveillance de leur fonction hépatique à intervalles réguliers, dans la mesure où un effet mineur et transitoire de l’ibuprofène sur les enzymes hépatiques a été rapporté. Une réduction de dose est recommandée chez les patients présentant des signes d’altération de la fonction hépatique. Le traitement doit être arrêté chez les patients développant une insuffisance hépatique sévère (voir rubrique 4.3).
Des réactions hépatiques sévères, incluant la jaunisse et des cas d’hépatite fatale, bien que rares, ont été rapportées avec l’ibuprofène comme avec d’autres AINS. En cas de persistance ou d’aggravation des anomalies des tests hépatiques, ou de développement de signes cliniques et de symptômes évoquant une maladie hépatique, ou de survenue de manifestations systémiques (éosinophilie, rash, etc.), l’ibuprofène doit être arrêté. Ces deux médicaments actifs induiraient une hépatotoxicité, voire une insuffisance hépatique, en particulier le paracétamol.
Insuffisance rénale
Le paracétamol peut être utilisé chez les patients souffrant d’insuffisance rénale chronique sans ajustement posologique. Il existe un risque minime de toxicité du paracétamol chez les patients atteints d'insuffisance rénale modérée à sévère. Cependant, compte tenu de la composante ibuprofène de ce produit, une prudence doit être observée lors de l’initiation du traitement chez les patients déshydratés. Les deux principaux métabolites de l’ibuprofène sont excrétés essentiellement dans l’urine et l’atteinte de la fonction rénale peut entraîner leur accumulation. La signification de cette observation n’est pas connue. Les AINS induiraient une néphrotoxicité sous diverses formes : néphropathie interstitielle, syndrome néphrotique et insuffisance rénale.
L’atteinte rénale due à la prise d’ibuprofène est généralement réversible. Chez les patients atteints d'insuffisance rénale, cardiaque ou hépatique, ceux prenant des diurétiques et des inhibiteurs de l’enzyme de conversion (IEC), et les personnes âgées, la prudence est requise dans la mesure où l’utilisation des AINS peut entraîner une détérioration de la fonction rénale. La dose doit être maintenue aussi faible que possible et la fonction rénale doit être surveillée chez ces patients. Le traitement doit être arrêté chez les patients qui développent une insuffisance rénale sévère (voir rubrique 4.3).
Utilisation combinée d’inhibiteurs de l’enzyme de conversion (IEC) ou d’antagonistes des récepteurs de l’angiotensine, d’anti-inflammatoires et de diurétiques thiazidiques
L’utilisation concomitante d’un médicament inhibant l’enzyme de conversion (IEC ou antagoniste des récepteurs de l’angiotensine), d’un anti-inflammatoire (AINS ou inhibiteur de la COX-2) et d’un diurétique thiazidique augmente le risque d’insuffisance rénale. Cela inclut les produits à combinaison fixe contenant plus d’une classe de médicament. L’utilisation combinée de ces médicaments doit être associée à une surveillance renforcée de la créatinine sérique, en particulier à l’instauration de la combinaison. L’association de médicaments de ces trois classes doit être utilisée avec prudence en particulier chez les personnes âgées ou chez les patients présentant une insuffisance rénale préexistante.
Sujets âgés
Aucune réduction de la posologie recommandée n’est requise. Cependant, il convient d’être prudent avec l’utilisation de l’ibuprofène, dans la mesure où elle ne doit pas être prise chez les adultes âgés de plus de 65 ans sans tenir compte des comorbidités et des traitements concomitants en raison du risque majoré d’effets indésirables, en particulier d’insuffisance cardiaque, d’ulcère gastro-intestinal et d’insuffisance rénale.
Effets hématologiques
De rares cas de dyscrasies ont été rapportés. Les patients sous traitement au long cours par ibuprofène doivent bénéficier d’une surveillance hématologique régulière.
Réactions anaphylactoïdes
Dans la pratique standard, pendant la perfusion intraveineuse, une surveillance attentive du patient est recommandée, en particulier en début de perfusion afin de détecter toute réaction anaphylactique causée par la substance active ou les excipients.
Les réactions d’hypersensibilité aiguë sévère (choc anaphylactique) sont très rarement observées. Aux premiers signes de réaction d’hypersensibilité après l’administration de CETAFEN 10 mg/3 mg par mL, solution pour perfusion, le traitement doit être arrêté et un traitement symptomatique doit être instauré. Les mesures médicales requises, en fonction des symptômes, doivent être initiées par un personnel spécialisé.
Troubles de la coagulation
Comme d’autres AINS, l’ibuprofène peut inhiber l’agrégation plaquettaire. Il a été démontré que l’ibuprofène prolonge le temps de saignement (mais dans l’intervalle de la normale) chez des sujets normaux. Dans la mesure où cette prolongation des saignements peut être exacerbée chez les patients présentant des troubles hémostatiques sous-jacents, les produits contenant de l'ibuprofène doivent être utilisés avec prudence chez les personnes présentant des anomalies intrinsèques de la coagulation et chez celles sous traitement anticoagulant. Les patients souffrant de troubles de la coagulation ou ceux subissant une chirurgie doivent être surveillés. Une vigilance médicale particulière est requise en cas d’utilisation chez les patients immédiatement après la réalisation d’une chirurgie majeure.
Événements gastro-intestinaux
Des hémorragies gastro-intestinales (GI), des ulcères ou des perforations, pouvant être fatals, ont été rapportés avec tous les AINS, à tout moment pendant le traitement, avec ou sans symptômes précurseurs ou antécédent d’événements GI graves.
Le risque d’hémorragie, d’ulcère ou de perforation GI est supérieur avec des doses croissantes d’AINS chez les patients ayant un antécédent d’ulcère, en particulier s’il est compliqué d'une hémorragie ou d’une perforation (voir rubrique 4.3), et chez les personnes âgées. Ces patients doivent débuter le traitement à la plus faible dose disponible.
Un traitement d’association avec des agents protecteurs (misoprostol ou inhibiteurs de la pompe à protons) doit être envisagé chez ces patients, ainsi que chez ceux nécessitant une faible dose concomitante d’acide acétylsalicylique ou d’autres médicaments susceptibles de majorer le risque gastro-intestinal (voir ci-dessous et rubrique 4.5). Les patients ayant un antécédent de toxicité GI, en particulier s’ils sont âgés, doivent signaler tout symptôme abdominal inhabituel (en particulier les saignements GI), plus particulièrement au début du traitement.
La prudence doit être recommandée aux patients recevant des médicaments concomitants susceptibles de majorer le risque d’ulcération ou de saignement, tels que les corticoïdes oraux, les anticoagulants comme la warfarine, les inhibiteurs sélectifs de recapture de la sérotonine ou les antiagrégants plaquettaires comme l’acide acétylsalicylique (voir rubrique 4.5).
En raison de la composante ibuprofène, CETAFEN 10 mg/3 mg par mL, solution pour perfusion doit être administré avec prudence chez les patients ayant un antécédent de maladie GI (rectocolite hémorragique, maladie de Crohn) et chez ceux souffrant de porphyrie.
Les personnes âgées présentent plus souvent des réactions indésirables aux AINS, en particulier d’hémorragies et de perforations gastro-intestinales qui peuvent être fatales (voir rubrique 4.2).
Ce produit doit être arrêté en cas de signe d’hémorragie ou d’ulcération gastro-intestinale.
Hypertension
Les AINS peuvent induire une hypertension de novo ou l’aggravation d’une hypertension préexistante, et les patients prenant des antihypertenseurs avec des AINS peuvent présenter une altération de la réponse hypotensive. La prudence est recommandée lors de la prescription d’AINS chez les patients hypertendus. La pression artérielle doit être étroitement surveillée lors de l’initiation du traitement par AINS et à intervalles réguliers par la suite.
Insuffisance cardiaque
Des cas de rétention d’eau et d'œdème ont été observés chez certains patients prenant des AINS ; en conséquence, la prudence est recommandée chez les patients présentant une rétention d’eau ou une insuffisance cardiaque.
Réactions cutanées sévères
Dans de très rares cas, les AINS peuvent causer des effets indésirables cutanés graves tels qu’une dermatite exfoliative, une nécro-épidermolyse bulleuse aiguë et un syndrome de Stevens-Johnson (SJS), qui peuvent être fatals et survenir sans signe avant-coureur. Des pustuloses exanthématiques aiguës généralisées (PEAG) ont été rapportées associées à des produits contenant de l’ibuprofène. Les patients semblent à plus haut risque de présenter ces réactions au début du traitement, celles-ci survenant dans la majorité des cas au cours du premier mois de traitement.
Les patients doivent être informés des signes et des symptômes de réactions cutanées graves ; il doit en outre leur être conseillé de consulter leur médecin à la première apparition d’un rash ou de tout autre signe d’hypersensibilité.
Exceptionnellement, la varicelle peut causer des complications infectieuses graves de la peau et des tissus mous. À ce jour, la contribution des AINS à l’aggravation de ces infections ne peut pas être exclue. En conséquence, il est recommandé d’éviter d’utiliser CETAFEN en cas de varicelle.
Asthme préexistant
Les produits contenant de l’ibuprofène ne doivent pas être administrés chez les patients présentant un asthme sensible à l’acide acétylsalicylique et doivent être utilisés avec prudence chez les patients ayant un asthme préexistant.
Effets ophtalmologiques
Des effets secondaires ophtalmologiques ont été observés avec les AINS ; en conséquence, les patients qui développent des troubles visuels pendant un traitement avec des produits contenant de l’ibuprofène doivent être soumis à un examen ophtalmologique.
Méningite aseptique
Pour les produits contenant de l’ibuprofène, les méningites aseptiques n’ont été rapportées que rarement, généralement mais pas toujours chez des patients souffrant d’un lupus érythémateux systémique (LES) ou d’autres affections du tissu conjonctif.
Interférences potentielles avec les tests de laboratoire
Avec les systèmes analytiques actuels, le paracétamol ne produit pas d’interférence avec les analyses de laboratoire. Cependant, avec certaines méthodes, il existe une possibilité d’interférences biologiques, décrites ci-dessous :
Tests urinaires
Le paracétamol à doses thérapeutiques peut interférer avec la détermination de l’acide 5-hydroxyindole acétique (5-HIAA), entraînant des résultats faux positifs. Les faux positifs peuvent être écartés en évitant la prise de paracétamol plusieurs heures avant et pendant le recueil des échantillons urinaires.
Dissimulation des symptômes d’infections sous-jacentes
CETAFEN peut masquer des symptômes d’infection, ce qui peut entraîner un retard d’instauration du traitement approprié et partant, l’aggravation de l’issue de l’infection. Cela a été observé dans la pneumonie communautaire bactérienne et dans les complications bactériennes de la varicelle. Lorsque CETAFEN est administré contre la fièvre ou pour le soulagement de douleurs associées à une infection, la surveillance de l’infection est recommandée. Dans un contexte non hospitalier, le patient doit consulter un médecin en cas de persistance ou d’aggravation des symptômes.
Usage prolongé des antalgiques
En cas d’usage prolongé d’antalgiques, des maux de tête peuvent survenir, qui ne doivent pas être traités par une augmentation de la dose du médicament.
Acidose métabolique à trou anionique élevé (AMTAE) due à une acidose pyroglutamate
Des cas d’acidose métabolique à trou anionique élevé (AMTAE) due à une acidose pyroglutamique ont été rapportés chez les patients atteints d’une maladie grave telle qu’une insuffisance rénale sévère et un sepsis, ou chez les patients souffrant de malnutrition ou d'autres sources de déficit en glutathion (par exemple, alcoolisme chronique) qui ont été traités par du paracétamol à une dose thérapeutique pendant une période prolongée ou par une association de paracétamol et de flucloxacilline. En cas de suspicion d’AMTAE due à une acidose pyroglutamique, il est recommandé d’arrêter immédiatement le paracétamol et d’effectuer une surveillance étroite. La mesure de la 5-oxoproline urinaire peut être utile pour identifier l’acidose pyroglutamique comme cause sous-jacente de l’AMTAE chez les patients présentant de multiples facteurs de risque.
Précautions spéciales
Il existe des données selon lesquelles les médicaments qui inhibent la synthèse de la cyclo-oxygénase/prostaglandine peuvent causer une altération de la fertilité féminine par un effet sur l’ovulation. Cet effet est réversible à l’arrêt du médicament.
L’ibuprofène doit être utilisé uniquement après une évaluation rigoureuse du rapport bénéfice/risque chez les patients présentant un trouble congénital du métabolisme des porphyrines (porphyrie aiguë intermittente, par exemple).
Avec la consommation concomitante d’alcool, les effets indésirables liés à la substance active, en particulier ceux affectant le tractus gastro-intestinal ou le système nerveux central, peuvent être augmentés avec l’utilisation d’AINS.
La prudence est requise chez les patients présentant certaines affections qui peuvent être aggravées :
· Chez les patients présentant des réactions allergiques à d’autres substances, dans la mesure où il existe également chez eux un risque majoré de survenue de réactions d’hypersensibilité avec la prise de ce médicament.
· Chez les patients souffrant de rhume des foins, de polypes nasaux ou de maladies pulmonaires obstructives chroniques, dans la mesure où ils présentent un risque accru de réactions allergiques. Celles-ci peuvent se manifester sous la forme de crises d’asthme (appelées asthme analgésique), d'œdème de Quincke ou d’urticaire.
Ce médicament contient 35,06 mg de sodium par flacon de 100 mL, ce qui équivaut à 1,75% de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Ibuprofène :
Comme avec d’autres produits à base d’ibuprofène, les combinaison suivantes avec / / doivent être évitées :
· Classe dicoumarol : Les AINS peuvent accroître l’effet des anticoagulants comme la warfarine. Des études expérimentales démontrent que l’ibuprofène renforce les effets de la warfarine sur le temps de saignement. Les AINS et la classe dicoumarol sont métabolisés par la même enzyme, CYP2C9.
· Antiagrégants plaquettaires : Les AINS ne doivent pas être combinés avec des antiagrégants plaquettaires comme la ticlopidine en raison de l’inhibition additive de la fonction plaquettaire (voir ci-dessous).
· Méthotrexate : Les AINS inhibent la sécrétion tubulaire du méthotrexate, et certaines interactions métaboliques avec une clairance réduite du méthotrexate peuvent également en découler. Le risque d’interaction potentielle entre un AINS et le méthotrexate doit également être pris en compte dans le cadre d’un traitement à faible dose par méthotrexate, en particulier chez les patients souffrant d'insuffisance rénale. Lorsqu’un traitement d’association est administré, la fonction rénale doit être surveillée. Il conviendra d’être prudent si un AINS et du méthotrexate sont administrés dans un intervalle de 24 heures, dans la mesure où les taux plasmatiques de méthotrexate peuvent augmenter, induisant une toxicité accrue. En conséquence, dans le traitement à forte dose par méthotrexate, il convient d’éviter systématiquement la prescription d’AINS.
· Acide acétylsalicylique : L’administration concomitante d’ibuprofène et d’acide acétylsalicylique n’est généralement pas recommandée en raison de la possibilité d’augmentation des effets indésirables. Les données expérimentales suggèrent que l’ibuprofène pourrait inhiber compétitivement l’effet de l’acide acétylsalicylique à faible dose sur l’agrégation plaquettaire lorsqu’ils sont administrés concomitamment. Malgré des incertitudes concernant l’extrapolation de ces données en situation clinique, la possibilité que l'utilisation régulière au long cours de l’ibuprofène puisse réduire l’effet cardioprotecteur de l’acide acétylsalicylique à faible dose ne peut être exclue. Aucun effet cliniquement pertinent n’est considéré comme probable en cas de prise occasionnelle d’ibuprofène (voir rubrique 5.1).
· Lithium : L’ibuprofène réduit la clairance rénale du lithium, entraînant une augmentation possible des taux de lithium sérique. Cette association doit être évitée sauf si des contrôles fréquents du lithium sérique peuvent être effectués, avec une possibilité de réduire la dose de lithium.
· Glycosides cardiaques : Les AINS peuvent exacerber l’insuffisance cardiaque, réduire la filtration glomérulaire et augmenter les taux plasmatiques de glycosides cardiaques (digoxine).
· Mifépristone : Une diminution de l’efficacité du médicament peut théoriquement survenir en raison de l’activité antiprostaglandine des anti-inflammatoires non stéroïdiens (AINS) incluant l’acide acétylsalicylique. Selon des données limitées, la co-administration d’AINS le jour de l’administration de prostaglandine n’affecte pas défavorablement les effets du mifépristone ou de la prostaglandine sur la maturation du col ou la contractilité utérine et ne réduit pas l’efficacité clinique sur l’interruption médicale de grossesse
· Inhibiteurs de l’enzyme de conversion (IEC) et antagonistes des récepteurs de l’angiotensine II (ARA II) : Il existe un risque majoré d’insuffisance rénale aiguë, généralement réversible, chez les patients atteints d'insuffisance rénale (par exemple patients déshydratés et/ou âgés) lorsqu’un traitement par IEC ou antagonistes de l’angiotensine II est administré simultanément à un AINS, y compris les inhibiteurs sélectifs de la cyclooxygénase-2. Cette combinaison doit donc être administrée avec prudence chez les patients atteints d'insuffisance rénale, en particulier chez les patients âgés. Les patients doivent être correctement hydratés et un contrôle de la fonction rénale doit être envisagé après l’initiation du traitement d’association, ainsi qu’à intervalles réguliers pendant le traitement (voir rubrique 4.4).
· Bêta-bloquants : Les AINS neutralisent l’effet hypotenseur des médicaments bloquant les récepteurs bêta-adrénergiques.
· Sulfonylurées : De rares cas d’hypoglycémie ont été rapportés chez des patients sous traitement par sulfonylurée recevant de l’ibuprofène.
· Zidovudine : Des données démontrent un risque majoré d’hémarthroses et d’hématome chez les hémophiles VIH-positifs recevant un traitement concomitant par zidovudine et ibuprofène.
· Quinolones : les données animales indiquent que les AINS peuvent augmenter le risque de convulsions associées aux quinolones. Les patients sous AINS et quinolone peuvent être à risque majoré de convulsions.
· Thiazides, préparations thiazidiques et diurétiques de l’anse : Les AINS peuvent neutraliser l’effet diurétique du furosémide et du bumétanide, possiblement via l’inhibition de la synthèse des prostaglandines. Ils peuvent également neutraliser l’effet hypotenseur des thiazides.
· Diurétiques épargneurs de potassium : L’administration concomitante peut entraîner une hyperkaliémie.
· Aminoglycosides : Les AINS peuvent réduire l’excrétion des aminoglycosides.
· Inhibiteurs sélectifs de recapture de la sérotonine (ISRS) : Les ISRS et les AINS induisent chacun un risque majoré de saignement, notamment du tractus gastro-intestinal. Ce risque est accru avec un traitement d’association. Le mécanisme peut potentiellement être lié à une réduction de la capture de la sérotonine dans les plaquettes (voir rubrique 4.4).
· Cyclosporine : L’administration concomitante d’AINS et de cyclosporine pourrait majorer le risque de néphrotoxicité en raison de la diminution de la synthèse de prostacycline dans le rein. En conséquence, en cas de traitement combiné, la fonction rénale doit être étroitement surveillée.
· Captopril : Les études expérimentales indiquent que l’ibuprofène neutralise les effets du captopril sur l’excrétion de sodium.
· Tacrolimus : L’administration concomitante d’AINS et de tacrolimus serait capable d’augmenter le risque de néphrotoxicité en raison de la diminution de la synthèse de prostacycline dans le rein. En conséquence, en cas de traitement d’association, la fonction rénale doit être étroitement surveillée.
· Corticoïdes : Le traitement concomitant induit un risque accru d’ulcération ou d'hémorragie gastro-intestinale.
· Inhibiteurs du CYP2C9 : L’administration concomitante d’ibuprofène et d’inhibiteurs du CYP2C9 peut augmenter l’exposition à l’ibuprofène (substrat du CYP2C9). Dans une étude sur le voriconazole et le fluconazole (inhibiteurs du CYP2C9), une augmentation de l’exposition à l’ibuprofène S(+) d’environ 80 à 100% a été démontrée. Une réduction de la dose d’ibuprofène doit être envisagée lorsque des inhibiteurs puissants du CYP2C9 sont administrés simultanément, en particulier lorsque de l’ibuprofène à forte dose est administré avec le voriconazole ou le fluconazole.
· Phénytoïne : Les taux plasmatiques de phénytoïne peuvent être augmentés dans le traitement concomitant par ibuprofène ; par conséquent, le risque de toxicité peut être accru.
· Probénécide et sulfinpyrazone : Les médicaments contenant du probénécide ou de la sulfinpyrazone peuvent retarder l’excrétion de l’ibuprofène.
· Extraits de plantes : Le ginkgo biloba peut augmenter le risque de saignement avec les AINS.
Paracétamol :
· Le probénécide inhibe la liaison du paracétamol à l’acide glucuronique, entraînant ainsi une réduction de la clairance du paracétamol par un facteur de 2 environ. Chez les patients prenant simultanément du probénécide, la dose de paracétamol doit être réduite.
· Des médicaments inducteurs d’enzyme comme certains antiépileptiques (phénytoïne, phénobarbital, carbamazépine) ont diminué l’AUC plasmatique du paracétamol à environ 60% dans les études pharmacocinétiques. D’autres substances ayant des propriétés inductrices enzymatiques (rifampicine, Hypericum) pourraient également entraîner une diminution des concentrations de paracétamol. En outre, le risque d’atteinte hépatique au cours du traitement à la dose maximale recommandée de paracétamol est probablement supérieur chez les patients recevant des inducteurs enzymatiques.
· La zidovudine pourrait affecter le métabolisme du paracétamol et vice versa, ce qui pourrait renforcer la toxicité des deux substances.
· Anticoagulants (warfarine) - la posologie peut devoir être réduite si le paracétamol et l’anticoagulant sont pris pendant une période prolongée.
· Une hépatotoxicité sévère aux doses thérapeutiques ou avec des surdoses modérées de paracétamol a été rapportée chez des patients recevant de l’isoniazide seul ou avec d’autres médicaments contre la tuberculose.
· Le paracétamol peut affecter la pharmacocinétique du chloramphénicol. La surveillance des taux plasmatiques de chloramphénicol est recommandée en cas d’association du paracétamol avec un traitement par injection de chloramphénicol.
· L’éthanol augmente la toxicité du paracétamol, possiblement en induisant une production hépatique de produits hépatotoxiques dérivés du paracétamol.
· Il convient d'être prudent lors de l'utilisation concomitante de paracétamol et de flucloxacilline, car la prise simultanée a été associée à une acidose métabolique à trou anionique élevé due à une acidose pyroglutamique, en particulier chez les patients présentant des facteurs de risque (voir rubrique 4.4).
Effets sur les tests biologiques
La prise de paracétamol peut affecter les analyses d’acide urique utilisant de l’acide phosphotungstique et les dosages de glycémie utilisant la glucose oxydase/peroxydase.
Population pédiatrique
Les études d’interaction n’ont été réalisées que chez l’adulte.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas d’expérience sur l’utilisation de ce produit chez l’homme pendant la grossesse. En raison de la composante ibuprofène, CETAFEN est contre-indiqué pendant le troisième trimestre de grossesse (voir ci-dessous).
Pour l’ibuprofène
L’inhibition de la synthèse des prostaglandines peut affecter défavorablement la grossesse et/ou le développement embryo-fœtal. Les données des études épidémiologiques suggèrent un risque accru de fausse couche, ainsi que de malformation cardiaque et de gastroschisis après l’utilisation d’un inhibiteur de synthèse des prostaglandines en début de grossesse. Le risque absolu de malformation cardiovasculaire était augmenté, passant de moins de 1% à environ 1,5 %. Le risque serait majoré avec la dose et la durée du traitement. Chez l’animal, l’administration d’un inhibiteur de synthèse des prostaglandines a démontré produire une augmentation des pertes pré et post-implantation, ainsi que de la létalité embryo-fœtale. En outre, des incidences accrues de malformations diverses, y compris cardiovasculaires, ont été rapportées chez des animaux recevant un inhibiteur de synthèse des prostaglandines pendant la période organogénétique.
A partir de la 20ème semaine de grossesse, l'utilisation de CETAFEN peut provoquer un oligo-hydramnios résultant d'un dysfonctionnement rénal fœtal. Cela peut survenir peu de temps après le début du traitement et est généralement réversible à l'arrêt. De plus, des cas de constriction du canal artériel ont été rapportés, après le traitement au cours du deuxième trimestre, dont la plupart ont disparu après l'arrêt du traitement. Par conséquent, pendant les premier et deuxième trimestres de grossesse, CETAFEN ne doit être administré que s’il est clairement nécessaire. Si CETAFEN est utilisé par une femme essayant de concevoir, ou pendant les premier et second trimestres de grossesse, la dose doit être maintenue aussi faible et la durée du traitement aussi courte que possible. Une surveillance prénatale de l'oligohydramnios et de la constriction du canal artériel doit être envisagée après une exposition à CETAFEN pendant plusieurs jours à partir de la 20ème semaine de gestation. CETAFEN doit être interrompu en cas d'oligohydramnios ou de constriction du canal artériel.
Au cours du troisième trimestre de grossesse, tous les inhibiteurs de synthèse des prostaglandines peuvent exposer le fœtus aux effets suivants :
· toxicité cardiopulmonaire (constriction / obturation prématurée du canal artériel et hypertension pulmonaire) ;
· dysfonction rénale (voir ci-dessus) ;
la mère et le nouveau-né aux effets suivants à la fin de la grossesse :
· prolongation possible du temps de saignement, un effet antiagrégant pouvant survenir même à de très faibles doses ;
· inhibition des contractions utérines entraînant un travail retardé ou prolongé.
En conséquence, CETAFEN est contre-indiqué pendant le troisième trimestre de grossesse (voir rubriques 4.3 et 5.3).
Pour le paracétamol
Un grand nombre de données chez les femmes enceintes utilisant du paracétamol ne suggère aucune toxicité malformative ni foeto/néonatale. Les études épidémiologiques sur le neurodéveloppement chez les enfants exposés au paracétamol in utero révèlent des résultats peu concluants. En cas de nécessité clinique, le paracétamol peut être utilisé pendant la grossesse ; cependant, il doit être utilisé à la dose minimale efficace pendant la plus courte durée possible et le moins fréquemment possible.
Le paracétamol est excrété dans le lait maternel, mais pas en quantité cliniquement significative, et les données publiées disponibles ne suggèrent pas de contre-indication de l’allaitement tant que la posologie recommandée n’est pas dépassée.
L’ibuprofène et ses métabolites peuvent passer en très faibles quantités dans le lait maternel. Avec des doses thérapeutiques lors d’un traitement de courte durée, le risque d’effet sur le nouveau-né semble peu probable.
À la lueur des données susmentionnées, il n’est pas nécessaire d'interrompre l’allaitement lors d’un traitement à court terme à la dose recommandée de ce produit.
Fertilité
L’utilisation du produit peut altérer la fertilité féminine et n’est pas recommandée chez les femmes essayant de concevoir. Chez les femmes ayant des difficultés à concevoir ou en cours d’investigations sur l’infertilité, le retrait de ce produit doit être envisagé.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les études cliniques sur CETAFEN 10 mg/3 mg par mL, solution pour perfusion et le paracétamol 500 mg/ibuprofène 150 mg comprimés pelliculés n’ont pas démontré d’effets indésirables autres que ceux répertoriés pour le paracétamol seul ou l’ibuprofène seul.
Les effets indésirables sont mentionnés ci-dessous selon les termes préférés MedDRA, par classe de système d'organe et fréquence absolue :
Très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à < 1/1 000) ; très rare (< 1/10 000) ; Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
|
Infections et infestations |
Très rare : Une exacerbation des inflammations liées aux infections (développement de fasciite nécrosante) coïncidant avec l’utilisation d’AINS a été décrite. |
|
Affections hématologiques et du système lymphatique |
Peu fréquent : Diminution de l’hémoglobine et de l’hématocrite. Bien qu’une relation causale n’ait pas été établie, des épisodes hémorragiques (épistaxis, ménorrhagie) ont été rapportés au cours du traitement avec ce médicament. Très rare : Des troubles hématopoïétiques (agranulocytose, anémie, anémie aplasique, anémie hémolytique, leucopénie, neutropénie, pancytopénie et thrombocytopénie avec ou sans purpura) ont été rapportés après l’administration d’ibuprofène. Cependant, ils n’avaient pas nécessairement de relation causale avec le médicament. |
|
Affections du système immunitaire |
Très rare : Des réactions d’hypersensibilité, incluant des éruptions cutanées et une sensibilité croisée avec des sympathomimétiques, ont été rapportées. Peu fréquent : D’autres réactions allergiques ont été rapportées, mais aucune relation causale n’a été établie : Maladie sérique, syndrome de lupus érythémateux, purpura de Henoch-Schönlein, angio-œdème. |
|
Troubles du métabolisme et de la nutrition |
Très rare : Les effets indésirables métaboliques incluaient l’hypokaliémie. Peu fréquent : Gynécomastie, réaction hypoglycémique. Fréquence indéterminée : Acidose métabolique à trou anionique élevé |
|
Affections du système nerveux |
Fréquent : Vertiges, céphalées, nervosité. Peu fréquent : Dépression, insomnie, confusion, instabilité émotionnelle, somnolence, méningite aseptique avec fièvre et coma. Rare : Paresthésie, hallucinations, rêves anormaux. Très rare : Stimulation paradoxale, névrite optique, atteinte psychomotrice, effets extrapyramidaux, tremblements et convulsions. |
|
Affections oculaires |
Peu fréquent : Des amblyopies (vision trouble et/ou altérée, scotomes et/ou altérations de la vision des couleurs) ont été observées, mais elles sont généralement réversibles à l’arrêt du traitement. Tout patient présentant des symptômes oculaires doit effectuer un examen ophtalmologique incluant le champ visuel central. |
|
Affections de l'oreille et du labyrinthe |
Très rare : Vertiges. Fréquent : Acouphènes (pour les médicaments contenant de l’ibuprofène). |
|
Affections cardiaques |
Fréquent : Œdème, rétention d’eau ; la rétention d’eau répond généralement rapidement à l’arrêt du traitement. Très rare : Palpitations ; tachycardie ; arythmies et autres dysrythmies cardiaques ont été rapportées. Des cas d’hypertension et d’insuffisance cardiaque ont été rapportés en association avec le traitement par AINS. |
|
Affections respiratoires, thoraciques et médiastinales |
Peu fréquent : Épaississement des sécrétions du tractus respiratoire. Chez les enfants subissant une amygdalectomie, un stridor a été rapporté. Des hypoxémies ont été rapportées. Très rare : Réactivité respiratoire incluant : asthme, exacerbation de l’asthme, bronchospasme et dyspnée. |
|
Affections gastro-intestinales |
Fréquent : Douleurs abdominales, diarrhées, dyspepsie, nausée, inconfort gastrique et vomissements, flatulences, constipation, légères pertes de sang gastro-intestinal pouvant causer une anémie dans des cas exceptionnels. Peu fréquent : Ulcère gastro-duodénal/gastro-intestinal, perforation ou hémorragie gastro-intestinale, avec des symptômes d’hématémèse et méléna parfois fatales, en particulier chez les personnes âgées. Des stomatites ulcéreuses et une exacerbation des colites et de la maladie de Crohn ont été rapportées après l’administration du produit. Moins fréquemment, des gastrites ont été observées et des pancréatites ont été rapportées. Une maladie acido-peptique a été rapportée. Très rare : Œsophagite, formation d’une sténose intestinale de type diaphragme. |
|
Affections hépatobiliaires |
Très rare : Lésion hépatique, en particulier lors d'un traitement au long cours, insuffisance hépatique. Fonction hépatique anormale, hépatite et jaunisse. Dans la surdose, le paracétamol peut causer une insuffisance hépatique aiguë, une insuffisance hépatique, une nécrose hépatique et des lésions hépatiques. |
|
Affections de la peau et du tissu sous-cutané |
Fréquent : Rash (notamment de type maculopapulaire), prurit. Très rare : Alopécie. Hyperhidrose, purpura et photosensibilité. Dermatites exfoliatives. Réactions bulleuses incluant érythème polymorphe, syndrome de Stevens Johnson et nécrolyse épidermique toxique. De très rares cas de réactions cutanées graves ont été rapportés. Dans des cas exceptionnels, des infections sévères de la peau et des complications des tissus mous peuvent survenir au cours de l'infection par la varicelle. Inconnu : Réaction médicamenteuse avec éosinophilie et symptômes systémiques (syndrome DRESS), pustulose exanthématique aiguë généralisée (PEAG). |
|
Affections du rein et des voies urinaires |
Peu fréquent : Rétention urinaire Rare : Lésion du tissu rénal (nécrose papillaire), en particulier au cours du traitement à long terme. Très rare : Néphrotoxicité sous diverses formes, incluant la néphrite interstitielle, le syndrome néphrotique, et l’insuffisance rénale aiguë et chronique. Les effets indésirables rénaux sont le plus souvent observés après une surdose, après un usage abusif chronique (souvent avec de multiples antalgiques), ou en association avec une hépatotoxicité liée au paracétamol. La nécrose tubulaire aiguë survient généralement en association avec une insuffisance hépatique, mais a été observée isolément dans de rares cas. Une augmentation possible du risque de carcinome à cellules rénales a également été associée à l’usage chronique de paracétamol. Une étude cas-témoin de patients atteints de maladie rénale terminale a suggéré que la consommation à long terme de paracétamol pouvait augmenter significativement le risque de maladie rénale terminale, en particulier chez les patients prenant plus de 1 000 mg par jour. |
|
Troubles généraux et anomalies au site d’administration |
Peu fréquent : Pyrexie Très rare : Fatigue et malaise. |
|
Lésions, intoxications et complications liées aux procédures |
Peu fréquent : Des hémorragies post-opératoires après amygdalectomie ont été rapportées. |
|
Investigations |
Fréquent : Élévation du taux d’alanine aminotransférase, de gamma-glutamyltransférase et anomalies aux tests de la fonction hépatique avec le paracétamol. Élévation de la créatininémie et de l’urée sanguine. Peu fréquent : Élévation du taux d’aspartate aminotransférase, des phosphatases alcalines sanguines, de la créatine phosphokinase sanguine, baisse de l’hémoglobine et élévation du nombre de plaquettes. Rare : élévation des concentrations d’acide urique dans le sang. |
Description des effets indésirables sélectionnés
Les études cliniques suggèrent que l’utilisation de l’ibuprofène, en particulier à forte dose (2 400 mg/jour) peut être associée à un risque légèrement majoré d’événements thrombotiques artériels (infarctus du myocarde ou accident vasculaire cérébral, par exemple) (voir rubrique 4.4).
Acidose métabolique à trou anionique élevé
Des cas d’acidose métabolique à trou anionique élevé due à une acidose pyroglutamique ont été observés chez des patients présentant des facteurs de risque et prenant du paracétamol (voir rubrique 4.4). Une acidose pyroglutamique peut survenir chez ces patients en raison des faibles taux de glutathion.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Symptômes
Paracétamol
Des lésions du foie, voire une insuffisance hépatique, peuvent survenir après une surdose de paracétamol. Les symptômes de surdose de paracétamol au cours des premières 24 heures sont la pâleur, les nausées, les vomissements, l’anorexie et les douleurs abdominales. L’atteinte hépatique peut devenir patente 12 à 48 heures après l’ingestion. Des anomalies du métabolisme du glucose et une acidose métabolique peuvent survenir. Dans l'intoxication sévère, une insuffisance hépatique peut évoluer vers une encéphalopathie, le coma et le décès. Une insuffisance rénale aiguë avec une nécrose tubulaire aiguë peut se développer en l’absence d’atteinte hépatique sévère.
Des arythmies cardiaques ont été rapportées. Une atteinte hépatique est possible chez les adultes ayant pris 10 g ou plus de paracétamol, en raison des quantités excessives d’un métabolite toxique.
Ibuprofène
Les symptômes incluent nausées, douleur abdominale et vomissements, vertiges, convulsion et, dans de rares cas, perte de conscience. Les signes cliniques du surdosage d’ibuprofène pouvant apparaître sont une dépression du système nerveux central et du système respiratoire.
Dans l’intoxication grave, une acidose métabolique peut survenir.
Une utilisation prolongée à des doses supérieures à celles recommandées ou un surdosage peut entraîner une acidose tubulaire rénale et une hypokaliémie.
Traitement
Paracétamol
Un traitement rapide est essentiel dans la prise en charge du surdosage de paracétamol, même en l’absence de symptômes patents, en raison du risque de lésions hépatiques qui se manifestent au bout de quelques heures voire quelques jours. Un traitement médical est recommandé, sans délai, chez tout patient ayant ingéré 7,5 g ou plus de paracétamol au cours des 4 dernières heures. Un lavage gastrique doit être envisagé. Une thérapie spécifique pour faire régresser l’atteinte hépatique, avec un antidote tel que l’acétylcystéine (par voie intraveineuse) ou la méthionine (par voie orale) doit être instaurée dès que possible.
L’efficacité de l’acétylcystéine est optimale lorsqu’elle est administrée au cours des huit premières heures suivant l’ingestion de la surdose ; l’effet diminue progressivement entre 8 et 16 heures. Il a généralement été considéré que l’initiation du traitement plus de 15 heures après le surdosage ne produisait aucun bénéfice et pouvait éventuellement aggraver le risque d’encéphalopathie hépatique. Cependant, il est désormais démontré que l’administration tardive est sûre, et les études menées chez des patients traités jusqu’à 36 heures après l’ingestion suggèrent que des résultats bénéfiques peuvent être obtenus au-delà de 15 heures. En outre, l’administration d’acétylcystéine intraveineuse chez des patients ayant déjà développé une insuffisance hépatique fulminante a démontré réduire la morbidité et la mortalité.
Une dose initiale de 150 mg/kg d’acétylcystéine dans 200 mL de glucose à 5% est administrée par voie intraveineuse pendant 15 minutes, suivie d’une perfusion IV de 50 mg/kg dans 500 mL de glucose à 5% sur 4 heures, puis 100 mg/kg dans 1 litre de glucose à 5% sur 16 heures. Le volume de fluides IV doit être modifié chez les enfants.
La méthionine est administrée par voie orale à 2,5 g toutes les 4 heures jusqu’à 10 g. Le traitement par méthionine doit être instauré dans les 10 heures suivant l’ingestion du paracétamol ; si tel n’est pas le cas, il sera inefficace et pourrait exacerber l’atteinte hépatique.
Les signes de symptômes graves peuvent ne pas être visibles jusqu’à 4 ou 5 jours suivant le surdosage, et les patients doivent faire l’objet d’une surveillance attentive pendant une durée prolongée.
Ibuprofène
Le traitement doit être symptomatique et de soutien, et inclure le maintien de voies aériennes dégagées ainsi que la surveillance des signes vitaux et cardiaques jusqu’à la stabilisation. Le lavage gastrique n’est recommandé que dans un intervalle de 60 minutes suivant l’ingestion d’une dose engageant le pronostic vital. Dans la mesure où le médicament est acide et excrété dans l’urine, il est théoriquement bénéfique d’administrer un alcalin pour induire une diurèse. Outre les mesures de soutien, l’utilisation de charbon activé par voie orale peut contribuer à réduire l’absorption et la réabsorption des comprimés d’ibuprofène.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Autres analgésiques et antipyrétiques, Anilides ; code ATC : N02BE51.
Mécanisme d’action
Bien que le site exact et le mécanisme de l’action analgésique du paracétamol ne soient pas clairement définis, il semble que la substance induise une analgésie par le biais d’une élévation du seuil de la douleur. Le mécanisme potentiel peut impliquer l’inhibition de la voie de l’oxyde nitrique médiée par divers récepteurs des neurotransmetteurs, incluant les récepteurs N-méthyl-D-aspartate et la substance P.
L’ibuprofène est un dérivé de l’acide propionique ayant une activité analgésique, anti-inflammatoire et antipyrétique. Les effets thérapeutiques du médicament en tant qu’AINS résultent de son effet inhibiteur sur l’enzyme cyclo-oxygénase, entraînant une réduction de la synthèse des prostaglandines.
Les données expérimentales suggèrent que l’ibuprofène pourrait inhiber compétitivement l’effet de l’acide acétylsalicylique à faible dose sur l’agrégation plaquettaire lorsqu’ils sont administrés concomitamment. Des études pharmacodynamiques ont démontré que lorsque des doses uniques d’ibuprofène à 400 mg étaient prises dans les 8 h précédant ou dans les 30 min suivant la libération immédiate de la dose d’acide acétylsalicylique (81 mg), l’effet de l’acide acétylsalicylique sur la formation de thromboxane ou l’agrégation plaquettaire était diminué. Malgré des incertitudes concernant l’extrapolation de ces données en situation clinique, la possibilité que l'utilisation régulière au long cours de l’ibuprofène puisse réduire l’effet cardioprotecteur de l’acide acétylsalicylique à faible dose ne peut être exclue. Aucun effet cliniquement pertinent n’est considéré comme probable en cas de prise occasionnelle d’ibuprofène (voir rubrique 4.5).
Études cliniques
Les études cliniques sur CETAFEN 10 mg/3 mg par mL, solution pour perfusion n'ont pas inclus de patients de 65 ans et plus pour déterminer s’ils répondaient différemment des sujets plus jeunes.
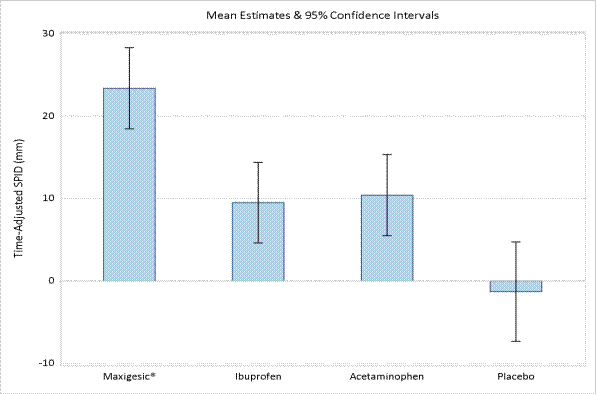
Dans une étude d’efficacité de phase III menée chez 276 patients présentant des douleurs légères à modérées après une bunionectomie, CETAFEN 10 mg/3 mg par mL, solution pour perfusion apportait un soulagement de la douleur supérieur au placebo ou à des doses comparables de paracétamol ou d’ibuprofène seuls.
L’analyse de la somme des différences d’intensité de la douleur en fonction du temps (SPID) de 0-48 heures a démontré que CETAFEN 10 mg/3 mg par mL, solution pour perfusion (moyenne = 23,41, ET = 2,50) produisait un soulagement plus efficace de la douleur que le placebo (moyenne = -1,30, ET = 3,07), le paracétamol (moyenne = 10,42, ET = 2,50) ou l’ibuprofène (moyenne = 9,51, ET = 2,49), avec un haut degré de signification statistique (p < 0,001).
Tableau 1 : Résumé de la SPID (0-48 heures) en fonction du temps par groupe de traitement.
|
CETAFEN 10 mg/3 mg par mL, solution pour perfusion |
Ibuprofène |
Paracétamol |
Placebo |
|
|
N=75 |
N=76 |
N=75 |
N=50 |
|
|
N |
75 |
76 |
75 |
50 |
|
Moyenne (ET) |
23,41 (2,89) |
9,51 (2,53) |
10,42 (2,49) |
-1,30 (2,08) |
|
Médiane |
23,10 |
5,40 |
3,45 |
-4,00 |
|
Min. ; Max. |
-34,08 ; 74,17 |
-30,68 ; 79,98 |
-26,78 ; 65,43 |
-22,42 ; 47,50 |
|
Estimation de la moyenne (ET) |
23,41 (2,50) |
9,51 (2,49) |
10,42 (2,50) |
-1,30 (3,07) |
|
Intervalle de confiance 95 % |
18,48 ; 28,34 |
4,61 ; 14,40 |
5,49 ; 15,35 |
-7,33 ; 4,74 |
|
Estimation de la différence (ET) |
- |
13,90 (3,53) |
12,99 (3,54) |
24,71 (3,96) |
|
Intervalle de confiance 95 % |
- |
6,95 ; 20,85 |
6,02 ; 19,96 |
16,92 ; 32,50 |
|
Valeur de p |
- |
<0,001 |
<0,001 |
<0,001 |
Figure 1 : SPID48 en fonction du temps jusqu’à la première dose du médicament de secours.
Remarque : Acétaminophène = paracétamol.
5.2. Propriétés pharmacocinétiques
CETAFEN 10 mg/3 mg par mL, solution pour perfusion s’administre en perfusion de 15 minutes ; le pic de concentration plasmatique de chaque médicament est atteint à la fin de la perfusion. Les deux substances actives dans CETAFEN 10 mg/3 mg par mL, solution pour perfusion atteignent la concentration plasmatique maximum dans le même délai et ont une demi-vie plasmatique similaire (paracétamol 2,39 ± 0,27 heures, ibuprofène 1,88 ± 0,28 heure).
Les paramètres pharmacocinétiques de CETAFEN 10 mg/3 mg par mL, solution pour perfusion, déterminés par une étude menée chez 29 volontaires sains, sont présentés au Tableau 2.
Tableau 2 : Moyenne (DS) des paramètres pharmacocinétiques du paracétamol et de l’ibuprofène dans chaque groupe de traitement.
|
|
Traitement (Moyenne ± DS) |
|||
|
Paracétamol |
CETAFEN 10 mg/3 mg par mL, solution pour perfusion Perfusion IV, 15 mn |
Paracétamol IV Perfusion IV, 15 mn |
CETAFEN 10 mg/3 mg par mL, solution pour perfusion Demi-dose Perfusion IV, 15 mn |
CETAFEN Comprimés Comprimé oral |
|
Cmax (ng/mL) |
26709,57 ± 5814,74 |
26236,06 ± 5430,52 |
12880,39 ± 2553,15 |
14907,16 ± 6255,10 |
|
AUC0-t (ng.h/mL) |
37553,97 ± 9816,96 |
35846,20 ± 8734,15 |
18327,40 ± 4758,34 |
34980,80 ± 9430,21 |
|
AUC0-∞ (ng.h/mL) |
39419,95 ± 10630,63 |
37651,43 ± 9454,60 |
19337,01 ± 5146,46 |
37023,82 ± 10388,31 |
|
Tmax (h) |
0,25 (fin de la perfusion) |
0,25 (fin de la perfusion) |
0,25 (fin de la perfusion) |
0,73 ± 0,42 |
|
t1/2 (h) |
2,39 ± 0,27 |
2,38 ± 0,25 |
2,44 ± 0,25 |
2,51 ± 0,33 |
|
Ibuprofène |
CETAFEN 10 mg/3 mg par mL, solution pour perfusion Perfusion IV, 15 mn |
Ibuprofène IV Perfusion IV, 15 mn |
CETAFEN 10 mg/3 mg par mL, solution pour perfusion Demi-dose Perfusion IV, 15 mn |
CETAFEN Comprimés Comprimé oral |
|
Cmax (ng/mL) |
39506,69 ± 6874,06 |
40292,97 ± 7460,04 |
20352,05 ± 3090,87 |
19637,38 ± 5178,29 |
|
AUC0-t (ng.h/mL) |
73492,69 ± 16509,61 |
72169,59 ± 15608,70 |
39642,48 ± 9679,16 |
70417,75 ± 16260,16 |
|
AUC0-∞ (ng.h/mL) |
74743,31 ± 17388,69 |
73410,65 ± 16500,76 |
40333,88 ± 10240,30 |
72202,48 ± 17445,46 |
|
Tmax (h) |
0,25 (fin de la perfusion) |
0,25 (fin de la perfusion) |
0,25 (fin de la perfusion) |
1,49 ± 0,89 |
|
t1/2 (h) |
1,88 ± 0,28 |
1,87 ± 0,27 |
1,88 ± 0,30 |
1,99 ± 0,36 |
Remarque : CETAFEN comprimés = CETAFENparacétamol 500 mg/ibuprofène 150 mg comprimés pelliculés.
Les paramètres pharmacocinétiques étaient similaires après une dose unique de CETAFEN 10 mg/3 mg par mL, solution pour perfusion administrée par voie intraveineuse ou par voie orale, à l’exception de la Cmax de la formulation intraveineuse qui était le double de celle de la formulation orale et, comme attendu, la Tmax suivant l’administration intraveineuse était atteinte beaucoup plus rapidement (en 15 minutes) qu’avec la formulation orale.
Distribution
Le paracétamol est distribué dans la majorité des tissus corporels. L’ibuprofène se lie fortement (90-99%) aux protéines plasmatiques.
Biotransformation
Le paracétamol est fortement métabolisé dans le foie et excrété dans l’urine, essentiellement sous forme de glucuronide inactif et de conjugués de sulfate. Moins de 5% sont excrétés sous forme inchangée. Les métabolites du paracétamol incluent un intermédiaire hydroxylé mineur qui a une activité hépatotoxique. Cet intermédiaire actif est détoxifié par conjugaison avec le glutathion ; cependant, il peut s’accumuler après un surdosage de paracétamol et en l’absence de traitement, peut causer des lésions hépatiques sévères et même irréversibles.
L’ibuprofène est fortement métabolisé en composés inactifs dans le foie, essentiellement par glucuronidation.
Dans une étude clinique à dose unique, l’effet de l’ibuprofène sur le métabolisme oxydatif du paracétamol a été évalué chez des volontaires sains à jeun. Les résultats de l’étude indiquaient que l’ibuprofène ne modifiait pas la quantité de paracétamol soumis au métabolisme oxydatif, dans la mesure où la quantité de paracétamol et de ses métabolites (mercapturate-, cystéine-, glucuronide- et sulfate-paracétamol) étaient similaires en administration seuls, sous forme de paracétamol, ou avec l’administration concomitante d’ibuprofène (en combinaison fixe).
Élimination
La demi-vie d’élimination du paracétamol varie d’environ 1 à 3 heures.
Tant les métabolites inactifs qu’une petite quantité d’ibuprofène inchangé sont excrétés rapidement et complètement par les reins, 95% de la dose administrée étant éliminés dans l’urine dans les quatre heures suivant la prise. La demi-vie d’élimination de l’ibuprofène se situe dans l’intervalle de 1,9 à 2,2 heures.
5.3. Données de sécurité préclinique
Dans des études de toxicité à dose unique et à doses répétées menées chez des rats, la co-administration de paracétamol et d’ibuprofène selon un rapport correspondant à celui de CETAFEN 10 mg/3 mg par mL, solution pour perfusion (soit un ratio paracétamol-ibuprofène de 3,3-à-1) et à des niveaux de dose à peu près équivalents à ceux que les patients recevraient lors de l’administration de CETAFEN à la dose maximale recommandée n’augmentait pas le risque de toxicité GI ou rénale.
L’effet de doses uniques intraveineuses ou périveineuses de CETAFEN 10 mg/3 mg par mL, solution pour perfusion dans une étude sur des irritations locales aiguës chez des lapins mâles a démontré que CETAFEN 10 mg/3 mg par mL, solution pour perfusion est peu susceptible de produire une irritation locale lorsqu’il est administré par voie intraveineuse à la dose recommandée. De plus, lors de la réalisation d’une évaluation de compatibilité sanguine in vitro, aucune hémolyse additionnelle, floculation/précipitation de protéines plasmatiques ou agrégation plaquettaire n’ont été observées avec CETAFEN 10 mg/3 mg par mL, solution pour perfusion comparé au paracétamol IV ou à l’ibuprofène IV seuls.
Ibuprofène
La toxicité subchronique et chronique de l’ibuprofène dans les expériences animales a été observée principalement sous forme de lésions et d’ulcérations dans le tractus gastro-intestinal. Les études in vitro et in vivo n’ont produit aucune preuve cliniquement pertinente de potentiel mutagène de l’ibuprofène. Dans les études menées chez des rats et des souris, aucun signe d’effet carcinogène de l’ibuprofène n’a été retrouvé. L’ibuprofène a causé l’inhibition de l’ovulation chez les lapins ainsi qu’une altération de l’implantation dans diverses espèces animales (lapin, rat, souris). Les études expérimentales ont démontré que l’ibuprofène traverse le placenta. Concernant les doses maternellement toxiques, une incidence accrue de malformations (malformations du septum ventriculaire) a été observée.
Paracétamol
Le paracétamol à des doses hépatotoxiques a démontré un potentiel génotoxique et carcinogène (tumeurs du foie et de la vessie) chez les souris et les rats. Cependant, il est considéré que cette activité génotoxique et cancérogène est associée à des changements dans le métabolisme du paracétamol à fortes doses/concentrations et que cela ne constitue pas un risque en utilisation clinique.
Il n’existe aucune étude conventionnelle disponible utilisant les normes actuellement acceptées pour l’évaluation de la toxicité sur la reproduction et le développement.
Chlorhydrate de cystéine monohydraté
Phosphate disodique dihydraté
Mannitol
Acide chlorhydrique (pour l'ajustement du pH)
Hydroxyde de sodium (pour l’ajustement du pH)
Eau pour préparations injectables
2 ans.
6.4. Précautions particulières de conservation
6.5. Nature et contenu de l'emballage extérieur
CETAFEN 10 mg/3 mg par mL, solution pour perfusion se présente dans un flacon en verre transparent de type II de 100 mL, fermé par un bouchon en caoutchouc bromobutyl gris et une capsule en aluminium, en conditionnement de 10 flacons.
6.6. Précautions particulières d’élimination et de manipulation
Inspecter visuellement CETAFEN 10 mg/3 mg par mL, solution pour perfusion pour rechercher la présence éventuelle de particules et d’une décoloration avant l’administration, si la solution et le conditionnement le permettent. En présence de particules opaques, d’une décoloration ou d’autres corps étrangers, la solution ne doit pas être utilisée.
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec des diluants. Si moins d’un flacon complet est requis pour une dose unique, le volume adéquat doit être perfusé et le reliquat de solution éliminé (voir également rubrique 4.2).
CETAFEN 10 mg/3 mg par mL, solution pour perfusion doit être utilisé chez un seul patient et une seule fois. Le produit ne contient aucun conservateur antimicrobien. Tout reliquat de solution doit être jeté.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Oberburgau 3
4866 Unterach am Attersee
AuTRICHE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 550 856 2 1 : 100 mL en flacon (verre). Boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I
Médicament réservé à l’usage hospitalier.
ANSM - Mis à jour le : 05/03/2025
CETAFEN 10 mg/3 mg par mL, solution pour perfusion
paracétamol/ibuprofène
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous ne devez pas prendre ce médicament plus de 2 jours.
1. Qu'est-ce que CETAFEN 10 mg/3 mg par mL, solution pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser CETAFEN 10 mg/3 mg par mL, solution pour perfusion ?
3. Comment utiliser CETAFEN 10 mg/3 mg par mL, solution pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CETAFEN 10 mg/3 mg par mL, solution pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CETAFEN 10 mg/3 mg par mL, solution pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Autres analgésiques et antipyrétiques, Anilides ; code ATC : N02BE51.
CETAFEN 10 mg/3 mg par mL, solution pour perfusion contient les substances actives paracétamol et ibuprofène. L’ibuprofène appartient à un groupe de médicaments appelés anti-inflammatoires non stéroïdiens (ou AINS). Le paracétamol a un mode d’action différent de l’ibuprofène, mais les deux substances agissent simultanément pour réduire la douleur.
CETAFEN 10 mg/3 mg par mL, solution pour perfusion est utilisé chez l’adulte pour le traitement symptomatique de courte durée de la douleur aiguë d’intensité modérée, lorsque la voie d’administration intraveineuse est nécessaire et/ou lorsque les autres voies d’administration ne sont pas possibles.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’utiliser CETAFEN 10 mg/3 mg par mL, solution pour perfusion ?
N’utilisez jamais CETAFEN 10 mg/3 mg par mL, solution pour perfusion :
· si vous êtes allergique aux substances actives, à d’autres AINS, ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous souffrez d’une insuffisance cardiaque sévère, d’une insuffisance hépatique ou d’une insuffisance rénale ;
· si vous buvez régulièrement de grandes quantités d'alcool ;
· si vous souffrez d’asthme, d’urticaire ou de réactions de type allergique après avoir pris de l’acide acétylsalicylique ou d’autres AINS ;
· si vous avez des antécédents d’hémorragie ou de perforation gastro-intestinale associés à un précédent traitement par AINS ;
· si vous souffrez d’un ulcère gastro-duodénal actif ou récidivant (ulcère de l’estomac ou duodénal), ou de saignements (deux épisodes distincts ou plus d’ulcération ou d’hémorragie confirmée) ;
· si vous présentez des saignements dans le cerveau (hémorragies cérébrovasculaires) ou tout autre saignement actif ;
· si vous souffrez d’un trouble de la coagulation sanguine ou d’une tendance majorée aux saignements ;
· si vous souffrez d’une déshydratation sévère (causée par des vomissements, une diarrhée ou un apport insuffisant en liquide) ;
· pendant les trois derniers mois de la grossesse ;
· si vous avez moins de 18 ans.
Avertissements et précautions
Afin d’éviter le risque de surdosage,
· assurez-vous que les autres médicaments ne contiennent pas de paracétamol,
· ne dépassez pas les doses maximales recommandées (voir rubrique 3).
Les effets secondaires peuvent être minimisés en utilisant la dose minimale efficace pendant la plus courte durée nécessaire pour contrôler les symptômes. Ne prenez pas CETAFEN 10 mg/3 mg par mL, solution pour perfusion pendant plus de 2 jours.
Pendant le traitement par CETAFEN, informez immédiatement votre médecin si vous avez des maladies graves, y compris une insuffisance rénale grave ou un sepsis (lorsque des bactéries et leurs toxines circulent dans le sang, entraînant des lésions au niveau des organes), ou si vous êtes atteint de malnutrition, d’alcoolisme chronique ou si vous prenez également de la flucloxacilline (un antibiotique). Une affection grave appelée acidose métabolique (une anomalie du sang et des fluides) a été signalée chez les patients qui prennent régulièrement du paracétamol pendant une période prolongée ou qui prennent du paracétamol en association avec de la flucloxacilline. Les symptômes de l’acidose métabolique peuvent inclure: de graves difficultés respiratoires avec une respiration rapide et profonde, une somnolence, une envie de vomir (nausée) et des vomissements.
Adressez-vous à votre médecin ou votre infirmier/ère avant de prendre CETAFEN 10 mg/3 mg par mL, solution pour perfusion si :
· vous prenez d’autres médicaments contenant du paracétamol, de l’ibuprofène, ou tout autre antalgique anti-inflammatoire (AINS) (afin d’éviter tout risque de surdose) ;
· vous souffrez de problèmes cardiaques incluant l’insuffisance cardiaque, l’angor (douleur à la poitrine), ou si vous avez subi une crise cardiaque, un pontage, une maladie artérielle périphérique (mauvaise circulation dans les jambes ou les pieds due à un rétrécissement ou à une obstruction des artères), ou tout type d’attaque (y compris « mini-AVC » ou accident ischémique transitoire (AIT) ;
· vous présentez une hypertension artérielle, un diabète, un taux élevé de cholestérol, avez un antécédent familial de maladie cardiaque ou d’attaque, ou si vous fumez ;
· vous souffrez d’une maladie du foie, d’une hépatite, d’une maladie rénale ou de problèmes de miction ;
· vous souffrez actuellement d’une infection ; CETAFEN peut masquer les symptômes ou les signes d’une infection (fièvre, douleur et gonflement) ;
· vous avez ou avez précédemment eu des brûlures d’estomac, une indigestion, un ulcère de l’estomac ou tout autre problème gastrique ;
· vous avez récemment subi ou prévoyez de subir une intervention chirurgicale ;
· vous avez une infection (voir la rubrique « Infections » ci-dessous).
· vous avez de l’asthme ;
· vous souffrez de déshydratation ou de diarrhée ;
· vous souffrez de problèmes intestinaux tels qu’une rectocolite hémorragique ou une maladie de Crohn ; *
· vous avez une maladie génétique héréditaire ou acquise affectant certains enzymes, qui se manifeste soit par des complications neurologiques soit par des problèmes cutanés, ou parfois les deux, appelée une porphyrie ;
· vous souffrez d’une maladie auto-immune, comme un lupus érythémateux ou d’autres affections du tissu conjonctif, car il pourrait y avoir un risque accru de méningite aseptique (inflammation de la membrane protectrice entourant le cerveau) ;
· vous avez le rhume des foins, des polypes nasaux ou une maladie respiratoire obstructive chronique, car il pourrait y avoir un risque accru de réactions allergiques ;
· vous êtes enceinte ou vous planifiez une grossesse (voir rubrique Grossesse, allaitement et fertilité).
Risque cardiovasculaire
Les anti-inflammatoires/antalgiques comme l’ibuprofène peuvent être associés à un risque légèrement accru de crise cardiaque ou d’accident vasculaire cérébral, en particulier lorsqu’ils sont utilisés à fortes doses. Ne pas dépasser la dose recommandée ou la durée du traitement.
Symptômes gastro-intestinaux
Des effets secondaires gastro-intestinaux graves (affectant l’estomac et les intestins) ont été rapportés avec l'utilisation d’AINS, incluant l’ibuprofène. Ils peuvent survenir avec ou sans symptômes précurseurs.
Le risque de survenue de ces effets secondaires est plus élevé chez les patients ayant un antécédent d’ulcère de l’estomac ou de l’intestin, en particulier si des saignements ou une perforation ont également été impliqués. Les patients âgés sont à plus haut risque d’effets secondaires gastro-intestinaux. Vous devez discuter de tout antécédent de problèmes gastro-intestinaux avec votre médecin et rester vigilant à tous symptômes abdominaux inhabituels, incluant nausées, vomissements, diarrhées, constipation, indigestion, douleur abdominale, selles goudronneuses, ou vomissements de sang.
Les patients âgés doivent discuter préalablement du traitement avec un médecin. Les patients âgés sont à plus haut risque d’effets secondaires, en particulier de saignements et de perforation du tube digestif.
Réactions cutanées
Des réactions cutanées graves ont été rapportées en association avec le traitement par ibuprofène. Vous devez immédiatement informer votre médecin ou votre infirmier/ère si vous développez des éruptions cutanées, des lésions des muqueuses, des vésicules ou d’autres signes d’allergie, car ils pourraient constituer les premiers signes d’une réaction cutanée très grave. Voir rubrique 4.
Infections
CETAFEN peut masquer des signes d’infection comme la fièvre et les douleurs. Il est donc possible que CETAFEN puisse retarder le traitement approprié d’une infection, ce qui pourrait entraîner un risque majoré de complications. Cela a été observé dans les pneumonies causées par des bactéries et dans les infections bactériennes de la peau associées à la varicelle. Si vous recevez ce médicament alors que vous présentez une infection et que vos symptômes de l’infection persistent ou s’aggravent, consultez un médecin sans délai.
Utilisation prolongée d’antalgiques
Si vous utilisez des antalgiques sur une période prolongée, cela peut générer des maux de tête qui ne doivent pas être traités avec des antalgiques supplémentaires. Si vous pensez être concerné, parlez-en à votre médecin ou votre pharmacien.
Problèmes visuels
Si vous remarquez des problèmes de vision après avoir utilisé CETAFEN, arrêtez de prendre ce médicament et consultez un médecin.
Enfants et adolescents
CETAFEN 10 mg/3 mg par mL, solution pour perfusion ne doit pas être pris par les enfants et les adolescents de moins de 18 ans.
Autres médicaments et CETAFEN 10 mg/3 mg par mL, solution pour perfusion
Informez votre médecin ou infirmier/ère si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Informez toujours votre médecin si vous prenez d’autres médicaments contenant du paracétamol, de l’ibuprofène ou d’autres AINS, y compris ceux que vous pouvez acheter sans ordonnance. Cela permet d’éviter le risque de surdosage.
CETAFEN peut affecter ou être affecté par certains autres médicaments. Par exemple :
· acide acétylsalicylique, salicylates ou autres AINS (incluant les inhibiteurs de la COX-2 comme le célécoxib ou l’étoricoxib) ;
· médicaments pour traiter les maladies cardiaques (digoxine ou bêta-bloquants) ;
· corticoïdes, comme la prednisone, la cortisone ;
· médicaments anti-coagulants (fluidifiant le sang/empêchant la formation de caillot, comme l’acide acétylsalicylique, la warfarine, la ticlopidine) ;
· médicaments qui abaissent la tension artérielle élevée (inhibiteurs de l’enzyme de conversion comme le captopril, bêta-bloquants comme l’aténolol, antagonistes des récepteurs de l’angiotensine II comme le losartan) ;
· médicaments pour traiter l’épilepsie ou les attaques (phénytoïne, phénobarbital, carbamazépine) ;
· médicaments utilisés pour traiter la manie (lithium) ;
· médicaments utilisés pour traiter la dépression comme les ISRS (inhibiteurs sélectifs de recapture de la sérotonine);
· probénécide, un médicament utilisé pour traiter la goutte ;
· diurétiques, médicaments utilisés pour augmenter le débit urinaire ;
· méthotrexate, un médicament utilisé pour traiter l’arthrite et certains types de cancer ;
· tacrolimus ou ciclosporine, médicaments immunosuppresseurs utilisés après une greffe d’organe ;
· zidovudine, un médicament utilisé pour traiter l’infection à VIH (le virus responsable du SIDA) ;
· sulfonylurée, un médicament utilisé pour traiter le diabète ;
· un type d’antibiotique appelé quinolone (comme la ciprofloxacine) ;
· un type d’antibiotique appelé aminoglycoside (comme la gentamicine ou la streptomycine) ;
· chloramphénicol, un antibiotique utilisé pour traiter les infections des yeux et des oreilles ;
· médicaments antifongiques comme le voriconazole ou le fluconazole ;
· médicaments utilisés pour traiter la tuberculose comme l’isoniazide et la rifampicine ;
· mifépristone, un médicament utilisé pour l’interruption médicale de grossesse ;
· certains remèdes phytothérapeutiques comme le ginkgo biloba (parfois utilisé pour traiter la démence) ou le millepertuis (Hypericum, parfois utilisé pour traiter la dépression légère) ;
· la flucloxacilline (antibiotique), en raison d'un risque grave d'anomalie sanguine et plasmatique (appelée acidose métabolique) qui doit faire l'objet d'un traitement d’urgence (voir rubrique 2).
Certains autres médicaments peuvent également affecter ou être affectés par le traitement par CETAFEN. Vous devez donc toujours consulter votre médecin, une infirmière ou un pharmacien avant de prendre tout autre médicament.
Si vous avez besoin d’effectuer un prélèvement de sang ou d’urine pour des analyses, vous devez informer votre médecin que vous prenez ce médicament car il peut interférer avec les résultats des analyses.
CETAFEN 10 mg/3 mg par mL, solution pour perfusion et de l’alcool
Ne consommez pas de boissons alcoolisées pendant votre traitement avec ce médicament. L’association de l’alcool et de CETAFEN peut causer des lésions du foie.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou à votre infirmier/ère avant de prendre ce médicament.
Grossesse
Ne prenez pas CETAFEN pendant les 3 derniers mois de grossesse car cela pourrait nuire à votre enfant à naître ou causer des problèmes à l’accouchement. Ce médicament peut causer des problèmes rénaux et cardiaques chez votre bébé. Il peut affecter votre tendance à saigner et celle de votre bébé et entraîner un travail plus tardif ou plus long que prévu.
Vous ne devez pas prendre CETAFEN pendant les 6 premiers mois de grossesse sauf en cas d’absolue nécessité et selon les prescriptions de votre médecin. Si vous avez besoin d'un traitement pendant cette période ou pendant que vous essayez de tomber enceinte, la dose la plus faible pendant la durée la plus courte possible doit être utilisée. S'il est pris pendant plus de quelques jours à partir de la 20ème semaine de grossesse, CETAFEN peut causer des problèmes rénaux chez votre bébé à naître qui peuvent diminuer le niveau de liquide amniotique qui entoure le bébé (oligohydramnios) ou le rétrécissement d'un vaisseau sanguin (canal artériel) dans le cœur du bébé. Si vous avez besoin d'un traitement de plus de quelques jours, votre médecin peut recommander une surveillance supplémentaire.
Allaitement
Seules de faibles quantités de paracétamol et d’ibuprofène passent dans le lait maternel. Ce médicament peut être administré pendant l’allaitement s’il est utilisé à la dose recommandée et pendant la plus courte durée possible.
Fertilité
Ce produit peut altérer la fertilité féminine et n’est pas recommandé chez les femmes essayant de concevoir. Cet effet est réversible à l’arrêt du médicament.
Conduite de véhicules et utilisation de machines
Des effets indésirables comme des vertiges, une somnolence, une fatigue et des troubles visuels sont possibles après la prise d’AINS. Si vous présentez ces effets, vous ne devez pas conduire de véhicule ni utiliser de machine.
CETAFEN 10 mg/3 mg par mL, solution pour perfusion contient du sodium
CETAFEN 10 mg/3 mg par mL, solution pour perfusion contient 35 mg de sodium (composant principal du sel de cuisine/table) pour 100 mL. Cela équivaut à 1,75% de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
3. COMMENT utiliser CETAFEN 10 mg/3 mg par mL, solution pour perfusion ?
CETAFEN 10 mg/3 mg par mL, solution pour perfusion vous sera administré par un professionnel de santé, par perfusion dans une veine. La perfusion devra être administrée sur 15 minutes.
Ce médicament est réservé à un traitement de courte durée, soit un maximum de 2 jours.
La dose recommandée est de :
Pour les adultes pesant plus de 50 kg : 1 flacon toutes les 6 heures, comme indiqué.
La dose quotidienne maximale est de quatre flacons, équivalant à 4 000 mg (4 g) de paracétamol et 1 200 mg d’ibuprofène.
Si vous pesez 50 kg ou moins, si vous êtes une personne âgée ou si vous avez des problèmes de foie ou de rein : Votre médecin pourra décider de réduire votre dose ou d’augmenter l’intervalle entre les doses en raison du risque accru d’effets secondaires.
Une dose plus forte que la dose recommandée ne renforce pas le soulagement de la douleur, mais peut exposer à des risques sérieux (voir également la rubrique « Si vous avez pris plus de CETAFEN que vous n’auriez dû »). La dose minimale efficace doit être administrée pendant la plus courte durée nécessaire pour soulager les symptômes. Si vous souffrez d’une infection, consultez immédiatement un médecin si les symptômes (comme la fièvre et la douleur) persistent ou s’aggravent (voir rubrique 2).
Si vous avez pris plus de CETAFEN 10 mg/3 mg par mL, solution pour perfusion que vous n’auriez dû
Contactez immédiatement un médecin ou un(e) infirmier/ère si vous pensez que vous avez pu accidentellement recevoir une trop grande quantité de ce médicament. Faites-le même si vous vous sentez bien. Cela est dû au fait qu’une trop grande quantité de paracétamol peut causer des lésions hépatiques graves à retardement, qui peuvent être fatales. Même en l’absence de signe de gêne ou d’intoxication, vous pourriez avoir besoin de soins médicaux d’urgence.
Afin d’éviter les lésions du foie, il est essentiel de recevoir un traitement médical dès que possible. Plus l’intervalle entre la prise et l'instauration du traitement avec un antidote est court (aussi peu d’heures que possible), plus la probabilité de pouvoir prévenir les lésions hépatiques est grande.
Les autres symptômes de surdosage peuvent inclure des nausées, des maux d’estomac, des vomissements (pouvant être striés de sang), des maux de tête, des acouphènes, une confusion et des mouvements oculaires désordonnés. À fortes doses, une somnolence, une douleur thoracique, des palpitations, une perte de conscience, des convulsions (principalement chez les enfants), une faiblesse et des vertiges, du sang dans les urines, de faibles taux de potassium dans le sang, une sensation de froid et des problèmes respiratoires ont été rapportés.
Si vous oubliez de prendre CETAFEN 10 mg/3 mg par mL, solution pour perfusion
Si vous arrêtez de prendre CETAFEN 10 mg/3 mg par mL, solution pour perfusion
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Arrêtez de prendre CETAFEN 10 mg/3 mg par mL, solution pour perfusion, informez immédiatement votre médecin et allez au service des urgences de l'hôpital le plus proche si vous présentez l’un des effets secondaires suivants :
Peu fréquent :
· vomissements de sang ou de substances ressemblant à du marc de café ;
· saignement de l’anus, selles noires et collantes, ou diarrhées sanglantes;
· gonflement du visage, des lèvres ou de la langue pouvant causer des difficultés à avaler ou à respirer.
Très rare :
· asthme, respiration sifflante, essoufflement ;
· démangeaisons soudaines ou sévères, éruptions cutanées, urticaire ;
· éruptions cutanées sévères avec vésicules et saignement au niveau des lèvres, des yeux, de la bouche, du nez et des organes génitaux (syndrome de Steven Johnson). De très rares cas de réactions cutanées graves ont été rapportés ;
· aggravation d’infections cutanées sévères existantes (vous pourriez remarquer une éruption cutanée, la formation de cloques et une décoloration de la peau, de la fièvre, une somnolence, des diarrhées et des nausées) ou aggravation d’autres infections incluant la varicelle ou le zona ou infections graves avec destruction (nécrose) du tissu sous-cutané et des muscles, vésication et desquamation de la peau ;
· fièvre, sensation générale de malaise, nausée, maux d’estomac, maux de tête et raideur du cou (symptômes de méningite aseptique, inflammation de la membrane protectrice entourant le cerveau).
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· une réaction cutanée sévère, appelée syndrome DRESS, peut survenir. Les symptômes de DRESS incluent : éruptions cutanées, fièvre, gonflement des ganglions lymphatiques et augmentation du nombre d’éosinophiles (type de globules blancs).
· une éruption cutanée rouge, squameuse et étendue avec des boules sous la peau et des vésicules essentiellement localisés sur les plis de la peau, le tronc et les membres supérieurs, accompagnés de fièvre à l’initiation du traitement (pustulose exanthémateuse généralisée aiguë). Voir également la rubrique 2.
D’autres effets indésirables peuvent survenir :
Fréquent (se produisant chez 1 à 10 personnes) :
· nausées ou vomissements ;
· perte d’appétit ;
· brûlures d’estomac ou des douleurs dans la partie supérieure de l’estomac ;
· crampes d’estomac, flatulences, constipation ou diarrhée, légère perte de sang gastro-intestinale ;
· éruptions cutanées, démangeaisons de la peau ;
· maux de tête ;
· vertiges ;
· sensation de nervosité ;
· tintements ou bourdonnements d’oreilles ;
· prise de poids inhabituelle, gonflement et rétention d’eau, gonflement des chevilles ou des jambes (œdème).
Peu fréquent (se produisant chez 1 à 100 personnes) :
· diminution du nombre de globules rouges, saignement de nez et règles plus abondantes (saignement menstruel) ;
· réactions allergiques – éruptions cutanées, fatigue, douleurs articulaires (maladie sérique, syndrome de lupus érythémateux, purpura de Henoch-Schönlein, angio-œdème) ;
· développement du tissu mammaire chez les hommes ; faible taux de sucre dans le sang ;
· insomnies ;
· altérations de l’humeur, par exemple dépression, confusion, nervosité ;
· problèmes ophtalmiques tels que vision trouble (réversible), yeux rouges et douloureux, démangeaisons ;
· épaississement des mucosités ;
· douleur sévère ou sensibilité dans l’estomac ; ulcère gastro-duodénal/gastro-intestinal ;
· inflammation de l’intestin et aggravation de l’inflammation du côlon (colite) et du tube digestif (maladie de Crohn), et complications des diverticulites dans le gros intestin (perforation ou fistule) ;
· incapacité à vidanger complètement la vessie (rétention urinaire) ;
· résultats de tests biologiques anormaux (résultat des analyses de sang, des tests des enzymes hépatiques et rénaux).
Rare (se produisant chez 1 à 1 000 personnes) :
· fourmillements au niveau des mains et des pieds ;
· rêves anormaux, visions (hallucinations) ;
· lésions du tissu rénal (en particulier avec le traitement prolongé) ;
· taux élevé d’acide urique dans le sang (hyperuricémie).
Très rare (se produisant chez 1 à 10 000 personnes) :
· faible taux de potassium – faiblesse, fatigue, crampes musculaires (hypokaliémie) ;
· signes d’anémie, tels que fatigue, maux de tête, essoufflement et pâleur ;
· saignements ou formation de bleus plus facilement que la normale, tâches rouges ou violacées sous la peau ;
· maux de tête sévères ou persistants ;
· impression de tournis (vertiges) ;
· battements de cœur rapides ou irréguliers, également appelés palpitations ;
· élévation de la pression artérielle et problèmes cardiaques potentiels ;
· inflammation de l'œsophage ;
· jaunissement de la peau et/ou des yeux, également appelé jaunisse ;
· atteinte du foie (en particulier en cas de traitement prolongé) ;
· perte de cheveux ;
· sudation accrue ;
· signes d’infections fréquentes ou inquiétantes tels que fièvre, frissons sévères, maux de gorge ou ulcères de la bouche ;
· néphrotoxicité sous diverses formes, incluant néphropathie interstitielle, syndrome néphrotique, et insuffisance rénale aiguë et chronique.
Fréquence indéterminée (ne peut être estimée à partir des données disponibles) :
· Une affection grave qui peut rendre le sang plus acide (appelée acidose métabolique), chez les patients atteints d’une maladie grave et utilisant du paracétamol (voir rubrique 2)
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CETAFEN 10 mg/3 mg par mL, solution pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants et des adolescents.
A conserver à une température ne dépassant pas 25 °C. Ne pas mettre au réfrigérateur. Ne pas congeler. À conserver dans l’emballage d’origine à l’abri de la lumière.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et sur le flacon après EXP. La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas ce médicament si vous remarquez que l’emballage est déchiré ou présente des signes d’altération. N’utilisez pas ce médicament si vous remarquez la présence de particules visibles ou une décoloration.
Ce produit est à usage unique. Le produit doit être utilisé immédiatement après ouverture. Tout reliquat de solution doit être jeté.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient CETAFEN 10 mg/3 mg par mL, solution pour perfusion
· Les substances actives sont : 10 mg/mL de paracétamol et 3 mg/mL d’ibuprofène.
· Les autres composants sont :
Chlorhydrate de cystéine monohydraté, phosphate disodique dihydraté, mannitol, acide chlorhydrique (pour l'ajustement du pH), hydroxyde de sodium (pour l’ajustement du pH), eau pour préparations injectables.
Qu’est-ce que CETAFEN 10 mg/3 mg par mL, solution pour perfusion et contenu de l’emballage extérieur
CETAFEN 10 mg/3 mg par mL, solution pour perfusion est une solution pour perfusion limpide et incolore, dépourvue de particules visibles. Elle se présente dans un flacon en verre transparent de 100 mL, fermé par un bouchon en caoutchouc bromobutyl gris et une capsule en aluminium. Le produit est délivré en conditionnement de 10 flacons.
Titulaire de l’autorisation de mise sur le marché
Oberburgau 3
4866 Unterach am Attersee
AuTRICHE
Exploitant de l’autorisation de mise sur le marché
84 QUAI JOSEPH GILLET
69004 LYON
Zona Industriale
85050 Tito (PZ)
Italie
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants :
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont réservées aux professionnels de santé :
Paracétamol/Ibuprofène Flacon 10 mg/mL + 3 mg/mL, solution pour perfusion
Inspecter visuellement CETAFEN 10 mg/3 mg par mL, solution pour perfusion pour rechercher la présence éventuelle de particules et d’une décoloration avant l’administration, si la solution et le conditionnement le permettent. En présence de particules opaques, d’une décoloration ou d’autres corps étrangers, la solution ne doit pas être utilisée.
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec des diluants. Si moins d'un flacon complet est requis pour une seule dose, le volume adéquat doit être perfusé et le reliquat de solution éliminé.
CETAFEN 10 mg/3 mg par mL, solution pour perfusion doit être utilisé chez un seul patient et une seule fois. Le produit ne contient aucun conservateur antimicrobien. Tout reliquat de solution doit être jeté.
Mode d’administration
CETAFEN 10 mg/3 mg par mL, solution pour perfusion doit être administré en perfusion intraveineuse de 15 minutes.
Pour prélever la solution, utiliser une aiguille de 0,8 mm (aiguille 21 G) et perforer verticalement le bouchon au point indiqué.
Chez les patients pesant moins de 50 kg chez lesquels un flacon complet (100 mL) n’est pas nécessaire, le volume adéquat doit être perfusé et le reliquat de solution éliminé.
Comme avec toutes les solutions pour perfusion délivrées en flacon de verre, il convient de rappeler qu’une étroite surveillance est requise, en particulier en fin de perfusion, indépendamment de la voie d’administration. Cette surveillance en fin de perfusion s’applique particulièrement pour la perfusion par voie centrale, afin d’éviter une embolie gazeuse.