Dernière mise à jour le 02/02/2026
FOSCAVIR 6 g/250 ml, solution pour perfusion
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : J05AD01
Qu’est-ce que FOSCAVIR ?
FOSCAVIR 6 g/250 ml, solution pour perfusion appartient à la famille des antiviraux. Il agit sur certains virus (tous les virus du groupe de l’herpès et certains rétrovirus comme le cytomégalovirus (CMV)). Il empêche la reproduction des virus dans les cellules infectées.
Dans quels cas est-il utilisé ?
Ce médicament est utilisé lorsque vos défenses immunitaires sont diminuées :
· Pour traiter des infections par le CMV si vous êtes atteints du SIDA.
· Pour traiter une infection par l’herpès (de la lèvre, du nez, des yeux, des parties génitales).
· Foscavir est administré aux personnes souffrant d’une infection virale à CMV suite à une greffe de moelle osseuse. Cette dernière est également appelée greffe de cellules souches hématopoïétiques (CSH). L’infection peut parfois être détectée avant que le patient ne commence à en ressentir les signes. On appelle cela une virémie à CMV.
Présentations
> 1 flacon(s) en verre de 250 ml
Code CIP : 346 445-0 ou 34009 346 445 0 4
Déclaration de commercialisation : 27/11/2000
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 20/11/2019 | Réévaluation SMR et ASMR | Le service médical rendu par FOSCAVIR est important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| II (Important) | Avis du 20/11/2019 | Réévaluation SMR et ASMR | Compte tenu : • de l’efficacité importante du foscarnet avec une barrière génétique de résistance élevée et de son activité en cas de résistance au ganciclovir ou au valganciclovir, • du profil de tolérance connu et similaire du foscarnet dans les indications initialement autorisées, • de son usage déjà établi lorsque l’administration de ganciclovir est impossible, en cas de résistance ou d’intolérance (notamment du fait de son hématotoxicité), • de l’absence d’alternative au foscarnet ayant une AMM et bien tolérée dans le traitement de la virémie à CMV, FOSCAVIR (foscarnet) apporte une amélioration du service médical rendu importante (ASMR II) dans le traitement de la virémie à CMV chez les receveurs d’une GCSH et pour lesquels le recours au ganciclovir ne peut être envisagé. En l’absence de nouvelle donnée susceptible de modifier le dernier avis de la Commission de la transparence, FOSCAVIR (foscarnet) conserve une amélioration du service médical rendu importante (ASMR II) dans le traitement des infections disséminées à CMV au cours du SIDA, et plus particulièrement rétiniennes, digestives (colites, oesophagites), pulmonaires et encéphaliques et dans le traitement d'attaque des infections mucocutanées à Herpès simplex virus (HSV) résistants ou insensibles à l'aciclovir chez les patients immunodéprimés. |
Autres informations
- Titulaire de l'autorisation : CLINIGEN HEALTHCARE B.V.
- Conditions de prescription et de délivrance :
- liste I
- réservé à l'usage HOSPITALIER
- Statut de l'autorisation : Valide
- Type de procédure : Procédure nationale
- Code CIS : 6 268 682 3
ANSM - Mis à jour le : 07/03/2025
FOSCAVIR 6 g/250 ml, solution pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Foscarnet sodique hexahydraté................................................................................................... 6 g
Pour 250 ml de solution.
Excipient à effet notoire :
Ce médicament contient 1,38 g de sodium par flacon de 250 ml.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide et incolore.
4.1. Indications thérapeutiques
· Traitement des infections disséminées à CMV au cours du SIDA, et plus particulièrement rétiniennes, digestives (colites, oesophagites), pulmonaires et encéphaliques.
· Traitement d'attaque des infections mucocutanées à Herpès simplex virus (HSV) résistants ou insensibles à l'aciclovir chez les patients immunodéprimés.
4.2. Posologie et mode d'administration
Il est impératif d'adapter les posologies suivantes à l'état de la fonction rénale (voir tableau posologique).
Il est impératif d'associer au traitement une hydratation par perfusion (voir hydratation).
Adultes :
Les posologies ci-après sont exprimées pour un patient à fonction rénale normale.
· Virémie à CMV chez les receveurs d’une greffe de CSH
En traitement d’attaque, le Foscavir sera administré à la dose de 120 mg/kg/j en 2 perfusions espacées de 12 heures pendant au moins 2 semaines. Chaque perfusion durera au moins une heure et devra être associée à une hydratation (voir Hydratation).
En traitement d’entretien, suite au traitement d’attaque de la virémie à CMV, Foscavir sera administré en perfusion journalière pendant environ deux heures à la posologie de 90 à 120 mg/kg, 7 jours par semaine, associé à l'hydratation.
Ces posologies sont à moduler suivant l'état de la fonction rénale (voir Tableau posologique).
Les patients dont l’infection progresse au cours du traitement d'entretien peuvent être soumis à nouveau au traitement d'attaque.
· Atteintes à CMV chez les patients atteints du SIDA
En traitement d’attaque, le foscarnet sera administré à la dose de 180 mg/kg/j en 2 ou 3 perfusions espacées de 12 ou 8 heures d’une heure minimum chacune (60 à 90 min) associée impérativement à une hydratation (voir Hydratation).
En cas de rétinite à CMV, un traitement d’entretien est institué après cicatrisation ou après 2 à 3 semaines de traitement d’attaque.
Le foscarnet est administré en une perfusion journalière d'environ deux heures, à la posologie de 90 à 120 mg/kg, 7 jours par semaine associé à l'hydratation.
Ces posologies sont à moduler suivant l'état de la fonction rénale (voir Tableau posologique).
Si la rétinite progresse au cours du traitement d'entretien, le patient doit être soumis à nouveau au traitement d'attaque.
Pour les atteintes digestives, l’efficacité du traitement n’a pas été établie.
· Infections à HSV
Traitement d'attaque :
Le foscarnet sera administré pendant 2 ou 3 semaines ou jusqu'à cicatrisation des lésions.
La dose habituelle est de 80 mg/kg/j en deux perfusions sur une heure minimum chacune chez les patients à fonction rénale normale. En cas de réponse jugée insuffisante, cette dose pourra être portée à 120 mg/kg/j habituellement en trois perfusions.
La posologie doit être adaptée à l'état de la fonction rénale (voir tableau posologique).
Le traitement doit être associé à une hydratation.
Traitement d’entretien :
L'efficacité du traitement d'entretien des infections à virus Herpès n'a pas été établie.
Chez les patients âgés :
Identique aux adultes.
Population pédiatrique :
L'efficacité et la sécurité d’emploi de l’utilisation du foscarnet chez les enfants n’ont pas été établies. Veuillez-vous référer aux rubriques 4.4 et 5.3.
Les patients souffrant d’une insuffisance hépatique ou rénale :
La dose doit être réduite chez les patients souffrant d’une insuffisance rénale conformément au niveau de clairance de la créatinine comme indiqué dans le tableau ci-dessus. Un ajustement de la dose n’est pas nécessaire chez les patients avec insuffisance hépatique.
Patients sous hémodialyse :
Il n'est pas recommandé d'administrer le foscarnet à des patients sous hémodialyse car les posologies n'ont pas été établies.
Mode d’administration
Précautions à prendre avant la manipulation ou l’administration du médicament :
Le foscarnet doit être administré uniquement par voie intraveineuse dans une veine centrale (cathéter), ou dans une veine périphérique.
Attention : Ne pas administrer le foscarnet en injection intraveineuse rapide.
Ne pas administrer le foscarnet sans hydratation (voir Hydratation).
Une dose individuelle à la concentration adaptée (24 mg/ml ou 12 mg/ml) à la voie d'administration (veine centrale ou périphérique) doit être préparée de façon aseptique avant l'administration.
La solution standard à 24 mg/ml peut être utilisée pure ou diluée en cas d'administration par voie intraveineuse dans une veine centrale (cathéter).
En cas de perfusion dans une veine périphérique, la solution à 24 mg/ml doit être diluée avant administration jusqu'à une concentration de 12 mg/ml à l'aide d'une solution à NaCl 0,9 % ou glucose à 5 %, afin d'éviter l'irritation locale des veines périphériques. La dilution et/ou l'élimination des quantités excédentaires doivent être réalisées dans des conditions d'asepsie. Les solutions diluées doivent être utilisées le plus rapidement possible après leur préparation (voir section 6.6).
La toxicité rénale du Foscavir peut être réduite par une hydratation adéquate du patient. Voir la section « Hydratation » ci-dessous.
En cas d'utilisation d'un système de perfusion en Y, perfuser simultanément 0,5 à 1 litre de NaCl 0,9 % ou de glucose à 5 %.
Ne pas administrer d’autres produits dans la même perfusion.
Lorsque le produit est perfusé dans une voie périphérique, l’hydratation intraveineuse simultanée tient lieu de dilution (voir Hydratation).
Ne pas administrer d’autres produits dans la même perfusion. Lorsque le produit est perfusé dans une voie périphérique, l’hydratation intraveineuse simultanée tient lieu de dilution (voir Hydratation).
Schéma d'un système de perfusion en Y
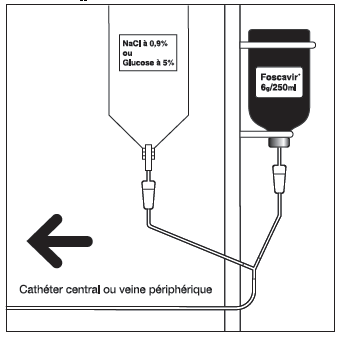
Hydratation :
L'attention est attirée sur l'importance de la prévention de la toxicité rénale du foscarnet par une hydratation convenable des patients.
En cas d'utilisation d'un système de perfusion en Y, il est recommandé de perfuser simultanément 0,5 à 1 litre de NaCl 0,9 % ou de glucose à 5 %.
Chez les patients adéquats, l’hydratation orale avec régimes d’hydratation semblables a été employée. Les patients cliniquement déshydratés doivent avoir leur état corrigé avant de commencer la thérapie Foscavir.
Durée du traitement :
Il est recommandé d'effectuer un traitement d'attaque de 2 à 3 semaines ou jusqu'à cicatrisation des lésions.
Le traitement d'entretien de la rétinite doit théoriquement être poursuivi de façon prolongée.
TABLEAU POSOLOGIQUE
Traitement d'attaque
|
Clairance de la créatinine |
Créatinine sérique |
Virémie à CMV (greffe de CSH) |
Rétinite à CMV (SIDA) |
HSV |
|
|
(ml/kg/min) |
μmol/l |
Dose toutes les 12 heures (mg/kg) en perfusion d’une heure |
Dose toutes les 8 heures (mg/kg) en perfusion d’une heure |
Dose toutes les 12 heures (mg/kg) en perfusion d’une heure |
Dose toutes les 8 à 12 heures (mg/kg) en perfusion d’une heure |
|
> 1,6 |
< 110 |
60 |
60 |
90 |
40 |
|
1,6 - 1,4 |
110 – 120 |
60 |
55 |
82 |
37 |
|
1,4 – 1,2 |
120 – 140 |
45 |
49 |
73 |
33 |
|
1,2 – 1,0 |
140 – 170 |
45 |
42 |
63 |
28 |
|
1,0 – 0,8 |
170 – 210 |
35 |
35 |
52 |
24 |
|
0,8 – 0,6 |
210 – 237 |
25 |
28 |
42 |
19 |
|
0,6 – 0,5 |
237 – 244 |
20 |
21 |
31 |
14 |
|
0,5 – 0,4 |
244 – 250 |
15 |
21 |
31 |
14 |
|
< 0,4 |
> 250 |
traitement non recommandé |
traitement non recommandé |
traitement non recommandé |
traitement non recommandé |
Traitement d'entretien
|
Clairance de la créatinine |
Créatinine sérique |
Virémie à CMV (greffe de CSH) |
Rétinite à CMV (SIDA) |
||
|
(ml/kg/min) |
μmol/l |
(mg/kg en 2 heures) |
(mg/kg en 2 heures) |
||
|
> 1,4 |
< 120 |
90 |
Toutes les 24 heures |
90 – 120 |
Toutes les 24 heures |
|
1,4 – 1,2 |
120 – 140 |
70 |
" |
78 – 104 |
" |
|
1,2 – 1,0 |
140 – 170 |
70 |
" |
75 – 100 |
" |
|
1,0 – 0,8 |
170 – 210 |
50 |
" |
71 – 94 |
" |
|
0,8 – 0,6 |
210 – 237 |
80 |
Toutes les 48 heures |
63 – 84 |
" |
|
0,6 – 0,5 |
237 – 244 |
60 |
" |
67 – 76 |
" |
|
0,5 – 0,4 |
244 – 250 |
50 |
" |
57 - 67 |
" |
|
< 0,4 |
> 250 |
traitement non recommandé |
traitement non recommandé |
||
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Une atteinte rénale pouvant survenir durant l'administration de Foscavir, il est impératif de contrôler la créatinine sérique tous les deux jours en traitement d'attaque et une fois par semaine en traitement d'entretien. Un ajustement des posologies est à prévoir au regard de la fonction rénale. Il est recommandé de maintenir une hydratation adéquate chez tous les patients (voir rubrique 4.2).
La fonction rénale des patients souffrant d’une maladie des reins ou bien recevant un traitement concomitant avec d’autres médicaments néphrotoxiques doit être étroitement surveillée (voir la rubrique 4.5).
Ce médicament contient 1,38 g de sodium par flacon de 250 ml, ce qui équivaut à 69 % de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte. La dose quotidienne maximale recommandée de ce médicament est de 12 g de Foscavir par jour (180 mg/kg/jour pour un patient adulte de 70 kg), ce qui équivaut à 138 % de l’apport alimentaire quotidien maximal recommandé par l’OMS en sodium.
Foscavir est considéré comme ayant une teneur élevée en sodium. Ceci doit être pris en compte en particulier pour les personnes suivant un régime à faible teneur en sodium. Son utilisation devrait être évitée lorsqu’une charge saline ne peut pas être supportée (par exemple dans le cas d’une myocardiopathie).
En raison de la faculté du Foscavir à chélater les ions métalliques bivalents comme le calcium, l'administration de ce médicament est associée à une diminution de la concentration sérique de calcium ionisé, proportionnelle au taux d’infusion du Foscavir, ce qui ne sera pas nécessairement reflété dans le total de la concentration sérique de calcium.
Les électrolytes, particulièrement le calcium et le magnésium seront évalués avant et pendant le traitement au Foscavir et les déficiences décelées seront corrigées.
Foscarnet a été associé à des cas de prolongation de l’intervalle QT et plus rarement à des cas de torsades de pointes (voir rubrique 4.8). Les patients avec des prolongations d’intervalles de conduction cardiaque connues, notamment des QT corrigés, les patients avec des perturbations électrolytiques importantes (hypokaliémie, hypo-magnésaemie), bradycardie, ainsi que les patients souffrant d’une maladie cardiaque sous-jacente telle qu’une insuffisance cardiaque congestive, ou ceux qui prennent des médicaments connus pour leur prolongation de l’intervalle QT doivent tous faire l’objet d’une surveillance étroite en raison d’un risque accru d’arythmie ventriculaire. Il est demandé aux patients de signaler immédiatement tout symptôme cardiaque.
Le Foscavir se dépose sur les dents, les os et le cartilage. Les données précliniques ont montré que ces dépôts étaient plus importants chez les animaux jeunes. La sécurité d’emploi de Foscavir et son effet sur le développement du squelette n’ont pas été étudiés chez les enfants. Veuillez vous référer à la rubrique 5.3.
Des crises, liées aux altérations d’électrolytes et de minéraux plasmiques ont été associées au traitement Foscavir. Des cas d’état de mal épileptique ont été signalés. Les patients doivent donc être soigneusement surveillés afin de déceler de tels changements et leurs possibles séquelles. Des suppléments de minéraux et d’électrolyte pourront s’avérer nécessaires.
Le Foscavir est excrété en concentrations importantes dans l’urine et peut être associé à des irritations et/ou ulcérations génitales importantes. Des précautions particulières doivent être prises au niveau de l’hygiène pour éviter ces problèmes, et le nettoyage de la zone génitale est recommandé après chaque miction.
Si les patients subissaient d’importantes nausées ou une paresthésie extrême, il est recommandé de réduire la vitesse d’infusion.
En cas de prescription de diurétiques, les thiazides sont recommandés.
Développement de résistance : Si l’administration de Foscavir n’entraîne pas une réponse thérapeutique ou bien engendre une aggravation de l’état après la réponse initiale, il est possible que cela soit dû à une sensibilité réduite des virus au foscarnet. Dans ce cas, il est nécessaire d’envisager l’interruption du traitement par Foscavir et d’utiliser un autre médicament.
Lorsque Foscavir est administré pour une virémie à CMV, observez attentivement l’apparition d’une infection spécifique à un organe. Si des symptômes d’infection (maladie à CMV) apparaissent, il convient d’ajuster la prise en charge thérapeutique.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Puisque le Foscavir peut affecter la fonction rénale, une toxicité ajoutée peut survenir lorsqu’il est utilisé conjointement à d’autres médicaments néphrotoxiques tels que les aminoglycosides, l’amphoréticine B, la ciclosporine A, l’aciclovir, le méthotrexate et le tacrolimus. En outre, puisque Foscavir peut diminuer la concentration de calcium sérique ionisé, il est conseillé de faire preuve d’une prudence extrême lorsqu’il est utilisé en concomitance avec d’autres médicaments reconnus comme influençant les concentrations de calcium sérique (comme par ex. la pentamidine IV). L’insuffisance rénale et l’hypocalcémie symptomatique (Signes de Trousseau et de Chvostek) ont été observées pendant le traitement concomitant de Foscavir et de Pentamidine IV. Une fonction rénale anormale a été signalée en ce qui concerne l’utilisation de Foscavir avec du Ritonavir et/ou du Saquinavir.
En raison du risque potentiel accru de prolongation de l’intervalle QT et de torsades de pointe, Foscavir doit être utilisé précautionneusement avec des médicaments connus pour leur prolongation de l’intervalle QT, particulièrement les médicaments de catégories IA (par ex. quinidine) et III (par ex. amiodarone, sotalol), les agents antiarythmiques ou les médicaments neuroleptiques. Une surveillance cardiaque étroite doit avoir lieu lors d’une co-administration.
Il n’y a pas d’interaction pharmacocinétique avec la Zidovudine (AZT), le ganciclovir, la didanosine (ddI), la zalcitabine (ddC) ou probénécide.
Les interactions médicamenteuses (incompatibilités pour la perfusion) sont décrites dans la rubrique 6.2.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe aucune donnée ou bien il existe une quantité limitée de données tirées de l’utilisation de foscarnet chez les femmes enceintes.
Les études animales ne suffisent pas en ce qui concerne la toxicité en matière de reproduction (voir la rubrique 5.3).
Foscavir est déconseillé pendant une grossesse.
Allaitement
Il n’existe pas d’informations suffisantes concernant le passage du foscarnet dans le lait maternel.
Les données toxicologiques/pharmacodynamiques à disposition chez les animaux ont indiqué le passage du foscarnet dans le lait (pour plus de détails, voir la rubrique 5.3).
Un risque chez les nouveau-nés/nourrissons ne peut pas être écarté.
Foscavir ne doit pas être utilisé pendant l’allaitement.
Il doit être alors décidé soit d’arrêter l’allaitement, soit d’arrêter le traitement par Foscavir en prenant en considération les avantages de l’allaitement pour l’enfant et les avantages du traitement pour la mère.
Fertilité
Il n’existe aucune donnée à disposition en ce qui concerne l’influence du Foscavir sur la fertilité.
Aucun effet sur la fertilité n’a été observé lors des études animales (voir la rubrique 5.3).
Femmes en âge de procréer / contraception pour les hommes et les femmes
Les femmes en âge de procréer doivent employer des méthodes de contraception efficaces durant le traitement Foscavir.
Les hommes subissant un traitement Foscavir ne doivent pas procréer jusqu’à 6 mois après la fin du traitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
La majorité des patients qui reçoivent du Foscavir souffrent d’un système immunitaire gravement compromis et de graves contaminations par virus. L’état physique des patients, la sévérité de la maladie sous-jacente, d’autres virus et thérapies concomitantes contribuent à la présence d’évènements adverses lors de l’utilisation de Foscavir.
Les effets indésirables rapportés au cours des essais cliniques et après commercialisation avec le Foscavir sont présentés dans le tableau ci-dessous. Ils sont classés par classes de système d’organes (SOC) et par ordre de fréquence en utilisant la convention suivante : très fréquent (≥1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (³ 1/10 000, < 1/1 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Notez que durant ces essais cliniques, l’hydratation et l’attention à l’équilibre des électrolytes n’ont pas été fournies de manière cohérente ; la fréquence de certains évènements adverses sera inférieure lorsque les recommandations actuelles sont respectées (voir les rubriques 4.2 et 4.4).
Tableau 1 : Fréquence des effets indésirables
|
SOC |
Fréquence |
Effet indésirable |
|
Affections hématologiques et du système lymphatique |
Très fréquent |
Anémie, granulocytopénie |
|
Fréquent |
Leucopénie, thrombocytopénie, neutropénie |
|
|
|
Peu fréquent |
Pancytopénie |
|
Affections du système immunitaire |
Fréquent |
Sepsis |
|
Indéterminée |
Hypersensibilité (y compris réactions anaphylactiques), réactions anaphylactoïdes |
|
|
Affections endocriniennes |
Indéterminée |
Diabète insipide |
|
Troubles du métabolisme et de la nutrition |
Très fréquent |
Perte d’appétit, hypokaliémie, hypomagnésémie, hypocalcémie |
|
|
Fréquent |
Hyperphosphatémie, hyponatrémie, hypophosphatémie, augmentation des phosphatases alcalines dans le sang, augmentation des lactodéshydrogénases dans le sang, hypercalcémie, déshydratation |
|
|
Peu fréquent |
Acidose |
|
Indéterminée |
Hypernatrémie |
|
|
Affections psychiatriques |
Fréquent |
Agressivité, agitation, anxiété, état confusionnel, dépression, nervosité |
|
Indéterminée |
Changements de l’état mental |
|
|
Affections du système nerveux |
Très fréquent |
Vertiges, céphalées, paresthésie |
|
Fréquent |
Coordination anormale, convulsions, hypoesthésie, contractions musculaires involontaires, neuropathie périphérique, tremblement |
|
|
Indéterminée |
Encéphalopathie |
|
|
Affections cardiaques |
Fréquent |
Palpitations, tachycardie |
|
Indéterminée |
Allongement de l’intervalle QT, arythmie ventriculaire, torsade de pointes |
|
|
Affections vasculaires |
Fréquent |
Hypertension, hypotension, thrombophlébitea |
|
Affections gastro- intestinales |
Très fréquent |
Diarrhée, nausées, vomissements |
|
Fréquent |
Douleurs abdominales, constipation, dyspepsie, pancréatite, hémorragie gastro-intestinale |
|
|
Indéterminée |
Ulcération oesophagienne |
|
|
Affections hépatobiliaires |
Fréquent |
Fonction hépatique anormale |
|
Affections de la peau et du tissu sous-cutané |
Très fréquent |
Eruption |
|
Fréquent |
Prurit |
|
|
Peu fréquent |
Urticaire, œdème de Quincke |
|
|
Indéterminée |
Erythème multiforme, épidermolyse aiguë toxique, syndrome de Stevens-Johnsonb |
|
|
Affections musculo-squelettiques et systémiques |
Fréquent |
Myalgies |
|
Indéterminée |
Faiblesse musculaire, myopathie, myosite, rhabdomyolyse |
|
|
Affections du rein et des voies urinaires |
Fréquent |
Insuffisance rénale, insuffisance rénale aiguë, dysurie, polyurie, protéinurie |
|
Peu fréquent |
Trouble tubulaire rénal, glomérulonéphrite, syndrome néphrotique |
|
|
Indéterminée |
Douleurs rénales, acidose tubulaire rénale, nécrose tubulaire rénale, nécrose tubulaire aiguë, néphropathie à cristaux, hématurie |
|
|
Affections des organes de reproduction et du sein |
Fréquent |
Ulcérations génitales et inconfortc |
|
Troubles généraux et anomalies au site d'administration |
Très fréquent |
Asthénie, frissons, fatigue, pyrexie |
|
Fréquent |
Malaise, œdèmes, douleur thoraciqued, douleur au point d’injection, inflammation du point d’injection |
|
|
Indéterminée |
Extravasation |
|
|
Investigations |
Très fréquent |
Elévation de la créatinine sanguine, baisse de l’hémoglobine |
|
Fréquent |
Baisse de la clairance de la créatinine rénale, EGC anormal, augmentation des gamma-GT, augmentation de l'alanine amino-transférase, augmentation de l’aspartate aminotransférase, lipase accrue |
|
|
Peu fréquent |
Hausse de l’amylase, élévation de la créatine phosphokinase dans le sang |
a Une thrombophlébite dans les veines périphériques après perfusion de solution foscarnet non diluée a été observée.
b Des cas d’éruptions vésiculo-bulleuses, dont des érythèmes multiformes, des épidermolyses aiguës toxiques et des syndromes de Stevens-Johnson, ont été signalés. Dans la plupart des cas, les patients prenaient d’autres médicaments, qui ont été associés à l’épidermolyse aiguë toxique ou au syndrome de Stevens-Johnson.
c Foscarnet passe en fortes concentrations dans l’urine et peut être associé à une irritation significative et une ulcération dans les zones génitales, notamment après un traitement prolongé
d Une douleur thoracique transitoire a été signalée parmi les réactions de perfusion au foscarnet.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
Des surdosages ont été rapportés lors de l’utilisation de Foscavir la plus forte dose étant 20 fois la dose recommandée.
Certains cas étaient des overdoses relatives, selon lesquelles la dose de médicament utilisée n’avait pas été rapidement ajustée lorsque le patient a commencé à souffrir d’une fonction rénale réduite.
Il existe des cas où aucune séquelle clinique n’a été signalée à la suite d’une overdose.
La tendance d’évènements indésirables rapportés en rapport à une overdose de Foscavir est conforme au profil connu des évènements adverses du médicament.
L'hémodialyse en augmentant l'élimination du Foscavir peut être bénéfique dans les cas pertinents.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Le foscarnet est un agent antiviral à large spectre qui inhibe in vitro, à des concentrations n'affectant pas la croissance cellulaire normale, tous les virus humains connus du groupe herpès (herpès simplex (HSV) types 1 et 2, herpès 6, varicelle zona, Epstein-Barr et cytomégalovirus (CMV)), en particulier les souches HSV mutantes présentant un déficit en thymidine kinase, et certains rétrovirus y compris le virus de l'immunodéficience humaine (VIH). Le foscarnet inhibe également in vitro l'ADN polymérase virale du virus de l'hépatite B.
Le foscarnet exerce son activité antivirale par inhibition directe de l'ADN polymérase virale spécifique et de la transcriptase inverse.
Le foscarnet ne nécessite pas d'activation (phosphorylation) par la thymidine kinase (TK) ou d'autres kinases. Il est ainsi actif in vitro contre les virus HSV mutants déficients en TK. Les souches de CMV résistantes au ganciclovir peuvent être sensibles au foscarnet. La sensibilité des résultats (DI50) varie de façon importante selon la méthode utilisée et le type de cellules employées. Le tableau ci-dessous donne une liste de virus et la DI50 correspondante :
|
Virus |
DI50 (µM) |
|
CMV |
50-800* |
|
HSV1, HSV2 |
10-130 |
|
VZV |
48-90 |
|
EBV |
< 500** |
|
HHV-6 |
49 |
|
CMV résistant à ganciclovir |
190 |
|
HSV-TK Minus Mutant |
67 |
|
HSV-DNA Polymérase Mutant |
5-443 |
|
HIV 1 |
11-32 |
|
HIV 1 résistant à la zidovudine |
10-32 |
|
* Moyenne = 269 µM |
|
|
** 97 % de la synthèse d'antigène viral inhibé à 500 µM |
|
Si aucune réponse clinique n'est observée après administration de foscarnet, la sensibilité au foscarnet des isolats viraux devrait être testée car des mutants naturellement résistants peuvent exister ou émerger in vitro et in vivo.
Il a été montré in vitro que le foscarnet avait une activité synergique de la zidovudine sur le VIH.
Virémie à CMV chez les receveurs d’une greffe de CSH
Une étude clinique pivot a permis d'étudier l'efficacité du foscarnet (n=110) sur la virémie à CMV après une greffe allogénique de CSH et de la comparer au ganciclovir (n=103). Les patients du bras ’foscarnet’ recevaient un traitement d’attaque de 2 semaines à la posologie de 60 mg 2 fois par jour puis un traitement d’entretien à la posologie de 90 mg/kg/jour pendant 2 semaines. La proportion de patients ayant survécu sans évènements après la greffe (ces évènements étant l’apparition de la maladie à CMV ou un décès pour un quelconque motif) dans les 180 jours après la greffe (point final primaire) a été de 66 % dans le groupe à foscarnet et de 73 % dans le groupe à ganciclovir. La non-infériorité du foscarnet par rapport au ganciclovir n’a pas été formellement démontrée dans cette étude (limite inférieure de l’intervalle de confiance à -17,9 % au lieu des -15 % attendus). Le pourcentage de patients ayant eu recours à un retraitement entre 7 jours et 100 jours après l’arrêt du traitement pour lequel ils étaient randomisés, est bien supérieur dans le bras foscarnet par rapport au bras ganciclovir (35,4 % versus 19,1 %, p=0,027 significatif) avec un délai moyen de 21 jours pour foscarnet et 27 jours pour ganciclovir.
Maladie à CMV chez les receveurs d'une greffe de CSH
Seules des données issues d’études prospectives limitées sont disponibles dans la littérature sur l’utilisation du foscarnet dans la maladie à CMV en dehors de l’infection à VIH dans un contexte d’immunodépression liée à la greffe de moelle avec un traitement d’attaque de 180 mg/kg/jour et un traitement d’entretien de 90-120 mg/kg/jour.
Rétinites à CMV chez les patients atteints du SIDA
La concentration inhibitrice moyenne 50 % (DI50) sur plus de cent isolats cliniques de CMV est environ de 270 µmol/l (81 mg/l), tandis qu'une inhibition réversible de la croissance des cellules normales est observée à environ 1000 µmol/l (300 mg/l).
Chez l'homme après traitement d'attaque, le foscarnet stabilise les lésions rétiniennes dans environ 90 % des cas. Cependant, compte tenu du caractère latent des infections à CMV et de l'activité virustatique de foscarnet, des rechutes surviennent chez la majorité des patients immunodéprimés après arrêt du traitement.
Chez les patients présentant une rechute de la rétinite, un nouveau traitement d'attaque présente la même efficacité que le traitement initial.
Infections à HSV
Dans une étude prospective randomisée chez des patients atteints de SIDA, les patients traités par foscarnet (120 mg/kg/j) ont cicatrisé en 11 à 25 jours, avec un arrêt des douleurs en 9 jours et un arrêt de la prolifération d'HSV en 7 jours.
5.2. Propriétés pharmacocinétiques
Il est fortement fixé au niveau de l’os et faiblement au niveau des protéines plasmatiques (< 20 %). Il passe dans le LCR et des concentrations de l’ordre de 10 à 70 % de la concentration plasmatique ont été retrouvées chez les patients infectés par le VIH.
Le volume de distribution total est de 5 l/kg.
Le foscarnet n’est pas métabolisé dans l’organisme.
Le foscarnet est principalement éliminé au niveau rénal par filtration glomérulaire et sécrétion tubulaire.
La clairance rénale est d'environ 130 ml/min et est étroitement liée avec la clairance de la créatinine. La demi-vie plasmatique terminale est en moyenne de 80 heures.
Le foscarnet est dialysable.
5.3. Données de sécurité préclinique
Les organes ou systèmes cibles mis en évidence au cours des études de toxicité en administration réitérée sont les reins (tubulopathies) et les os (résorption osseuse). Les changements osseux étaient caractérisés par une activité ostéoclastique augmentée et une résorption osseuse. Environ 20 % de la dose administrée est absorbée par les os et le cartilage, et les dépôts sont plus importants chez les animaux jeunes et en cours de croissance. Ces effets ont été observés chez le chien uniquement. L’explication de ces modifications peut être liée au fait que le foscarnet, en raison de sa similarité structurelle avec le phosphate, est incorporé dans l’hydroxyapatite. Des études auto radiographiques ont révélé que le foscarnet avait une grande affinité pour le tissu osseux. Les études ont également montré que les modifications osseuses étaient réversibles. Il a été démontré que le sodium de foscarnet avait un effet délétère sur le développement de l’émail des dents des souris et des rats. Les conséquences de ces dépôts sur le développement du squelette n’ont pas été étudiées.
Des potentiels génotoxiques (anomalies chromosomiques in vitro) ont été mis en évidence dans quelques études. L’étude des fonctions de reproduction n’a montré aucun effet délétère (notamment tératogène). Aucun effet cancérogène n’a été rapporté lors des études chez la Souris et le Rat.
Eau pour préparations injectables
Foscavir n'est pas compatible avec les solutions de glucose à 30 %, d'amphotéricine B, d'aciclovir sodique, de ganciclovir, d'iséthionate de pentamidine, de triméthoprime-sulfamétoxazole, de chlorhydrate de vancomycine et solutions pouvant contenir du calcium.
Il est recommandé de ne pas administrer d'autres produits dans la même perfusion.
Non ouvert : 2 ans
Après ouverture : le produit doit être utilisé immédiatement.
Les doses individuelles de foscarnet doivent être aseptiquement transférées dans une poche en plastique pour perfusion par la pharmacie hospitalière.
La stabilité physico-chimique après dilution en poche PVC a été démontrée pendant 7 jours à une température ne dépassant pas 30°C. Toutefois, d’un point de vue microbiologique, à moins que la méthode et les conditions d’ouverture et de dilution excluent le risque de contamination microbienne, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservations avant utilisation relèvent de la seule responsabilité de l’utilisateur.
Si le produit a été réfrigéré, un précipité peut apparaître. Il est recommandé dans ce cas de remettre le flacon à température ambiante en l'agitant de façon répétée jusqu’à disparition complète de ces particules et obtention d’une solution limpide. Si des particules sont encore présentes, le produit ne doit pas être utilisé et doit être jeté. Après perforation du bouchon, la solution doit être utilisée dans les 24 heures.
6.4. Précautions particulières de conservation
Avant ouverture : À conserver à une température ne dépassant pas 25°C. Ne pas réfrigérer.
Pour les conditions de conservation du médicament après première ouverture et/ou dilution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Flacon de 250 ml.
6.6. Précautions particulières d’élimination et de manipulation
Le foscarnet ne contient pas de conservateurs.
En cas d’administration dans une veine périphérique, voir la rubrique 4.2 pour les instructions de dilution du produit avant administration.
Le contact accidentel du foscarnet sur la peau ou dans les yeux peut entraîner des irritations locales et des sensations de brûlures.
Il est recommandé dans ce cas de rincer à l'eau la partie du corps concernée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SCHIPHOL BOULEVARD 359
WTC SCHIPHOL AIRPORT
D TOWER 11TH FLOOR
1118BJ SCHIPHOL
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 346 445 0 4 : 250 ml en flacon (verre)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament réservé à l’usage hospitalier.
ANSM - Mis à jour le : 07/03/2025
FOSCAVIR 6 g/250 ml, solution pour perfusion
Foscarnet sodique hexahydraté
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FOSCAVIR 6 g/250 ml, solution pour perfusion et dans quel cas est-il utilisé ?
2. Quelles sont les informations à connaitre avant d'utiliser FOSCAVIR 6 g/250 ml, solution pour perfusion ?
3. Comment utiliser FOSCAVIR 6 g/250 ml, solution pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FOSCAVIR 6 g/250 ml, solution pour perfusion ?
6. Contenu de l’emballage et autres informations
1. QU’EST-CE QUE FOSCAVIR 6 g/250 ml, solution pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : J05AD01
Qu’est-ce que FOSCAVIR ?
FOSCAVIR 6 g/250 ml, solution pour perfusion appartient à la famille des antiviraux. Il agit sur certains virus (tous les virus du groupe de l’herpès et certains rétrovirus comme le cytomégalovirus (CMV)). Il empêche la reproduction des virus dans les cellules infectées.
Dans quels cas est-il utilisé ?
Ce médicament est utilisé lorsque vos défenses immunitaires sont diminuées :
· Pour traiter des infections par le CMV si vous êtes atteints du SIDA.
· Pour traiter une infection par l’herpès (de la lèvre, du nez, des yeux, des parties génitales).
· Foscavir est administré aux personnes souffrant d’une infection virale à CMV suite à une greffe de moelle osseuse. Cette dernière est également appelée greffe de cellules souches hématopoïétiques (CSH). L’infection peut parfois être détectée avant que le patient ne commence à en ressentir les signes. On appelle cela une virémie à CMV.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FOSCAVIR 6 g/250 ml, solution pour perfusion ?
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L’AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Adressez-vous à votre médecin ou infirmier/ère avant d’utiliser Foscavir :
· Si vos reins fonctionnent mal. Dans ce cas, votre médecin pourra adapter la dose à votre état.
· Si votre taux de calcium dans le sang est bas avant de recevoir ce médicament et si vous prenez un médicament qui abaisse le taux de calcium dans le sang.
· Si vous avez des problèmes cardiaques.
· Si vous ressentez des fourmillements des mains ou des lèvres et des nausées. Dans ce cas, votre infirmière réduira la vitesse de perfusion.
En cas de contact accidentel avec le produit, rincez à l’eau la peau ou les muqueuses (à l’intérieur de la bouche, du nez, des oreilles ou des organes génitaux) qui sont entrées en contact avec le produit.
Il est recommandé, après avoir uriné, de suivre une hygiène intime rigoureuse : lavez à l’eau courante la verge (ou la vulve) pour éviter d’avoir des lésions au niveau des organes génitaux (ulcérations génitales).
Examens de sang
Avant et pendant votre traitement, votre médecin pourra vous demander de faire des analyses de sang et d’urine. Ces examens visent à contrôler le fonctionnement de vos reins et la quantité de minéraux dans votre sang.
Enfants et adolescents
Sans objet.
Autres médicaments et FOSCAVIR 6 g/250 ml, solution pour perfusion
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Cette catégorie inclut les médicaments sans ordonnance et la phytothérapie. En effet, Foscavir peut affecter le fonctionnement de certains médicaments et, à l’inverse, certains médicaments peuvent affecter le fonctionnement de Foscavir.
En particulier, informez votre médecin ou votre infirmier/ère si vous prenez déjà l’un des médicaments suivants :
· Pentamidine (traitement des infections).
· Amphotéricine B (traitement des infections fongiques).
· Aciclovir (traitement des infections virales).
· Antibiotiques de la famille des aminoglycosides, comme la gentamicine et la streptomycine (traitement des infections).
· Ciclosporine A, méthotrexate ou tacrolimus (immunosuppresseurs).
· Médicaments appelés inhibiteurs de la protéase, comme le ritonavir et le saquinavir.
· Quinidine, amiodarone, sotalol ou tout autre médicament susceptible d’affecter la fréquence ou le rythme cardiaques.
· Anxiolytiques (neuroleptique).
FOSCAVIR 6 g/250 ml, solution pour perfusion avec des aliments et boissons
Sans objet.
Grossesse et allaitement
· L’utilisation de ce médicament est déconseillée pendant la grossesse.
· Il est déconseillé de tomber enceinte pendant un traitement avec Foscavir et donc des méthodes de contraception efficaces doivent être utilisées.
· Les hommes suivant un traitement avec Foscavir ne doivent pas procréer pendant le traitement et jusqu’à 6 mois après la fin du traitement.
· Ne pas prendre de Foscavir en cas d’allaitement.
Conduite de véhicules et utilisation de machines
Foscavir peut affecter votre capacité à conduire un véhicule ou à utiliser des outils ou des machines. En raison d’un risque de convulsions, mouvements anormaux et vertiges rapportés avec ce médicament. Avertissez votre médecin si vous devez effectuer l'une de ces activités.
FOSCAVIR 6 g/250 ml, solution pour perfusion contient du sodium
La dose quotidienne maximale recommandée de ce médicament contient 2,75 g de sodium (composant principal du sel de cuisine/table). Cela équivaut à 138 % de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
Parlez-en à votre médecin ou votre pharmacien si vous avez besoin de Foscavir quotidiennement pendant une période prolongée, surtout si vous devez suivre un régime à faible teneur en sel (sodium).
3. COMMENT UTILISER FOSCAVIR 6 g/250 ml, solution pour perfusion ?
· Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin en cas de doute.
· Chaque perfusion prend au minimum 1 heure. Ne touchez pas au matériel pendant votre perfusion.
· La dose de Foscavir administrée dépend du fonctionnement de vos reins ainsi que de votre poids.
· Il est impératif de maintenir une hydratation adéquate pendant la perfusion, ce qui contribue également à éviter les problèmes rénaux. En cas de besoin, votre médecin ou votre infirmier/ère vous apporteront l’hydratation nécessaire simultanément à votre perfusion de Foscavir.
Si vous avez pris plus de FOSCAVIR 6 g/250 ml, solution pour perfusion que vous n’auriez dû :
En cas de prise extrêmement massive de Foscavir, avertir immédiatement votre médecin ou votre pharmacien.
Des surdosages ont été rapportés. La plus forte dose était de 20 fois la dose normale.
Les symptômes s'apparentent à une hypocalcémie aiguë avec sensation de fourmillement et occasionnellement convulsions, insuffisance rénale fonctionnelle.
L'hémodialyse en augmentant l'élimination de Foscavir peut être bénéfique dans certains cas.
Si vous oubliez de prendre FOSCAVIR 6 g/250 ml, solution pour perfusion
Si vous arrêtez de prendre FOSCAVIR 6 g/250 ml, solution pour perfusion
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Certains effets secondaires peuvent être graves et nécessiter la consultation immédiate d’un médecin :
· Réactions allergiques sévères, dont une chute de la tension artérielle, un choc et un gonflement de la peau (angio-œdème). Elles sont connues sous le nom d’hypersensibilité et de réactions anaphylactiques ou anaphylactoïdes.
· Éruptions cutanées sévères. Ces types d’éruptions cutanées peuvent être associés à des rougeurs, un gonflement et des cloques au niveau la peau, de la bouche, de la gorge, des yeux et d’autres parties internes du corps, pouvant parfois entraîner la mort. Elles sont appelées érythème multiforme, syndrome de Stevens-Johnson ou épidermolyse aiguë toxique.
Si vous rencontrez l’un de ces symptômes, informez-en immédiatement votre médecin ou rendez-vous au service d’urgences le plus proche.
Parmi les autres effets secondaires figurent :
Effets indésirables très fréquemment rapportés (touchent plus d'un patient sur 10) :
· Réduction du nombre de globules rouges (démontrée dans les analyses sanguines). Vous pouvez vous sentir fatigué ou être pâle.
· Faible niveau de globules blancs (granulocytopénie). Les signes incluent des infections et une forte température (fièvre).
· Perte d'appétit.
· Diminution du taux de potassium dans le sang.
· Diminution du taux de magnésium dans le sang.
· Diminution du taux de calcium dans le sang.
· Vertiges.
· Maux de tête.
· Fourmillements.
· Diarrhée.
· Nausées, vomissements.
· Eruption cutanée.
· Sensation de faiblesse ou de fatigue.
· Frissons, température élevée.
· Changement du bon fonctionnement de vos reins (démontré dans les analyses sanguines) : par ex. élévation de la créatinine sanguine, baisse de l’hémoglobine.
Effets indésirables fréquemment rapportés (touchent 1 à 10 patients sur 100) :
· Niveaux bas de globules blancs (leucopénie et/ou neutropénie). Les signes incluent infections et forte température (fièvre).
· Réduction du nombre de plaquettes dans votre sang. Vous pouvez avoir des ecchymoses plus facilement.
· Infection du sang (sepsis).
· Augmentation ou diminution du taux de phosphate dans le sang.
· Diminution du taux de sodium dans le sang.
· Augmentation du taux de calcium dans le sang.
· Déshydratation.
· Fonction hépatique anormale.
· Elévation des enzymes hépatiques (Gamma-GT, alanine aminotransférase, aspartate aminotransférase, LDH).
· Changement de votre état psychologique. Par ex. : agressivité, agitation, anxiété, confusion, dépression, nervosité.
· Problèmes de coordination.
· Convulsions.
· Pertes de sensation au niveau de la peau.
· Battements de cœur inhabituels (palpitations cardiaques).
· Rythme cardiaque rapide (tachycardie).
· Affections nerveuses susceptibles d’engendrer des modifications de vos sensations ou des faiblesses musculaires (neuropathie).
· Tremblements.
· Hypertension.
· Hypotension, ce qui peut engendrer des vertiges.
· Gonflement, douleur et rougeurs le long d’une veine.
· Douleur dans le ventre (abdomen), constipation et indigestion.
· Saignements gastro-intestinaux.
· Pancréas inflammé (pancréatite) ou changements dans la façon dont votre pancréas fonctionne. Les signes incluent d’importantes douleurs à l’estomac et une modification éventuelle des analyses de sang (augmentation des lipases).
· Démangeaisons de la peau.
· Douleurs musculaires.
· Problèmes rénaux, par ex. douleurs dans les reins (douleurs dans le bas du dos), insuffisance rénale, présence de protéines dans les urines.
· Douleurs lorsque vous urinez.
· Plaies ou ulcérations génitales. Il s’agit de lésions uniques ou multiples qui disparaissent à l’arrêt du traitement, voir « Précautions d’emploi ».
· Sensation de mal-être général.
· Douleur et inflammation au point d’injection.
· Douleur thoracique.
· Gonflement des pieds et des jambes.
· Changement dans les tests qui montrent le bon fonctionnement de votre cœur (ECG).
Effets indésirables peu fréquemment rapportés (touchent 1 à 10 patients sur 1 000) :
· Diminution des globules rouges, des globules blancs et des plaquettes.
· Acidité élevée du sang entrainant une accélération de la respiration.
· Éruption cutanée avec démangeaisons (urticaire).
· Problèmes rénaux (trouble tubulaire rénal, glomérulonéphrite, syndrome néphrotique).
· Augmentation de certaines enzymes dans le sang par ex. amylase, créatine phosphokinase.
Effets indésirables de fréquence indéterminée (la fréquence ne peut pas être estimée sur la base des données disponibles) :
· Diabète. Les signes incluent le fait d’uriner plus souvent que d’habitude. Plus rarement, vous pouvez également ressentir une grande soif.
· Augmentation du taux de sodium dans le sang.
· Encéphalopathie.
· Battements de cœur inhabituels ou modification du rythme cardiaque, par ex. torsade de pointes.
· Ulcère de l’œsophage.
· Problèmes musculaires : muscles douloureux, endoloris, faibles ou tremblants, destruction du tissu musculaire (rhabdomyolyse : couleur anormale des urines, faiblesse, sensibilité ou raideur musculaire sévère).
· Atteinte rénale par ex. douleurs, présence de sang dans les urines, nécrose tubulaire, néphropathie à cristaux.
· Extravasation.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FOSCAVIR 6 g/250 ml, solution pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon. La date de péremption fait référence au dernier jour de ce mois.
Avant ouverture : À conserver à une température ne dépassant pas 25°C. Ne pas réfrigérer.
Après ouverture : le produit doit être utilisé immédiatement.
Après dilution :
Les doses individuelles de foscarnet doivent être aseptiquement transférées dans une poche en plastique pour perfusion par la pharmacie hospitalière.
La stabilité physico-chimique après dilution en poche PVC a été démontrée pendant 7 jours à une température ne dépassant pas 30°C. Toutefois, d’un point de vue microbiologique, à moins que la méthode et les conditions d’ouverture et de dilution excluent le risque de contamination microbienne, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservations avant utilisation relèvent de la seule responsabilité de l’utilisateur.
Si le produit a été réfrigéré, un précipité peut apparaître. Il est recommandé dans ce cas de remettre le flacon à température ambiante en l'agitant de façon répétée jusqu’à disparition complète de ces particules et obtention d’une solution limpide. Si des particules sont encore présentes, le produit ne doit pas être utilisé et doit être jeté.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FOSCAVIR 6 g/250 ml, solution pour perfusion
· La substance active est :
Foscarnet sodique hexahydraté............................................................................................. 6 g
Pour un flacon de 250 ml.
· Les autres composants sont : Acide chlorhydrique (E507), eau pour préparations injectables. Voir la rubrique 2 « FOSCAVIR 6 g/250 ml, solution pour perfusion contient du sodium ».
Qu’est-ce que FOSCAVIR 6 g/250 ml, solution pour perfusion et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution injectable en flacon. Boite de 1.
Titulaire de l’autorisation de mise sur le marché
SCHIPHOL BOULEVARD 359
WTC SCHIPHOL AIRPORT
D TOWER 11TH FLOOR
1118BJ SCHIPHOL
PAYS-BAS
Exploitant de l’autorisation de mise sur le marché
CLINIGEN HEALTHCARE FRANCE
20 AVENUE RENE CASSIN
69009 LYON
HAFNERSTRASSE 36
A-8055 GRAZ
AUTRICHE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Faites attention avec Foscavir
· En cas d’atteinte de la fonction rénale :
o Un contrôle régulier de la créatine sérique s’impose.
o Un ajustement des posologies sera prévu en cas d’atteinte de la fonction rénale. Pour prévenir une modification de la fonction rénale qui pourrait survenir au cours du traitement, il est impératif de maintenir une hydratation adéquate.
· Ne pas utiliser de solutions pouvant contenir du calcium.
· En cas de contact accidentel, rincer à l’eau la peau ou les muqueuses qui sont entrées en contact avec le produit.
Mode d’administration
Le foscarnet doit être administré uniquement par voie intraveineuse dans une veine centrale (cathéter), ou dans une veine périphérique.
Attention : Ne pas administrer le foscarnet en injection intraveineuse rapide.
Ne pas administrer le foscarnet sans hydratation.
Ne pas utiliser de solutions pouvant contenir du calcium, du glucose à 30 %, amphotéricine B, acyclovir sodique, ganciclovir, iséthionate de pentamidine, triméthoprime-sulfamétoxazole, chlorhydrate de vancomycine.
Comme pour toute perfusion, le respect d'une asepsie stricte lors de la manipulation est impératif.
Une dose individuelle à la concentration adaptée (24 mg/ml ou 12 mg/ml) à la voie d'administration (veine centrale ou périphérique) doit être préparée de façon aseptique avant l'administration.
La solution standard à 24 mg/ml peut être utilisée pure ou diluée en cas d'administration par voie intraveineuse dans une veine centrale (cathéter).
En cas de perfusion dans une veine périphérique, la solution à 24 mg/ml doit être diluée avant administration jusqu'à une concentration de 12 mg/ml à l'aide d'une solution à NaCl 0,9 % ou glucose à 5 %, afin d'éviter l'irritation locale des veines périphériques. La dilution et/ou l'élimination des quantités excédentaires doivent être réalisées dans des conditions d'asepsie. Les solutions diluées doivent être utilisées le plus rapidement possible après leur préparation.
La toxicité rénale du Foscavir peut être réduite par une hydratation adéquate du patient. Voir la section « Hydratation » ci-dessous.
En cas d'utilisation d'un système de perfusion en Y, perfuser simultanément 0,5 à 1 litre de NaCl 0,9 % ou de glucose à 5 %.
Ne pas administrer d’autres produits dans la même perfusion. Lorsque le produit est perfusé dans une voie périphérique, l’hydratation intraveineuse simultanée tient lieu de dilution (voir Hydratation).
Schéma d'un système de perfusion en Y
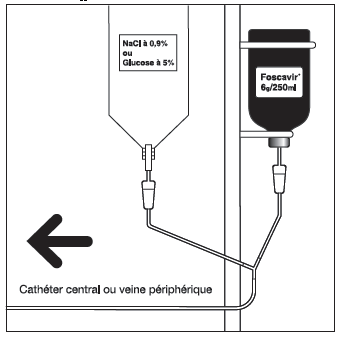
Hydratation :
L'attention est attirée sur l'importance de la prévention de la toxicité rénale du foscarnet par une hydratation convenable des patients.
En cas d'utilisation d'un système de perfusion en Y, il est recommandé de perfuser simultanément 0,5 à 1 litre de NaCl 0,9 % ou de glucose à 5 %. Chez les patients adéquats, l’hydratation orale avec régimes d’hydratation semblables a été employée. Les patients cliniquement déshydratés doivent avoir leur état corrigé avant de commencer la thérapie Foscavir.
Durées et conditions de conservation : Voir section 5 de la notice.
Précautions particulières d’élimination et de manipulation :
Le foscarnet ne contient pas de conservateurs.
Le contact accidentel du foscarnet sur la peau ou dans les yeux peut entraîner des irritations locales et des sensations de brûlures.
Il est recommandé dans ce cas de rincer à l'eau la partie du corps concernée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.