
ZEULIDE 3,75 mg, poudre et solvant pour suspension injectable à libération prolongée - Résumé des caractéristiques du produit |
 |
|
ANSM - Mis à jour le : 25/02/2025
ZEULIDE 3,75 mg, poudre et solvant pour suspension injectable à libération prolongée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Chaque flacon contient 3,75 mg d’acétate de leuproréline (équivalent à 3,57 mg de leuproréline sous forme de base libre).
1 mL de suspension reconstituée contient 1,875 mg d’acétate de leuproréline.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour suspension injectable à libération prolongée.
Poudre : poudre blanche à blanchâtre.
Solvant : solution limpide, incolore, exempt de particules visibles (pH 5,0 – 7,0).
4.1. Indications thérapeutiques 
ZEULIDE 3,75 mg est indiqué dans le traitement du cancer de la prostate hormono-dépendant à un stade avancé.
ZEULIDE 3,75 mg est indiqué dans le traitement du cancer de la prostate hormono-dépendant à un stade localement avancé, en association avec la radiothérapie.
ZEULIDE 3,75 mg est indiqué dans le traitement du cancer de la prostate hormono-dépendant localisé chez les patients à risque intermédiaire ou élevé, en association avec la radiothérapie.
Fibromes utérins
ZEULIDE 3,75 mg est indiqué dans le traitement du léiomyome utérin (fibrome utérin). Ce traitement peut être utilisé avant une chirurgie ou en complément d’une chirurgie, ou en tant qu’alternative définitive aux symptômes chez les femmes en péri-ménopause qui ne souhaitent pas d’intervention chirurgicale.
Endométriose
ZEULIDE 3,75 mg est indiqué dans le traitement de l’endométriose. Il peut être utilisé en tant que traitement unique ou en tant que complément à une chirurgie.
Cancer du sein
ZEULIDE 3,75 mg est indiqué dans le traitement des femmes pré- et péri-ménopausées souffrant d’un cancer du sein à un stade avancé se prêtant à une manipulation hormonale.
ZEULIDE 3,75 mg est indiqué en tant que traitement adjuvant, en association à du tamoxifène ou à un inhibiteur de l’aromatase, du cancer du sein à un stade précoce répondant à l’hormonothérapie chez les femmes pré- et péri-ménopausées à haut risque de récidive (âge jeune, tumeur de haut grade, envahissement ganglionnaire). Chez les femmes ayant reçu une chimiothérapie, le statut pré-ménopausique doit être confirmé avant la fin de la chimiothérapie.
Protection ovarienne
Préservation de la fonction ovarienne chez les femmes pré-ménopausées présentant une maladie néoplasique et recevant une chimiothérapie susceptible de provoquer une insuffisance ovarienne prématurée.
Puberté précoce centrale
ZEULIDE 3,75 mg est également indiqué dans le traitement des enfants présentant un diagnostic de puberté précoce centrale (PPC) confirmé par l’apparition de caractéristiques sexuelles secondaires avant l’âge de neuf ans chez les fillettes et dix ans chez les garçons.
4.2. Posologie et mode d'administration 
La dose de ZEULIDE 3,75 mg permettant la libération continue d'acétate de leuproréline pendant un mois est incorporée dans une formulation à effet retard.
La poudre lyophilisée doit être reconstituée et administrée en une unique injection intramusculaire chaque mois. L’administration par voie intra-artérielle ou intraveineuse doit être évitée. Le flacon de poudre de microsphères de ZEULIDE 3,75 mg doit être reconstitué immédiatement avant l’administration du médicament par injection intramusculaire. Comme pour tout autre médicament administré par injection, il est nécessaire de changer régulièrement le point d'injection.
Cancer de la prostate
La dose habituelle recommandée de ZEULIDE est de 3,75 mg en une injection à libération prolongée sur un mois et administrés en une injection intramusculaire une fois par mois.
La réponse au traitement par ZEULIDE 3,75 mg doit être contrôlée en mesurant régulièrement les taux sériques de testostérone et d’antigène prostatique spécifique (PSA). Des études cliniques ont montré que les taux de testostérone augmentent pendant les 4 premiers jours de traitement chez la majorité des patients non orchidectomisés. Ils diminuent ensuite atteignant des taux de castration au bout de 3 à 4 semaines. Une fois atteints, ces taux de castration (définis par un taux de testostérone inférieur ou égal à 0,5 ng/mL) se maintiennent tout au long du traitement.
Chez les patients ayant une réponse sous-optimale, il est conseillé de confirmer que les taux sériques de testostérone ont atteint ou se maintiennent aux taux de castration. Des augmentations transitoires des taux de phosphatase acide surviennent parfois en début de traitement mais reviennent généralement à des valeurs normales ou proches de la normale dès la 4e semaine de traitement.
Durée de traitement
En règle générale, le traitement du cancer de la prostate à un stade avancé par ZEULIDE 3,75 mg est un traitement à long terme ; le traitement ne doit pas être arrêté même en cas de rémission ou d'amélioration.
Des essais cliniques ont montré qu’une radiothérapie suivie d’un traitement par suppression androgénique de 3 ans est préférable à une radiothérapie suivie d’un traitement par suppression androgénique de 6 mois. Chez les patients atteints d'un cancer de la prostate hormono-dépendant localisé ou localement avancé à haut risque qui reçoivent une radiothérapie, la durée du traitement par suppression androgénique préconisée dans les recommandations médicales est de 2 à 3 ans.
Chez les patients atteints d’un cancer de la prostate localisé à risque intermédiaire, il est recommandé d'associer la radiothérapie à un traitement par suppression androgénique pour une durée de 4 à 6 mois.
Fibromes utérins et endométriose
La dose habituelle recommandée de ZEULIDE est de 3,75 mg en une injection à libération prolongée sur un mois et administrés en une injection intramusculaire une fois par mois pendant une période maximale de six mois.
Cancer du sein
La dose habituelle recommandée de ZEULIDE est de 3,75 mg en une injection à libération prolongée sur un mois et administrés en une injection intramusculaire une fois par mois en association avec du tamoxifène ou un inhibiteur de l’aromatase.
Chez les femmes recevant une chimiothérapie, la leuproréline peut être débutée après la fin de la chimiothérapie, une fois que le statut pré-ménopausique a été confirmé (voir rubrique 4.4).
La durée de traitement recommandée pour un traitement adjuvant en association avec une autre hormonothérapie est d’au maximum 5 ans.
En association avec un inhibiteur de l’aromatase :
Le traitement par leuproréline doit être instauré au minimum 6 à 8 semaines avant de commencer le traitement par l’inhibiteur de l’aromatase. Un minimum de deux injections (en respectant un intervalle de 1 mois entre les injections) doit être administré avant de débuter le traitement par l’inhibiteur de l’aromatase.
La suppression ovarienne doit être confirmée par de faibles concentrations sanguines de FSH et d’œstradiol avant de commencer l’inhibiteur de l’aromatase et ces concentrations doivent être à nouveau mesurées tous les trois mois pendant le traitement combiné par leuproréline et un inhibiteur de l’aromatase (voir rubrique 4.4).
Pendant le traitement par un inhibiteur de l’aromatase, la leuproréline ne doit pas être arrêtée afin d’éviter toute augmentation rebond des œstrogènes circulants chez les femmes pré-ménopausées.
Préservation de la fonction ovarienne
La dose habituelle recommandée de ZEULIDE est de 3,75 mg en une injection à libération prolongée sur un mois et administrés en une injection intramusculaire une fois par mois. Les patientes doivent recevoir cette dose deux semaines avant de commencer la chimiothérapie afin de permettre la suppression des taux d’hormones sexuelles, puis elles poursuivront avec une administration mensuelle de ZEULIDE 3,75 mg pendant toute la durée de la chimiothérapie.
Population pédiatrique
Le traitement des enfants par acétate de leuproréline doit se faire sous la supervision générale d’un pédiatre endocrinologue. Le schéma posologique doit être adapté au cas par cas.
La dose de départ recommandée dépend du poids corporel.
Enfants dont le poids corporel est ≥ 20 kg
La dose habituelle recommandée de ZEULIDE est de 3,75 mg d’acétate de leuproréline en une injection à libération prolongée sur un mois et administrés en une injection intramusculaire une fois par mois. La dose correspond à 2 ml de médicament reconstitué (c.-à-d. la dose entière du médicament [voir rubrique 6.6]).
Enfants dont le poids corporel est < 20 kg
Dans ces rares cas, la posologie suivante doit être administrée en fonction de l’activité clinique de la puberté précoce centrale : 1,88 mg d’acétate de leuproréline en une injection à libération prolongée sur un mois et administrés en une injection intramusculaire une fois par mois. La dose correspond à 1 ml de médicament reconstitué (voir rubrique 6.6). Le reste de la suspension doit être éliminé. La prise de poids de l’enfant doit être surveillée.
Selon l’activité de la puberté précoce centrale, il peut être nécessaire d’augmenter la posologie si la suppression est insuffisante (démontrée sur le plan clinique, par exemple, par un spotting ou une suppression inadéquate des gonadotrophines au test à la GnRH). La dose mensuelle minimale efficace à administrer doit être déterminée au moyen du test à la GnRH.
Il est recommandé d’utiliser le volume le plus faible possible pour les injections chez les enfants afin de réduire le désagrément associé à l’injection intramusculaire.
Des abcès stériles au site d’injection se produisent souvent lorsque de l’acétate de leuproréline est administré par voie intramusculaire à des doses plus élevées que celles recommandées. Dès lors, si cela devait survenir, il est possible de réduire l’absorption de l’acétate de leuproréline de l’injection à libération prolongée (voir rubrique 4.4).
La durée du traitement dépend des paramètres cliniques mesurés au début du traitement ou pendant le traitement (projection de la taille définitive, vitesse de croissance, âge osseux et/ou accélération de l’âge osseux) et sera décidée par le pédiatre traitant en concertation avec le tuteur légal et, le cas échéant, l’enfant traité. L’âge osseux doit être surveillé pendant le traitement selon des intervalles de 6 à 12 mois.
Chez les fillettes ayant la maturation osseuse d’un enfant de plus de 12 ans et chez les garçons ayant la maturation osseuse d’un enfant de plus de 13 ans, l’arrêt du traitement doit être envisagé en tenant compte des paramètres cliniques.
Chez les fillettes, une grossesse doit être exclue avant de démarrer le traitement. La survenue d’une grossesse pendant le traitement ne peut généralement être exclue. En pareil cas, il faut consulter un médecin.
Remarque : L’intervalle entre les administrations doit être de 30 ± 2 jours afin de prévenir la réapparition des symptômes de puberté précoce.
Populations particulières
Insuffisance rénale / hépatique
La pharmacocinétique de ZEULIDE 3,75 mg chez les patients atteints d’insuffisance hépatique ou rénale n’a pas été déterminée.
Population âgée
Comme pour les adultes.
Mode d’administration
ZEULIDE 3,75 mg doit être préparé, et administré uniquement par un professionnel de santé ayant pris connaissance des instructions relatives aux étapes de reconstitution et d’administration.
ZEULIDE 3,75 mg doit être administré uniquement par voie intramusculaire. Ne pas administrer par une autre voie. En cas d’administration sous-cutanée accidentelle, le patient doit être étroitement surveillé car aucune donnée n’est disponible concernant l’administration ZEULIDE 3,75 mg par d’autres voies que l’injection intramusculaire. Pour les instructions sur la reconstitution du médicament avant administration, voir la rubrique 6.6.
Concernant les hommes :
Orchidectomie antérieure.
ZEULIDE 3,75 mg ne doit pas être utilisé seul chez les patients ayant un cancer de la prostate et présentant des signes de compression de la moelle épinière ou de métastases spinales.
Concernant les femmes :
ZEULIDE 3,75 mg est contre-indiqué chez les femmes qui sont enceintes ou qui pourraient être enceintes alors qu’elles sont traitées par ce médicament.
ZEULIDE 3,75 mg est également contre-indiqué chez les femmes pendant l’allaitement (voir rubrique 4.6).
ZEULIDE 3,75 mg ne doit pas être administré aux patientes qui présentent des saignements vaginaux non diagnostiqués.
Dans le cas d’un cancer du sein chez des femmes pré- et péri-ménopausées : instauration de l’inhibiteur de l’aromatase avant obtention de la suppression ovarienne adéquate par leuproréline (voir rubriques 4.2 et 4.4).
Concernant les fillettes présentant une puberté précoce centrale
ZEULIDE 3,75 mg est contre-indiqué chez les fillettes qui présentent une puberté précoce centrale qui sont enceintes ou qui pourraient être enceintes alors qu’elles sont traitées par ce médicament.
ZEULIDE 3,75 mg est également contre-indiqué chez les fillettes pendant l’allaitement (voir rubrique 4.6).
ZEULIDE 3,75 mg ne doit pas être administré aux fillettes qui présentent une puberté précoce et ont des saignements vaginaux non diagnostiqués.
4.4. Mises en garde spéciales et précautions d'emploi 
Généralités
Des convulsions ont été rapportées suite à l’administration d’acétate de leuproréline. Ces cas ont été observés chez des patients ayant des antécédents de crises de convulsions, d’épilepsie, de troubles cérébrovasculaires, d’anomalies ou de tumeurs du système nerveux central et chez les patients prenant des traitements concomitants ayant été associés aux crises tels que le bupropion et les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS). Des convulsions ont également été rapportées chez des patients en cas d’absence d'une quelconque maladie mentionnée ci-dessus.
Il existe un risque accru d’épisode de dépression (pouvant être sévère) chez les patients sous traitement par agonistes de la GnRH, tels que l’acétate de leuproréline. Les patients doivent être informés en conséquence et convenablement traités si des symptômes apparaissent.
Le traitement doit être immédiatement interrompu si le patient présente un quelconque signe ou symptôme indiquant une anaphylaxie/une réaction anaphylactique (dyspnée, asthme, rhinite, œdème angioneurotique ou de la glotte, hypotension, urticaire, éruption cutanée, prurit ou pneumonie interstitielle). Les patients doivent être informés avant l’instauration du traitement, qu’en cas d’apparition de l’un des symptômes mentionnés précédemment, ils doivent arrêter le traitement et consulter leur médecin. Les patients ayant présenté une réaction d’hypersensibilité à la leuproréline doivent être étroitement surveillés et ne doivent pas reprendre ZEULIDE 3,75 mg.
Des cas de dysfonctionnement hépatique et de jaunisse accompagnés d’un taux élevé d’enzymes hépatiques ont été rapportés avec l’utilisation de l’acétate de leuproréline. Par conséquent, une surveillance étroite et les mesures appropriées doivent être mises en place si nécessaire.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par flacon, c’est-à-dire qu’il est essentiellement « sans sodium ».
Hypertension intracrânienne idiopathique
Des cas d’hypertension intracrânienne idiopathique (méningite séreuse) ont été rapportés chez des patients recevant de la leuproréline. Les patients doivent être avertis de la possibilité de signes et symptômes d’hypertension intracrânienne idiopathique, notamment des céphalées sévères ou récurrentes, de troubles visuels et d’acouphènes. En présence d’une hypertension intracrânienne idiopathique, l’interruption du traitement par leuproréline doit être envisagée.
Réactions indésirables cutanées sévères
Des réactions indésirables cutanées sévères (SCAR), dont le syndrome de Stevens-Johnson (SSJ), et la nécrolyse épidermique toxique (NET, ou syndrome de Lyell), qui peuvent engager le pronostic vital ou être fatals, ont été rapportés en association avec le traitement par leuproréline. Au moment de la prescription, les patients doivent être informés des signes et symptômes, et surveillés étroitement en cas de réactions cutanées graves. En cas d’apparition de signes et symptômes évocateurs de ces réactions, le traitement par leuproréline doit être arrêté immédiatement et un autre traitement doit être envisagé (le cas échéant).
Concernant les hommes
Lors des premières phases du traitement par ZEULIDE 3,75 mg, comme lors des traitements avec d’autres agonistes de la GnRH, une augmentation transitoire des taux de testostérone peut se produire. Dans certains cas, ceci peut être associé à une « poussée » ou à une exacerbation de la croissance tumorale qui se traduit par une aggravation temporaire des symptômes du cancer de la prostate. Ces symptômes se dissipent généralement en poursuivant le traitement (voir rubrique 4.8). La « poussée » peut parfois se manifester par des symptômes systémiques ou neurologiques (par ex. douleurs osseuses, etc.). De plus, des cas d’atrophie testiculaire et de gynécomastie ont été également décrits avec d’autres agonistes de la GnRH.
Chez les patients traités avec de l’acétate de leuproréline, des cas isolés d’obstruction urétérale (avec ou sans hématurie) et de compression de la moelle épinière ou de lésions métastatiques vertébrales ont été observés, pouvant entraîner une paralysie avec ou sans complications fatales. Les patients risquant de présenter une obstruction urétérale, une compression de la moelle épinière ou des lésions métastatiques vertébrales doivent être soigneusement examinés et étroitement surveillés durant les premières semaines du traitement. Un traitement prophylactique avec des antiandrogènes doit être envisagé pour ces patients.
Des complications urologiques ou neurologiques peuvent survenir, celles-ci doivent être traitées par des mesures spécifiques appropriées.
Une diminution de la densité osseuse a été rapportée dans la littérature médicale chez les hommes ayant subi une orchidectomie ou ayant été traités par un agoniste de la GnRH. L’ajout d’un antiandrogène au traitement peut réduire la perte osseuse mais augmente le risque d’autres effets indésirables tels que des problèmes de coagulation et des œdèmes. Lorsqu’un antiandrogène est utilisé sur une longue période, il convient d’apporter une attention particulière aux contre-indications et aux précautions associées à son utilisation prolongée. Les patients à risque ou avec des antécédents d’ostéoporose doivent être soigneusement examinés et étroitement surveillés pendant le traitement par acétate de leuproréline (voir rubrique 4.8).
La réponse au traitement par ZEULIDE 3,75 mg doit être surveillée en procédant à des examens cliniques et à l’analyse régulière des taux sériques de testostérone et du PSA.
Certains patients peuvent présenter des changements métaboliques (par ex. intolérance au glucose ou aggravation d’un diabète existant, stéatose hépatique), une hypertension, des changements de poids et des troubles cardiovasculaires. Comme attendu avec ce type de médicament, un développement ou une aggravation du diabète peut survenir et par conséquent, les patients diabétiques peuvent nécessiter une surveillance de la glycémie plus fréquente pendant le traitement par ZEULIDE 3,75 mg. Les patients à haut risque de présenter des maladies métaboliques ou cardiovasculaires doivent être soigneusement évalués avant de commencer le traitement et correctement surveillés pendant le traitement par privation androgénique. Le traitement par acétate de leuproréline entraîne une suppression du système hypophyso-gonadique. Les résultats des tests diagnostiques des fonctions de la gonadostimuline hypophysaire et des gonades effectués pendant et après le traitement par acétate de leuproréline peuvent être altérés.
Une augmentation du temps de prothrombine a été rapportée chez les patients traités avec de l’acétate de leuproréline.
L’acétate de leuproréline doit être utilisé avec précaution en cas de maladie cardiovasculaire (y compris l’insuffisance cardiaque congestive), de thromboembolie, d'œdème, de dépression et d’apoplexie hypophysaire.
L’acétate de leuproréline doit être utilisé avec précaution chez les patients présentant des troubles sanguins, une thrombocytopénie ou prenant un traitement anticoagulant.
Une thérapie par privation androgénique peut allonger l’intervalle QT
Chez les patients ayant des antécédents ou des facteurs de risque d’allongement de l’intervalle QT, de même que chez les patients traités en concomitance avec des substances connues pour allonger l’intervalle QT (voir rubrique 4.5), les médecins doivent évaluer le rapport bénéfices-risques, y compris la possibilité de torsades de pointe, avant d’instaurer un traitement par ZEULIDE 3,75 mg.
Concernant les femmes
Étant donné que les règles doivent normalement cesser lorsque l’on utilise des doses efficaces de ZEULIDE 3,75 mg, la patiente doit avertir son médecin si des règles régulières persistent.
Étant donné qu’une perte de la densité osseuses est attendue dans le cadre d’une ménopause naturelle, celle-ci devrait également être observée lors de l’induction médicale d’un état hypo-œstrogénique. Cette perte osseuse s’est révélée réversible après l’arrêt d’un traitement de six mois par acétate de leuproréline.
Pendant la première phase du traitement, les stéroïdes sexuels augmentent temporairement au-dessus des valeurs initiales en raison de l’effet physiologique du médicament. Il est dès lors possible d’observer une augmentation des signes et symptômes cliniques pendant les premiers jours de traitement, mais ceux-ci disparaissent lorsque le traitement est poursuivi aux doses adéquates. On a toutefois rapporté des saignements vaginaux abondants nécessitant une intervention médicale ou chirurgicale lors de la poursuite du traitement lorsque le médicament était utilisé pour le traitement de léiomyomes utérins sous-muqueux.
L’utilisation sûre de l’acétate de leuproréline pendant la grossesse n’a pas été établie cliniquement. Avant d’instaurer un traitement par acétate de leuproréline, il est conseillé de déterminer si la patiente est enceinte. La leuproréline n’est pas un contraceptif. Si une contraception est nécessaire, une méthode non hormonale doit être utilisée.
Cancer du sein
Afin de garantir une suppression ovarienne adéquate chez les femmes pré- et péri-ménopausées, le traitement par leuproréline doit être administré pendant au moins 6 à 8 semaines avant de débuter l’inhibiteur de l’aromatase, et les injections mensuelles de leuproréline doivent être administrées conformément au calendrier prévu et sans interruption pendant toute la durée du traitement par l’inhibiteur de l’aromatase.
Les femmes pré-ménopausées au moment du diagnostic du cancer du sein et qui deviennent aménorrhéiques après la chimiothérapie peuvent continuer ou non à produire des œstrogènes. Quel que soit leur statut menstruel, le statut pré-ménopausique doit être confirmé, après la chimiothérapie et avant de débuter la leuproréline, en s’assurant que les concentrations sanguines d’œstradiol et de FSH se situent dans les valeurs de référence pour les femmes pré-ménopausées, afin d’éviter tout traitement inutile par leuproréline chez une femme qui présenterait une ménopause chimio-induite.
Après avoir commencé la leuproréline, il est important de confirmer qu’il y a bien suppression ovarienne (ménopause induite par un analogue de la gonadotrophine) en réalisant des dosages sériés des taux circulants de FSH et d’œstradiol si ce sous-groupe de femmes entre en considération pour le traitement par un inhibiteur de l’aromatase selon les recommandations cliniques actuelles. Par conséquent, la suppression ovarienne doit être confirmée par la détermination de concentrations sanguines faibles de FSH et d’œstradiol avant le début du traitement par l’inhibiteur de l’aromatase et ces analyses doivent être répétées tous les trois mois pendant toute la durée du traitement combiné par la leuproréline et un inhibiteur de l’aromatase. Ceci, pour éviter toute augmentation rebond des taux circulants d’œstrogènes, induite par l’inhibiteur de l’aromatase et pouvant avoir des conséquences éventuelles pour le cancer du sein. Il est à noter que les taux circulants de FSH sont réduits en réponse à la suppression ovarienne induite par l’analogue de la gonadotrophine (ménopause induite), contrairement à ce qui se passe au cours de la ménopause naturelle, où les taux de FSH sont élevés.
Les patientes qui ont arrêté le traitement par leuproréline doivent également arrêter les inhibiteurs de l’aromatase dans le mois qui suit la dernière administration de leuproréline. Une attention particulière doit également être accordée aux informations de prescription des médicaments administrés conjointement, tels que les inhibiteurs de l’aromatase, le tamoxifène, les inhibiteurs de CDK4/6, pour toute information pertinente relative à la sécurité lorsque ces produits sont administrés avec la leuproréline.
Il convient d’évaluer la densité minérale osseuse avant d’instaurer le traitement par leuproréline, en particulier chez les femmes qui présentent d’autres facteurs de risque de l’ostéoporose. Aucune donnée spécifique n’est disponible concernant les patientes ayant une ostéoporose établie ou des facteurs de risque d’ostéoporose (p. ex., consommation abusive chronique d’alcool, fumeuses, traitement à long terme de médicaments qui réduisent la densité minérale osseuse, comme les anticonvulsivants ou les corticoïdes, antécédents familiaux d’ostéoporose, malnutrition, comme l’anorexie). Puisqu’une diminution de la densité minérale osseuse est susceptible d’être plus préjudiciable chez ces patientes, le traitement par leuproréline doit être envisagé au cas par cas et ne doit être instauré qu’après avoir soigneusement évalué les bénéfices du traitement par rapport au risque. Ces patientes doivent être surveillées étroitement et un traitement ou une prophylaxie de l’ostéoporose doit être instauré si nécessaire.
Lorsqu’un agoniste de la GnRH est utilisé conjointement à un inhibiteur de l’aromatase ou à du tamoxifène, le risque de troubles musculo-squelettiques (notamment des douleurs articulaires ou musculo-squelettiques) est d’environ 89% avec l’inhibiteur de l’aromatase et 76% avec le tamoxifène.
Une hypertension a été rapportée comme étant un effet indésirable ciblé, à une fréquence définie comme « très fréquente », en cas d’association d’un agoniste de la GnRH en association avec de l’exéméstane ou du tamoxifène.
Les femmes pré-ménopausées atteintes d’un cancer du sein et recevant un agoniste de la GnRH en association avec de l’exéméstane ou du tamoxifène doivent faire l’objet d’une surveillance régulière des facteurs de risque cardiovasculaires et de la pression sanguine.
Une hyperglycémie et un diabète ont été signalés en tant qu’effets indésirables ciblés, à une fréquence définie comme « fréquente », en cas d’association d’un agoniste de la GnRH en association avec de l’exéméstane ou du tamoxifène. Les femmes pré-ménopausées atteintes d’un cancer du sein et recevant un agoniste de la GnRH en association avec de l’exéméstane ou du tamoxifène doivent faire l’objet d’une surveillance régulière des facteurs de risque du diabète par le biais d’une surveillance régulière de la glycémie et l’instauration d’un traitement antidiabétique approprié, si nécessaire, conformément aux recommandations nationales.
Une dépression a été rapportée chez environ 50% des patientes traitées par un agoniste de la GnRH en association avec du tamoxifène ou de l’exéméstane, mais moins de 5% des patientes ont présenté une dépression sévère (grade 3-4). Les patientes doivent être informées en conséquence et traitées si des symptômes surviennent. Les patientes ayant une dépression connue ou des antécédents de dépression doivent faire l’objet d’une surveillance attentive pendant le traitement.
Le traitement des femmes pré-ménopausées atteintes d’un cancer du sein à un stade précoce répondant à l’hormonothérapie et traitées par leuproréline en association avec du tamoxifène ou un inhibiteur de l’aromatase doit se faire sur base d’une évaluation minutieuse des risques et des bénéfices.
Population pédiatrique
Avant d’instaurer le traitement, un diagnostic précis de la puberté précoce centrale idiopathique et/ou neurogène est nécessaire.
Il s’agit d’un traitement à long terme, qui est ajusté individuellement. ZEULIDE 3,75 mg doit être administré selon un calendrier le plus précis possible à intervalles mensuels réguliers. Le fait de retarder exceptionnellement la date d’injection de quelques jours (30 ± 2 jours) n’influence pas le résultat du traitement.
Dans le cas d’un abcès stérile au site d’injection (rapporté le plus fréquemment après l’injection IM d’une dose plus élevée que celle recommandée), il est possible que l’absorption d’acétate de leuproréline à libération prolongée soit réduite. Dans ce cas, les paramètres hormonaux (testostérone, œstradiol) doivent être contrôlés toutes les deux semaines (voir rubrique 4.2).
Le traitement des enfants qui présentent des tumeurs cérébrales évolutives doit se faire sur base d’une évaluation minutieuse des risques et des bénéfices.
Chez les fillettes, la survenue de saignements vaginaux, d’un spotting et de pertes vaginales après la première injection peut être le signe d’un retrait hormonal. Des saignements vaginaux survenant au-delà du premier/deuxième mois de traitement doivent être investigués.
La densité minérale osseuse (DMO) peut diminuer pendant un traitement de la puberté précoce par une GnRHa. Toutefois, à l’arrêt du traitement, la masse osseuse accumulée par la suite est maintenue et le pic de masse osseuse atteint à la fin de l’adolescence ne semble pas affecté par le traitement.
Une épiphysiolyse de la tête fémorale peut être observée après l’arrêt du traitement par la GnRHa. Il semblerait que les faibles taux d’œstrogènes induits au cours du traitement par des agonistes de la GnRH affaibliraient la plaque épiphysaire. L’augmentation de la vitesse de croissance à l’arrêt du traitement entraîne alors une diminution des forces de cisaillement nécessaires pour déplacer l’épiphyse.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Étant donné qu’une thérapie par privation androgénique peut allonger l’intervalle QT, l’utilisation concomitante de ZEULIDE 3,75 mg avec des médicaments connus pour allonger l’intervalle QT ou des produits capables d’induire une torsade de pointe, tels que les antiarythmiques de classe IA (ex : quinidine, disopyramide) ou de classe III (ex : amiodarone, sotalol, dofétilide, ibutilide), méthadone, moxifloxacine, antipsychotiques, etc. devra être soigneusement évaluée (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement 
Grossesse
ZEULIDE 3,75 mg est contre-indiqué chez les femmes qui sont enceintes ou pourraient devenir enceintes alors qu’elles reçoivent le médicament (voir rubrique 4.3, « Contre-indications »).
L'injection d’acétate de leuproréline peut avoir des effets néfastes sur le fœtus lorsqu’elle est administrée pendant la grossesse. Toute grossesse doit être exclue avant de débuter le traitement par ZEULIDE 3,75 mg. Un avortement spontané peut se produire si le médicament est administré pendant la grossesse.
On ignore si l’acétate de leuproréline est excrété dans le lait maternel. Par conséquent, ZEULIDE 3,75 mg ne doit pas être utilisé chez les femmes allaitantes. Voir rubrique 4.3, « Contre-indications ».
Fertilité
Les études menées chez l'animal ont mis en évidence que la leuproréline pouvait avoir des effets sur la fertilité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Les effets indésirables observés avec ZEULIDE 3,75 mg sont principalement dus à son action pharmacologique spécifique, c.-à-d. les augmentations et les diminutions des taux de certaines hormones.
Concernant les hommes
Sauf indication contraire, le profil de sécurité suivant de ZEULIDE 3,75 mg est basé sur les résultats d’un essai clinique de phase III dans lequel des patients atteints d’un cancer de la prostate ont été traités avec six doses intramusculaires de ZEULIDE 3,75 mg, une fois par mois, et suivis pendant une période de 26 semaines. La plupart des effets indésirables rapportés liés au traitement étaient ceux généralement associés aux traitements de suppression de la testostérone.
Les effets indésirables les plus fréquemment rapportés liés à ZEULIDE 3,75 mg incluent des bouffées de chaleur, une douleur au point d'injection, une irritation au point d'injection, des sueurs nocturnes et des céphalées.
Les effets indésirables suivants, rapportés lors d’études cliniques, ont été classés par système d’organes et par ordre décroissant de fréquence (très fréquents : ≥ 1/10 ; fréquents : ≥ 1/100 à < 1/10 ; peu fréquents : ≥ 1/1 000 à < 1/100 ; rares : ≥ 1/10 000 à < 1/1000 ; très rares : < 1/10 000 et fréquence indéterminée [ne peut être estimée sur la base des données disponibles]).
Tableau 1. Nombre et fréquence des effets indésirables pendant le traitement par ZEULIDE 3,75 mg chez l’homme.
|
Classe des systèmes d’organes |
Très fréquent |
Fréquent |
Peu fréquent |
Fréquence indéterminée |
|
Troubles du métabolisme et de la nutrition |
|
Augmentation de l’appétit |
Anorexie, hypercholestérolémie, hyperlipidémie |
|
|
Affections psychiatriques |
|
|
Troubles du sommeil, insomnie, baisse de la libido, sautes d'humeur et dépression* |
|
|
Affections du système nerveux |
|
Céphalée |
Somnolence |
Hypertension intracrânienne idiopathique (méningite séreuse) (voir rubrique 4.4) |
|
Affections de l'oreille et du labyrinthe |
|
|
Vertiges |
|
|
Affections vasculaires |
Bouffées de chaleur |
|
|
|
|
Affections gastro-intestinales |
|
|
Douleur dans le bas-ventre, diarrhées, nausées, vomissements |
|
|
Affections hépatobiliaires |
|
|
Hyperbilirubinémie |
|
|
Affections de la peau et du tissu sous-cutané |
|
Hyperhidrose, sueurs nocturnes, sueurs froides |
Œdème périorbital, urticaire, prurit |
Syndrome de Stevens-Johnson (SSJ) /nécrolyse épidermique toxique (NET ou syndrome de Lyell) (voir rubrique 4.4), éruption cutanée toxique, érythème polymorphe |
|
Affections musculo-squelettiques et systémiques |
|
Douleur dorsale |
Arthralgie, spasmes musculaires, douleur dans les extrémités |
|
|
Affections du rein et des voies urinaires |
|
|
Rétention urinaire, incontinence urinaire, pollakiurie |
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|
|
Pneumopathie interstitielle |
|
Affections des organes de reproduction et du sein |
|
Dysfonctionnement érectile |
Gonflement de la poitrine, poitrine sensible, absence d’éjaculation |
|
|
Affections cardiovasculaires |
|
|
|
Allongement de l’intervalle QT (voir rubriques 4.4 et 4.5) |
|
Troubles généraux et anomalies au point d'administration |
|
Fatigue, asthénie, pyrexie, effets indésirables locaux (voir tableau 2) |
Faiblesse, sensation de chaud et froid, sensation de nervosité |
|
|
Investigations |
|
|
Augmentation de l’aspartate amino transférase, augmentation de l’alanine amino transférase, augmentation de la bilirubine, augmentation de la gamma glutamyl transférase |
|
*Lors d’une étude post-commercialisation, les sautes d’humeur et la dépression étaient des réactions fréquentes chez les utilisateurs à long terme du médicament.
En termes de gravité, 98 % de l’ensemble des effets indésirables liés au traitement étaient légers ou modérés. Quatre-vingt-neuf pour cent (89 %) des bouffées de chaleur rapportées étaient légères et neuf pour cent (9 %) étaient modérées. Deux cas de bouffées de chaleur (0,2 %) rapportées étaient graves.
Un total de 35 effets indésirables locaux au point d’injection ont été signalés chez 29 patients (18,1 %) au cours de l’étude.
Les effets indésirables locaux suite à l’administration de ZEULIDE 3,75 mg sont ceux généralement rapportés avec d'autres médicaments similaires administrés par injection intramusculaire. Les douleurs, irritations, gênes, contusions et érythèmes au point d'injection sont les effets indésirables qui ont été rapportés le plus fréquemment. Des effets peu fréquents étaient une réaction au point d’injection, un gonflement, une lésion et une hémorragie (Tableau 2).
Tableau 2. Fréquence des patients présentant des effets indésirables locaux pendant le traitement par ZEULIDE 3,75 mg
|
CSO primaire* Terme préférentiel : Troubles généraux et anomalies au point d'administration |
Patients avec des effets indésirables locaux associés |
|
% |
|
|
Fréquent |
|
|
Douleur au point d’injection |
8,1 |
|
Irritation au point d’injection |
4,4 |
|
Gêne au point d’injection |
1,9 |
|
Érythème au point d’injection |
1,3 |
|
Contusions au point d’injection |
1,3 |
|
|
|
|
Peu fréquents |
|
|
Réaction au point d’injection |
0,6 |
|
Gonflement au point d’injection |
0,6 |
|
Lésion au point d’injection |
0,6 |
|
Hémorragie au point d’injection |
0,6 |
*Les sujets peuvent entrer dans plusieurs catégories ; EIL : effets indésirables locaux ; CSO : classe des systèmes d’organes.
En cas d’administrations répétées de ZEULIDE 3.75 mg, des gonflements (0,6 %), douleurs (0,6 %), contusions (0,6 %) et irritations (0,6 %) ont été rapportés comme étant des effets indésirables locaux récurrents. Ces évènements ont tous été rapportés comme non graves et légers. Aucun patient n’a arrêté le traitement à cause d’évènements indésirables locaux.
Dans un essai clinique de phase I (CRO-02-43) mené chez des sujets sains recevant une dose unique de Leuprolide Depot GP-Pharm 7,5 mg, un seul cas d’induration au point d’injection a été rapporté.
D’autres évènements indésirables ayant été rapportés avec le traitement par acétate de leuproréline incluent l’impuissance, une diminution de la libido (deux conséquences pharmacologiques de la privation de testostérone), un œdème périphérique, une embolie pulmonaire, des palpitations, une myalgie, une faiblesse musculaire, des frissons, une dyspnée, des vertiges périphériques, une éruption cutanée, une amnésie, des troubles de la vision et une sensibilité cutanée. L’infarctus d’un adénome hypophysaire existant a rarement été rapporté suite à l’administration des agonistes de la GnRH à action de longue durée et de courte durée. De rares cas de thrombopénie et de leucopénie ont été rapportés. Des variations de la tolérance au glucose ont été rapportées.
Concernant les femmes
Des cas de thromboembolie veineuse et artérielle grave ont été rapportés, dont des cas de thrombose veineuse profonde, d’embolie pulmonaire, d’infarctus du myocarde, d’accident vasculaire cérébral et d’accident ischémique transitoire. Bien qu’une relation temporelle ait été avancée dans certains cas, la plupart de ces événements étaient associés à des facteurs de risque ou à l’utilisation d’un médicament concomitant. On ignore s’il existe une relation de cause à effet entre l’utilisation d’un agoniste de la GnRH et ces événements.
Les effets indésirables les plus fréquents que l’on observe avec la leuproréline sont associés à une hypo-œstrogénie. Les plus fréquents sont les bouffées de chaleur, les sautes d’humeur, y compris la dépression (occasionnellement sévère) et la sécheresse vaginale. Le taux d’œstrogène revient à la normale lorsque le traitement est arrêté.
Cet état d’hypo-œstrogénie induit une faible perte de la densité osseuse pendant le traitement, dont une partie peut ne pas être réversible (voir rubrique 4.4).
Modifications de la densité minérale osseuse : au cours d’études cliniques contrôlées, des patientes atteintes d’endométriose (six mois de traitement) ou de fibromes utérins (trois mois de traitement) ont été traitées par leuprolide 3,75 mg à libération prolongée. Chez les patientes atteintes d’endométriose, la densité osseuse vertébrale, mesurée par absorptiométrie à rayon X à double énergie (DXA), avait diminué en moyenne de 3,9% à six mois par comparaison aux valeurs relevées avant le traitement. Chez ces patientes qui ont été examinées 6 ou 12 mois après l’arrêt du traitement, la densité minérale osseuse moyenne est revenue aux valeurs initiales dans une proportion de 2%. Lorsque le leuprolide 3,75 mg à libération prolongée a été administré pendant trois mois aux patientes atteintes de fibromes utérins, la densité minérale osseuse de l’os trabéculaire vertébral, évaluée par radiographie numérique quantitative (QDR), a révélé une réduction moyenne de 2,7% par rapport aux valeurs initiales. Six mois après l’arrêt du traitement, on a observé une tendance à la récupération.
Le tableau ci-dessous décrit les effets indésirables associés à la leuproréline observés sur base de l’expérience des essais cliniques menés auprès de patientes atteintes de fibromes utérins, d’endométriose, d’un cancer du sein ou chez lesquelles une protection ovarienne était recherchée, ainsi que sur base de l’expérience post-marketing. Les effets indésirables sont regroupés par système de classe d’organe et de fréquence. Les fréquences sont définies comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimé sur la base des données disponibles).
Tableau 3. Nombre et fréquence des effets indésirables pendant le traitement par acétate de leuproréline 3,75 mg chez la femme.
|
Classe des systèmes d’organes |
Très fréquent |
Fréquent |
Peu fréquent |
Très rare |
Fréquence indéterminée |
|
Affections hématologiques et du système lymphatique |
|
|
|
|
Anémie (rapportée pour les médicaments de cette classe), thrombocytopénie, leucopénie |
|
Affections du système immunitaire |
|
|
|
|
Réaction d’hypersensibilité (y compris éruption, prurit, urticaire et, rarement, respiration sifflante, pneumopathie inflammatoire, réactions anaphylactiques) |
|
Troubles du métabolisme et de la nutrition |
|
Fluctuation de poids |
Diminution de l’appétit, lipides anormaux |
|
Tolérance au glucose anormale pouvant influencer le contrôle du diabète |
|
Affections psychiatriques |
Insomnie |
Modification de l’humeur, dépression (voir rubrique 4.4) |
|
|
|
|
Affections du système nerveux |
Céphalées (occasionnellement sévères) |
Paresthésie, étourdissements |
|
Une hémorragie de l’hypophyse a été rapportée après l’administration initiale chez des patients atteints d’un adénome hypophysaire |
Paralysie (voir rubrique 4.4), crises convulsives Hypertension intracrânienne idiopathique (méningite séreuse) (voir rubrique 4.4) |
|
Affections oculaires |
|
|
Troubles de la vue |
|
|
|
Affections cardiaques |
|
|
Palpitations |
|
|
|
Affections vasculaires |
Bouffées de chaleur |
|
|
|
Embolie pulmonaire, hypertension, hypotension (voir rubrique 4.4) |
|
Affections gastro-intestinales |
|
Nausées |
Diarrhée, vomissements |
|
|
|
Affections hépatobiliaires |
|
|
Résultats anormaux aux tests de la function hépatique (généralement transitoires) |
|
Fonction hépatique anormale, jaunisse |
|
Affections de la peau et du tissu sous-cutané |
|
|
Perte de cheveux |
|
Syndrome de Stevens-Johnson (SSJ) /nécrolyse épidermique toxique (NET ou syndrome de Lyell) (voir rubrique 4.4), éruption cutanée toxique, érythème polymorphe |
|
Affections musculo-squelettiques et systémiques |
|
Arthralgie, faiblesse musculaire |
Myalgie |
|
Fracture de la colonne vertébrale (voir rubrique 4.4), réduction de la masse osseuse pouvant se produire lors de l’utilisation d’agonistes de la GnRH |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
|
|
Pneumopathie interstitielle |
|
Affections des organes de reproduction et du sein |
|
Sensibilité mammaire, atrophie des seins, sécheresse vulvovaginale |
|
|
Hémorragie vaginale |
|
Troubles généraux et anomalies au site d'administration |
|
Œdème périphérique, réactions indésirables locales (voir tableau 2)* |
Pyrexie, fatigue |
|
|
* Sur base d’une étude clinique menée avec ZEULIDE 3,75 mg auprès de patients atteints d’un cancer de la prostate
Chez les femmes atteintes d’un cancer du sein à un stade précoce et traitées par un agoniste de la GnRH en association avec du tamoxifène ou un inhibiteur de l’aromatase, les effets indésirables les plus fréquemment observés étaient les bouffées de chaleur, les affections musculo-squelettiques, la fatigue, l’insomnie, l’hyperhydrose, la sécheresse vulvovaginale et la dépression.
Population pédiatrique
Dans la phase initiale du traitement, on observe une augmentation à court terme, semblable à une flambée, du taux d’hormones sexuelles, suivie d’un retour aux valeurs concordant avec la période pré-pubère. En raison de cet effet pharmacologique, des effets indésirables peuvent survenir en particulier au début du traitement.
Les effets indésirables suivants, observés lors des investigations cliniques, ont été classés ci-dessous par système de classe d’organe et par ordre décroissant de fréquence (très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimé sur la base des données disponibles).
Tableau 4. Nombre et fréquence des effets indésirables pendant le traitement par acétate de leuproréline 3,75 mg chez l’enfant.
|
Classe des systèmes d’organes |
Fréquent |
Très rare |
Fréquence indéterminée |
|
|
Affections psychiatriques |
Labilité émotionnelle |
|
|
|
|
Affections du système nerveux |
Céphalées |
Comme pour d’autres médicaments de cette classe, de très rares cas d’apoplexie hypophysaire ont été rapportés après l’administration initiale chez des patients atteints d’un adénome hypophysaire. |
Crises convulsives Hypertension intracrânienne idiopathique (méningite séreuse) (voir rubrique 4.4) |
|
|
Affections gastro-intestinales |
Douleurs abdominales / crampes abdominales, nausées/vomissements |
|
|
|
|
Affections de la peau et du tissu sous-cutané |
Acné |
|
Syndrome de Stevens-Johnson (SSJ) /nécrolyse épidermique toxique (NET ou syndrome de Lyell) (voir rubrique 4.4), éruption cutanée toxique, érythème polymorphe |
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Pneumopathie interstitielle |
|
|
Affections des organes de reproduction et du sein |
Saignements vaginaux, spotting, pertes vaginales** |
|
|
|
|
Troubles généraux et anomalies au point d'administration |
Réactions au site d’injection* |
|
|
|
|
Maladies et symptômes du système immunitaire |
|
Réactions allergiques générales (fièvre, éruption, p. ex., démangeaisons, réactions anaphylactiques) |
|
* Sur base d’une étude clinique menée avec ZEULIDE 3,75 mg auprès de patients atteints d’un cancer de la prostate
** En général, la survenue d’un spotting lors de la poursuite du traitement (après une éventuelle hémorragie de privation au cours du premier mois de traitement) doit être interprétée comme étant le signe d’un potentiel sous-dosage. La freination hypophysaire doit être déterminée par un test à la GnRH.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Il n’y a aucune expérience clinique des effets d’un surdosage significatif de ZEULIDE 3,75 mg ou d’acétate de leuproréline. Lors d’essais cliniques dans lesquels de l’acétate de leuproréline était administré quotidiennement en injection sous-cutanée chez des patients atteints d’un cancer de la prostate, des doses atteignant 20 mg/jour pendant deux ans n’ont causé aucun effet indésirable en dehors de ceux observés avec une dose de 1 mg/jour.
Dans des études menées sur des animaux, des doses allant jusqu’à 500 fois la dose humaine recommandée ont provoqué une dyspnée, une baisse de l’activité et une irritation locale au point d’injection. En cas de surdosage, le patient doit être étroitement surveillé et sera traité de façon symptomatique.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Mécanisme d’action
L’acétate de leuproréline est inactif lorsqu’il est administré par voie orale en raison de sa faible perméabilité membranaire et son inactivation presque complète par les enzymes protéolytiques de l’intestin.
L’acétate de leuproréline possède de puissantes propriétés d’agoniste de la GnRH lorsqu’il est administré sur une courte durée et de manière intermittente ; cependant, lorsqu’il est administré sur une longue durée en continu, les analogues de la GnRH, induisent l’inhibition de la sécrétion de gonadotrophine et la suppression de la stéroïdogenèse testiculaire et ovarienne. L’effet est réversible à l’arrêt du traitement.
Effets pharmacodynamiques
Lorsqu’il se lie aux récepteurs hypophysaires de la GnRH, l’acétate de leuproréline induit d’abord une augmentation des concentrations sériques de l’hormone lutéinisante (LH) et de l’hormone folliculostimulante (FSH), tant chez l’homme que chez la femme. Chez l’homme, le taux de testostérone augmente tout d’abord en réponse à la libération précoce de la LH, puis chute à des taux correspondant au taux de castration en l’espace de 2 à 4 semaines. Chez les femmes pré-ménopausées, le taux d’œstradiol diminue à un taux correspondant à celui observé chez les femmes post-ménopausées dans le mois suivant l’instauration du traitement.
Efficacité et sécurité cliniques
Concernant les hommes
Lors d’une étude clinique ouverte, multicentrique, à dose multiple portant sur ZEULIDE 3,75 mg, 160 patients atteints d’un cancer de la prostate et n’ayant pas d’antécédents de traitement systémique ou d’hormonothérapie pour traiter le cancer de la prostate, de chirurgie de la prostate ou d’orchidectomie, ont été recrutés.
Les objectifs étaient de déterminer l’efficacité et la sécurité de ZEULIDE 3,75 mg lorsqu’il est administré à des patients atteints d’un cancer de la prostate qui pourraient bénéficier d'un traitement par privation androgénique. ZEULIDE 3,75 mg a été administré par voie intramusculaire à raison d’une dose par mois pendant 6 mois.
Les taux de testostérone étaient surveillés à plusieurs intervalles pendant 168 jours. Comme attendu, après la première injection les taux moyens de testostérone ont rapidement augmenté par rapport aux taux de départ (4,119 ±1,341 ng/mL), et ont atteint des pics (Cmax) de 6,598 ±2,249 ng/mL dès le troisième jour. Après cette augmentation, les taux de testostérone ont chuté, et le 21e jour, 78,7 % des patients évaluables ont atteint la castration médicale (définie par un taux de testostérone inférieur à 0,5 ng/mL). Le 28e jour, 96,8 % des patients ont atteint des taux correspondant à la castration et 73,1 % ont atteint des taux ≤ 0,2 ng/mL (Figure 1).
Figure 1. Taux plasmatiques moyens de testostérone (±écart type) pendant le traitement administré à raison d’une injection IM par mois de ZEULIDE 3,75 mg 3,75 mg pendant six mois
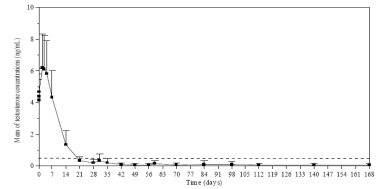
Les critères d’efficacité secondaires incluaient la détermination des concentrations sériques de LH, FSH et de PSA. Le 14e jour et 4 jours après la première injection de ZEULIDE 3,75 mg, les concentrations sériques moyennes de LH et de FSH avaient atteint un niveau inférieur à celui des concentrations basales. Les concentrations étaient restées largement en dessous des valeurs de départ du 28 e jour jusqu’à la fin de l’étude. Pendant le traitement, les taux sériques moyens de PSA ont graduellement diminué (premier mois) puis sont restés constamment en dessous du taux basal jusqu'à la fin de l'étude. Cependant, une variation importante entre les individus en termes de concentrations de PSA a été observée tout au long de l’étude.
La fréquence des réponses « acute-on-chronic » a été de 10,5 % et la fréquence de l’échappement testostérone a été de 11,8 %. Aucun événement indésirable lié au médicament indiquant une augmentation du taux de testostérone (rétention urinaire, compression de la moelle épinière ou exacerbation de la douleur osseuse) n’a été rapportée chez les patients présentant un échappement de testostérone.
L'essai RTOG 85-31 a démontré l’intérêt de l’association hormono-radiothérapie chez les patients atteints d'un cancer de la prostate à un stade localement avancé. Cette étude a inclus 977 patients atteints d'un cancer de la prostate localement avancé de stade T1-T3 avec atteinte des ganglions lymphatiques ou cancer étendu hors de la prostate et/ou aux vésicules séminales, dont 488 ont suivi un traitement par suppression androgénique prolongé avec de la goséréline en association avec une radiothérapie et 489 une radiothérapie seule. Les résultats ont montré que l’adjonction d’une hormonothérapie à l’irradiation améliorait significativement la survie sans progression à 10 ans (37 % contre 23 % (p < 0,001) dans le groupe radiothérapie seule). Par ailleurs, la survie sans progression avec une valeur de PSA < 1,5 ng/ml était de 31 % dans le groupe hormono-radiothérapie contre 9 % dans le groupe radiothérapie seule ; une récidive locale est survenue chez 23 % contre 38 % des patients (p < 0,0001) et la progression avec métastases est survenue chez 24 % contre 39 % des patients (p < 0,0001). La survie globale était de 49 % contre 39 % (p = 0,002) et le taux de mortalité lié à la maladie de 16 % contre 22 % (p = 0,0052).
Les arguments étayant l’indication dans le cancer de la prostate localisé à haut risque sont basés sur des études publiées relatives à l’association de la radiothérapie et d’analogues de la GnRH, dont l’acétate de leuproréline. Les données cliniques de cinq études publiées ont été analysées (EORTC 22863, RTOG 85-31, RTOG 92-02, RTOG 8610 et D’Amico et al., JAMA, 2004), elles démontrent toutes un bénéfice de l’association d’un analogue de la GnRH avec la radiothérapie. Il n’était pas possible de distinguer clairement dans les études publiées les populations étudiées respectives pour les indications dans le cancer de la prostate localement avancé et dans le cancer de la prostate localisé à haut risque.
L'étude RTOG 94-08 a quant à elle démontré la supériorité de l'association de la radiothérapie avec une hormonothérapie par suppression androgénique par rapport à la radiothérapie seule chez les patients atteints d'un cancer de la prostate localisé avec un profil de risque intermédiaire. Cet essai clinique randomisé de phase III a été mené chez des patients atteints d'un cancer de la prostate localisé de stade T1b, T1c, T2a ou T2b et présentant un taux de PSA ≤ 10 ng/ml. Le sous-groupe de patients à risque intermédiaire (défini par un score de Gleason 6 associé à un taux de PSA compris entre > 10 ng/ml et 20 ng/ml ou un stade T2b) comprenait un groupe de 524 patients ayant reçu un traitement par suppression androgénique de courte durée (avec de l'acétate de leuproréline ou de la goséréline) pendant 4 mois (2 mois avant et 2 mois en association avec la radiothérapie) et un groupe de 544 patients ayant reçu une radiothérapie seule. La survie globale après 10 ans était de 61 % dans le groupe hormono-radiothérapie contre 54 % dans le groupe radiothérapie seule (hazard ratio 1,23, 95 % CI [1,02-1,49 ; p = 0,03]) ; le taux de mortalité lié à la maladie était de 3 % contre 10 % (hazard ratio 2,49, 95 % CI [1,50-4,11 ; p = 0,004]) et la progression biochimique était de 28 % contre 45 % (hazard ratio 1,79, 95 % CI [1,45-2,21 ; p < 0,001]).
Concernant les femmes
Préservation de la fonction ovarienne :
Dans six études observationnelles, l’administration mensuelle de leuproréline pendant une chimiothérapie s’est révélée avoir un effet protecteur (évalué par des mesures cliniques et les symptômes d’une insuffisance ovarienne précoce) sur la fonction ovarienne ultérieure. Dans une étude prospective, randomisée et contrôlée, menée auprès de jeunes femmes pré-ménopausées présentant un cancer du sein positif aux récepteurs hormonaux (RH) et négatif aux RH, sous chimiothérapie, un traitement mensuel par leuproréline, a réduit le risque de développer une insuffisance ovarienne prématurée.
Population pédiatrique
Il se produit un freinage réversible de la libération des gonadotrophines hypophysaires, suivi d’une diminution des taux d’œstradiol (E2) ou de la testostérone qui atteignent des valeurs concordant avec la phase pré-pubère.
La stimulation gonadique initiale (flambée) peut provoquer des saignements vaginaux chez les fillettes qui ont déjà eu leurs premières règles à l’instauration du traitement. Une hémorragie de privation peut survenir au début du traitement. Les saignements cessent normalement en poursuivant le traitement. Les effets thérapeutiques suivants peuvent être démontrés :
· Freinage des taux des gonadotrophines basales et stimulées jusqu’à des taux pré-pubères ;
· Freinage des taux d’hormones sexuelles prématurément élevés jusqu’à des taux pré-pubères et l’arrêt des menstruations prématurées ;
· Arrêt/involution du développement pubère somatique (stades de Tanner) ;
· Amélioration/normalisation du rapport âge chronologique/âge osseux ;
· Prévention de l’accélération progressive de l’âge osseux ;
· Réduction de la vitesse de croissance et normalisation de celle-ci ;
· Augmentation de la taille définitive.
Le traitement entraîne la suppression de l’axe hypothalamus-hypophyse-gonades prématurément activé de manière pathologique en fonction de l’âge pré-pubère.
Dans une étude clinique à long terme menée auprès d’enfants recevant de la leuproréline à des doses allant jusqu’à 15 mg par mois pendant > 4 ans, une reprise des signes de la puberté a été observée après l’arrêt du traitement. Le suivi de 20 fillettes jusqu’à l’âge adulte a démontré que 80% d’entre elles avaient des cycles menstruels normaux et que 7 d’entre elles ont eu 12 grossesses. Parmi ces 7 femmes, 4 ont eu des grossesses multiples.
5.2. Propriétés pharmacocinétiques 
Absorption
Après trois injections de ZEULIDE 3,75 mg, à raison d’une injection par mois, sur un échantillon de patients atteints de cancer de la prostate (N=12), le pic de concentration plasmatique d’acétate de leuproréline était le même pour les trois cycles. Après la première administration (0 au 28e jour), la Cmax était de 13 145,6 ±3 070,6 pg/mL. Le délai médian pour atteindre la Cmax (Tmax) était de 0,04 jours, correspondant à 0,96 h (plage de 0,96 – 4,08 h).
Distribution
Aucune étude de distribution du médicament n’a été réalisée avec ZEULIDE 3,75 mg. Cependant, chez des volontaires sains de sexe masculin, le volume moyen de distribution de l’acétate de leuproréline à l'état d'équilibre après une administration intraveineuse en bolus de 1,0 mg était de 27 L. In vitro, la liaison aux protéines plasmatiques humaines varie entre 43 % et 49 %.
Biotransformation
Aucune étude du métabolisme du médicament n’a été réalisée avec ZEULIDE 3,75 mg. Cependant, chez des volontaires de sexe masculin sains, l'administration intraveineuse en bolus de 1 mg d’acétate de leuproréline a entraîné une clairance systémique moyenne de 7,6 L/h, avec une demi-vie d’élimination terminale d’environ 3 heures selon un modèle à deux compartiments.
La leuproréline devrait être métabolisée en peptides inactifs plus petits pouvant être excrétés ou catabolisés ultérieurement.
Élimination
Aucune étude d’excrétion du médicament n’a été réalisée avec ZEULIDE 3,75 mg. Cependant, suite à l’administration d’acétate de leuproréline chez 3 patients, moins de 5 % de la dose a été récupérée sous forme de substance mère et de métabolite M-I dans l’urine.
Populations particulières
Insuffisance rénale/hépatique
La pharmacocinétique du médicament chez les patients atteints d’insuffisance hépatique et rénale n’a pas été déterminée.
5.3. Données de sécurité préclinique 
Comme attendu aux vues des propriétés pharmacologiques connues, les études non cliniques ont montré des effets réversibles sur le système de reproduction. Dans les études de toxicité pour la reproduction, l'acétate de leuproréline n’a présenté aucune tératogénicité. Cependant, une embryotoxicité/létalité a été observée chez le lapin.
Des études de cancérogénicité réalisées chez le rat avec l’acétate de leuproréline administré par voie sous-cutanée (0,6 à 4 mg/kg/jour), ont montré une augmentation dose-dépendante des adénomes hypophysaires. De plus, une augmentation significative mais non dose-dépendante des adénomes Langerhansiens du pancréas chez la femelle et des adénomes des cellules interstitielles testiculaires chez le mâle a été observée, en regardant l’incidence la plus élevée dans le groupe recevant de faibles doses. L’administration d’acétate de leuproréline a entraîné l’inhibition de la croissance de certaines tumeurs hormonodépendantes (tumeurs prostatiques chez des rats Noble et Dunning et tumeurs mammaires induites par le DMBA chez des rats femelles). Aucun effet semblable n’a été observé dans les études de cancérogénicité réalisées chez la souris. Aucune étude de cancérogénicité n’a été réalisée avec ZEULIDE 3,75 mg.
L'acétate de leuproréline ne s’est pas révélé mutagène lors de tests réalisés in vitro et in vivo. Aucune étude de mutagénicité n’a été réalisée avec ZEULIDE 3,75 mg.
Excipients du lyophilisat (flacon) :
Polysorbate 80
Mannitol (E421)
Carmellose sodique (E466)
Citrate de triéthyle
Polymère d'acide D,L-lactique et d'acide glycolique (PLGA)
Excipients du solvant (seringue préremplie) :
Mannitol (E421)
Hydroxyde de sodium (pour ajustement du pH)
Acide chlorhydrique (pour ajustement du pH)
Eau pour préparations injectables
Aucun solvant autre que le solvant stérile fourni pour ZEULIDE 3,75 mg ne peut être utilisé pour la reconstitution de la poudre de ZEULIDE 3,75 mg.
Une fois reconstitué avec le solvant, la suspension doit être administrée immédiatement.
6.4. Précautions particulières de conservation 
A conserver à une température ne dépassant pas 25°C. Ne pas congeler.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur 
· Un (1) flacon en verre de type I contenant 3,75 mg d'acétate de leuproréline sous forme de poudre lyophilisée, scellé à l'aide d'une capsule en élastomère et d'un bouchon en aluminium muni d'un capuchon amovible en plastique
· Une (1) seringue préremplie en verre de type I contenant 2 mL de solvant, munie d’un capuchon en élastomère.
· Un (1) adaptateur en polycarbonate / PEHD incluant une (1) aiguille stérile de calibre 20 gauge.
6.6. Précautions particulières d’élimination et de manipulation 
Mode d'administration
Le flacon de ZEULIDE 3,75 mg doit être reconstitué immédiatement avant l’administration du médicament par une unique injection intramusculaire. Assurez-vous d'employer une technique aseptique.
La solution reconstituée est une suspension d’aspect laiteux, de couleur blanche.
Utilisez le solvant inclus dans le kit du produit. Aucun autre solvant ne peut être utilisé pour la reconstitution de ZEULIDE 3,75 mg.
Ce médicament est destiné à une seule injection. Toute solution restante non utilisée doit être éliminée.
Reconstituer ZEULIDE 3,75 mg conformément aux instructions suivantes. Lisez attentivement avant d'administrer le produit:
|
1 |
|
Retirer complètement la capsule du dessus du flacon pour faire apparaître le bouchon en caoutchouc. Vérifier qu'aucun morceau de la capsule ne reste sur le flacon. |
|
2 |
|
Placer le flacon verticalement sur une table. Retirer l'opercule de la plaquette contenant l'adaptateur pour flacon (MIXJECT). Ne pas retirer l'adaptateur pour flacon de la plaquette. Placer fermement la plaquette contenant l'adaptateur pour flacon sur le dessus du flacon et percer le flacon en position totalement verticale. Appuyer délicatement jusqu'à sentir que l'adaptateur est enclenché.
|
|
3 |
|
Apposez l’agrippoir ‑blanc sur la seringue jusqu’à ce qu’il s’enclenche. Dévissez le capuchon en caoutchouc de la seringue dans le sens inverse des aiguilles d’une montre. Puis enlevez l’emballage-coque du MIXJECT.
|
|
4 |
|
Attachez la seringue à l’adaptateur du flacon en la vissant dans le sens des aiguilles d’une montre dans l’ouverture sur le côté de l’adaptateur du flacon. Faire doucement tourner la seringue au maximum pour garantir une connexion étroite.
|
|
5 |
|
Tout en maintenant la seringue et le flacon bien attachés en position droite, appuyez doucement sur le piston pour transvaser tout le diluant dans le flacon.
|
|
6 |
|
La seringue toujours raccordée au flacon, secouez doucement le flacon pendant environ une minute jusqu’à obtenir une suspension uniforme d’un blanc laiteux. Pour éviter la séparation de la suspension, procédez aux étapes suivantes sans attendre.
|
|
7 |
|
Retournez le système MIXJECT de manière à ce que le flacon soit en haut. Saisissez fermement le système MIXJECT par la seringue et tirez doucement sur la tige du piston pour prélever le produit reconstitué dans la seringue.
Du produit peut s’agglomérer en paquets sur la paroi du flacon. C’est normal. |
|
8 |
|
Détachez l’adaptateur du flacon de l’assemblage MIXJECT-seringue : Saisissez fermement la seringue et tournez le flacon (en tenant le capuchon en plastique de l’adaptateur) dans le sens des aiguilles d’une montre. |
|
9 |
|
Tenez la seringue DROITE. De l’autre main, tirez le capuchon de l’aiguille vers le haut. Appuyez sur le piston pour évacuer l’air de la seringue. La seringue contenant le produit est prête pour une administration immédiate.
|
|
10 |
|
Administrez l’injection intramusculaire en insérant l’aiguille selon un angle de 90 degrés dans la région glutéale. Veillez à ce que la quantité totale du produit soit injectée. Il faut alterner les points d’injection.
|
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
3, RUE DU BOURG L’ABBE
75003 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 301 662 4 6 : poudre en flacon (verre) + 2 mL de solvant en seringue préremplie (verre), boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |