 Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !Inscrivez-vous ici pour le tester en avant-première, partager vos impressions, et nous aider à l’améliorer !
 Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !DEXAMETHASONE KRKA 4 mg/ml, solution injectable/pour perfusion - Résumé des caractéristiques du produit |
 |
|
ANSM - Mis à jour le : 20/02/2023
DEXAMETHASONE KRKA 4 mg/ml, solution injectable/pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Sous forme de phosphate sodique de dexaméthasone.
Excipient à effet notoire : une ampoule de 1 ml de solution contient environ 3 mg de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable/pour perfusion (injection/perfusion).
La solution injectable/pour perfusion est une solution limpide, incolore à jaune clair, pratiquement exempte de particules.
4.1. Indications thérapeutiques 
· œdème cérébral associé à une tumeur cérébrale, procédures neurochirurgicales, abcès cérébral, méningite bactérienne (par exemple tuberculose, typhoïde, brucellose) ;
· choc chez les polytraumatisés/prévention du syndrome respiratoire aigu post traumatique ;
· crise d'asthme sévère et aiguë ;
· traitement parentéral initial de maladies cutanées étendues, aiguës et sévères comme l'érythrodermie, le pemphigus vulgaris, l'eczéma aigu ;
· traitement parentéral initial des maladies auto-immunes comme le lupus érythémateux systémique (en particulier les formes viscérales) ;
· polyarthrite rhumatoïde active avec une évolution sévère et progressive, par exemple des formes destructrices à évolution rapide et/ou des manifestations extra-articulaires ;
· traitement palliatif des tumeurs malignes ;
· prophylaxie et traitement des vomissements postopératoires ou induits par un traitement cytostatique dans le cadre de traitements antiémétiques ;
· infection à coronavirus SARS-COV-2 2019 (COVID-19) chez les adultes et les adolescents (âgés de 12 ans et pesant plus de 40 kg) qui nécessitent une oxygénothérapie.
Administration locale
· injection intra-articulaire: inflammation persistante d'une ou de quelques articulations après prise en charge générale de maladies articulaires inflammatoires chroniques, arthrose activée, formes aiguës de périarthropathie huméroscapulaire ;
· thérapie d'infiltration (lorsqu’elle est strictement indiquée) : tendovaginites et bursites non bactérienne, polyarthropathie, tendinopathie insertionnelle ;
· ophtalmologie : administration sous-conjonctivale dans les kératoconjonctivites non infectieuses, sclérites (sauf sclérites nécrosantes), uvéites antérieures et intermédias.
4.2. Posologie et mode d'administration 
La posologie dépend de la nature et de la gravité de la maladie et de la réponse individuelle du patient au traitement. En général, des doses initiales relativement élevées sont administrées et elles devraient être significativement plus élevées dans les formes aiguës sévères que dans les maladies chroniques.
Sauf indication contraire, les recommandations posologiques suivantes s'appliquent :
Administration systémique
· Œdème cérébral :
Adultes : selon la cause et la gravité, une dose initiale de 8 à 10 mg (jusqu'à 80 mg) en I.V., suivie de 16 à 24 mg (jusqu'à 48 mg/jour en I.V., divisée en 3 à 4 (6) doses individuelles pendant 4 à 8 jours. Une administration à plus long terme et à plus faible dose de DEXAMETHASONE KRKA peut être nécessaire pendant l'irradiation et dans le traitement conservateur des tumeurs cérébrales inopérables.
· Œdème cérébral dû à une méningite bactérienne : 0,15 mg/kg de poids corporel toutes les 6 heures pendant 4 jours, enfants 0,4 mg/kg de poids corporel toutes les 12 heures pendant 2 jours ; commençant avant la première administration de l'antibiotique. Cas graves, états toxiques (par exemple tuberculose, typhoïde; uniquement avec un traitement anti-infectieux concomitant): 4 à 20 mg/jour en I.V., dans des cas uniques (par exemple typhoïde) initialement jusqu'à 200 mg.
Il convient de tenir compte des recommandations officielles concernant le recours à la corticothérapie pour la prise en charge adéquate des maladies infectieuses.
· Choc chez les polytraumatisés/prévention du syndrome respiratoire aigu post traumatique : initialement 40 à 100 mg (enfants 40 mg) en I.V., une dose répétée après 12 heures ou 16 à 40 mg toutes les 6 heures pendant 2 à 3 jours.
· Crise d'asthme aiguë sévère :
Adultes : 8 à 20 mg en I.V., le plus tôt possible.
Enfants : 0,15 à 0,3 mg/kg de poids corporel en I.V. Les doses doivent être répétées si nécessaire, en fonction de la réponse individuelle et des besoins cliniques.
· Maladies aiguës de la peau : selon la nature et l'étendue de la maladie, des doses quotidiennes de 8 à 40 mg I.V., dans les cas graves jusqu'à 100 mg. Suivi d'un traitement à doses décroissantes.
· Prophylaxie et traitement des vomissements induits par traitement cytostatique dans les traitements antiémétiques : 8 à 20 mg en I.V., avant de commencer la chimiothérapie, puis 4 à 8 mg une à deux fois par jour pendant 2 à 3 jours si nécessaire (chimiothérapie modérément émétisante) ou jusqu'à 3 à 4 jours (chimiothérapie hautement émétisante).
· Prophylaxie et traitement des vomissements postopératoires : une dose unique de 4 à 8 mg en I.V., avant le début de la chirurgie ; chez les enfants de plus de 2 ans : 0,15 mg/kg de poids corporel (max. jusqu'à 8 mg) ;
· Traitement de la Covid-19 :
o Patients adultes : 6 mg en I.V. par jour pendant 10 jours maximum.
o Population pédiatrique (adolescents âgés de 12 ans et plus) : la dose recommandée est de 6 mg/dose en I.V. par jour pendant 10 jours maximum.
La durée du traitement sera déterminée au cas par cas en fonction de l’état clinique du patient.
o Sujets âgés, insuffisance rénale, insuffisance hépatique : aucun ajustement posologique n'est nécessaire.
Administration locale
Mode d’administration
DEXAMETHASONE KRKA doit être administré par injection intraveineuse lente (plus de 2 à 3 minutes) ou par perfusion, mais peut également être administré par voie intramusculaire si des problèmes d'accès veineux se produisent et si la circulation sanguine est adéquate. DEXAMETHASONE KRKA peut également être administré par infiltration et par injection intra-articulaire ou sous-conjonctivale. La durée du traitement dépend de l'indication.
Dans l'hypothyroïdie ou la cirrhose du foie, de faibles doses peuvent être suffisantes ou une réduction de dose peut être nécessaire.
Infiltration : La zone la plus douloureuse ou celle des attaches tendineuses est infiltrée avec DEXAMETHASONE KRKA. Attention, ne pas injecter dans le tendon ! Les injections fréquentes doivent être évitées et des précautions aseptiques strictes doivent être observées.
Dans le cas où des doses élevées sont nécessaires en un seul traitement, l'utilisation de médicaments à base de dexaméthasone avec des dosages/volumes plus élevés doit être envisagée.
Conformité en vue de l’utilisation:
Seules des solutions limpides doivent être utilisées. Le contenu de l'ampoule est destiné à un prélèvement unique. Toute solution injectable restante doit être jetée.
Voir rubrique 6.6 pour les informations de compatibilité.
Hypersensibilité aux substances actives ou à l'un des excipients mentionnés à la rubrique 6.1.
Infection fongique systémique; infection systémique, sauf si un traitement anti-infectieux spécifique est utilisé.
L'injection intra-articulaire est contre-indiquée :
· si l'infection est présente dans ou à proximité immédiate de l'articulation à traiter ;
· dans l'arthrite bactérienne ;
· en cas d’instabilité de l'articulation à traiter ;
· en cas de tendance aux saignements (spontanément ou dus à des agents anticoagulants) ;
· en cas de calcification périarticulaire ;
· dans la nécrose osseuse avasculaire ;
· en cas de rupture de tendon ;
· en cas d’articulation de Charcot.
L'infiltration sans traitement causal supplémentaire est contre-indiquée si l'infection est présente dans la zone d'administration, tout comme l'administration sous-conjonctivale dans les affections oculaires virales, bactériennes et mycosiques ou les lésions et ulcères cornéens.
4.4. Mises en garde spéciales et précautions d'emploi 
Des cas uniques de réactions anaphylactiques sévères avec collapsus circulatoire, arrêt cardiaque, arythmie, bronchospasme et/ou hypotension ou hypertension ont été observés avec l'utilisation de DEXAMETHASONE KRKA.
Grâce à l'immunosuppression, le traitement par DEXAMETHASONE KRKA peut entraîner un risque accru d'infections bactériennes, virales, parasitaires, opportunistes et fongiques. Il peut masquer les symptômes d'une infection existante ou en développement, rendant ainsi le diagnostic plus difficile. Les infections latentes, comme la tuberculose ou l'hépatite B, peuvent être réactivées.
En cas de situations particulières de stress physique (traumatisme, chirurgie, accouchement, etc.) pendant le traitement par DEXAMETHASONE KRKA, une augmentation temporaire de la dose peut être nécessaire.
Le traitement par DEXAMETHASONE KRKA ne doit être administré qu'en cas d’indications strictes et, si nécessaire, d'un traitement anti-infectieux ciblé supplémentaire si l'un des éléments suivants est présent :
· infections virales aiguës (hépatite B, zona, herpès simplex, varicelle, kératite herpétique) ;
· hépatite chronique active Ag HBs positive ;
· environ 8 semaines avant jusqu’à 2 semaines après la vaccination avec des vaccins vivants ;
· mycoses et parasitoses systémiques (p. ex. nématodes) ;
· chez les patients atteints de strongyloïdose soupçonnée ou confirmée (infection par les vers filamenteux), les glucocorticoïdes peuvent entraîner l'activation et la prolifération massive de ces parasites ;
· poliomyélite ;
· lymphadénite après vaccination au BCG ;
· infections bactériennes aiguës et chroniques ;
· chez les patients ayant des antécédents de tuberculose, utiliser uniquement sous protection tuberculostatique.
En outre, le traitement avec DEXAMETHASONE KRKA ne doit être administré qu’en cas d’indications strictes et, si nécessaire, un traitement spécifique supplémentaire doit être prévu pour :
· ulcères gastro-intestinaux ;
· ostéoporose ;
· insuffisance cardiaque sévère ;
· hypertension artérielle difficile à contrôler ;
· diabète sucré difficile à contrôler ;
· troubles psychiatriques (également dans le passé), y compris suicidalité : une surveillance neurologique ou psychiatrique est recommandée ;
· glaucome à angle fermé et angle ouvert : une surveillance ophtalmique et un traitement d'appoint sont recommandés ;
· ulcérations cornéennes et lésions cornéennes : une surveillance ophtalmique et un traitement d'appoint sont recommandés.
Troubles visuels
Des troubles visuels peuvent apparaitre lors d'une corticothérapie par voie systémique ou locale. En cas de vision floue ou d'apparition de tout autre symptôme visuel apparaissant au cours d'une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d'une cataracte, d'un glaucome, ou d'une lésion plus rare telle qu'une choriorétinopathie séreuse centrale (CRSC), décrits avec l'administration de corticostéroïdes par voie systémique ou locale.
En raison du risque de perforation intestinale, DEXAMETHASONE KRKA ne peut être utilisé qu’en cas d’indication urgente et sous surveillance appropriée pour :
· colite ulcéreuse sévère avec menace de perforation, éventuellement sans irritation péritonéale ;
· diverticulite ;
· entéro-anastomose (immédiatement après l'opération).
Les signes d'irritation péritonéale après perforation gastro-intestinale peuvent être absents chez les patients recevant des doses élevées de glucocorticoïdes.
La possibilité d'un besoin accru d'insuline ou d'antidiabétiques oraux doit être prise en considération lors de l'administration de DEXAMETHASONE KRKA à des diabétiques.
Une surveillance régulière de la pression artérielle est nécessaire pendant le traitement par DEXAMETHASONE KRKA, en particulier lors de l'administration de doses plus élevées et chez les patients souffrant d'hypertension artérielle difficile à contrôler.
En raison du risque de détérioration, les patients souffrant d'insuffisance cardiaque sévère doivent être étroitement surveillés.
Avec de fortes doses de dexaméthasone, une bradycardie peut survenir.
Des réactions anaphylactiques graves peuvent survenir.
Le risque de troubles tendineux, de tendinite et de rupture tendineuse est accru lorsque les fluoroquinolones et les glucocorticoïdes sont administrés ensemble.
Une myasthénie concomitante peut initialement s'aggraver pendant le traitement par DEXAMETHASONE KRKA.
Les vaccinations avec des vaccins inactivés sont généralement possibles. Cependant, il convient de noter que la réponse immunitaire et donc le vaccin peuvent être compromis à des doses plus élevées de corticostéroïdes.
Aux doses élevées, un apport suffisant en potassium et une restriction en sodium doivent être assurés et les taux sériques de potassium doivent être surveillés.
L'arrêt brusque du traitement après environ 10 jours peut entraîner une exacerbation ou une rechute de la maladie sous-jacente et une insuffisance corticosurrénalienne aiguë/un syndrome de sevrage de la cortisone. Par conséquent, la dose doit être réduite lentement si le traitement doit être interrompu.
Certaines maladies virales (varicelle, rougeole) peuvent être très graves chez les patients traités aux glucocorticoïdes. Les patients immunodéprimés qui n'ont jamais été infectés par la varicelle ou la rougeole sont particulièrement à risque. Si ces patients sont en contact avec des personnes infectées par la rougeole ou la varicelle pendant qu'ils suivent un traitement par DEXAMETHASONE KRKA, un traitement préventif devrait être initié, si nécessaire.
Au cours de l'expérience de post-commercialisation, un syndrome de lyse tumorale (SLT) a été signalé chez des patients présentant des tumeurs malignes hématologiques après l'utilisation de la dexaméthasone seule ou en association avec d'autres agents chimiothérapeutiques. Le patient à haut risque de SLT, comme les patients avec un taux élevé de prolifération, une charge tumorale élevée et une sensibilité élevée aux agents cytotoxiques, doit être surveillé étroitement et les précautions appropriées doivent être prises.
L'administration intraveineuse doit se faire par injection lente (plus de 2 à 3 minutes), car des effets secondaires tels que des picotements désagréables ou des paresthésies peuvent survenir s'ils sont injectés trop rapidement.
DEXAMETHASONE KRKA est destiné à une utilisation à court terme. En cas d'utilisation incorrecte sur une période plus longue, des avertissements et des précautions supplémentaires, tels que décrits pour l'administration à long terme de médicaments contenant des glucocorticoïdes, doivent être envisagés.
Les éventuels effets secondaires et interactions systémiques doivent être pris en compte après administration locale.
L'administration intra-articulaire de glucocorticoïdes augmente le risque d'infections articulaires. L'administration à long terme et les injections répétées de glucocorticoïdes dans les articulations portantes peuvent aggraver les modifications des articulations liées à l'usure. Cela est probablement dû à une surcharge des articulations touchées après que la douleur ou d'autres symptômes ont été soulagés.
Crise liée à la présence de phéochromocytome
La survenue de crises liées à la présence de phéochromocytome, dont l’issue peut être fatale, a été rapportée après administration de corticoïdes systémiques. Les corticoïdes ne doivent être administrés aux patients chez lesquels un phéochromocytome est suspecté ou identifié qu’après une évaluation appropriée du rapport bénéfice/risque.
Cardiomyopathie hypertrophique
Une cardiomyopathie hypertrophique a été rapportée après une administration systémique de corticostéroïdes incluant de la dexaméthasone à des nourrissons prématurés. Dans la majorité des cas signalés, cette situation était réversible à l’arrêt du traitement. Chez les nourrissons prématurés traités par dexaméthasone systémique, une évaluation diagnostique et une surveillance de la fonction et de la structure cardiaques doivent être réalisées (rubrique 4.8).
Utilisation ophtalmique locale
Le syndrome de Cushing et/ou la suppression surrénale peut se produire après l'absorption systémique de dexaméthasone ophtalmique en cours de traitement intensif ou à long terme chez les patients prédisposés, y compris les enfants et les patients traités avec des inhibiteurs de la CYP3A4 (y compris le ritonavir et cobicistat). Dans ces cas, le traitement doit être progressivement interrompu.
La prudence est recommandée avec l'administration sous-conjonctivale de stéroïdes car cela peut être associé à un risque potentiel d'amincissement scléral ou de fonte sclérale.
Population pédiatrique
Chez les nouveau-nés prématurés :
Les données disponibles suggèrent des effets indésirables sur le développement neurologique à long terme après un traitement précoce (initié dans les premières 96 heures qui suivent la naissance) des nouveau-nés prématurés atteints de maladie pulmonaire chronique à des doses de départ de 0,25 mg/kg deux fois par jour.
Dans la phase de croissance des enfants, le rapport bénéfice/risque du traitement par DEXAMETHASONE KRKA doit être évalué avec attention.
Patients âgés
Étant donné que les patients âgés présentent un risque accru d'ostéoporose, le rapport bénéfice/risque du traitement par DEXAMETHASONE KRKA doit être évalué avec attention.
L'utilisation de DEXAMETHASONE KRKA peut conduire à des résultats positifs dans les contrôles antidopage.
Excipients
Ce médicament contient 3 mg de sodium par ampoule, ce qui équivaut à 0,15 % de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
+ Œstrogènes (par exemple contraceptifs oraux)
La demi-vie des glucocorticoïdes peut être prolongée. Par conséquent, l'effet des corticoïdes peut être accru.
+ Médicaments qui induisent le CYP3A4, tels que la rifampicine, la phénytoïne, la carbamazépine, les barbituriques et la primidone
L'effet des corticoïdes peut être réduit.
Les inhibiteurs du CYP3A4 (y compris le kétoconazole, l'itraconazole, le ritonavir et le cobicistat) peuvent réduire la clairance de la dexaméthasone, ce qui peut entraîner une augmentation de l'effet et une suppression surrénalienne/un syndrome de Cushing. Cette association doit être évitée, sauf dans les cas où le bénéfice du traitement l'emporte sur le risque accru d'effets indésirables systémiques des corticostéroïdes. Si tel est le cas, les patients doivent être surveillés pour les effets systémiques des corticostéroïdes.
+ Éphédrine
Le métabolisme des glucocorticoïdes peut être accéléré et donc leur efficacité réduite.
+ Inhibiteurs de l'ECA
Risque accru de modifications de la formule sanguine.
+ Glycosides cardiaques
L'effet des glycosides peut être accru par une carence en potassium.
+ Salurétiques/laxatifs
L'excrétion de potassium peut être augmentée.
+ Antidiabétiques
L'effet hypoglycémiant peut être réduit.
+ Dérivés de la coumarine
L'effet anticoagulant peut être réduit ou augmenté. Un ajustement posologique de l'anticoagulant peut être nécessaire en cas de co-administration.
+ Anti-inflammatoires non stéroïdiens (AINS), salicylates et indométhacine
Le risque d'ulcères gastro-intestinaux et de saignements est accru.
+ Relaxants musculaires non dépolarisants
L'effet relaxant musculaire peut durer plus longtemps.
+ Atropine, autres anticholinergiques
Des augmentations supplémentaires de la pression intraoculaire sont possibles lors d'une utilisation concomitante.
+ Praziquantel
Les corticostéroïdes peuvent entraîner une baisse de la concentration de praziquantel dans le sang.
+ Chloroquine, hydroxychloroquine, méfloquine
Il existe un risque accru de myopathies, de cardiomyopathies.
+ Protiréline
Une augmentation réduite de la TSH peut être observée pendant l'administration de protiréline.
+ Agents immunosuppresseurs
Sensibilité accrue aux infections et éventuellement aggravation ou manifestation d'infections latentes. De plus, pour la cyclosporine, les niveaux sanguins de cyclosporine sont augmentés, il y a un risque accru de convulsions.
Les fluoroquinolones peuvent augmenter le risque de troubles tendineux.
Effet sur les méthodes d'investigation
Les réactions cutanées lors des tests d'allergie peuvent être supprimées.
4.6. Fertilité, grossesse et allaitement 
Grossesse
La dexaméthasone traverse le placenta. Pendant la grossesse, en particulier au cours du premier trimestre, ce médicament ne doit être administré qu'après une évaluation approfondie du rapport bénéfice/risque.
Lors d'un traitement à long terme avec des glucocorticoïdes pendant la grossesse, les troubles de la croissance fœtale ne peuvent être exclus.
L'administration de corticostéroïdes à des animaux gravides peut provoquer des anomalies du développement fœtal, notamment une fente palatine, un retard de croissance intra-utérin et des effets sur la croissance et le développement du cerveau. Il n'y a aucune preuve que les corticostéroïdes entraînent une incidence accrue d'anomalies congénitales, telles que fente palatine/lèvre chez l'Homme (voir rubrique 5.3).
Si des glucocorticoïdes sont administrés vers la fin de la grossesse, il existe un risque d'atrophie du cortex surrénal fœtal, qui peut nécessiter un traitement de remplacement chez le nouveau-né, qui doit être lentement réduit.
Les études ont montré un risque accru d’hypoglycémie néonatale à la suite de l’administration de corticostéroïdes, y compris de dexaméthasone, pendant une courte période chez des femmes à risque d’accouchement prématuré tardif.
La dexaméthasone est excrétée dans le lait maternel. Il n'y a eu aucun cas connu de préjudice à l'enfant. Néanmoins, le médicament doit être utilisé qu'en cas d’indications strictes pendant la lactation. Si la maladie nécessite des doses plus élevées, l'allaitement doit être interrompu.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Le risque d'effets indésirables est faible lors d'un traitement à court terme par la dexaméthasone, à l'exception d'un traitement parentéral à forte dose où des changements d'électrolytes, des œdèmes, une augmentation éventuelle de la pression artérielle, un arrêt cardiaque, des troubles du rythme cardiaque ou des convulsions peuvent survenir, et des manifestations cliniques d'infections peuvent également être observées au cours d'un traitement à court terme. Une attention devra être portée aux éventuelles ulcérations gastriques et intestinales (souvent induites par le stress), car le traitement aux corticoïdes peut réduire leurs symptômes et diminuer la tolérance au glucose.
Les effets indésirables suivants peuvent survenir, ils dépendent fortement de la dose et de la durée du traitement, leur fréquence ne peut donc pas être spécifiée :
Infections et infestations :
Masquage des infections, manifestation et exacerbation des infections virales, infections fongiques, bactériennes, parasitaires et opportunistes, activation de la strongyloïdose (voir rubrique 4.4).
Affections hématologiques et du système lymphatique :
Leucocytose modérée, lymphocytopénie, éosinopénie, polycytémie.
Affections du système immunitaire :
Réactions d'hypersensibilité (ex. exanthème induit par des médicaments), réactions anaphylactiques sévères, telles que arythmies, bronchospasmes, hypo- ou hypertension, collapsus circulatoire, arrêt cardiaque, affaiblissement du système immunitaire.
Affections endocriniennes :
Syndrome de Cushing (symptômes typiques : visage lunaire, obésité centrale et pléthore), suppression surrénalienne (voir rubrique 4.4).
Troubles du métabolisme et de la nutrition :
Rétention de sodium avec œdème, augmentation de l'excrétion de potassium (risque d'arythmie), prise de poids, tolérance au glucose réduite, diabète sucré, hypercholestérolémie et hypertriglycéridémie, augmentation de l'appétit.
Affections psychiatriques :
Dépression, irritabilité, euphorie, entraînement accru, psychoses, manie, hallucinations, labilité émotionnelle, anxiété, troubles du sommeil, suicidalité.
Affections du système nerveux :
Hypertension intracrânienne bénigne, manifestation d'épilepsie latente, augmentation de la susceptibilité aux crises dans l'épilepsie diagnostiquée.
Affections oculaires :
Cataracte, en particulier avec opacité sous-capsulaire postérieure, glaucome, détérioration des symptômes associés à l'ulcère cornéen, augmentation de la fréquence des infections virales, fongiques et bactériennes de l'œil, détérioration des infections bactériennes de la cornée, ptose, mydriase, chimiose, perforation sclérale iatrogène, choriorétinopathie. Rares cas d'exophtalmie réversible, et après administration sous-conjonctivale également kératite à herpès simplex, perforation cornéenne en cas de kératite existante, vision trouble (voir également rubrique 4.4).
Affections cardiaques :
Cardiomyopathie hypertrophique chez les nourrissons prématurés (voir rubrique 4.4).
Affections vasculaires :
Hypertension, risque accru d'athérosclérose et de thrombose, vascularite (également en tant que syndrome de sevrage après un traitement à long terme), augmentation de la fragilité capillaire.
Affections gastro-intestinales :
Ulcères gastro-intestinaux, saignements gastro-intestinaux, pancréatite, gêne gastrique, hoquet.
Affections de la peau et du tissu sous-cutané :
Stries rubra, atrophie, télangiectasie, pétéchies, ecchymose, hypertrichose, acné induite par les stéroïdes, dermatite de type rosacée (périorale), modifications de la pigmentation de la peau.
Affections musculosquelettiques et du tissu conjonctif :
Myopathie, atrophie et faiblesse musculaires, ostéoporose (dose-dépendante, possible également en administration à court terme), nécrose osseuse aseptique, troubles tendineux, tendinite, rupture tendineuse, lipomatose péridurale, inhibition de la croissance chez l'enfant.
Affections des organes de reproduction et du sein :
Troubles de la sécrétion d'hormones sexuelles (en conséquence: menstruations irrégulières jusqu'à l'aménorrhée, hirsutisme, impuissance).
Troubles généraux et anomalies au site d'administration :
Retard de cicatrisation des plaies.
Administration locale :
Des réactions locales d'irritation et d'intolérance sont possibles (sensation de chaleur, douleur prolongée), en particulier avec une utilisation ophtalmique. L'atrophie cutanée et l'atrophie du tissu sous-cutané au site d'injection ne peuvent être exclues si les corticoïdes ne sont pas soigneusement injectés dans la cavité articulaire.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Symptômes
Les intoxications aiguës à la dexaméthasone ne sont pas connues. En cas de surdosage chronique, une augmentation des effets indésirables (voir rubrique 4.8), en particulier des effets endocriniens, métaboliques et électrolytiques, peut être attendue.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : Corticostéroïdes à usage systémique, glucocorticoïdes, code ATC : H02AB02.
La dexaméthasone est un glucocorticoïde monofluoré aux propriétés et effets anti-allergiques, anti-inflammatoires et stabilisateurs de membrane prononcés sur le métabolisme des glucides, des protéines et des graisses.
La dexaméthasone a un effet glucocorticoïde environ 7,5 fois plus important que la prednisolone et la prednisone, et par rapport à l'hydrocortisone, elle est 30 fois plus efficace, sans effets minéralocorticoïdes.
Les glucocorticoïdes, tels que la dexaméthasone, exercent leurs effets biologiques en activant la transcription des gènes sensibles aux corticostéroïdes. Les effets anti-inflammatoires, immunosuppresseurs et antiprolifératifs sont causés par une diminution de la formation, de la libération et de l'activité des médiateurs inflammatoires, par l'inhibition de fonctions spécifiques et la migration des cellules inflammatoires. De plus, les corticostéroïdes peuvent empêcher l'effet des lymphocytes T et des macrophages sensibilisés sur les cellules cibles.
Lorsqu'un traitement corticoïde à long terme est nécessaire, la possibilité d'induction d'une insuffisance surrénalienne transitoire doit être envisagée. La suppression de l'axe hypothalamo-hypophyso-surrénalien dépend également de facteurs individuels.
Utilisation dans le traitement de la maladie à coronavirus SARS-Cov-2 2019 (COVID-19) chez les adultes et adolescents qui nécessitent une oxygénothérapie
L’essai RECOVERY (Randomised Evaluation of COVid-19 thERapY,)1 est un essai institutionnel, randomisé, contrôlé, conduit en ouvert à partir d’une plateforme adaptative destinée à évaluer les traitements potentiels de la COVID-19 chez les patients hospitalisés.
L’essai a été mené dans 176 centres hospitaliers au Royaume-Uni.
Au total, 6 425 patients ont été randomisés pour être traités par la dexaméthasone (2 104 patients), ou par les soins de support usuels seuls (4 321 patients). Pour 89 % des patients l’infection par le virus SARS-CoV-2 était confirmée par un test en laboratoire.
Au moment de la randomisation, 16 % des patients recevaient une ventilation mécanique invasive ou étaient placés sous oxygénation par membrane extracorporelle, 60 % recevaient un apport en oxygène associé ou non à une ventilation non invasive, et 24 % ne recevaient pas d’oxygénothérapie.
L’âge moyen des patients était de 66,1 ± 15,7 ans. 36 % des patients étaient de sexe féminin. 24 % des patients présentaient des antécédents de diabète, 27 % présentaient des antécédents de pathologies cardiaques et 21 %, des antécédents de maladie pulmonaire chronique.
Critère de jugement principal
La mortalité à 28 jours était significativement plus faible dans le groupe recevant la dexaméthasone que dans le groupe recevant les soins usuels seuls ; 482 décès (22,9 %) ayant été rapportés sur 2 104 patients et 1 110 (25,7 %) sur 4 321 patients (risque relatif 0,83 ; [intervalle de confiance : IC 95 % : 0,75 à 0,93 ; P < 0,001].
Le taux de décès était plus faible dans le groupe recevant la dexaméthasone que dans le groupe recevant les soins usuels chez les patients recevant une ventilation mécanique invasive (29,3 % contre 41,4 % ; risque relatif 0,64 [IC 95 % : 0,51 à 0,81] et chez les patients recevant une oxygénothérapie sans ventilation mécanique invasive (23,3 % contre 26,2 % ; risque relatif 0,82 [IC 95 % : 0,72 à 0,94].
Il n’a pas été observé d’effet significatif de la dexaméthasone dans le groupe de patients ne recevant pas de support respiratoire au moment de la randomisation (17,8 % contre 14,0 % ; risque relatif 1,19 [IC 95 % : 0,91 à 1,55].
Critères de jugement secondaires
Les patients du groupe dexaméthasone ont eu une durée d’hospitalisation plus courte que celle du groupe recevant les soins usuels seuls (médiane, 12 jours contre 13 jours) et une probabilité de sortie d’hôpital en vie dans les 28 jours plus élevée (risque relatif 1,10 ; [IC 95 % : 1,03 à 1,17].
Comme pour le critère de jugement principal, l’effet le plus significatif en termes de sortie en vie de l’hôpital sous 28 jours a été observé chez les patients qui recevaient une ventilation mécanique invasive au moment de la randomisation (risque relatif 1,48 [IC 95 % : 1,16 à 1,90], puis chez les patients recevant de l’oxygène sans ventilation mécanique invasive (risque relatif, 1,15 [IC 95 % : 1,06 à 1,24]. Aucun effet bénéfique n’a été observé chez les patients qui ne recevaient pas d’oxygène (risque relatif, 0,96 [IC 95 % : 0,85 à 1,08].
|
Résultats |
Dexaméthasone (N = 2104) |
Soins usuels (N = 4321) |
Risque relatif ou ratio (IC 95 %)* |
|
|
|
Nombre/Nombre total de patients (%) |
|
|
Critère principal |
|
|
|
|
Mortalité à 28 jours |
482/2 104 (22,9) |
1 110/4 321 (25,7) |
0,83 (0,75 à 0,93) |
|
Critères secondaires |
|
|
|
|
Sortie de l’hôpital sous 28 jours |
1 413/2 104 (67,2) |
2 745/4 321 (63,5) |
1,10 (1,03 à 1,17) |
|
Ventilation mécanique invasive ou décès† |
456/1 780 (25,6) |
994/3 638 (27,3) |
0,92 (0,84 à 1,01) |
|
Ventilation mécanique invasive |
102/1 780 (5,7) |
285/3 638 (7,8) |
0,77 (0,62 à 0,95) |
|
Décès |
387/1 780 (21,7) |
827/3 638 (22,7) |
0,93 (0,84 à 1,03) |
* Les risques relatifs ont été ajustés sur l’âge en fonction du taux de mortalité à 28 jours et du délai de sortie en vie de l’hôpital. Les risques relatifs ont été ajustés sur l’âge en fonction du taux de progression vers ventilation mécanique invasive ou de décès et des sous-composants.
† Les patients qui recevaient une ventilation mécanique invasive au moment de la randomisation ont été exclus de cette catégorie.
Données de sécurité
Quatre effets indésirables (EI) graves ont été observés en lien avec le traitement à l’étude : deux cas graves d’hyperglycémie, un cas grave de psychose induite par la corticothérapie et un cas d’hémorragie digestive haute. Les évènements ont tous été résolus.
Analyses en sous-groupes
Effets de l’administration de la DEXAMÉTHASONE sur la mortalité à 28 jours, en fonction de l’âge et de l’assistance respiratoire reçue au moment de la randomisation2
|
|
Dexaméthasone |
|
RR (IC 95 %) |
||||||||
|
Pas d’oxygène ( |
|
|
|||||||||
|
< 70 |
10/197 (5,1 %) |
18/462 (3,9 %) |
1,31 (0,60 à 2,83) |
||||||||
|
> 70 < 80 |
25/114 (21,9 %) |
35/224 (15,6 %) |
1,46 (0,88 à 2,45) |
||||||||
|
≥ 80 |
54/190 (28,4 %) |
92/348 (26,4 %) |
1,06 (0,76 à 1,49) |
||||||||
|
Sous-total |
89/501 (17,8 %) |
145/1034 (14,0 %) |
1,19 (0,91 à 1,55) |
||||||||
|
Oxygène uniquement ( |
|
|
|||||||||
|
< 70 |
53/675 (7,9 %) |
193/1 473 (13,1 %) |
0,58 (0,43 à 0,78) |
||||||||
|
≥ 70 < 80 |
104/306 (34,0 %) |
178/531 (33,5 %) |
0,98 (0,77 à 1,25) |
||||||||
|
≥ 80 |
141/298 (47,3 %) |
311/600 (51,8 %) |
0,85 (0,70 à 1,04) |
||||||||
|
Sous-total |
298/1 279 (23,3 %) |
682/2 604 (26,2 %) |
0,82 (0,72 à 0,94) |
||||||||
|
Ventilation mécanique ( |
|
|
|||||||||
|
< 70 |
66/269 (24,5 %) |
217/569 (38,1 %) |
0,61 (0,46 à 0,81) |
||||||||
|
≥ 70 < 80 |
26/49 (53,1 %) |
58/104 (55,8 %) |
0,85 (0,53 à 1,34) |
||||||||
|
≥ 80 |
3/6 (50,0 %) |
8/10 (80,0 %) |
0,39 (0,10 à 1,47) |
||||||||
|
Sous-total |
95/324 (29,3 %) |
283/683 (41,4 %) |
0,64 (0,51 à 0,81) |
||||||||
|
Total des participants |
482/2 104 (22,9 %) |
1110/4321 (25,7 %) |
0,83 (0,75 à 0,93) |
||||||||
|
|
|
|
p < 0,001 |
||||||||
|
|
|
0,5 |
0,75 |
1 |
1,5 |
2 |
|
||||
|
|
|
|
Supériorité de la dexaméthasone |
Supériorité des soins usuels seuls |
|
||||||
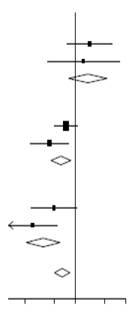 Effets de l’administration de la DEXAMÉTHASONE sur la mortalité à 28 jours, en fonction de l’assistance respiratoire reçue au moment de la randomisation et d’antécédents de maladie chronique2
Effets de l’administration de la DEXAMÉTHASONE sur la mortalité à 28 jours, en fonction de l’assistance respiratoire reçue au moment de la randomisation et d’antécédents de maladie chronique2
|
|
Dexaméthasone |
Soins usuels |
RR (IC 95 %) |
||||||||
|
Pas d’oxygène ( |
|
|
|||||||||
|
Pathologie antérieure |
65/313 (20,8 %) |
100/598 (16,7 %) |
1,22 (0,89 à 1,66) |
||||||||
|
Aucune pathologie antérieure |
24/188 (12,8 %) |
45/436 (10,3 %) |
1,12 (0,68 à 1,83) |
||||||||
|
Sous-total |
89/501 (17,8 %) |
145/1034 (14,0 %) |
1,19 (0,91 à 1,55) |
||||||||
|
Oxygène uniquement ( |
|
|
|||||||||
|
Pathologie antérieure |
221/702 (31,5 %) |
481/1 473 (32,7 %) |
0,88 (0,75 à 1,03) |
||||||||
|
Aucune pathologie antérieure |
77/577 (13,3 %) |
201/1 131 (17,8 %) |
0,70 (0,54 à 0,91) |
||||||||
|
Sous-total |
298/1279 (23,3 %) |
682/2 604 (26,2 %) |
0,82 (0,72 à 0,94) |
||||||||
|
Ventilation artificielle ( |
|
|
|||||||||
|
Pathologie antérieure |
51/159 (32,1 %) |
150/346 (43,4 %) |
0,75 (0,54 à 1,02) |
||||||||
|
Aucune pathologie antérieure |
44/165 (26,7 %) |
133/337 (39,5 %) |
0,56 (0,40 à 0,78) |
||||||||
|
Sous-total |
95/324 (29,3 %) |
283/683 (41,4 %) |
0,64 (0,51 à 0,81) |
||||||||
|
Tous les participants |
482/2104 (22,9 %) |
1110/4 321 (25,7 %) |
0,83 (0,75 à 0,93) |
||||||||
|
|
|
|
p < 0,001 |
||||||||
|
|
|
0,5 |
0,75 |
1 |
1,5 |
2 |
|
||||
|
|
|
|
Supériorité de la dexaméthasone |
Supériorité des soins de routine |
|
||||||
2 (source: Horby P. et al., 2020; https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1 ; doi: https://doi.org/10.1101/2020.06.22.20137273)
5.2. Propriétés pharmacocinétiques 
La dexaméthasone se lie en fonction de la dose aux albumines plasmatiques. À des doses très élevées, la plus grande partie circule librement dans le sang. Dans l'hypoalbuminémie, la proportion de corticoïdes non liés (actifs) augmente. Quatre heures après l'administration intraveineuse de dexaméthasone radioactivement marquée chez l'Homme, la concentration maximale de dexaméthasone dans le liquide cérébrospinal est d'environ 1/6 de sa concentration plasmatique. Avec sa demi-vie biologique de plus de 36 heures, la dexaméthasone appartient aux glucocorticoïdes à très longue durée d’action. En raison de sa longue durée d'action, une accumulation et un surdosage peuvent survenir avec l'administration quotidienne et continue de dexaméthasone.
La demi-vie d'élimination sérique moyenne de la dexaméthasone chez l'adulte est d'environ 250 minutes (+ 80 minutes). Il est excrété principalement par le rein sous forme d'alcool libre de dexaméthasone. Il est partiellement métabolisé. Les métabolites sont, sous forme de glucoronates ou de sulfate, également principalement éliminés par les reins. La dysfonction rénale n'affecte pas substantiellement l'élimination de la dexaméthasone. La demi-vie d'élimination est prolongée en cas de maladie hépatique sévère.
5.3. Données de sécurité préclinique 
24 mois.
Après dilution:
La stabilité physico-chimique en cours d'utilisation a été démontrée pendant 48 heures à 15-25°C.
D'un point de vue microbiologique, à moins que la méthode de dilution exclut le risque de contamination microbienne, le produit doit être utilisé immédiatement.
En cas d’utilisation non immédiate, la durée et les conditions de conservation en cours d'utilisation sont de la responsabilité de l'utilisateur.
6.4. Précautions particulières de conservation 
A conserver à une température ne dépassant pas 30°C.
Conserver dans l'emballage d'origine à l'abri de la lumière.
Pour les conditions de conservation après dilution du médicament, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur 
Ampoule marquée d'un point blanc et d'un anneau jaune (verre de type I, verre ambré) : 1, 3, 5, 10, 20, 25, 50 et 100 ampoules de 1 ml de solution injectable/pour perfusion, conditionnées sous plaquettes (PVC/Aluminium), dans une boîte.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
DEXAMETHASONE KRKA 4 mg/ml, solution injectable/pour perfusion est de préférence administré par injection intraveineuse directe ou injecté dans le tube de perfusion. La solution injectable/pour perfusion est compatible avec les solutions de perfusion suivantes (à chaque fois 250 et 500 ml) et est destinée à être utilisée dans les 48 heures :
· solution saline isotonique
· solution de Ringer
· solution de glucose à 5 %
· solution de glucose à 10 %
Lorsque le médicament est utilisé en association avec des solutions pour perfusion, les informations de chaque fournisseur sur leurs solutions pour perfusion, y compris les informations sur la compatibilité, les contre-indications, les effets indésirables et les interactions, doivent être prises en compte.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
ŠMARJEŠKA CESTA 6
8501 NOVO MESTO
SLOVENIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 302 043 6 8 : 1 ml en ampoule (verre). Boîte de 20.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |