Dernière mise à jour le 08/01/2026
NOYADA 5 mg/5ml, solution buvable
Indications thérapeutiques
NOYADA contient la substance active captopril qui appartient à la famille des inhibiteurs de l’enzyme de conversion de l’angiotensine. Les inhibiteurs de l’enzyme de conversion de l’angiotensine agissent en permettant à vos vaisseaux sanguins de se dilater pour que votre cœur ait moins de difficulté à pomper le sang.
Le captopril est indiqué chez les adultes, les personnes âgées et les enfants dans les cas suivants :
· Personnes dont le cœur ne pompe plus autant de sang qu'auparavant. On appelle cette maladie une insuffisance cardiaque.
· Personnes ayant récemment eu un infarctus du myocarde. Une attaque cardiaque survient lorsqu'un des principaux vaisseaux sanguins approvisionnant le muscle cardiaque en sang est bloqué. Cela signifie que le cœur ne reçoit pas l'oxygène dont il a besoin et le muscle cardiaque est alors endommagé.
· Maladie rénale chez les personnes diabétiques.
Présentations
> 1 flacon(s) en verre brun avec fermeture de sécurité enfant de 100 ml avec adaptateur avec seringues de 1 ml et de 5 ml
Code CIP : 34009 301 005 4 7
Déclaration de commercialisation : 12/09/2017
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 57,80 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 58,82 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 07/02/2018 | Inscription (CT) | Le service médical rendu par NOYADA est important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 07/02/2018 | Inscription (CT) | Prenant en compte : • la faible qualité de la démonstration des données disponibles (étude de bioéquivalence du captopril en solution buvable versus captopril en comprimé ainsi que les données d’ATU), • l’absence de données sur son éventuel impact sur la morbidité ou la mortalité, en particulier dans la population pédiatrique pour laquelle cette forme est la plus adaptée, la Commission considère que NOYADA n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux autres IEC déjà disponibles sous forme solide pour le traitement de l’hypertension artérielle, de l’insuffisance cardiaque, de l’infarctus du myocarde et de la néphropathie diabétique du diabète de type I. |
ANSM - Mis à jour le : 24/08/2022
NOYADA 5 mg/5 ml, solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque ml de la solution orale 5 mg/5 ml contient 1mg de captopril
Excipient(s) à effet notoire : benzoate de sodium (E211)
Chaque mL de solution buvable de NOYADA contient 0,5 mg de benzoate de sodium (E211).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide, incolore.
4.1. Indications thérapeutiques
NOYADA est indiqué dans le traitement de :
- l’hypertension artérielle
- l’insuffisance cardiaque : NOYADA en association avec des diurétiques et, le cas échéant, des digitaliques et des bêta-bloquants est indiqué dans le traitement de l’insuffisance cardiaque chronique associée à une réduction de la fonction ventriculaire systolique.
- l’infarctus du myocarde :
o Traitement de courte durée (4 semaines) : NOYADA est indiqué dans les 24 premières heures chez les patients en situation hémodynamique stable.
o Prévention à long terme de l’insuffisance cardiaque symptomatique : NOYADA est indiqué chez les patients cliniquement stables avec dysfonction ventriculaire gauche asymptomatique (fraction d'éjection ≤ à 40 %).
- la néphropathie diabétique du diabète de type I : NOYADA est indiqué dans le traitement de la néphropathie diabétique macroprotéinurique du diabète insulinodépendant (voir rubrique 5.1).
4.2. Posologie et mode d'administration
NOYADA est disponible sous deux dosages : 5 mg/5 ml et 25 mg/5 ml ;
Pour les posologies les plus faibles qui comprennent des fractions de mg, le dosage 5 mg/5 ml devrait être utilisé.
Pour les posologies les plus élevées, le dosage 25 mg/5 ml est recommandé.
Un guide d’utilisation des dosages de NOYADA 5 mg/5 ml et NOYADA 25 mg/5 ml est fourni dans le tableau ci-dessous, pour les posologies les plus courantes :
|
|
Posologie
|
NOYADA 5mg/5ml |
NOYADA 25mg/5ml |
|
Adultes |
6.25 mg
|
6.25 ml |
|
|
12.5 mg
|
12.5 ml |
|
|
|
25 mg |
|
5 ml |
|
|
37.5 mg |
|
7.5 ml |
|
|
50 mg |
|
10 ml |
|
|
75 mg |
|
15 ml |
|
|
100 mg |
|
20 ml |
|
|
150 mg |
|
30 ml |
|
|
Population pédiatrique |
0.15 mg/kg |
0.15 ml/kg |
|
|
0.3 mg/kg |
0.3 ml/kg |
|
Pour plus d’informations sur la mesure des doses, veuillez consulter la rubrique 6.5
NOYADA 5 mg/5 ml, solution buvable est fourni avec les dispositifs d’administration suivants :
- une seringue de 1 ml avec des traits de graduation numérotés correspondant à 0,1 ml (= 0,1 mg de captopril) et des graduations intermédiaires correspondant à 0,05 ml de solution (= 0,05 mg de captopril).
- une seringue de 5 ml avec des traits de graduation numérotés correspondant à 1 ml (= 1 mg de captopril) et des graduations intermédiaires correspondant à 0,2 ml de solution (= 0,2 mg de captopril).
NOYADA 5 mg/5ml, solution buvable est fourni avec les dispositifs d’administration suivants :
- une seringue de 5 ml avec des traits de graduation numérotés correspondant à 1 ml (= 5 mg de captopril) et des graduations intermédiaires correspondant à 0,2 ml de solution (= 1 mg de captopril).
- un godet doseur de 30 ml avec des traits de graduation numérotés correspondant à 5 ml (= 25 mg de captopril) et des graduations intermédiaires correspondant à 1 ml (= 5 mg de captopril).
La dose doit être adaptée en fonction du profil du patient (voir rubrique 4.4) et de sa réponse tensionnelle. La dose maximale journalière recommandée est de 150 mg.
NOYADA peut être administré avant, pendant ou après les repas.
Hypertension artérielle : la dose initiale recommandée est de 25 à 50 mg par jour en 2 prises. La dose peut être augmentée par paliers, en respectant des intervalles d’au moins 2 semaines, jusqu’à 100 à 150 mg/jour en 2 prises pour atteindre la pression artérielle cible. NOYADA peut être utilisé seul ou en association avec d’autres antihypertenseurs, notamment les diurétiques thiazidiques. Un schéma posologique d’une prise par jour peut être approprié en cas d’association avec un antihypertenseur comme les diurétiques thiazidiques (voir rubriques 4.3, 4.4, 4.5 et 5.1).
Chez les patients présentant un système rénine-angiotensine aldostérone très actif (hypovolémie, hypertension rénovasculaire, décompensation cardiaque), il est préférable d’administrer une dose initiale de 6,25 mg ou 12,5 mg une fois par jour. L’instauration de ce traitement doit se faire de préférence sous surveillance médicale rapprochée. Ces doses seront ensuite administrées 2 fois par jour. La posologie pourra être augmentée graduellement jusqu’à 50 mg par jour en 1 ou 2 prises et si nécessaire jusqu’à 100 mg par jour en 1 ou 2 prises.
Insuffisance cardiaque : le traitement par captopril devra être initié sous étroite surveillance médicale. La dose initiale habituelle est de 6,25 à 12,5 mg par jour répartis en 2 ou 3 prises. La titration jusqu’à la dose efficace (75 à 150 mg par jour) doit se faire en fonction de la réponse du patient, de son statut clinique et la tolérance, jusqu’à un maximum de 150 mg par jour en 2 prises. La dose doit être augmentée par paliers, en respectant des intervalles d’au moins 2 semaines afin d’évaluer la réponse du patient.
Infarctus du myocarde
- Traitement de courte durée : le traitement par captopril sera initié en milieu hospitalier le plus tôt possible après le début des signes et/ou symptômes chez des patients hémodynamiquement stables. Une dose test de 6,25 mg est administrée puis 2 heures après une dose de 12,5 mg et 12 heures après une dose de 25 mg. Le lendemain, le captopril sera administré à la dose de 100 mg/jour en 2 prises pendant 4 semaines si la tolérance hémodynamique du patient le permet.
A la fin de ces 4 semaines de traitement, l'état du patient sera réévalué avant prise de décision thérapeutique pour la phase de post-infarctus du myocarde.
- Traitement chronique : si le traitement par captopril n'a pas été débuté à la phase aiguë de l'infarctus du myocarde dans les 24 premières heures, il est suggéré de commencer le traitement entre le 3ème et le 16ème jour de l'infarctus dès que les conditions de mise sous traitement sont réunies (stabilité hémodynamique; prise en charge d'une éventuelle ischémie résiduelle).
La mise en route du traitement, jusqu'à ce que soit atteinte la dose de 75 mg, sera réalisée en milieu hospitalier sous surveillance stricte, notamment tensionnelle.
La dose initiale doit être faible (voir rubrique 4.4) surtout si les patients présentent une pression artérielle normale ou basse au départ. Le traitement est initié à la dose de 6,25 mg suivi par 12,5 mg 3 fois par jour pendant 2 jours puis de 25 mg 3 fois par jour si la tolérance hémodynamique du patient le permet.
La dose recommandée pour une cardioprotection efficace dans le traitement au long cours est de 75 mg à 150 mg par jour en deux ou trois prises.
En cas d'hypotension symptomatique, comme dans l'insuffisance cardiaque, la posologie des diurétiques et/ou autres vasodilatateurs associés pourra être réduite pour permettre d'atteindre la dose d'équilibre de captopril. Le cas échéant, la dose de captopril sera adaptée en fonction de la tolérance clinique du patient.
Le captopril peut être associé aux autres traitements de l'infarctus du myocarde tels que les thrombolytiques, les bêta-bloquants, l'aspirine.
Néphropathie diabétique : chez les patients souffrant de néphropathie diabétique du diabète de type I, la posologie quotidienne recommandée de captopril est de 50 à 100 mg, répartis en deux ou trois prises. Si une nouvelle diminution de la pression artérielle est souhaitée, un autre traitement antihypertenseur peut être associé (voir rubriques 4.3, 4.4, 4.5 et 5.1).
Insuffisance rénale : le captopril étant principalement éliminé par les urines, la dose devra être réduite ou l’intervalle entre les doses devra être augmenté chez les patients présentant une insuffisance rénale. En cas d’association avec un traitement diurétique, il est préférable d’utiliser un diurétique de l’anse (par ex furosémide) plutôt qu’un diurétique thiazidique chez les patients souffrant d’insuffisance rénale sévère.
En cas d’insuffisance rénale, les doses journalières suivantes sont recommandées afin d’éviter une accumulation du captopril.
|
Clairance de la créatinine (ml/min/1,73m2) |
Doses initiales recommandées (mg) |
Doses journalières maximales (mg) |
|
>40 |
25-50 |
150 |
|
21-40 |
25 |
100 |
|
10-20 |
12.5 |
75 |
|
<10 |
6.25 |
37.5 |
Sujet âgé : comme avec les autres antihypertenseurs, il faudrait envisager d’initier le traitement à une dose initiale inférieure (6,25 mg deux fois par jour) chez les sujets âgés qui peuvent présenter une fonction rénale altérée et d’autres dysfonctions organiques (voir ci-dessus et rubrique 4.4).
Une titration de la dose devra être faite en fonction de la pression artérielle obtenue et la dose devra être la plus faible possible pour atteindre un contrôle adéquat.
Population pédiatrique
La sécurité et l’efficacité du captopril n’ont pas été entièrement établies. L’utilisation du captopril chez les enfants et les adolescents doit être instaurée sous surveillance médicale étroite. La dose initiale de captopril est d’environ 0,3 mg/kg de poids corporel par jour répartis en 3 prises égales. Chez les patients nécessitant des précautions particulières (enfant présentant une insuffisance rénale, nourrisson prématuré, nouveau-nés et nourrissons car leur fonction rénale est différente de celle des enfants plus âgés et des adultes), la dose initiale doit être seulement de 0,15 mg/kg de poids corporel. Le captopril est généralement administré aux enfants 3 fois par jour, mais les doses et intervalles de doses doivent être adaptés individuellement selon la réponse du patient.
Mode d’administration
Voie orale uniquement.
Substitution du NOYADA avec différentes formulations de captopril :
Une fois la titration faite jusqu’à la dose efficace, le traitement par NOYADA solution buvable doit être maintenu. En cas de nécessité de substitution par une autre formulation de captopril, une nouvelle titration devra être effectuée.
· Antécédent d'angio-œdème lié à la prise d'un inhibiteur de l'enzyme de conversion de l'angiotensine.
· Angio-œdème héréditaire/idiopathique.
· 2ème et 3ème trimestres de la grossesse (voir rubriques 4.4 et 4.6).
· L’association de NOYADA à des médicaments contenant de l’aliskiren est contre-indiquée chez les patients présentant un diabète ou une insuffisance rénale (DFG [débit de filtration glomérulaire] < 60 ml/min/1,73 m2) (voir rubriques 4.5 et 5.1).
· Utilisation concomitante avec un traitement par sacubitril/valsartan. Le traitement par captopril ne doit pas être débuté moins de 36 heures après la dernière dose de sacubitril/valsartan (voir également rubriques 4.4 et 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
Hypotension
De rares cas d'hypotension ont été observés chez des patients présentant une hypertension non compliquée. Une hypotension symptomatique peut survenir plus particulièrement chez des patients hypertendus en état de déplétion hydrosodée suite à un traitement diurétique important, un régime hyposodé, une diarrhée, des vomissements ou une hémodialyse. La déplétion hydrosodée doit être corrigée avant d'administrer un inhibiteur de l'enzyme de conversion et une dose initiale plus faible doit être envisagée.
Les patients présentant une insuffisance cardiaque ont un plus grand risque d’hypotension et il est recommandé d’instaurer le traitement par un inhibiteur de l'enzyme de conversion de l'angiotensine à une dose initiale plus faible. La prudence est de rigueur en cas d’augmentation de la dose de captopril ou du diurétique chez les patients présentant une insuffisance cardiaque.
Comme avec tout antihypertenseur, une baisse excessive de la pression artérielle peut augmenter le risque d'infarctus du myocarde ou d'accident vasculaire cérébral chez les patients présentant une cardiopathie ischémique ou une pathologie vasculaire cérébrale.
Si une hypotension se développe, le patient doit être placé en position allongée. Un remplissage volémique par une solution saline administrée par voie intraveineuse peut être nécessaire.
Hypertension rénovasculaire
Le risque d'hypotension et d'insuffisance rénale augmente chez les patients avec sténose bilatérale des artères rénales ou sténose artérielle rénale sur rein fonctionnellement unique traités par un inhibiteur de l'enzyme de conversion. La perte de la fonction rénale peut survenir même en cas de modification légère de la créatinine sérique. Chez ces patients, le traitement doit être initié sous surveillance médicale étroite avec des posologies faibles, une titration prudente et un suivi de la fonction rénale.
Insuffisance rénale
En cas d’insuffisance rénale (clairance de la créatinine ≤ 40 ml/min), la dose initiale de captopril doit être adaptée en fonction de la clairance de la créatinine (voir rubrique 4.2), puis en fonction de la réponse du patient au traitement. Une surveillance régulière du potassium et de la créatinine relèvent de la pratique médicale habituelle chez ces patients.
Hypersensibilité/Angio-œdème
Un angio-oedème des extrémités, de la face, des lèvres, des muqueuses, de la langue, de la glotte ou du larynx peut apparaître chez les patients traités par un inhibiteur de l'enzyme de conversion, particulièrement lors des premières semaines du traitement. Cependant, dans de rares cas, un angio-oedème sévère peut survenir après un traitement de longue durée par un inhibiteur de l'enzyme de conversion.
En cas de survenue d'un angio-oedème, le traitement doit être interrompu immédiatement. Un angio-oedème affectant la langue, la glotte ou le larynx peut être fatal. Un traitement d'urgence doit être initié. En cas d'atteinte de la langue, de la glotte ou du larynx, susceptible de provoquer une obstruction des voies respiratoires, un traitement approprié, qui peut comprendre une solution d'épinéphrine sous-cutanée 1:1000 (0,3 ml à 0,5 ml) et/ou des mesures visant à assurer une bonne ventilation, doit être administré rapidement. Le patient doit être hospitalisé et gardé sous observation pendant au moins 12 à 24 heures et ne doit pas sortir de l'hôpital avant résolution complète des symptômes.
L'utilisation concomitante d'inhibiteurs de l'enzyme de conversion avec l’association sacubitril/valsartan est contre-indiquée en raison du risque accru d'angio-œdème. Le traitement par sacubitril/valsartan ne doit pas être débuté moins de 36 heures après la dernière dose de captopril. Le traitement par captopril ne doit pas être débuté moins de 36 heures après la dernière dose de sacubitril/valsartan (voir rubriques 4.3 et 4.5).
L'utilisation concomitante d'inhibiteurs de l'enzyme de conversion avec le racecadotril, les inhibiteurs mTOR (par exemple, sirolimus, évérolimus, temsirolimus) et la vildagliptine peut entraîner un risque accru d’angio-œdème (par exemple, gonflement des voies aériennes ou de la langue, avec ou sans atteinte respiratoire) (voir rubrique 4.5). Il convient de faire preuve de prudence lors de la mise en route d’un traitement par racécadotril, inhibiteurs de mTOR (par exemple sirolimus, évérolimus, temsirolimus) et de la vildagliptine à un patient qui prend déjà un inhibiteur de l'enzyme de conversion.
Il a été rapporté que les patients de couleur noire recevant des inhibiteurs de l'enzyme de conversion de l'angiotensine présentaient une incidence plus élevée d'angio-oedème en comparaison aux patients qui ne sont pas de couleur noire.
Angio-oedème intestinal
Un angio-oedème intestinal a également été très rarement rapporté chez des patients traités par inhibiteurs de l'enzyme de conversion. Ces patients présentaient une douleur abdominale (avec ou sans nausées ou vomissements) ; dans certains cas, il n’y avait pas préalablement d’angio-oedème du visage et les taux de C-1 estérase étaient normaux. L’angio-oedème a été diagnostiqué par tomodensitométrie ou échographie abdominales ou au cours de la chirurgie, et les symptômes ont disparu après l’arrêt du traitement par l’inhibiteur de l'enzyme de conversion. Un angio-oedème intestinal doit être envisagé lors du diagnostic différentiel chez les patients traités par des inhibiteurs de l'enzyme de conversion de l'angiotensine présentant une douleur abdominale (voir rubrique 4.8).
Toux
Une toux a été rapportée suite à l'utilisation d'inhibiteurs de l'enzyme de conversion. Elle est non productive et caractérisée par sa persistance ainsi que par sa disparition à l'arrêt du traitement.
Double blocage du système rénine-angiotensine-aldostérone (SRAA)
Il est établi que l’association d’inhibiteurs de l’enzyme de conversion (IEC), d’antagonistes des récepteurs de l’angiotensine-II (ARA II) ou d’aliskiren augmente le risque d’hypotension, d’hyperkaliémie et d’altération de la fonction rénale (incluant le risque d’insuffisance rénale aiguë). En conséquence, le double blocage du SRAA par l’association d’IEC, d’ARA II ou d’aliskiren n’est pas recommandé (voir rubriques 4.5 et 5.1). Néanmoins, si une telle association est considérée comme absolument nécessaire, elle ne pourra se faire que sous la surveillance d’un spécialiste et avec un contrôle étroit et fréquent de la fonction rénale, de l’ionogramme sanguin et de la pression artérielle. Les IEC et les ARA II ne doivent pas être associés chez les patients atteints d’une néphropathie diabétique.
Insuffisance hépatique
Les inhibiteurs de l'enzyme de conversion ont été rarement associés à un syndrome débutant par un ictère cholestatique et progressant vers une nécrose hépatique fulminante et parfois une issue fatale. On ignore le mécanisme de ce syndrome. Les patients sous traitement par un inhibiteur de l'enzyme de conversion présentant un ictère ou une augmentation marquée des enzymes hépatiques doivent arrêter le traitement par un inhibiteur de l'enzyme de conversion et recevoir une surveillance médicale appropriée.
Les inhibiteurs de l'enzyme de conversion peuvent provoquer une hyperkaliémie car ils inhibent la libération d'aldostérone. Cet effet n'est généralement pas significatif chez les patients dont la fonction rénale est normale. Cependant, chez les patients ayant une fonction rénale altérée et/ou prenant des suppléments de potassium (y compris des substituts de sel), des diurétiques épargneurs de potassium, du triméthoprime ou du cotrimoxazole (association triméthoprime/sulfaméthoxazole) et en particulier des antagonistes de l'aldostérone ou des antagonistes des récepteurs de l'angiotensine II, une hyperkaliémie peut survenir. Les diurétiques épargneurs de potassium et les antagonistes des récepteurs de l'angiotensine II doivent être utilisés avec précaution chez les patients recevant des inhibiteurs de l'enzyme de conversion, et la kaliémie et la fonction rénale doivent être surveillés (voir rubrique 4.5).
Association avec le Lithium
L’association de lithium et de captopril n’est pas recommandée (voir rubrique 4.5).
Rétrécissement aortique et mitral/myocardiopathie hypertrophique obstructive
Les inhibiteurs de l'enzyme de conversion doivent être utilisés avec précaution chez les patients présentant un rétrécissement valvulaire ou un obstacle à l'éjection ventriculaire gauche et évités en cas de choc cardiogénique et d'obstruction hémodynamique significative.
Neutropénie/agranulocytose
Une neutropénie/agranulocytose, une thrombopénie et une anémie ont été rapportées chez les patients recevant des inhibiteurs de l'enzyme de conversion, dont le captopril. La neutropénie survient rarement chez les patients à fonction rénale normale et ne présentant pas d'autres facteurs de risque. Le captopril doit être utilisé avec une prudence extrême chez les patients ayant une collagénose, chez ceux recevant un traitement immunosuppresseur, en cas de traitement par allopurinol ou procaïnimide ou en cas d'association de ces facteurs de risque, particulièrement en présence d'une insuffisance rénale pré-existante. Certains de ces patients ont présenté des infections graves qui, dans un petit nombre de cas, n'ont pas répondu à une antibiothérapie intensive.
Si le captopril est administré à ces patients, il est conseillé d'effectuer une numération des globules blancs et de la formule leucocytaire avant le début du traitement, puis toutes les deux semaines pendant les trois premiers mois du traitement par captopril et périodiquement par la suite. Pendant le traitement, chaque patient doit recevoir comme consigne de signaler tout signe d'infection (par exemple, maux de gorge, fièvre) et une numération de la formule leucocytaire doit être effectuée. Le captopril et tout autre traitement concomitant en cause (voir rubrique 4.5) seront interrompus si une neutropénie (granulocytes neutrophiles < 1000/mm3) est détectée ou suspectée.
Chez la plupart des patients, la numération des neutrophiles revient rapidement à la normale après arrêt du captopril.
Anémie
Une anémie avec baisse du taux d'hémoglobine a été mise en évidence chez des patients transplantés rénaux ou hémodialysés, baisse d'autant plus importante que les valeurs de départ sont élevées. Cet effet ne semble pas dose-dépendant mais serait lié au mécanisme d'action des inhibiteurs de l'enzyme de conversion. Cette baisse est modérée, survient dans un délai de 1 à 6 mois puis reste stable.
Elle est réversible à l'arrêt du traitement. Celui-ci peut être poursuivi chez ce type de patients, en pratiquant un contrôle hématologique régulier.
Protéinurie
Une protéinurie peut survenir, notamment chez les patients présentant une insuffisance rénale pré-existante ou recevant des doses relativement élevées d'inhibiteur de l'enzyme de conversion.
Une protéinurie totale excédant 1 g par jour a été observée chez environ 0,7% des patients traités par captopril. La majorité des patients avait une pathologie rénale préexistante ou avait reçu des doses relativement élevées de captopril (plus de 150 mg/jour) ou les deux. Un cinquième des patients protéinuriques ont présenté un syndrome néphrotique. Dans la plupart des cas, la protéinurie a diminué ou totalement régressé en six mois, que le traitement par captopril ait été poursuivi ou non.
Les patients atteints de protéinurie ont rarement présenté des altérations des paramètres de la fonction rénale, tels que l'urée ou la créatinine. Une estimation de la protéinurie (« test-bandelette » sur les premières urines du matin) doit être effectuée, avant le début du traitement et périodiquement par la suite, chez les patients avec antécédents de pathologie rénale.
Réactions anaphylactoïdes lors d'une désensibilisation
Des réactions anaphylactoïdes prolongées, menaçant le pronostic vital ont rarement été rapportées chez des patients suivant un traitement de désensibilisation au venin d'hyménoptère alors qu'ils recevaient un traitement par un autre inhibiteur de l'enzyme de conversion. Chez les mêmes patients, l'arrêt temporaire de l'inhibiteur de l'enzyme de conversion a permis d'éviter ces réactions mais celles-ci sont réapparues suite à une reprise involontaire. Par conséquent, une surveillance particulière doit être exercée chez les patients traités par inhibiteur de l'enzyme de conversion qui suivent ce type de désensibilisation.
Réactions anaphylactoïdes lors d'une dialyse à haut débit/apharèse des lipoprotéines (LDL)
Des réactions anaphylactoïdes ont été rapportées chez des patients hémodialysés avec des membranes de dialyse à haut débit ou soumis à une aphérèse des lipoprotéines de faible densité par adsorption sur dextrane sulfate. Chez ces patients, un changement de type de membrane de dialyse ou de classe de médicament doit être envisagé.
Intervention chirurgicale/anesthésie
Une hypotension peut survenir chez des patients subissant une intervention chirurgicale majeure ou traités par un agent anesthésique connu pour faire baisser la pression artérielle. L'interruption thérapeutique, lorsqu'elle est possible, est donc recommandée la veille de l'intervention pour le captopril. En cas d'hypotension celle-ci pourra être corrigée par un remplissage volémique.
Patients diabétiques
La glycémie fera l'objet d'une surveillance particulière chez les patients diabétiques préalablement traités par antidiabétiques oraux ou par insuline, notamment pendant le premier mois de traitement par un inhibiteur de l'enzyme de conversion.
La fonction rénale chez les patients atteints d'insuffisance cardiaque
Certains patients peuvent développer des élévations stables de l'azote uréique sanguin et de la créatinine sérique >20% au-dessus de la normale ou du niveau de base lors d'un traitement de longue durée avec le captopril. Quelques patients, généralement ceux souffrant d'une maladie rénale grave préexistante, ont dû interrompre leur traitement en raison d'une augmentation progressive de la créatinine.
Origine ethnique
Comme observé avec d'autres inhibiteurs de l'enzyme de conversion de l'angiotensine, le captopril est apparemment moins actif sur la pression artérielle chez les personnes noires que chez les autres personnes, probablement en raison d'une plus forte prévalence d'un taux de rénine bas dans la population noire hypertendue.
Grossesse
Les inhibiteurs de l'enzyme de conversion de l'angiotensine ne doivent pas être débutés au cours de la grossesse. A moins que le traitement par IEC ne soit considéré comme essentiel, il est recommandé aux patientes qui envisagent une grossesse de modifier leur traitement antihypertenseur pour un médicament ayant un profil de sécurité bien établi pendant la grossesse. En cas de diagnostic de grossesse, le traitement par IEC doit être arrêté immédiatement et si nécessaire un traitement alternatif sera débuté (voir rubriques 4.3 et 4.6).
Sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par ml, c'est-à-dire qu'il est essentiellement "sans sodium".
Benzoate de sodium
Le benzoate de sodium peut augmenter la jaunisse (jaunissement de la peau et des yeux) chez les nouveau-nés (jusqu'à 4 semaines). Ce médicament contient 0,5 mg de benzoate de sodium par ml.
Nouveau-nés : la réponse au traitement par les inhibiteurs de l'enzyme de conversion est très variable chez les nouveau-nés, et certains développent une hypotension profonde même à de faibles doses ; le traitement doit être initié à une dose test qui sera augmentée avec précaution. Des effets indésirables comme une apnée, des convulsions, une insuffisance rénale et une hypotension sévère non prévisible sont très fréquents au cours du premier mois de vie, par conséquent il est recommandé d'utiliser les inhibiteurs de l'enzyme de conversion avec précaution, en particulier chez les nouveau-nés prématurés.
Les patients prématurés traités par captopril présentent un risque d’oligurie.
La surveillance de routine des nourrissons traités par inhibiteur de l'enzyme de conversion doit comprendre des évaluations de la fonction rénale, de la pression artérielle et des mesures de la saturation en oxygène transcutanées.
Enfants plus âgés : Comme pour les nouveau-nés, les enfants plus âgés peuvent présenter une hypotension sévère après administration de captopril. Une dose test initiale faible doit être administrée au patient en position allongée afin d'éviter une hypotension grave et une tachycardie. Comme chez les adultes, une hyperkaliémie peut survenir en association avec des diurétiques épargneurs de potassium. La surveillance de routine doit inclure des évaluations de la fonction rénale. Les doses doivent être réduites chez les patients présentant une insuffisance rénale.
Une leucopénie a été rapportée chez des enfants présentant une insuffisance rénale et traités par captopril.
NOYADA ne contenant pas d'agent de masquage du goût ou de l’odeur, il y a une possibilité de manque d’observance du patient qu’il est nécessaire de surveiller pour assurer la posologie appropriée. Les patients doivent être informés que la solution buvable de NOYADA peut avoir une légère odeur sulfureuse, ce qui ne suggère pas une détérioration du produit ou que le produit est impropre à l'utilisation.
NOYADA est disponible en deux dosages : 5 mg/5 ml et 25 mg/5 ml ; la prudence est de rigueur afin de s’assurer que le bon dosage est donné au patient. Le médecin doit prescrire le dosage le plus approprié en fonction des besoins du patient (voir rubrique 4.2).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Diurétiques épargneurs de potassium, suppléments potassiques ou substituts de sel contenant du potassium :
Bien que la kaliémie demeure habituellement dans les limites de la normale, une hyperkaliémie peut survenir chez certains patients traités par cilazapril. Les diurétiques épargneurs de potassium (p. ex. spironolactone, triamtérène ou amiloride), les suppléments potassiques ou les substituts de sel contenant du potassium peuvent entraîner des augmentations significatives de la kaliémie. Il convient également de faire preuve de prudence lors de l’administration de cilazapril avec d’autres médicaments hyperkaliémiants, tels que le triméthoprime et le cotrimoxazole (triméthoprime/sulfaméthoxazole) car le triméthoprime agit comme un diurétique épargneur de potassium tel que l’amiloride. Par conséquent, l’association du cilazapril avec les médicaments susmentionnés n’est pas recommandée. Si une utilisation concomitante est indiquée, elle doit se faire avec précaution et être accompagnée d’une surveillance fréquente de la kaliémie.
Ciclosporine :
Une hyperkaliémie peut survenir lors de l’utilisation concomitante d’IEC avec de la ciclosporine. Une surveillance de la kaliémie est recommandée.
Héparine :
Une hyperkaliémie peut survenir lors de l’utilisation concomitante d’IEC avec de l’héparine. Une surveillance de la kaliémie est recommandée.
Diurétiques (thiazidiques ou diurétique de l’anse) :
Un traitement préalable avec des diurétiques à dose élevée peut provoquer une hypovolémie et un risque d'hypotension lors de l'instauration du traitement par le captopril (voir rubrique 4.4). Les effets hypotenseurs peuvent être réduits par arrêt du diurétique, par augmentation de la prise sodée ou hydrique et l'initiation d'un traitement par une faible dose de captopril. Cependant, les études spécifiques avec l'hydrochlorotiazide ou le furosémide n'ont pas mis en évidence d'interactions médicamenteuses cliniquement significatives.
Autres agents antihypertenseurs :
Le captopril a été administré sans problème avec d'autres antihypertenseurs communément utilisés (bêta-bloquants, inhibiteurs calciques à longue durée d'action). L'administration concomitante de ces agents peut potentialiser les effets hypotenseurs du captopril.
Un traitement concomitant par nitroglycérine et autres dérivés nitrés ou par vasodilatateurs devra être administré avec prudence.
Alpha-bloquants :
L’administration concomitante d’alpha-bloquants peut augmenter les effets antihypertenseurs du captopril et le risque d’hypotension orthostatique.
Traitement de l'infarctus aigu du myocarde :
Le captopril peut être administré en association avec l'acide acétylsalicylique (à doses cardiologiques), les thrombolytiques, les bêta-bloquants et/ou les dérivés nitrés chez des patients ayant subi un infarctus du myocarde.
Lithium :
Une augmentation réversible de la lithémie et de la toxicité du lithium a été rapportée lors de l'administration concomitante de lithium et d'un inhibiteur de l'enzyme de conversion. L'administration concomitante de diurétiques thiazidiques peut augmenter le risque de toxicité du lithium et amplifier le risque déjà accru avec les inhibiteurs de l'enzyme de conversion de toxicité du lithium. L'association de captopril avec le lithium est déconseillée, mais si l'association est jugée nécessaire, une surveillance étroite de la lithémie doit être effectuée (voir rubrique 4.4).
Antidépresseurs tricycliques/Antipsychotiques :
Les inhibiteurs de l'enzyme de conversion peuvent augmenter les effets hypotenseurs de certains antidépresseurs tricycliques et des antipsychotiques (voir rubrique 4.4). Il existe un risque d'hypotension orthostatique.
Allopurinol, procaïnamide, cytostatiques ou immunosuppresseurs :
L’administration concomitante d'un inhibiteur de l'enzyme de conversion peut augmenter le risque de leucopénie et particulièrement lorsque ce dernier est utilisé à des doses supérieures à celles actuellement recommandées.
Anti-inflammatoires non stéroïdiens :
Il a été décrit un effet additif des anti-inflammatoires non stéroïdiens (AINS) et des inhibiteurs de l'enzyme de conversion sur l'augmentation de la kaliémie, tandis que la fonction rénale peut décroître. En principe, ces effets sont réversibles. De rares cas d'insuffisance rénale aiguë peuvent survenir, particulièrement chez les patients à fonction rénale altérée comme les personnes âgées ou les personnes déshydratées. Une administration chronique d'anti-inflammatoires non stéroïdiens peut réduire l'effet antihypertenseur de l'inhibiteur de l'enzyme de conversion.
Sympathomimétiques :
Ils peuvent réduire les effets antihypertenseurs des inhibiteurs de l'enzyme de conversion ; les patients doivent être surveillés étroitement.
Antidépresseurs tricycliques, neuroleptiques, amifostine, baclofène :
L'administration simultanée de ces médicaments avec le captopril peut potentiellement augmenter les effets antihypertenseurs et le risque d'hypotension orthostatique.
Antidiabétiques :
Les études pharmacologiques ont montré que les IEC, dont le captopril, peuvent renforcer les effets hypoglycémiants de l’insuline et des antidiabétiques oraux, tels que les sulfonylurées. Si semblable interaction – très rare – survient, il peut s’avérer nécessaire de réduire la dose de l’antidiabétique en cas de traitement simultané par IEC.
Examens biologiques :
Le captopril peut conduire à un faux positif lors de la recherche urinaire d'acétone.
Double blocage du système rénine-angiotensine-aldostérone (SRAA) :
Les données issues des essais cliniques ont montré que le double blocage du SRAA par l’utilisation concomitante d’inhibiteurs de l’enzyme de conversion (IEC), d’antagonistes des récepteurs de l’angiotensine-II (ARA II) ou d’aliskiren, est associé à une fréquence plus élevée des effets indésirables tels que l’hypotension, l’hyperkaliémie et l’altération de la fonction rénale (incluant l’insuffisance rénale aiguë) en comparaison à l’utilisation d’un seul médicament agissant sur le SRAA (voir rubriques 4.3, 4.4 et 5.1).
Dans de rares cas, des réactions nitritoïdes accompagnées de symptômes tels que bouffées vasomotrices, vertiges, nausées, vomissements et chute de tension artérielle jusqu'à l'effondrement circulatoire ont été observées chez des patients traités simultanément par des inhibiteurs de l'IEC et des préparations injectables à base d'or (aurothiomalate de sodium).
Médicaments augmentant le risque d'angio-œdème :
L’utilisation concomitante d’IEC avec l’association sacubitril/valsartan est contre-indiquée en raison du risque accru d’angio-oedème (voir rubriques 4.3 et 4.4).
L’utilisation concomitante d’IEC avec le racécadotril, les inhibiteurs de mTOR (p. ex. sirolimus, évérolimus, temsirolimus) et la vildagliptine peut entraîner un risque accru d’angio-oedème (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement
Grossesse
L’utilisation des IEC est déconseillée pendant le 1er trimestre de la grossesse (voir rubrique 4.4). L’utilisation des IEC est contre-indiquée aux 2ème et 3ème trimestres de la grossesse (voir rubriques 4.3 et 4.4).
Les données épidémiologiques disponibles concernant le risque de malformation après exposition aux IEC au 1er trimestre de la grossesse ne permettent pas de conclure. Cependant une petite augmentation du risque de malformations congénitales ne peut être exclue.
A moins que le traitement par IEC ne soit considéré comme essentiel, il est recommandé aux patientes qui envisagent une grossesse de modifier leur traitement antihypertenseur pour un médicament ayant un profil de sécurité bien établi pendant la grossesse. En cas de diagnostic de grossesse, le traitement par IEC doit être arrêté immédiatement et si nécessaire un traitement alternatif sera débuté.
L’exposition aux IEC au cours des 2ème et 3ème trimestres de la grossesse est connue pour entraîner une foetotoxicité (diminution de la fonction rénale, oligohydramnios, retard d’ossification des os du crâne) et une toxicité chez le nouveau-né (insuffisance rénale, hypotension, hyperkaliémie) (voir rubrique 5.3). En cas d’exposition à un IEC à partir du 2ème trimestre de la grossesse, il est recommandé d’effectuer une échographie foetale afin de vérifier la fonction rénale et les os de la voûte du crâne. Les nouveau-nés de mère traitée par IEC doivent être surveillés sur le plan tensionnel (voir rubriques 4.3 et 4.4).
Les données limitées de pharmacocinétique montrent des concentrations très faibles dans le lait maternel (voir rubrique 5.2). Bien que ces concentrations ne semblent pas cliniquement pertinentes, l’administration de NOYADA est déconseillée au cours de l’allaitement des enfants prématurés et au cours des premières semaines de vie, en raison du risque hypothétique d’effets cardiovasculaires et rénaux et du manque d’expérience clinique.
Dans le cas des enfants plus âgés, l’administration de NOYADA au cours de l’allaitement peut être envisagée si ce traitement est nécessaire pour la mère et que l’apparition de tout effet indésirable est surveillée chez l’enfant.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables rapportés avec le captopril et présentés ci-dessous sont classés par ordre de fréquence, selon la convention suivante : effets très fréquents (≥ 1/10), fréquents (≥ 1/100 ; < 1/10), peu fréquents (≥ 1/1 000 ; < 1/100), rares (≥ 1/10 000 ; < 1/1 000) et très rares (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Tableau 1. Effets indésirables rapportés avec le captopril au cours des études cliniques et de l’expérience après commercialisation
|
Fréquence
Classe de système d’organes |
Fréquent |
Peu fréquent |
Rare |
Très rare |
|
Affections hématologiques et du système lymphatique |
|
|
|
Neutropénie/agranulocytose (voir rubrique 4.4), pancytopénie particulièrement chez les patients avec une fonction rénale altérée (voir rubrique 4.4), anémie (y compris aplasique et hémolytique), thrombopénie, lymphadénopathie, éosinophilie, maladies auto-immune et/ou anticorps antinucléaires positifs. |
|
Troubles du métabolisme et de la nutrition
|
|
|
Anorexie |
Hyperkaliémie, hyponatrémie, hypoglycémie (voir rubrique 4.4) |
|
Affections psychiatriques
|
Troubles du sommeil |
|
|
Confusion, dépression |
|
Affections du système nerveux
|
Altération du goût, sensations vertigineuses
|
|
Somnolence, céphalées et paresthésie |
Incidents cérébrovasculaires, y compris accident vasculaire cérébral et syncope |
|
Affections oculaires
|
|
|
|
Vision trouble |
|
Affections cardiaques
|
|
Tachycardie ou tachyarythmie, angor, palpitations
|
|
Arrêt cardiaque, choc cardiogénique
|
|
Affections vasculaires
|
|
|
Hypotension (voir rubrique 4.4), syndrome de Raynaud, flush, pâleur
|
|
|
Affections respiratoires, thoraciques et médiastinales
|
Toux sèche et irritative (non productive) (voir rubrique 4.4) et dyspnée
|
|
|
Bronchospasme, rhinite, alvéolite allergique/pneumopathie à éosinophiles
|
|
Affections gastro-intestinales
|
Nausées, vomissements, irritations gastriques, douleurs abdominales, diarrhée, constipation, sécheresse buccale
|
|
Angio-oedème intestinal, stomatite/ulcération aphteuses
|
Glossite, ulcère gastro-duodénal, pancréatite
|
|
Affections hépatobiliaires
|
|
|
|
Insuffisance hépatique et cholestase (incluant l'ictère), hépatite, éventuellement nécrotique, enzymes hépatiques et bilirubine élevés |
|
Affections de la peau et du tissu sous-cutané
|
Prurit avec ou sans rash, rash, et alopécie
|
Angio-œdème (voir rubrique 4.4)
|
|
Urticaire, syndrome de Stevens-Johnson, érythème polymorphe, photosensibilité, érythrodermie, réactions pemphigoïdes, dermatite exfoliatrice et pemphigoïde bulleuse. |
|
Affections musculo-squelettiques et systémiques
|
|
|
|
Myalgie, arthralgie |
|
Affections du rein et des voies urinaires
|
|
|
Troubles de la fonction rénale dont insuffisance rénale, polyurie, oligurie, augmentation de la fréquence des mictions |
Syndrome néphrotique
|
|
Affections des organes de reproduction et du sein
|
|
|
|
Impuissance, gynécomastie
|
|
Troubles généraux et anomalies au site d'administration
|
|
|
Douleur thoracique, fatigue, malaise |
Fièvre
|
|
Investigations
|
|
|
|
Protéinurie, éosinophilie, hyperkaliémie, hyponatrémie, augmentation de l'urémie, de la créatinine et de la bilirubine sériques, baisse de l'hémoglobine, de l'hématocrite, des leucocytes, des plaquettes, anticorps antinucléaires positifs, augmentation de la vitesse de sédimentation des globules rouges
|
Population pédiatrique
Les effets indésirables les plus importants observés dans la population pédiatrique étaient une toux sèche persistante, une hyperkaliémie, un angio-oedème, une diminution du taux de filtration glomérulaire, une hypotension, une neutropénie, une insuffisance hépatique et des troubles de la fonction rénale.
Les réactions le plus fréquemment observées au cours du traitement par captopril étaient maux de tête, tachycardie, vomissements, troubles posturaux, anémie, éruptions cutanées et anorexie.
Des effets indésirables comme une apnée, des convulsions, une insuffisance rénale et une hypotension sévère non prévisible sont très fréquents au cours du premier mois de vie, par conséquent il est recommandé d'utiliser les inhibiteurs de l'enzyme de conversion avec précaution, notamment chez les nouveau-nés prématurés (voir rubrique 4.4).
Les patients prématurés traités par captopril présentent un risque d’oligurie (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Les symptômes de surdosage sont une hypotension sévère, choc, stupeur, une bradycardie, un désordre électrolytique et une insuffisance rénale.
En cas de surdosage, le patient doit être étroitement surveillé, de préférence en unité de soins intensifs. Les niveaux sériques d’électrolytes et la créatinine doivent être fréquemment surveillés, ainsi que la pression artérielle. Les mesures thérapeutiques dépendent de la nature et de la gravité des symptômes.
En cas d'ingestion récente, des mesures doivent être prises pour empêcher l'absorption et accélérer l'élimination, par exemple le lavage gastrique, l'administration d'agents adsorbants et de sulfate de sodium dans les 30 minutes suivant l'ingestion.
En cas d'hypotension, mettre le patient en position adaptée au choc et administrer rapidement un supplément de chlorure de sodium et soluté de remplissage. Un traitement par angiotensine II peut être envisagé.
La bradycardie ou une réaction vagale étendue doivent être traitées par l'administration d'atropine. La pose d'un pacemaker peut être envisagée.
Le captopril est hémodialysable. L’utilisation de membranes de haut flux en polyacrylonitrile est déconseillée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Le captopril est un inhibiteur compétitif hautement spécifique de l'enzyme de conversion de l’angiotensine I.
Le bénéfice des inhibiteurs de l'enzyme de conversion semble résulter essentiellement de l'inhibition du système rénine-angiotensine-aldostérone plasmatique. La rénine est une enzyme endogène produite par les reins, et libérée dans la circulation où elle convertit l'angiotensinogène en angiotensine I, un décapeptide relativement inactif.
L'enzyme de conversion de l'angiotensine (une peptidyldipeptidase) convertit l'angiotensine I en angiotensine II. L'angiotensine II est un vasoconstricteur puissant, qui provoque une vasoconstriction artérielle et augmente la pression sanguine. Elle est aussi responsable de la stimulation de la sécrétion d'aldostérone par le cortex surrénalien.
L'inhibition de l'enzyme de conversion de l'angiotensine entraîne la diminution de l'angiotensine II plasmatique. Il en résulte une diminution de l'activité vasopressive et de la sécrétion d'aldostérone. Cette dernière diminution est faible, mais elle peut entraîner une légère augmentation de la kaliémie, associée à une perte de sodium et de liquides.
Lorsque l'angiotensine II n'exerce plus de rétrocontrôle négatif sur la sécrétion de rénine, l'activité de la rénine plasmatique augmente.
L'enzyme de conversion de l'angiotensine dégrade également la bradykinine, un peptide de type kinine (puissant vasodilatateur), en métabolites inactifs. Par conséquent, l'inhibition de l'enzyme de conversion de l'angiotensine entraîne l'augmentation du système kallikréine-kinine circulant et local, ce qui contribue à la vasodilatation périphérique par activation du système des prostaglandines. Ce mécanisme, qui est responsable de certains effets secondaires, pourrait jouer un rôle dans l'effet hypotenseur du captopril.
L’activité anti-hypertensive après une prise unique par voie orale de captopril est en général maximale entre 60 et 90 minutes après la prise. La durée d’action est dose dépendante. La baisse de la pression artérielle peut être progressive, et plusieurs semaines de traitement peuvent être nécessaires pour atteindre un effet thérapeutique optimal. Les effets antihypertenseurs du captopril et des diurétiques thiazidiques sont cumulatifs.
Chez les patients présentant une hypertension, le captopril entraîne une baisse de la tension artérielle en décubitus et en orthostatisme, sans induire la moindre hausse compensatoire du rythme cardiaque, ni de rétention hydrosodée.
Dans les études hémodynamiques, le captopril a provoqué une réduction marquée de la résistance artérielle périphérique. En général, il n'y avait pas de modifications cliniquement pertinentes du débit plasmatique rénal ou du taux de filtration glomérulaire. Pour la plupart des patients, l’activité antihypertensive se manifeste environ 15 à 30 minutes après la prise par voie orale du captopril ; l'effet maximal étant atteint après 60 à 90 minutes. La baisse maximale de la pression artérielle pour une dose définie de captopril était généralement visible après trois à quatre semaines.
A la dose journalière recommandée, l'effet antihypertenseur persiste même pendant un traitement à long terme. L'interruption temporaire du captopril ne provoque pas d’augmentation rapide et excessive de la tension artérielle (effet rebond). Le traitement de l'hypertension par captopril entraîne également une réduction de l'hypertrophie ventriculaire gauche.
Les études hémodynamiques chez les patients présentant une insuffisance cardiaque ont indiqué que le captopril provoquait une diminution de la résistance périphérique totale et un effet vasodilatateur veineux. Cela entraîne une diminution de la pré-charge et de la post-charge du cœur (baisse de la pression de remplissage ventriculaire). De plus, des augmentations du débit cardiaque, de l’index cardiaque et de la capacité d'exercice ont été observées au cours du traitement par captopril.
Efficacité et sécurité cliniques
Dans une large étude contrôlée versus placebo chez des patients présentant une dysfonction ventriculaire gauche (FEVG ≤ 40 %) après infarctus du myocarde, il est apparu que le captopril (initié entre le 3ème et le 16ème jour après l'infarctus) a prolongé la survie et a réduit la mortalité cardiovasculaire par une réduction de l’évolution vers l'insuffisance cardiaque symptomatique et réduction de l'hospitalisation pour insuffisance cardiaque en comparaison au placebo. Il y avait également une réduction des récidives d'infarctus du myocarde et des revascularisations cardiaques et/ou de la nécessité de traitements complémentaires par diurétiques et/ou digitaliques ou une augmentation de leur dosage en comparaison au placebo.
Une analyse rétrospective a montré que le captopril avait réduit les récidives d’infarctus du myocarde et les revascularisations cardiaques (aucun d'eux n'était des critères de l'étude).
Une autre large étude contrôlée versus placebo chez des patients présentant un infarctus du myocarde a montré que le captopril (administré dans les 24 heures et poursuivi pendant un mois) réduit significativement la mortalité totale après 5 semaines en comparaison au placebo. L'effet bénéfique du captopril sur la mortalité totale restait détectable même après une année. Aucune indication d'un effet négatif lié à la mortalité précoce le premier jour du traitement n'a été découverte.
Les effets cardioprotecteurs du captopril sont observés quel que soit l'âge, le sexe du patient, la localisation de l’infarctus et les traitements associés à l’efficacité démontrée dans le post-infarctus (thrombolytiques, bêtabloquants et aspirine).
Néphropathie associée au diabète de type I
Un essai multicentrique contrôlé versus placebo en double aveugle a montré que l'administration du captopril chez des patients présentant un diabète insulino-dépendant avec protéinurie, associée ou non à une hypertension artérielle (l'administration simultanée d'autres antihypertenseurs pour contrôler la tension artérielle était autorisée) a entrainé une réduction significative (51 %) du temps de doublement de la créatininémie et une réduction significative (51 %) de l'insuffisance rénale en phase terminale (dialyse ou transplantation rénale) et de la mortalité en comparaison au placebo. Chez les patients atteints de diabète avec microalbuminurie, le traitement par le captopril réduisait l'excrétion d'albumine dans les deux ans.
Les effets du traitement par le captopril sur la préservation de la fonction rénale complètent les bénéfices induits par la baisse de la tension artérielle.
L’utilisation de l’association d’un inhibiteur de l’enzyme de conversion (IEC) avec un antagoniste des récepteurs de l’angiotensine II (ARA II) a été analysée au cours de deux larges essais randomisés et contrôlés (ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) et VANEPHRON-D (The Veterans Affairs Nephropathy in Diabetes). L’étude ONTARGET a été réalisée chez des patients ayant des antécédents de maladie cardiovasculaire ou de maladie vasculaire cérébrale, ou atteints d’un diabète de type 2 avec atteinte des organes cibles. L’étude VA NEPHRON-D a été réalisée chez des patients diabétiques de type 2 et atteints de néphropathie diabétique. En comparaison à une monothérapie, ces études n’ont pas mis en évidence d’effet bénéfique significatif sur l’évolution des atteintes rénales et/ou cardiovasculaires et sur la mortalité, alors qu’il a été observé une augmentation du risque d’hyperkaliémie, d’insuffisance rénale aiguë et/ou d’hypotension. Ces résultats sont également applicables aux autres IEC et ARA II, compte tenu de la similarité de leurs propriétés pharmacodynamiques. Les IEC et les ARA II ne doivent donc pas être associés chez les patients atteints de néphropathie diabétique. L’étude ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints) a été réalisée dans le but d’évaluer le bénéfice de l’ajout d’aliskiren à un traitement standard par IEC ou un ARA II chez des patients atteints d’un diabète de type 2 et d’une insuffisance rénale chronique, avec ou sans troubles cardiovasculaires. Cette étude a été arrêtée prématurément en raison d’une augmentation du risque d’événements indésirables. Les décès d’origine cardiovasculaire et les accidents vasculaires cérébraux ont été plus fréquents dans le groupe aliskiren que dans le groupe placebo ; de même les événements indésirables et certains événements indésirables graves tels que l’hyperkaliémie, l’hypotension et l’insuffisance rénale ont été rapportés plus fréquemment dans le groupe aliskiren que dans le groupe placebo.
5.2. Propriétés pharmacocinétiques
Le captopril est actif par voie orale sans nécessiter de biotransformation.
Absorption
L'absorption minimale moyenne est d'environ 75%. Les pics plasmatiques sont atteints dans les 60-90 minutes. La présence d'aliments dans le tube digestif réduit l'absorption d'environ 30-40%.
Environ 25-30% de la substance circulante sont liés aux protéines plasmatiques.
La demi-vie d'élimination apparente du captopril inchangé dans le sang est d'environ 2 heures. Plus de 95% de la dose absorbée sont éliminés dans les urines en 24 heures; 40-50% sont sous forme inchangée et le reste est formé de métabolites disulphides inactifs (captopril disulphide et captopril cysteine disulphide). L'insuffisance rénale peut induire une accumulation. En conséquence, la dose doit être réduite et/ou l’intervalle entre les prises allongé chez les patients présentant une insuffisance rénale (voir rubrique 4.2).
Les études animales démontrent que le captopril ne traverse pas la barrière hémato-encéphalique de façon significative.
Allaitement :
Après administration d'une dose de 100 mg de captopril administré par voie orale 3 fois par jour, chez 12 femmes, les concentrations maximales de captopril dans le lait étaient de 4,7 μg/L 3,8 heures après la prise. On estime qu'un enfant allaité exclusivement à partir du lait maternel serait exposé à une dose maximale correspondant à 0,002% de la dose quotidienne de captopril de la mère.
Pharmacocinétique des solutions orales
Au cours d’une étude de bioéquivalence, croisée, randomisée, à dose unique, le pic plasmatique de captopril après administration orale d’un comprimé de référence à 25 mg (Cmax 268,8±114,6 ng/ml) a été légèrement plus élevé que celui observé après administration de NOYADA 25 mg/5ml (Cmax 229,8±60,9 ng/ml).
5.3. Données de sécurité préclinique
Le captropil n’a pas eu d’effet sur la fertilité des rats mâles et femelles à des doses allant jusqu’à 1800 mg/kg/jour. Les données précliniques basées sur les études conventionnelles de sécurité pharmacologique, de toxicologie à dose répétée, de génotoxicité et du pouvoir carcinogène, n'ont pas révélé d'autres risques spécifiques pour l'homme.
18 mois.
A utiliser dans les 21 jours suivant la première ouverture.
6.4. Précautions particulières de conservation
Ne pas mettre au réfrigérateur.
A conserver à une température ne dépassant pas 25°C.
A conserver dans l’emballage extérieur, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Flacon en verre brun avec système de fermeture sécurisé résistant aux enfants.
Chaque flacon est présenté dans une boîte contenant une seringue de 1ml et une seringue de 5 ml avec adaptateur et une notice destinée aux patients.
![]()
Pour une seringue de 1 ml – chaque trait de graduation numéroté correspond à 0,1 ml équivalent à 0,1 mg de captopril. Les graduations intermédiaires correspondent à 0,05 ml de solution soit 0,05 mg de captopril.
![]()
Pour une seringue de 5 ml – chaque trait de graduation numéroté correspond à 1 ml équivalent à 1 mg de captopril. Les graduations intermédiaires correspondent à 0,2 ml, soit 0,2 mg de captopril.
Flacon de 100 ml.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières pour l’élimination.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
194, BUREAUX DE LA COLLINE
BATIMENT D
92213 Saint-Cloud
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 005 4 7 : 100 ml de solution en flacon (verre brun) avec seringues de 1 ml et de 5 ml ; boite de 1
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
10. DATE DE MISE A JOUR DU TEXTE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.
Médicaments soumis à prescription médicale.
ANSM - Mis à jour le : 24/08/2022
NOYADA 5mg/5ml, solution buvable
Captopril
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que NOYADA 5mg/5ml solution buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre NOYADA 5mg/5ml solution buvable ?
3. Comment prendre NOYADA 5mg/5ml solution buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver NOYADA 5mg/5ml solution buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE NOYADA 5mg/5ml solution buvable ET DANS QUELS CAS EST-IL UTILISE ?
NOYADA contient la substance active captopril qui appartient à la famille des inhibiteurs de l’enzyme de conversion de l’angiotensine. Les inhibiteurs de l’enzyme de conversion de l’angiotensine agissent en permettant à vos vaisseaux sanguins de se dilater pour que votre cœur ait moins de difficulté à pomper le sang.
Le captopril est indiqué chez les adultes, les personnes âgées et les enfants dans les cas suivants :
· Personnes dont le cœur ne pompe plus autant de sang qu'auparavant. On appelle cette maladie une insuffisance cardiaque.
· Personnes ayant récemment eu un infarctus du myocarde. Une attaque cardiaque survient lorsqu'un des principaux vaisseaux sanguins approvisionnant le muscle cardiaque en sang est bloqué. Cela signifie que le cœur ne reçoit pas l'oxygène dont il a besoin et le muscle cardiaque est alors endommagé.
· Maladie rénale chez les personnes diabétiques.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE NOYADA 5mg/5ml solution buvable ?
Ne prenez jamais NOYADA 5mg/5ml solution buvable :
· si vous êtes allergique (hypersensible) au captopril, à tout autre inhibiteur de l’enzyme de conversion ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous avez déjà présenté une réaction qui comprenait le gonflement des mains, des lèvres, du visage ou de la langue dont la cause n'était pas connue.
· si vous êtes enceinte depuis plus de 3 mois (il est préférable d'éviter NOYADA en début de grossesse; voir rubrique Grossesse).
· si vous avez du diabète ou une insuffisance rénale et que vous êtes traité(e) par un médicament contenant de l’aliskiren pour diminuer votre pression artérielle.
· si vous avez pris ou prenez actuellement l’association sacubitril/valsartan, un médicament utilisé pour traiter un type d’insuffisance cardiaque au long cours (chronique) chez l’adulte, car le risque d’angio-oedème (gonflement rapide sous la peau dans une région telle que la gorge) est accru.
Si l'un de ces cas s'applique à vous ou à votre enfant, demandez conseil à votre médecin avant de prendre ce médicament.
Avertissements et précautions
Adressez-vous à votre médecin, votre pharmacien ou à votre infirmier/ère si :
· vous prenez l’un des médicaments suivants pour traiter une hypertension :
o un «antagoniste des récepteurs de l’angiotensine II » (ARA-II) (aussi connu sous le nom de sartan – par exemple valsartan, telmisartan, irbésartan), en particulier si vous avez des problèmes rénaux dus à un diabète.
o Aliskiren.
Votre médecin pourra être amené à surveiller régulièrement le fonctionnement de vos reins, votre pression artérielle et le taux des électrolytes (par ex. du potassium) dans votre sang.
Voir aussi les informations dans la rubrique « Ne prenez jamais NOYADA 5mg/5ml solution buvable ».
Si vous prenez l’un des médicaments qui suivent, le risque d’angio-œdème peut être accru :
● Le racécadotril, un médicament utilisé pour traiter la diarrhée.
● Des médicaments utilisés pour prévenir le rejet d’un organe transplanté et pour traiter le cancer (p. ex. temsirolimus, sirolimus, évérolimus).
● La vildagliptine, un médicament utilisé pour traiter le diabète.
Adressez-vous à votre médecin si :
· vous pensez être enceinte ou planifiez une grossesse. NOYADA est déconseillé pendant la grossesse, et ne doit pas être pris si vous êtes enceinte depuis plus de 3 mois car ce médicament pourrait porter gravement préjudice à votre bébé s'il était utilisé à ce stade (voir la rubrique grossesse),
· vous allaitez ou vous allez débuter l’allaitement,
· vous suivez un régime pauvre en sel,
· vous prenez des diurétiques (médicaments pour aider à uriner),
· vous avez récemment souffert de vomissements ou de diarrhées importants,
· vous êtes sous dialyse,
· vous avez des problèmes cardiaques, en particulier des problèmes avec les valves de votre cœur
· vous souffrez d'une maladie du foie,
· vous êtes diabétique,
· votre visage, votre cou ou votre gorge gonfle,
· votre peau ou le blanc de vos yeux changent de couleur, vous devez consulter immédiatement votre médecin,
· vous devez subir une intervention chirurgicale à l'hôpital ou vous devez vous rendre chez votre dentiste,
· vous avez des maux d'estomac – vous devez informer votre médecin que vous prenez NOYADA
· vous vous sentez nauséeux, ressentez fortement les battements de votre cœur et éprouvez une faiblesse musculaire – vous pourriez présenter des quantités élevées de potassium dans votre sang et votre médecin doit réaliser une analyse de sang pour le vérifier.
Traitement immunosuppresseur
Si vous êtes sous traitement immunosuppresseur, votre médecin pourra réaliser des analyses pendant votre traitement par NOYADA pour s'assurer que vous ne présentez aucun signe d'infection. Si vous commencez à avoir les symptômes d'une infection, tels que des maux de gorge ou de la fièvre, vous devez contacter votre médecin immédiatement.
Patients avec maladie rénale
Si vous souffrez d'une maladie rénale, votre médecin pourra réaliser des analyses avant et pendant votre traitement par NOYADA pour vérifier les niveaux de protéines dans votre urine.
Désensibilisation aux piqûres de guêpes
Si vous devez suivre un traitement de désensibilisation aux piqûres de guêpes ou d'abeilles, vous devez informer votre médecin que vous prenez NOYADA. Dans de rares cas, une réaction allergique grave peut survenir si vous suivez un traitement de désensibilisation pendant que vous prenez ce médicament.
Dialyse
Si vous êtes sur le point de recevoir un traitement pour éliminer du cholestérol de votre sang par une machine (appelée LDL-aphérèse), vous devez informer votre médecin que vous prenez NOYADA. Vous pourriez utiliser un autre type de dialyse pendant que vous prenez ce médicament.
Analyses de sang et d’urine
Informez votre médecin ou infirmier/ère que vous prenez NOYADA avant d'effectuer toute analyse de sang ou d'urine car ce médicament peut interférer avec les résultats de certaines analyses.
Origine ethnique
Si vous êtes un patient noir, vous pourriez avoir besoin de doses plus élevées de NOYADA pour réduire votre tension artérielle.
Enfants
Sans objet.
Autres médicaments et NOYADA 5mg/5ml solution buvable
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
NOYADA peut modifier la façon dont d’autres médicaments agissent.
De plus, certains autres médicaments peuvent également modifier les effets de NOYADA. Il est particulièrement important d’informer votre médecin si vous prenez :
· Des médicaments utilisés pour traiter l'asthme et le rhume (sympathomimétiques), comme l'éphédrine et le salbutamol.
· Des analgésiques anti-inflammatoires non stéroïdiens (AINS), comme l'indométacine et l'ibuprofène.
· Des médicaments qui vous aident à uriner (diurétiques) comme le bendrofluméthiazide et le chlortalidone.
· Des nitrates, des médicaments indiqués dans le traitement des douleurs thoraciques (angine de poitrine) et des problèmes cardiaques comme le trinitrate de glycérol et le dinitrate d'isosorbide.
· De la procaïnamide, un médicament indiqué dans le traitement du rythme cardiaque irrégulier.
· De l'aspirine (acide acétylsalicylique) et d'autres médicaments destinés à fluidifier le sang.
· Tout autre médicament indiqué dans le traitement de l'hypertension, par ex. des bêtabloquants comme le propanolol et l'aténolol ou des antagonistes calciques comme l'amlodipine et la nifédipine.
· Des suppléments potassiques (y compris des substituts de sel), des diurétiques épargneurs de potassium et d’autres médicaments qui peuvent augmenter la quantité de potassium dans le sang (p. ex. le triméthoprime et le cotrimoxazole pour traiter des infections causées par des bactéries ; la ciclosporine, un médicament immunosuppresseur utilisé pour prévenir le rejet d’un organe transplanté ; et l’héparine, un médicament utilisé pour fluidifier le sang afin d’éviter la formation de caillots)
· Des médicaments indiqués dans le traitement du diabète (insulines et sulfonylurées). Il pourrait être nécessaire de modifier votre dose pendant que vous prenez NOYADA.
· Du lithium, un médicament indiqué dans le traitement d'un type de dépression connu sous le nom de trouble bipolaire.
· Des médicaments indiqués pour traiter le cancer ou chez des patients ayant subi une transplantation, (agents cytostatiques/ agents immunosuppresseurs), comme du fluorouracile, de l’estramustine, du méthotrexate, de la ciclosporine et de l'azathioprine.
· Des médicaments indiqués dans le traitement de la dépression et d'autres problèmes de santé mentale comme l'amitriptyline et la chlorpromazine. La prise concomitante de ces médicaments et de NOYADA peut vous donner des sensations d'étourdissements ou vous faire vous évanouir lorsque vous vous levez après avoir été en position assise.
· De l'allopurinol, un médicament indiqué dans le traitement de la goutte
Votre médecin pourrait avoir besoin de modifier la dose de vos médicaments et/ou prendre d’autres précautions :
Si vous prenez un antagoniste des récepteurs de l’angiotensine II (ARA-II) ou de l’aliskiren (voir aussi les informations dans les rubriques « Ne prenez jamais NOYADA 5mg/5ml solution buvable » et « Avertissements et précautions »).
Si vous devez subir une opération
Avant une opération et une anesthésie (même chez le dentiste), vous devez informer votre médecin ou dentiste que vous prenez NOYADA car il pourrait en résulter une chute brutale de votre tension artérielle.
NOYADA 5mg/5ml solution buvable avec des aliments
Sans objet.
Grossesse
Vous devez informer votre médecin si vous pensez être enceinte ou planifiez une grossesse. Votre médecin vous conseillera normalement d'arrêter de prendre NOYADA avant de tomber enceinte ou dès que vous apprenez votre grossesse et il vous conseillera de prendre un autre médicament. NOYADA est déconseillé en début de grossesse, et ne doit pas être pris si vous êtes enceinte de plus de 3 mois car ce médicament pourrait porter gravement préjudice à votre bébé s'il était utilisé après le troisième mois de grossesse.
Allaitement
Vous devez informer votre médecin si vous allaitez ou allez débuter l’allaitement. L'allaitement des nouveau-nés (les premières semaines après la naissance), et particulièrement des bébés prématurés, est déconseillé pendant la prise de NOYADA.
Pour les bébés plus âgés, votre médecin vous conseillera quant aux bénéfices et risques de la prise de NOYADA pendant l'allaitement, en comparaison avec d'autres traitements.
Conduite de véhicules et utilisation de machines
Le captopril peut affecter votre capacité à conduire, en général lorsque vous commencez à prendre votre médicament ou lorsque votre médecin modifie votre dose. Si vous avez des sensations d'étourdissement ou de vertige quand vous prenez NOYADA, vous ne devez pas conduire de véhicule ni utiliser de machines.
NOYADA 5mg/5ml solution buvable contient du sodium et du benzoate de sodium
NOYADA contient 0,5 mg de benzoate de sodium par millilitre. Le benzoate de sodium peut augmenter la jaunisse (jaunissement de la peau et des yeux) chez les nouveau-nés (jusqu'à 4 semaines).
Odeur de NOYADA 5mg/5ml solution buvable
Ne vous inquiétez pas si vous sentez une légère odeur sulfureuse (œuf pourri) provenant de la solution buvable NOYADA. Cela ne signifie pas que ce médicament est impropre à l'emploi. Dans la mesure du possible, nous recommandons d'administrer ce médicament à l'aide de la seringue de mesure fournie.
3. COMMENT PRENDRE NOYADA 5mg/5ml solution buvable ?
Substitution du NOYADA avec des différentes formulations de captopril :
Si vous prenez NOYADA, vous ne devez pas le changer pour utiliser un autre médicament contenant du captopril sans l’avis de votre médecin.
NOYADA 5 mg/5 ml, solution buvable contient les dispositifs d’administration suivants :
· une seringue de 1 ml avec des traits de graduation numérotés correspondant à 0,1 ml (= 0,1 mg de captopril) et des graduations intermédiaires correspondant à 0,05 ml de solution (= 0,05 mg de captopril).
· une seringue de 5 ml avec des traits de graduation numérotés correspondant à 1 ml (=1mg de captopril) et des graduations intermédiaires correspondant à 0,2 ml de solution (=0.2mg de captopril).
Patients âgés ou patients présentant des troubles rénaux :
Votre médecin pourra débuter votre traitement à une dose inférieure. Si vous présentez un trouble rénal, votre médecin augmentera la dose progressivement jusqu'à ce que votre pression artérielle soit correctement contrôlée et ce jusqu'à un maximum de 150 mg par jour.
Votre médecin pourra adapter la dose selon vos besoins personnels.
Traitement de l'hypertension artérielle :
La dose de départ habituelle est de 12,5 mg à 25 mg deux fois par jour. Votre médecin pourra progressivement augmenter cette dose jusqu’à 100 mg à 150 mg par jour. Vous pouvez aussi avoir besoin de prendre d'autres médicaments antihypertenseurs.
Si vous présentez des problèmes rénaux ou cardiaques ou avez des faibles niveaux sanguins, vous pourrez recevoir une dose de départ inférieure, de 6,25 mg ou 12,5 mg. Cette dose pourra être augmentée progressivement jusqu’à 50 mg à 100 mg par jour.
Traitement de l'insuffisance cardiaque :
La dose de départ habituelle est de 6,25 mg à 12,5 mg deux à trois fois par jour. Votre médecin pourra progressivement augmenter cette dose jusqu’à un maximum de 150 mg par jour.
Après un infarctus du myocarde - traitement à court terme :
La dose de départ habituelle est de 6,25 mg, elle sera ensuite progressivement augmentée par votre médecin jusqu'à un maximum de 100 mg par jour.
Après un infarctus du myocarde - traitement à long terme :
La dose de départ habituelle est de 6,25 mg, elle sera ensuite progressivement augmentée par votre médecin jusqu'à un maximum de 150 mg par jour.
Utilisation chez les patients diabétiques :
La dose habituelle est de 75 mg à 100 mg par jour. Les patients âgés débutent généralement à la dose de 6,25 mg deux fois par jour.
Utilisation chez les enfants :
Votre médecin prescrira le dosage de NOYADA le plus approprié en fonction de l'âge, du poids et du schéma posologique de l'enfant
Assurez-vous de mesurer la bonne quantité.
La dose de départ est de 0,3 mg/kg de poids corporel répartie en 3 prises égales par jour. La dose pourra ensuite être progressivement augmentée par le médecin.
Enfants présentant des problèmes rénaux, bébés prématurés, nouveau-nés et nourrissons
La dose de départ est de 0,15 mg/kg de poids corporel.
Assurez-vous de mesurer la bonne quantité.
A quel moment prendre NOYADA 5 mg/5ml, solution buvable
Vous devez essayer de prendre NOYADA environ à la même heure chaque jour. Comme les aliments ne modifient pas l’absorption du captopril, il peut être pris avant, pendant ou après les repas.
BIEN AGITER AVANT UTILISATION
Mode d’administration
Votre médecin, pharmacien ou infirmier/ère vous montrera comment administrer ce médicament. La boîte contenant ce médicament contient une seringue de dosage de 1 ml et une seringue de dosage de 5 ml avec adaptateur.
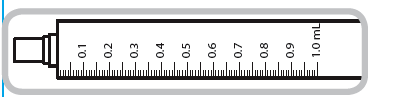
Seringue de 1 ml. Chaque trait de graduation numéroté (trait orange) correspond à 0,1 ml de solution équivalant à 0,1 mg de captoril. Les graduations intermédiaires correspondent à 0.05 ml de solution soit 0.05 mg de captopril.
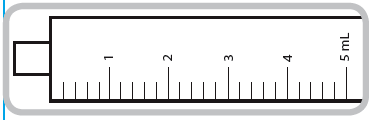
Seringue de 5 ml. Chaque trait de graduation numéroté (trait violet) correspond à 1 ml de solution équivalant à 1 mg de captopril. Les graduations intermédiaires correspondent à 0,2 ml de solution soit 0,2 mg de captopril.
Les instructions relatives à l'utilisation de la seringue sont fournies ci-dessous. Si vous avez une question concernant la dose que vous devez utiliser ou sur la façon d’utiliser la seringue, vous devez interroger votre pharmacien.
Instructions d’utilisation
· Ouvrez le flacon : enfoncez le bouchon et tournez-le dans le sens inverse des aiguilles d’une montre (figure1)
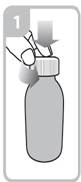
· En tenant le flacon d'une main, prenez l'adaptateur en plastique de la seringue et insérez-le dans le flacon (figure 2). Assurez-vous qu'il soit bien fixé
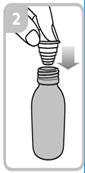
· Prenez la seringue et insérez-la dans l'adaptateur (figure 3). Retournez entièrement le flacon.
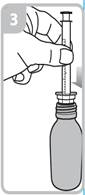
· Remplissez la seringue avec une petite quantité de solution en tirant le piston vers le bas (figure 4a), puis poussez le piston vers le haut pour enlever le plus de bulles possible (figure 4b). Tirez le piston vers le bas jusqu’au trait de graduation correspondant à la quantité en millilitres (ml) prescrite par votre médecin (figure 4c).
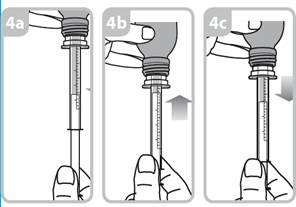
· Retournez le flacon à l’endroit. Retirez la seringue de l'adaptateur (figure 5).
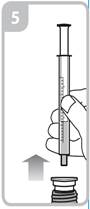
· Administrez le contenu de la seringue dans la bouche en poussant le piston jusqu'au fond de la seringue (figure 6) et assurez-vous que tout le médicament soit bien avalé.

Enlevez l'adaptateur du flacon et refermez le flacon avec le bouchon à vis en plastique.
Après utilisation lavez l'adaptateur et la seringue à l'eau chaude. Séchez-les avec une serviette en papier propre et rangez-les dans la boîte avec votre médicament.
Si vous avez pris plus de NOYADA 5 mg/5 ml, solution buvable que vous n’auriez dû :
Si vous ou une autre personne avez pris plus de NOYADA que vous n’auriez dû, rendez-vous immédiatement au service des urgences de l'hôpital le plus proche ou informez immédiatement votre médecin. Emmenez avec vous la boite et le flacon avec ce qu'il reste de solution.
Si vous oubliez de prendre NOYADA 5 mg/5 ml, solution buvable :
Si vous arrêtez de prendre NOYADA 5 mg/5 ml, solution buvable :
Vous ne devez pas arrêter de prendre NOYADA sans consulter tout d’abord votre médecin, même si vous vous sentez bien. Si vous pensez que vous devez arrêter de prendre ce médicament, vous devez en discuter avec votre médecin avant d'arrêter de le prendre.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, votre pharmacien ou votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables graves
Si vous (ou votre enfant) présentez un des effets suivants, arrêtez de prendre NOYADA et contactez votre médecin IMMÉDIATEMENT :
· Gonflement des mains, du visage, des lèvres ou de la langue.
· Respiration sifflante ou difficulté à respirer.
· Ulcères, éruption cutanée bulleuse ou brûlure, peau rouge, décollement de la peau au niveau des lèvres, de la langue et des organes génitaux, pouvant s’étendre aux yeux, au visage et au corps (une maladie très rare connue sous le nom de syndrome de Stevens-Johnson).
· Maux de gorge ou fièvre.
· Étourdissements graves ou évanouissements.
· Douleur thoracique grave qui s’étend jusqu'au bras gauche.
· Respiration rapide et profonde, peau moite et froide et sensations d'anxiété.
· Douleurs d'estomac graves.
· Jaunissement de la peau et/ou des yeux.
Autres effets indésirables
Fréquents : Pouvant affecter jusqu'à une personne sur 10
· Des convulsions ont été observées chez les nourrissons.
· Troubles de la respiration chez les nourrissons pendant leur sommeil.
· Troubles posturaux chez les nourrissons.
· Faibles quantités d'urines chez les bébés prématurés.
· Perte de poids chez les bébés prématurés.
· Troubles du sommeil.
· Modifications du goût.
· Étourdissements.
· Toux sèche, irritante.
· Essoufflement.
· État nauséeux.
· Indigestion ou douleur d'estomac.
· Diarrhées ou constipation.
· Bouche sèche.
· Démangeaisons ou éruptions cutanées rouges.
· Perte des cheveux.
Peu fréquents : Pouvant affecter jusqu'à une personne sur 100
· Battements du cœur rapides et irréguliers, ou palpitations.
· Rougeur ou pâleur inhabituelle.
· Hypotension. Vous pouvez ressentir des étourdissements ou vous évanouir.
· Doigts ou orteils douloureux, froids et pâles en raison d’un manque d'afflux sanguin (syndrome de Raynaud).
Rares : Pouvant affecter jusqu'à une personne sur 1 000
· Perte d'appétit.
· Somnolence.
· Maux de tête.
· Picotements, sensation de piqûres ou engourdissement de la peau.
· Douleur et gonflement à l'intérieur de la bouche.
· Ulcères buccaux.
· Modifications du fonctionnement de vos reins. Votre médecin réalisera des analyses pour contrôler ces modifications.
· Modifications de la fréquence des urines.
· Crampes d'estomac, douleur abdominale ou douleur qui se déplace de l'estomac jusqu'au dos.
· Fatigue.
· Sentiment général de mal être.
Très rares : Pouvant affecter jusqu'à une personne sur 10 000
· Saignements de nez ou de gencives.
· Ganglions enflés.
· Modifications dans votre sang. Votre médecin réalisera des analyses pour contrôler ces modifications.
· Modifications des taux de potassium, de sodium et de sucres dans le sang. Votre médecin réalisera des analyses pour contrôler ces modifications.
· Confusion.
· Dépression.
· Mini-AVC.
· Évanouissements.
· Vision trouble.
· Nez bouché.
· Oppression thoracique ou douleur lancinante dans la poitrine.
· Modifications du fonctionnement du foie ou atteinte hépatique. Votre médecin réalisera des analyses pour contrôler ces modifications.
· Démangeaisons et jaunissement de la peau.
· Sensibilité à la lumière.
· Douleurs musculaires ou articulaires.
· Difficulté à avoir une érection ou à la maintenir.
· Gonflement du tissu mammaire chez les hommes (gynécomastie)
· Fièvre.
· Attaque ou choc cardiaque.
· Ulcères d’estomac.
· Syndrome de Stevens-Johnson (une maladie grave avec des cloques sur la peau, la bouche, les yeux et les organes génitaux).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER NOYADA 5 mg/5 ml, solution buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N'utilisez pas ce médicament après la date de péremption indiquée sur la boite et le flacon après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ne pas mettre au réfrigérateur. A conserver dans l’emballage extérieur, à l’abri de la lumière.
A conserver à une température ne dépassant pas 25°C.
A utiliser dans les 21 jours après ouverture
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient NOYADA 5 mg/5 ml, solution buvable
· La substance active est : captopril
Chaque ml de la solution orale 5 mg/5 ml contient 1mg de captopril
· Les autres composants sont : EDTA disodique, benzoate de sodium (E211), acide citrique (E330), citrate de sodium (E331), eau purifiée. Il peut également contenir de l'hydroxyde de sodium (E524) pour ajustement du pH.
Qu’est-ce que NOYADA 5 mg/5 ml, solution buvable et contenu de l’emballage extérieur
Noyada 5 mg/5 ml, solution buvable se présente sous forme de solution limpide, incolore en flacon en verre brun de 100 ml.
Chaque boîte contient un flacon de solution, une seringue de dosage de 1 ml et une seringue de dosage de 5 ml avec adaptateur.
Titulaire de l’autorisation de mise sur le marché
194, BUREAUX DE LA COLLINE
BATIMENT D
92213 Saint-Cloud
FRANCE
Exploitant de l’autorisation de mise sur le marché
LABORATOIRES ETHYPHARM
179, BUREAUX DE LA COLLINE
92210 SAINT-CLOUD
FRANCE
MARTINDALE PHARMACEUTICALS LIMITED
BAMPTON ROAD
HAROLD HILL, ROMFORD
ESSEX
RM3 8UG
ROYAUME-UNI
Ou
Ethypharm
Z.I. de Saint Arnoult
28170 Châteauneuf-en-Thymerais
France
Ou
Ethypharm
Chemin de la Poudrière,
76120 Le Grand Quevilly
France
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
A compléter ultérieurement par le titulaire
Sans objet.