
ANSM - Mis à jour le : 03/04/2025
OZALIN 2 mg/mL, solution buvable en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Chaque mL d’OZALIN contient 2 mg de midazolam.
Chaque ampoule de 5 mL d’OZALIN contient 10 mg de midazolam.
Excipients à effet notoire : éthanol (moins de 100 mg par ampoule), sodium (moins de 1 mmol (23 mg) par ampoule), gammadex (400 mg par ampoule, quantité inférieure à l’exposition quotidienne autorisée de 20 mg/kg/jour à la dose recommandée).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution buvable en récipient unidose.
Solution limpide à légèrement opalescente, jaune pâle à brun clair, avec un pH compris entre 3,6 et 4,2.
4.1. Indications thérapeutiques 
4.2. Posologie et mode d'administration 
La solution buvable OZALIN doit être administrée uniquement par des professionnels de santé.
Les règles de jeûne préopératoire doivent être respectées avant la sédation.
Posologie
La dose doit être adaptée en fonction du poids du patient.
OZALIN doit être administré par voie orale en dose unique de 0,25 mg/kg dans la population pédiatrique à partir de l’âge de six mois. L’administration d’une dose ultérieure immédiate n’est pas recommandée (voir rubrique 5.2).
La dose maximale ne doit pas dépasser 20 mg de midazolam (équivalent à 2 ampoules), même pour les enfants et les adolescents pesant plus de 80 kg.
OZALIN est indiqué pour une administration en dose unique. Il n’existe pas de données disponibles concernant une administration répétée d’OZALIN.
Chez les enfants et les adolescents obèses, la dose doit être déterminée en fonction du poids réel, sans excéder 20 mg.
La dose doit être adaptée en fonction du poids du patient. L’applicateur pour administration orale est gradué en kilogrammes de poids corporel, de 3 kg à 40 kg (voir rubrique 6.6, pictogramme n°6) et présente trois types de graduations :
· Une petite graduation correspondant à 1 kg, soit 0,25 mg de midazolam,
· Une graduation intermédiaire correspondant à 5 kg, soit 1,25 mg de midazolam,
· Une grande graduation correspondant à 10 kg, soit 2,5 mg de midazolam.
Pour les patients pesant plus de 40 kg, 2 ampoules sont nécessaires. La dose minimale pouvant être prélevée par ampoule correspond à une dose pour 3 kg. Pour les patients pesant 41 et 42 kg, nécessitant plus d’une ampoule, prélevez une dose correspondant à moins de 40 kg dans la première ampoule et prélevez le complément de dose dans la seconde ampoule, selon les exemples ci-dessous :
· Pour un patient de 41 kg, il est recommandé de prélever une dose correspondant à 30 kg dans la première ampoule et à 11 kg dans la seconde ampoule,
Pour un patient de 42 kg, il est recommandé de prélever une dose correspondant à 30 kg dans la première ampoule et à 12 kg dans la seconde ampoule.
Populations particulières
Insuffisance rénale
OZALIN doit être utilisé avec prudence chez les patients présentant une insuffisance rénale chronique car l’élimination du midazolam peut être retardée et ses effets peuvent être prolongés.
Insuffisance hépatique
L’insuffisance hépatique diminue la clairance du midazolam, ce qui augmente la demi-vie terminale (pour l’élimination) ainsi que la biodisponibilité. Une surveillance attentive de ces effets et des signes vitaux est nécessaire après l’administration de midazolam chez ces patients (voir rubrique 4.4).
Population pédiatrique
La sécurité et l’efficacité d’OZALIN chez les enfants âgés de moins de six mois n’ont pas été établies. Aucune donnée n’est disponible (voir rubrique 5.1).
Mode d’administration
OZALIN doit être administré par voie orale uniquement et à l’aide de son applicateur spécifique pour administration orale, gradué en kilogrammes de poids corporel.
OZALIN doit être administré en moyenne 30 minutes avant la procédure ou l’anesthésie.
L’applicateur pour administration orale et la canule filtrante sont des dispositifs de prélèvement et d’administration à usage unique.
Il est indispensable de jeter, après utilisation, l’ampoule, l’applicateur pour administration orale et la canule filtrante.
Des instructions détaillées sont fournies à la rubrique 6.6.
Chez les patients présentant :
· une hypersensibilité à la substance active, aux benzodiazépines ou à l’un des excipients mentionnés à la rubrique 6.1,
· une myasthénie grave,
· une insuffisance respiratoire sévère,
· une anomalie anatomique des voies respiratoires ou une maladie pulmonaire,
· un syndrome d’apnée du sommeil,
· une insuffisance hépatique sévère.
4.4. Mises en garde spéciales et précautions d'emploi 
Administration à des patients à haut risque
Le midazolam doit être utilisé avec prudence chez les patients présentant une insuffisance respiratoire chronique car il peut aggraver la dépression respiratoire.
Le midazolam doit être utilisé avec prudence chez les patients présentant une insuffisance hépatique légère ou modérée, une insuffisance cardiaque ou une insuffisance rénale chronique. Le midazolam ou son métabolite peut s’accumuler chez les patients présentant une insuffisance rénale chronique ou une insuffisance hépatique, et la clairance du midazolam peut être diminuée chez les patients présentant une insuffisance cardiaque.
Le midazolam par voie orale doit être utilisé avec prudence chez les patients en mauvaise santé générale car ils sont plus sensibles aux effets des benzodiazépines sur le système nerveux central.
Modification de l’élimination du midazolam
Le midazolam oral doit être utilisé avec prudence chez les patients traités par des médicaments connus pour inhiber ou induire le CYP3A4 (voir rubrique 4.5).
Utilisation concomitante d’alcool/de dépresseurs du système nerveux central
L’utilisation combinée de midazolam et d’alcool et/ou de dépresseurs du système nerveux central doit être évitée. Une telle association est susceptible d’augmenter les effets cliniques du midazolam, ce qui peut provoquer une sédation profonde ou une dépression respiratoire cliniquement significative (voir rubrique 4.5).
Antécédents d’alcoolisme ou de toxicomanie
A l’instar des autres benzodiazépines, le midazolam doit être évité chez les patients présentant des antécédents d’alcoolisme ou de toxicomanie.
Amnésie
Le midazolam peut provoquer une amnésie antérograde.
Conditions de sortie
Les patients ayant reçu du midazolam doivent être accompagnés d’un adulte à leur sortie de la salle de soins et quitter la salle de soins et l’hôpital uniquement après que les effets sédatifs se sont dissipés et après avoir obtenu l’autorisation du médecin.
Excipients
Pour une dose unique recommandée de 0,25 mg/kg (et avec une dose maximale de midazolam de 20 mg), la quantité correspondante de gammadex est de 10 mg/kg (avec une dose maximale de 800 mg). Cette quantité de gammadex est inférieure à la dose quotidienne autorisée (200 mg/kg/jour, et 20 mg/kg/jour pour les enfants de moins de deux ans). Par conséquent, même si OZALIN était administré par erreur à la dose de 0,5 mg/kg, la quantité de gammadex ne dépasserait pas la dose quotidienne autorisée.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule, c.-à-d. qu’il est essentiellement « sans sodium ».
Ce médicament contient au maximum 17,4 mg d’alcool (éthanol, composant de l’arôme orange) par dose (ampoule de 5 ml), équivalent à 3,5 mg/ml (éthanol/solution) ou 0,32 % p/v.
La quantité d’éthanol dans 1 ampoule de 5 ml de ce médicament (17,4 mg) équivaut à 0,2 ml de vin. La quantité d’éthanol dans 2 ampoules de 5 ml de ce médicament (34,8 mg) équivaut à 0,4 ml de vin, à la dose maximale de 20 mg de midazolam.
La faible quantité d’alcool contenue dans ce médicament n’est pas susceptible d’entraîner d’effet notoire.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Interactions pharmacocinétiques
Le midazolam étant principalement métabolisé par l’enzyme CYP3A4, les inhibiteurs et inducteurs du CYP3A4 peuvent, respectivement, augmenter ou diminuer les concentrations plasmatiques. Par conséquent, les effets cliniques du midazolam peuvent être augmentés ou diminués et sa durée d’action peut être prolongée ou raccourcie. Une surveillance attentive des effets cliniques et des signes vitaux du patient est donc recommandée après l’administration de midazolam avec un inhibiteur du CYP3A4, même après une dose unique.
En cas d’inhibition ou d’inhibition irréversible du CYP3A4, l’effet sur la pharmacocinétique du midazolam peut persister plusieurs jours ou plusieurs semaines après l’administration du modulateur du CYP3A4 (clarithromycine, érythromycine, inhibiteurs de la protéase du VIH, vérapamil, diltiazem, atorvastatine, aprépitant, par exemple).
En cas d’administration concomitante avec l’éthinylestradiol et le norgestrel (utilisés comme contraceptifs oraux), l’exposition au midazolam n’est pas significativement altérée.
Inhibiteurs du CYP3A4 :
· Antifongiques azolés : kétoconazole, itraconazole, voriconazole, fluconazole, posaconazole.
· Inhibiteurs de la protéase du VIH : saquinavir et autres inhibiteurs de la protéase, y compris associations contenant du ritonavir.
· Antibiotiques macrolides : clarithromycine, érythromycine, télithromycine, roxithromycine ; la roxithromycine augmente de 30 % la demi-vie terminale du midazolam administré par voie orale sous forme de comprimés.
· Inhibiteurs calciques : diltiazem, vérapamil ; le vérapamil et le diltiazem multiplient les concentrations plasmatiques du midazolam oral par 3 et 4, respectivement, et augmentent sa demi-vie terminale de 41 % et 49 %, respectivement.
· Antagonistes de la substance P : aprépitant ; l’aprépitant entraîne une augmentation dose-dépendante des concentrations plasmatiques de midazolam oral. La concentration plasmatique est multipliée par 3,3 après 80 mg/jour d’aprépitant et sa demi-vie terminale par un facteur de 2 environ.
· Antagonistes H2 : cimétidine, ranitidine.
· Inhibiteurs sélectifs de la recapture de la sérotonine : fluvoxamine.
· Médicaments anticholinergiques : propivérine.
· Autres médicaments (atorvastatine, néfazodone, aprépitant, ivacaftor).
· Substances végétales : jus de pamplemousse, Echinacea purpurea, rhizome du curcuma.
Inducteurs du CYP3A4 :
· Antibiotiques de rifamycine : rifampicine ; la rifampicine réduit la concentration plasmatique du midazolam oral de 96 % chez les sujets sains, avec une disparition presque totale des effets psychomoteurs du midazolam.
· Médicaments antiépileptiques : carbamazépine, phénytoïne ; l’administration répétée de carbamazépine ou de phénytoïne réduit la concentration plasmatique du midazolam oral jusqu’à 90 % et diminue la demi-vie terminale de 60 %.
· Inhibiteurs de la transcriptase inverse : éfavirenz ; le rapport α-hydroxymidazolam (métabolite généré par le CYP3A4) est multiplié par un facteur de cinq par rapport au midazolam, ce qui confirme l’effet inducteur de l’éfavirenz sur le CYP3A4.
· Millepertuis (Hypericum perforatum).
Le midazolam n’est pas connu pour modifier la pharmacocinétique d’autres médicaments.
Interactions pharmacodynamiques
L’administration concomitante du midazolam avec d’autres agents sédatifs/hypnotiques et des dépresseurs du système nerveux central est susceptible d’augmenter la sédation et la dépression respiratoire.
Ces agents sédatifs/hypnotiques comprennent l’alcool (y compris les médicaments contenant de l’alcool), les opiacés/opioïdes (utilisés comme antalgiques, antitussifs ou traitements substitutifs), les antipsychotiques, les autres benzodiazépines utilisées comme anxiolytiques ou hypnotiques, les barbituriques, le propofol, la kétamine, l’étomidate, les antidépresseurs sédatifs, les antihistaminiques, les antiépileptiques et les antihypertenseurs d’action centrale. Le midazolam diminue la concentration alvéolaire minimale (CAM) des anesthésiques par inhalation.
L’effet combiné de l’alcool et du midazolam doit être strictement évité, et la consommation d’alcool doit être strictement évitée lors de l’administration de midazolam (voir rubrique 4.4 et rubrique 4.9).
4.6. Fertilité, grossesse et allaitement 
Grossesse
Les données sur le midazolam sont insuffisantes pour évaluer sa sécurité pendant la grossesse. Les études effectuées chez l’animal n’indiquent pas d’effet tératogène, mais une fœtotoxicité a été observée avec d’autres benzodiazépines. Il n’existe pas de données sur les expositions pendant les deux premiers trimestres de la grossesse.
Des effets indésirables pour la mère ou le fœtus ont été rapportés lors de l’administration de doses élevées de midazolam pendant le dernier trimestre de la grossesse, pendant l’accouchement ou lorsque le midazolam était utilisé en tant qu’agent pour l’induction de l’anesthésie lors d’une césarienne : risque d’inhalation chez la mère, irrégularités du rythme cardiaque du fœtus, hypotonie, mauvaise succion, hypothermie et détresse respiratoire du nouveau-né.
De plus, les nourrissons nés de mères ayant reçu des benzodiazépines de manière chronique à un stade plus avancé de la grossesse peuvent avoir acquis une dépendance physique et peuvent présenter un risque de développer des symptômes de sevrage pendant la période postnatale.
Par conséquent, le midazolam peut être utilisé pendant la grossesse s’il est clairement nécessaire, mais il est préférable d’éviter de l’utiliser lors d’une césarienne.
Le risque pour les nouveau-nés doit être pris en considération en cas d’administration de midazolam lors de toute intervention chirurgicale proche du terme.
Allaitement
Le midazolam est excrété en faibles quantités dans le lait maternel. Les mères qui allaitent doivent être avisées d’interrompre l’allaitement pendant 24 heures après l’administration du midazolam.
Fertilité
Les études effectuées chez l’animal n’ont pas mis en évidence de diminution de la fertilité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
OZALIN a une influence majeure sur l’aptitude à conduire des véhicules et à utiliser des machines.
Une sédation, une amnésie antérograde, une altération de l’attention et une altération de la fonction musculaire peuvent affecter momentanément l’aptitude à conduire des véhicules ou à utiliser des machines. Avant d’administrer OZALIN, le patient doit être averti de ne pas conduire ou utiliser une machine avant d’avoir complètement récupéré. C’est au médecin de décider du moment de reprise de ces activités. Il est recommandé au patient d’être accompagné d’un adulte lors de son retour à domicile après sa sortie.
Au cours de l’administration du midazolam, les effets indésirables suivants ont été rapportés à une fréquence indéterminée, qui ne peut être estimée sur la base des données disponibles :
|
Effet indésirable - fréquence indéterminée |
|
|
Affections cardiaques |
Tachycardie, bradycardie. |
|
Affections psychiatriques |
Réactions paradoxales (agitation, excitation, hallucinations, agressivité, désinhibition, dysphorie, comportement indésirable, anxiété), dérèglement du sommeil, mouvements involontaires, akathisie, instabilité de la marche, tremblements. |
|
Affections du système nerveux |
Sédation prolongée/hypersédation, endormissement, somnolence, sensations vertigineuses, ataxie, vertige, dysarthrie, bouche sèche, salivation, énurésie, céphalées, amnésie antérograde. |
|
Affections oculaires |
Vision trouble, diplopie (Généralement légère) |
|
Affections respiratoires, thoraciques et médiastinales |
Hypoxémie, désaturation transitoire, laryngospasme, dépression respiratoire, obstruction des voies aériennes, ronchi/bruit respiratoire, hoquet, dyspnée. |
|
Affections gastro-intestinales |
Vomissements, nausées. |
|
Affections de la peau et du tissu sous-cutané |
Prurit, réaction urticarienne, rash cutané. |
|
Affections musculo-squelettiques et systémiques |
Altération du contrôle musculaire. |
|
Troubles généraux et anomalies au site d’administration |
Fatigue inhabituelle, sensation de faiblesse. |
|
Affections du système immunitaire |
Hypersensibilité, angioedème. |
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Symptômes
A l’instar de toutes les benzodiazépines, le midazolam induit fréquemment un endormissement, une ataxie, une dysarthrie et un nystagmus. Un surdosage en midazolam engage rarement le pronostic vital si ce produit est pris seul, mais un surdosage peut provoquer une aréflexie, une apnée, une hypotension, une dépression cardiorespiratoire et, dans de rares cas, un coma. Les effets dépresseurs respiratoires des benzodiazépines sont plus graves chez les patients présentant une maladie respiratoire ou cardiaque ou si le médicament est associé à d’autres dépresseurs du système nerveux central, dont l’alcool.
Traitement
Dans la plupart des cas, une surveillance des signes vitaux s’avère nécessaire.
En cas de surdosage, une attention particulière doit être accordée aux fonctions respiratoires et cardiovasculaires en soins intensifs.
En cas de surdosage, des vomissements doivent être induits si le patient est conscient (dès que possible et, dans tous les cas, dans l’heure suivant l’administration orale du midazolam). Si le patient est inconscient, un lavage gastrique doit être effectué tout en protégeant les voies respiratoires. Si le lavage gastrique n’est pas efficace, du charbon activé doit être administré afin de réduire l’absorption.
Le flumazénil, un antagoniste des benzodiazépines, est indiqué en cas d’intoxication sévère accompagnée de dépression respiratoire ou de coma. Ce traitement doit être uniquement administré sous étroite surveillance. La demi-vie du flumazénil est courte (environ une heure), ce qui nécessite une surveillance après la disparition de l’effet de ce produit. Une extrême prudence s’impose lors de l’utilisation du flumazénil en cas de surdosage d'un patient consécutif à l’administration concomitante de différents médicaments et chez des patients épileptiques déjà traités par benzodiazépines. Le flumazénil ne doit être utilisé qu’avec une extrême prudence chez les patients traités par des antidépresseurs tricycliques ou des médicaments qui abaissent le seuil épileptogène, et chez les patients présentant des anomalies à l’ECG (allongement du QRS ou de l’intervalle QT).
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : benzodiazépines, code ATC : N05CD08
Mécanisme d’action
Le midazolam est un dérivé du groupe des imidazobenzodiazépines. Les effets pharmacologiques des benzodiazépines résultent d’interactions réversibles avec le récepteur de l’acide γ-aminobutyrique (GABA) des benzodiazépines du système nerveux central, principal neurotransmetteur inhibiteur du système nerveux central.
Effets pharmacodynamiques
Les propriétés pharmacodynamiques du midazolam et de ses métabolites, similaires à celles des autres benzodiazépines, comprennent des effets sédatifs, anxiolytiques, amnésiques (amnésie antérograde), hypnotiques, myorelaxants et anticonvulsivants.
L’action pharmacologique du midazolam se caractérise par une courte durée d’action due à une transformation métabolique rapide. L’action du midazolam est facilement inversée par l’antagoniste des récepteurs des benzodiazépines : le flumazénil.
Efficacité et sécurité cliniques
Les données issues des rapports publiés sur les études menées chez des patients pédiatriques démontrent clairement que le midazolam oral agit comme un sédatif et un anxiolytique avant une intervention chirurgicale nécessitant une anesthésie ainsi que dans le cadre d’autres procédures médicales nécessitant une sédation sans anesthésie.
Plusieurs études ont été menées auprès de centaines d’enfants nécessitant une sédation modérée avant une prémédication anesthésique ou une intervention médicale. Ces enfants ont reçu une dose unique de midazolam par voie orale (sans qu’il soit associé à un autre dépresseur du système nerveux central). La sédation maximale a généralement été atteinte dans les 30 à 45 minutes suivant l’administration du midazolam pour une dose de midazolam comprise entre 0,25 et 1,0 mg/kg. En ce qui concerne l’effet anxiolytique, des données similaires ont été obtenues. Les effets sédatifs ont été obtenus pour des concentrations plasmatiques de midazolam comprises entre 30 et 160 ng/mL et une concentration plasmatique efficace pour 50 % des patients (CE50) comprise entre 18 et 171 ng/mL en fonction de la méthode utilisée pour évaluer la sédation (données pédiatriques et adultes).
Une étude portant sur OZALIN a été menée chez des patients pédiatriques âgés de 6 mois à 17 ans et nécessitant une prémédication anesthésique. Les résultats issus de cette étude correspondent à ceux issus de la littérature. Des effets sédatifs et anxiolytiques ont été observés dans les 30 minutes suivant l’administration orale d’une dose unique d’OZALIN de 0,269 mg/kg en moyenne et d’une concentration plasmatique de midazolam comprise entre 15 et 65 ng/mL. Une CE50 de 53,82 ng/mL a été observée après l’administration orale d’OZALIN à la dose de 15 mg (0,245 mg/kg en moyenne) chez des sujets adultes en bonne santé. Aucune donnée n’est disponible chez les enfants et adolescents non à jeun âgés de 6 mois à 17 ans et recevant une dose orale unique d’OZALIN.
5.2. Propriétés pharmacocinétiques 
Après administration par voie orale, le midazolam est absorbé rapidement et complètement.
Données issues de la littérature
Après administration par voie orale du midazolam, la concentration plasmatique maximale (Cmax) est atteinte en 30 à 60 minutes (Tmax). Une Cmax comprise entre 70 et 154 ng/mL a été rapportée après l’administration d’une dose de 15 mg chez des adultes en bonne santé. Une Cmax allant de 30 à 200 ng/mL a été rapportée en fonction de la dose administrée (de 0,25 à 1,0 mg/kg) et de l’âge de l’enfant (de 6 mois à 17 ans).
La biodisponibilité varie entre 30 et 50 % selon l’étude et la formulation orale utilisée.
Données relatives à OZALIN
Après administration d’une dose unique d’OZALIN par voie orale, la Cmax a été atteinte en 35 à 45 minutes (Tmax médian) chez les sujets adultes et adolescents, respectivement. D’après l’analyse pharmacocinétique de la population (PK-POP) des données adultes et pédiatriques, la plus grande partie du midazolam est absorbée au cours des 30 minutes suivant l’administration d’OZALIN.
Après l’administration d’une dose orale de 15 mg (0,245 mg/kg en moyenne) d’OZALIN, une Cmax de 113 ng/mL a été obtenue chez des sujets adultes en bonne santé. Avec une dose d’OZALIN de 0,12 à 0,30 mg/kg, une Cmax moyenne de 40,8 ng/mL a été atteinte chez les enfants.
La biodisponibilité absolue du midazolam administré par voie orale est de 39,4 % chez les adultes ayant reçu une dose de 15 mg d’OZALIN.
Distribution
La distribution tissulaire du midazolam administré par voie orale est très rapide et, dans la plupart des cas, la phase de distribution n’est pas apparente ou est essentiellement terminée dans les 1 à 2 heures suivant l’administration orale. Le midazolam est très lipophile et largement distribué. Le midazolam est fortement lié aux protéines plasmatiques (de l’ordre de 96 à 98 %) et principalement à l’albumine.
Le passage du midazolam dans le liquide céphalo-rachidien est lent et négligeable. Chez l’Homme, le midazolam traverse la barrière placentaire et pénètre lentement dans la circulation fœtale. De faibles quantités de midazolam sont retrouvées dans le lait maternel.
Données issues de la littérature
Le volume de distribution à l’état d’équilibre est compris entre 1,0 et 2,5 L/kg et atteint jusqu’à 6,6 L/kg.
Données relatives à OZALIN
Le volume de distribution du midazolam est de 4,7 L/kg chez les sujets adultes en bonne santé.
D’après l’analyse PK-POP, le volume central de distribution et le volume périphérique de distribution ont été estimés à 27,9 L et à 413 L, respectivement, pour un sujet typique pesant 34 kg.
Biotransformation
Le midazolam est presque complètement éliminé par biotransformation. Le midazolam est hydroxylé par l’enzyme CYP3A4 et le principal métabolite urinaire et plasmatique est l’α-hydroxymidazolam. Les concentrations plasmatiques de l’α-hydroxymidazolam représentent 30 à 50 % de celles de la molécule parente. L’α-hydroxymidazolam est pharmacologiquement actif et contribue de manière significative (environ 34 %) aux effets du midazolam oral.
Données issues de la littérature
Après administration orale, l’effet de premier passage hépatique est estimé à entre 30 et 60 % environ.
Après administration orale chez l’enfant, le rapport de l’aire sous la courbe (ASC) de l’α-hydroxymidazolam au midazolam varie de 0,38 à 0,75.
Données relatives à OZALIN
Environ 40 % de l’exposition à l’α-hydroxymidazolam est due à l’effet de premier passage hépatique.
Le rapport métabolique est respectivement de 0,504, 0,364 et 0,313 chez les enfants, les adolescents et les adultes.
Elimination
Chez les sujets adultes en bonne santé, la clairance plasmatique est comprise entre 300 et 500 mL/min (ou entre 4 et 13 mL/min/kg). Le midazolam est principalement éliminé par excrétion rénale ; 60 à 80 % de la dose administrée est excrétée dans les 24 heures suivant l’administration et est retrouvée sous forme d’α-hydroxymidazolam glucuroconjugué. Moins de 1 % de la dose administrée est retrouvée sous forme inchangée dans les urines. La demi-vie d’élimination du midazolam est d’environ 3 heures. Celle de l’α-hydroxymidazolam est d’environ 2 heures.
Données issues de la littérature
Chez les enfants, la demi-vie peut varier considérablement, de 0,5 à 7 heures selon l’étude, quel que soit l’âge de l’enfant et la dose de midazolam. La clairance plasmatique a été estimée à entre 1,5 et 3,6 L/h/kg.
Données relatives à OZALIN
La demi-vie a été estimée à 3,6 heures chez les adolescents. D’après l’analyse PK-POP, la clairance du midazolam a été estimée à 34,7 L/h et la clairance de l’α-hydroxymidazolam à 40,6 L/h, pour un sujet typique pesant 34 kg.
Pharmacocinétique dans les populations particulières
Nouveau-nés et nourrissons
OZALIN n’a pas été étudié chez les patients pédiatriques de moins de 6 mois.
Patients obèses
La demi-vie moyenne du midazolam est plus élevée chez les patients obèses que chez les patients non-obèses (5,9 heures versus 2,3 heures). Cela est dû à une augmentation d’environ 50 % du volume de distribution corrigé en fonction du poids corporel total. Il n’existe pas de différence significative en termes de clairance plasmatique entre les sujets obèses et non-obèses. Une surveillance plus longue des patients obèses après l’intervention peut s’avérer nécessaire.
Patients présentant une insuffisance hépatique
Chez les patients cirrhotiques, la demi-vie d’élimination peut être plus longue et la clairance plus faible que celle observée chez les sujets sains, en raison du risque d’accumulation d’α-hydroxymidazolam (voir rubriques 4.2 et 4.3).
Patients présentant une insuffisance rénale
La demi-vie d’élimination chez les patients présentant une insuffisance rénale chronique est similaire à celle observée chez les sujets sains. Néanmoins, le midazolam oral doit être utilisé avec prudence chez les patients présentant une altération de la fonction rénale.
Patients présentant une insuffisance cardiaque
La demi-vie d’élimination est plus longue chez les patients présentant une insuffisance cardiaque congestive que chez les sujets sains (voir rubrique 4.4).
5.3. Données de sécurité préclinique 
Il n’y a pas de données précliniques pertinentes pour le prescripteur autres que celles déjà mentionnées dans les autres rubriques du RCP.
Avant ouverture : 3 ans.
Après ouverture : le produit doit être utilisé immédiatement après ouverture et doit ensuite être éliminé.
6.4. Précautions particulières de conservation 
A conserver à une température ne dépassant pas 25°C.
Ne pas mettre au réfrigérateur. Ne pas congeler.
A conserver dans l’emballage d’origine, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur 
Ampoule en verre ambré de 5 mL (verre de type I), canule filtrante et applicateur pour administration orale. L’ampoule, la canule filtrante et l’applicateur pour administration orale sont conditionnés dans un blister individuel.
Boîte contenant 1 ampoule, 1 canule filtrante et 1 applicateur pour administration orale.
Boîte contenant 5 ampoules, 5 canules filtrantes et 5 applicateurs pour administration orale.
Boîte contenant 10 ampoules, 10 canules filtrantes et 10 applicateurs pour administration orale.
L’applicateur pour administration orale et la canule filtrante sont à usage unique. L’applicateur pour administration orale dispose de graduations indiquées en kg de poids corporel : de 3 kg à 40 kg, avec graduations tous les 1 kg.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
Utilisation dans la population pédiatrique
OZALIN doit être administré par voie orale uniquement.
Instructions pour une utilisation en toute sécurité de l’ampoule d’OZALIN, de l’applicateur pour administration orale et de la canule filtrante mentionnées sur le blister.
OZALIN doit être administré uniquement avec son applicateur dédié et spécifique, gradué en kilogrammes de poids corporel.
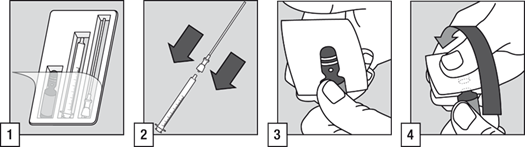 C
C
(1) L’administration au patient nécessite l’utilisation de l’ampoule, de l’applicateur pour administration orale et de la canule filtrante.
(2) Connecter la canule filtrante sur l’extrémité de l’applicateur pour administration orale.
(3) Effectuer des tapotements sur le haut de l’ampoule pour vous assurer qu’il ne reste plus de liquide. Recouvrir la tête de l’ampoule à l’aide d’une compresse et placez l’un de vos pouces sur le point blanc.
(4) Tenir l’ampoule fermement en faisant en sorte que le point blanc soit placé vers le haut et face à vous. Tirer le col de l’ampoule vers l’arrière et celle-ci s’ouvrira facilement.
(5)
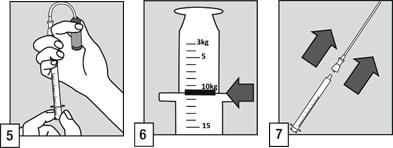 |
(6) Tout en maintenant l’ampoule en position verticale, remplissez l’applicateur pour administration orale jusqu’à la graduation correspondant au poids du patient en kilogrammes (kg). Alignez la marque repère avec le haut du rebord de l’applicateur pour prélever la dose appropriée.
(7) Retirez la canule filtrante de l’extrémité de l’applicateur pour administration orale.
(8) Vider le contenu de l’applicateur pour administration orale dans la bouche du patient. La solution doit être avalée immédiatement.
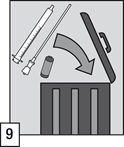
(9) Après utilisation, jeter l’ampoule, la canule filtrante, l’applicateur pour administration orale ainsi que tout contenu inutilisé, dans un conteneur réservé à cet effet et conformément aux exigences locales en vigueur concernant les substances contrôlées et les accessoires pharmaceutiques.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
MANNERHEIMINTIE 12 B
00100 HELSINKI
FINLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 550 599 9 8 : Solution buvable en ampoule de 5 mL (verre ambré) + canule filtrante + applicateur, boîte de 5.
· 34009 550 600 1 7 : Solution buvable en ampoule de 5 mL (verre ambré) + canule filtrante + applicateur, boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I.
Médicament réservé à l'usage hospitalier.
Médicament pouvant être administré par tout médecin spécialisé en anesthésie-réanimation ou en médecine d'urgence dans les cas où il intervient en situation d'urgence ou dans le cadre d'une structure d'assistance médicale mobile ou de rapatriement sanitaire (article R. 5121-96 du code de la santé publique).
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |