
ANSM - Mis à jour le : 11/01/2024
KALDENN 4,32 - 5,28 GBq, générateur radiopharmaceutique
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
KALDENN est un générateur radiopharmaceutique de rubidium-82 (82Rb) contenant du strontium-82 (82Sr) comme nucléide père qui décroît en nucléide fils, le rubidium-82 (82Rb).
Le strontium-82 (82Sr) est adsorbé par de l’oxyde d’étain sur une colonne chromatographique. KALDENN permet d’obtenir par élution une solution injectable stérile et apyrogène de chlorure de rubidium-82 (82Rb).
L’activité du générateur est comprise entre 4,32 et 5,28 GBq de 82Sr à date et heure de calibration. L’activité de la solution de chlorure de rubidium (82Rb) obtenue à chaque élution dépend de l’activité de strontium-82 présent, du temps écoulé depuis l’élution précédente et du débit d’élution du générateur.
Spécifications
Les spécifications de l’éluat sont les suivantes :
· 82Sr ≤ 2x10-5 MBq/MBq 82Rb
· 83Rb ≤ 5x10-5 MBq/MBq 82Rb
· 85Sr ≤ 2x10-4 MBq/MBq 82Rb
· pour tous les autres radio-contaminants : ≤ 5x10-6 MBq/MBq 82Rb
· la teneur en étain doit être inférieure à 1 µg/mL
Propriétés physiques
Excipient à effet notoire :
Chaque mL de solution contient 9 mg de chlorure de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
Générateur radiopharmaceutique.
Il permet d’obtenir par élution des solutions injectables de chlorure de rubidium-82.
4.1. Indications thérapeutiques 
Ce médicament est à usage diagnostique uniquement.
L’éluat du générateur (solution injectable de chlorure de rubidium-82 (82Rb)) est destiné à l’imagerie par Tomographie par Emission de Positons (TEP) du myocarde au repos et sous stress pharmacologique, dans le but d’évaluer la perfusion régionale myocardique chez les adultes ayant une pathologie des artères coronaires connue ou suspectée.
4.2. Posologie et mode d'administration 
Posologie
Chez l’adulte et le sujet âgé
L'activité recommandée chez un adulte est de 740 à 2220 MBq (cette activité doit être adaptée selon la masse corporelle du patient, le type de caméra TEP utilisée et le mode d’acquisition des images). Cette activité doit être administrée par perfusion intraveineuse.
Insuffisance rénale et hépatique
Une diminution de la fonction hépatique ou rénale altérant la clairance de la solution de chlorure de rubidium 82Rb n’est pas attendue car le 82Rb, avec une demi-vie de 75 secondes, décroît en gaz 82Kr stable et le gaz 82Kr est naturellement expiré par voie respiratoire.
Population pédiatrique
La sécurité et l’efficacité de KALDENN chez les enfants n’ont pas été établies.
Mode d’administration
Administration intraveineuse par perfusion.
Pour les instructions sur la préparation du produit, voir la rubrique 12.
Préparation des patients : voir rubrique 4.4.
L’administration de ce radiopharmaceutique doit se faire avec un débit de 10 mL/minute les premières semaines d’utilisation du générateur et jusque 50 mL/minute les dernières semaines d’utilisation du générateur, au moyen d’un cathéter posé dans une large veine périphérique, en ne dépassant pas un volume total de 100 mL. Ne jamais dépasser le débit d’élution de 50 mL/minute, ce qui pourrait conduire à un relargage de strontium 82Sr.
Acquisition des images
En général, deux doses distinctes doivent être administrées afin d’effectuer une étude au repos et une étude lors d’une épreuve pharmacologique :
Pour une étude de la perfusion myocardique au repos :
· administrer une activité unique de solution de chlorure de rubidium (82Rb)
· débuter l’imagerie TEP en mode liste lorsqu’une activité est détectée dans le système de détection. En général, l’acquisition des images dure 7 à 8 minutes.
Pour une étude de la perfusion myocardique lors d’une épreuve pharmacologique :
· afin d’éviter la persistance d’activité résiduelle de l’injection précédente de chlorure de rubidium (82Rb), débuter l’épreuve pharmacologique au moins 10 minutes après la fin de l’injection de l’activité de chlorure de rubidium (82Rb) administrée précédemment.
· Réaliser l’épreuve pharmacologique en accord avec la procédure en vigueur (en utilisant un médicament vasodilatateur approuvé à cet effet)
· Sous stress pharmacologique, administrer une activité unique de chlorure de rubidium (82Rb)
Patients avec dysfonction ventriculaire gauche
Chez les patients avec une FEVG <40%, il est conseillé de surveiller l’absence d’apparition de signes d’insuffisance cardiaque congestive suite aux volumes d’éluat injecté (voir rubrique 4.4).
Pour obtenir une quantification fiable de la perfusion myocardique de repos et de stress avec la TEP au Rubidium-82, il est indispensable d’utiliser un logiciel adapté intégrant un modèle compartimental de captation myocardique du Rubidium-82 et de vérifier que les courbes des premiers passages sanguin et myocardique du Rubidium-82 sont de bonne qualité (absence de mouvement significatif du patient durant l’acquisition dynamique ou replacer si besoin les régions d’intérêt, pic de signal bien identifié sur la courbe de premier passage sanguin).
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi 
Possibilité de réactions d’hypersensibilité ou anaphylactiques
En cas de réaction d’hypersensibilité ou de réaction anaphylactique, l’administration du produit doit être immédiatement arrêtée et un traitement par voie intraveineuse doit être mis en place, si nécessaire. Afin de permettre une prise en charge rapide en cas d’urgence, il convient d’avoir à disposition immédiate les médicaments, le personnel et le matériel nécessaires, notamment une sonde d’intubation trachéale et du matériel de ventilation.
Justification individuelle du rapport bénéfice/risque
Pour chaque patient, l’exposition aux radiations ionisantes doit pouvoir être justifiée par le bénéfice attendu. Dans tous les cas, l’activité administrée doit être aussi faible que possible pour obtenir raisonnablement les informations diagnostiques requises.
Insuffisants cardiaques
Lors de l’injection, une attention particulière doit être portée aux patients présentant une insuffisance cardiaque congestive, du fait de l’expansion du volume intravasculaire lié au volume d’éluat injecté.
Population pédiatrique
La sécurité et l’efficacité du chlorure de rubidium 82Rb chez l’enfant n’ont pas été établies. L’administration chez l’enfant devra être évitée, car la dose efficace par MBq est plus élevée chez les enfants que chez les adultes (voir rubrique 11).
Préparation du patient
Le patient doit être à jeun depuis au moins 6 heures. Le patient doit être bien hydraté avant le début de l’examen.
Après l´examen TEP
Du fait de la demi-vie très brève du 82Rb, les patients n’ont pas de précautions particulières à prendre vis à vis de l’exposition aux rayonnements après l’examen.
Mises en garde spécifiques
Seule une solution de chlorure de sodium 9 mg /mL injectable sans impureté ni additif peut être utilisée pour l’élution du générateur.
La solution injectable de chlorure de rubidium (82Rb) est prévue pour une administration par voie intraveineuse uniquement au moyen d’un système de perfusion adéquat (voir rubrique 12), permettant des mesures et une administration d’activités précises de chlorure de rubidium (82Rb) ne devant pas dépasser en activité unique : 2220 MBq, et en activité cumulée : 4440 MBq sous un débit de 50 ml/minute, avec un volume maximum par perfusion de 100 mL et un volume total ne devant pas dépasser 200 mL.
La solution de chlorure de rubidium (82Rb) contient du sodium. En fonction du moment de l’injection, la teneur en sodium administrée peut-être supérieure à 1 mmol dans certains cas. Il convient d’en tenir compte chez les patients suivant un régime hyposodé strict.
Précautions à prendre dans le respect du risque environnemental, voir rubrique 6.6.
La solution de chlorure de rubidium (82Rb) contribue à une exposition cumulée aux radiations ionisantes.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu'il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Aucune étude d’interaction n’a été réalisée.
4.6. Fertilité, grossesse et allaitement 
Femmes en âge de procréer
Une grossesse doit être exclue avant la réalisation de l’examen.
Lors de l’administration d’un produit radiopharmaceutique à une femme en âge de procréer, il est important de s'informer sur une éventuelle grossesse. Toute femme n'ayant pas eu ses règles doit être considérée comme enceinte jusqu'à preuve du contraire.
Grossesse
Ce médicament est contre-indiqué pendant la grossesse.
Aucune étude sur la reproduction chez l’animal n’a été menée avec le rubidium-82. La dangerosité du 82Rb sur le fœtus lorsqu’il est administré à une femme enceinte n’est pas connue. Cependant, la radioactivité peut potentiellement causer des anomalies génétiques, mais qui à ce niveau d’activité, n’ont pas été mises en évidence.
Allaitement
L’excrétion du rubidium-82 dans le lait maternel n’est pas connue. Du fait de la courte demi-vie du 82Rb (75 secondes), il est peu probable que ce produit se retrouve dans le lait maternel. Toutefois, comme de nombreuses substances actives sont excrétées dans le lait, des précautions seront prises lors de son administration à une femme allaitante. Il est en général suffisant de ne pas reprendre l’allaitement dans l’heure qui suit la dernière injection de 82RbCl et d’éliminer le lait tiré.
Fertilité
Aucune étude sur la fertilité n’a été réalisée.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
L’état cardiovasculaire du patient et les éventuels effets indésirables doivent être pris en compte afin de déterminer cette aptitude.
Aucun évènement indésirable associé au Rubidium-82 n’a été observé lors des études cliniques.
L'exposition à des rayonnements ionisants peut induire un cancer ou le développement de déficiences héréditaires. La dose efficace étant de 6mSv lorsque la radioactivité cumulée maximale recommandée de 4440 MBq est administrée, la probabilité de survenue de ces effets indésirables est considérée comme peu probable.
Une exposition involontaire des patients aux radiations ionisantes due à une contamination par le strontium peut survenir pour les patients recevant du chlorure de rubidium 82Rb issu du générateur KALDENN lorsque le contrôle de qualité n’est pas réalisé correctement sur le site d’administration. Les directives concernant le contrôle de qualité sur les sites d’administration doivent être scrupuleusement respectées (voir rubrique 12).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Du fait de la nature du produit et de son utilisation, un surdosage cliniquement significatif de 82Rb est improbable. Afin d’éviter l’administration d’une quantité importante de Strontium 82Sr et 85Sr (relargage), il convient de respecter scrupuleusement la procédure d’utilisation et de ne pas dépasser le débit maximal d’élution de 50 mL/minute.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Mécanisme d’action
Aucune activité pharmacologique n’a été observée aux activités administrées à des fins diagnostiques. L’utilisation en diagnostic médical de KALDENN repose essentiellement sur les propriétés de bio-distribution du 82Rb.
Effets pharmacodynamiques
Aux concentrations chimiques et aux activités recommandées pour les examens de diagnostic, le chlorure de rubidium-82 ne semble pas avoir d’activité pharmacodynamique.
Dans les études sur l’Homme, une activité myocardique a été mise en évidence au cours de la première minute qui suit l’injection intraveineuse périphérique de 82Rb. Lorsque des zones d’infarctus ou d’ischémie sont présentes dans le myocarde, il est possible de visualiser ces zones hypofixantes dans les deux à sept minutes suivant l’injection.
Chez les patients souffrant de dysfonction cardiaque (FEVG < 40 %), le temps de circulation peut être allongé et l’extraction myocardique du rubidium 82Rb peut être également retardée/diminuée (voir rubrique 4.4).
La circulation systémique distribuant le 82Rb dans tout le corps lors du premier passage, une diffusion du traceur est également observée dans d’autres tissus tels que les reins, le foie, la rate et les poumons.
Efficacité et sécurité clinique
Après quarante ans d’utilisation clinique de l’imagerie par Tomographie d’Emission de Positons (TEP) avec du rubidium-82, de nombreuses publications ont montré que cette technique d’imagerie améliorait très sensiblement l’analyse de la perfusion myocardique comparativement aux scintigraphies monophotoniques (faites généralement avec du 99m-Tc comme traceur) et cela sans aucun effet indésirable imputable au rubidium-82. Cet avantage de la technique TEP sur les gammas caméras a été confirmé pour les détecteurs les plus récents type CZT.
Entre 2008 et 2019, 7 méta-analyses ont comparé les performances diagnostiques de la tomographie d’émission par simples photons (SPECT) de la perfusion myocardique, la tomographie par émission de positons (TEP) de la perfusion myocardique et l’imagerie par résonance magnétique (IRM) de la perfusion myocardique. Le nombre total de patients inclus dans ces 7 méta-analyses était de 32.065 pour l’imagerie SPECT, de 5.163 pour l’imagerie cardiaque en TEP et de 3.820 pour l’IRM. Les sensibilités pour la détection de sténose coronaire significative variaient de 69 à 88% pour l’imagerie cardiaque en SPECT, de 83 à 93% pour l’imagerie cardiaque en TEP et de 88 à 89% pour l’IRM cardiaque. Les spécificités pour la détection de sténose coronaire significative variaient de 61 à 85% pour l’imagerie SPECT, de 81 à 89% pour l’imagerie TEP et de 81 à 89% pour l’IRM. L’imagerie TEP avec le rubidium-82 offre donc une meilleure sensibilité et spécificité pour la détection de sténose coronaire significative que celles de l’imagerie SPECT conventionnelle avec technetium-99m, en particulier chez les patients en surpoids et les femmes avec une atténuation mammaire importante. En outre, elle ajoute une réelle valeur pronostique pour prédire le risque de décès d’origine cardiaque aux facteurs traditionnels de risque coronarien. Enfin, elle permet de mesurer le flux sanguin myocardique sous stress pharmacologique et au repos et de calculer ainsi la réserve myocardique de perfusion qui a un intérêt déterminant pour le diagnostic de l’ischémie myocardique équilibrée et l’atteinte microvasculaire en mettant en évidence une diminution significative de la réserve de perfusion myocardique malgré une répartition en apparence homogène du signal avec une interprétation purement qualitative.
5.2. Propriétés pharmacocinétiques 
Après administration intraveineuse, la clairance sanguine du 82Rb est rapide du fait de la diffusion interstitielle importante au niveau des capillaires du myocarde, la fraction d’extraction du 82Rb étant de 65 %.
Le Rubidium présente une distribution biologique similaire à celle du Potassium.
Absorption au niveau des tissus
Le 82Rb est absorbé par les cellules myocardiques via des pompes Na+/K+ ATP-ase. L'augmentation de l'absorption de 82Rb diminue avec l'augmentation du débit sanguin du myocarde.
L’absorption myocardique du 82Rb est observée dans la première minute après l'injection du chlorure de 82Rb. Chez des patients présentant une diminution cliniquement importante de la fonction cardiaque, ce délai peut être prolongé.
L’absorption du 82Rb est également observée dans les reins, le foie, la rate et les poumons.
Élimination
Avec une demi-vie physique de 75 secondes, le Rb-82 est très rapidement converti par décroissance radioactive en une quantité infime de gaz stable Kr-82, expiré naturellement par les poumons. L'excrétion rénale et hépatique ne devrait pas jouer un rôle essentiel dans l'élimination du Rb-82, bien qu'une partie de la dose de Rb-82 puisse être excrétée dans l'urine avant la décroissance radioactive.
5.3. Données de sécurité préclinique 
Aucune toxicité n’a été observée lors de l’administration répétée de 10 mL/kg/jour durant 14 jours chez la souris et une administration répétée de 3,0 ml/kg/jour pendant 14 jours chez le chien.
Le chlorure de rubidium (82Rb) n’est pas destiné à une administration régulière ou continue.
Aucune étude de mutagénicité ou de carcinogénicité à long-terme n’ont été effectuées.
Solution pour élution : Chlorure de sodium 0,9%
Générateur : 61 jours après la date de fabrication
La date de calibration et la date de péremption sont indiquées sur l’étiquetage du générateur.
Éluat : chlorure de rubidium-82 (82Rb) : à utiliser immédiatement après élution du fait de la demi-vie très brève.
6.4. Précautions particulières de conservation 
Générateur : A conserver à une température ne dépassant pas 25°C.
Éluat : Pour les conditions de conservation du médicament après élution, voir la rubrique 6.3.
Le générateur ne doit pas être utilisé si l’une des limites d’expiration est franchie :
· une utilisation après la date de péremption,
· un volume d’élution total de 30 L est passé dans la colonne depuis le début de l’utilisation du générateur,
· teneur en 82Sr supérieure à 2x10-5 MBq/MBq de 82Rb en fin d’élution,
· teneur en 85Sr supérieure à 2x10-4 MBq/MBq de 82Rb en fin d’élution.
Du fait de la courte demi-vie du 82Rb, pratiquement toute la radioactivité de l’éluat disparaît dans les 15 minutes après la fin de l’élution.
Les produits radiopharmaceutiques doivent être conservés conformément à la réglementation en vigueur sur les matériaux radioactifs.
6.5. Nature et contenu de l'emballage extérieur 
Le générateur est une colonne chromatographique en acier inoxydable contenu dans un pot en acier inoxydable, équipé d’une poignée de transport, étiqueté et dont l’intérieur contient un blindage en plomb adapté. Il est livré en conteneur de transport de type A.
6.6. Précautions particulières d’élimination et de manipulation 
Mises en garde générales
Les produits radiopharmaceutiques ne doivent être réceptionnés, utilisés et administrés que par des personnes autorisées et dans des services agréés. Leur réception, leur stockage, leur utilisation, leur transfert et leur élimination sont soumis aux réglementations et/ou autorisations appropriées des autorités compétentes.
Les produits radiopharmaceutiques doivent être préparés de manière à satisfaire à la fois aux normes de radioprotection et de qualité pharmaceutique. Des conditions d'asepsie appropriées doivent être appliquées.
Si, à un moment quelconque lors de la préparation du médicament, l’intégrité du récipient est compromise, le produit ne doit pas être utilisé.
Les procédures d’administration doivent être effectuées de manière à limiter le risque de contamination du médicament et d’exposition des opérateurs aux rayonnements. Un blindage adéquat est obligatoire.
L'administration de produits radiopharmaceutiques présente des risques pour les autres personnes, en raison des rayonnements externes ou de la contamination par les urines, les vomissements, etc. Des mesures de protection contre les radiations doivent être prises, conformément aux réglementations nationales.
Lors du contrôle de la qualité de l’éluat, une inspection visuelle du produit à la recherche de particules et de signes de décoloration sera effectuée. Ne pas administrer l’éluat issu du générateur en cas de suspicion de matériaux étrangers.
La mesure de l’activité du 82Rb dans l’éluat et du taux de 82Sr et 85Sr après décroissance du 82Rb (test de relargage) sont effectués au début de chaque jour où le générateur sera utilisé. Les élutions pour ces contrôles et les administrations aux patients sont conduites exactement de la même manière (voir la rubrique 12).
Elimination
Le personnel hospitalier devra vérifier la quantité de radioactivité présente dans le générateur avant de l’éliminer. Le générateur ne doit pas être jeté via le système de collecte de déchets usuel. Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur sur le plan local.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
POLE BIO OUEST
RUE DU MOULIN DE LA ROUSSELIERE
44800 SAINT HERBLAIN
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 550 986 3 8 : générateur pour élution de 4,32 à 5,28 GBq de 82Sr.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Les données listées dans le Tableau 1 sont extraites de la publication n°128 de la CIPR (Commission Internationale de Protection Radiologique).
Tableau 1:Doses de rayonnement absorbées pour le chlorure de Rubidium-82 (82Rb)
|
Organe |
Dose absorbée par unité d’activité administrée (mGy/MBq) |
||||
|
|
Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
Surrénales |
2,4 x 10-3 |
3,6 x 10-3 |
5,1 x 10-3 |
7,0 x 10-3 |
1,0 x 10-2 |
|
Surfaces osseuses |
4,2 x 10-4 |
5,6 x 10-4 |
8,5 x 10-4 |
1,4 x 10-3 |
3,1 x 10-3 |
|
Cerveau |
1,4 x 10-4 |
1,4 x 10-4 |
1,6 x 10-4 |
1,9 x 10-4 |
2,8 x 10-4 |
|
Sein |
1,9 x 10-4 |
2,0 x 10-4 |
1,3 x 10-2 |
2,2 x 10-2 |
4,3 x 10-2 |
|
Vésicule biliaire |
7,2 x 10-4 |
8,5 x 10-4 |
1,2 x 10-3 |
2,0 x 10-3 |
5,7 x 10-3 |
|
Tube digestif |
|||||
|
Estomac |
8,3 x 10-4 |
1,1 x 10-3 |
1,6 x 10-3 |
2,7 x 10-3 |
5,4 x 10-3 |
|
Intestin grêle |
2,0 x 10-3 |
2,6 x 10-3 |
4,6 x 10-3 |
7,7 x 10-3 |
1,5 x 10-2 |
|
Côlon |
1,1 x 10-3 |
1,4 x 10-3 |
2,5 x 10-3 |
4,1 x 10-3 |
7,8 x 10-3 |
|
Côlon ascendant |
1,1 x 10-3 |
1,4 x 10-3 |
2,5 x 10-3 |
4,1 x 10-3 |
7,9 x 10-3 |
|
Côlon descendant |
1,1 x 10-3 |
1,4 x 10-3 |
2,4 x 10-3 |
3,9 x 10-3 |
7,6 x 10-3 |
|
Cœur |
4,0 x 10-3 |
5,2 x 10-3 |
8,2 x 10-3 |
1,3 x 10-2 |
2,4 x 10-2 |
|
Reins |
9,3 x 10-3 |
1,1 x 10-2 |
1,6 x 10-2 |
2,4 x 10-2 |
4,3 x 10-2 |
|
Foie |
9,8 x 10-4 |
1,3 x 10-3 |
2,0 x 10-3 |
3,0 x 10-3 |
5,8 x 10-3 |
|
Poumons |
2,6 x 10-3 |
3,8 x 10-3 |
5,5 x 10-3 |
8,5 x 10-3 |
1,7 x 10-2 |
|
Muscles |
2,3 x 10-4 |
3,6 x 10-4 |
7,2 x 10-4 |
2,2 x 10-3 |
4,3 x 10-3 |
|
Œsophage |
1,5 x 10-3 |
2,4 x 10-3 |
3,7 x 10-3 |
8,1 x 10-3 |
1,5 x 10-2 |
|
Ovaires |
5,0 x 10-4 |
4,9 x 10-4 |
1,2 x 10-3 |
2,0 x 10-3 |
4,4 x 10-3 |
|
Pancréas |
2,6 x 10-3 |
3,7 x 10-3 |
7,6 x 10-3 |
9,7 x 10-3 |
2,1 x 10-2 |
|
Moelle osseuse rouge |
3,8 x 10-4 |
4,6 x 10-4 |
7,8 x 10-4 |
1,5 x 10-3 |
3,8 x 10-3 |
|
Peau |
1,8 x 10-4 |
2,3 x 10-4 |
3,7 x 10-4 |
6,1 x 10-4 |
1,2 x 10-3 |
|
Rate |
1,8 x 10-4 |
3,9 x 10-4 |
2,4 x 10-3 |
2,8 x 10-3 |
3,8 x 10-3 |
|
Testicules |
2,6 x 10-4 |
3,3 x 10-4 |
5,0 x 10-4 |
7,9 x 10-4 |
1,5 x 10-3 |
|
Thymus |
1,5 x 10-3 |
2,4 x 10-3 |
3,7 x 10-3 |
8,1 x 10-3 |
1,5 x 10-2 |
|
Thyroïde |
3,1 x 10-4 |
3,8 x 10-4 |
6,2 x 10-4 |
1,0 x 10-3 |
1,9 x 10-3 |
|
Paroi de la vessie |
1,8 x 10-4 |
3,9 x 10-4 |
2,4 x 10-3 |
2,8 x 10-3 |
3,8 x 10-3 |
|
Utérus |
1,0 x 10-3 |
1,1 x 10-3 |
1,5 x 10-2 |
2,3 x 10-2 |
4,1 x 10-2 |
|
Autres tissus |
3,1 x 10-4 |
5,0 x 10-4 |
9,3 x 10-4 |
2,1 x 10-3 |
4,7 x 10-3 |
|
Dose efficace par unité d’activité administrée (mSv/MBq) |
1,1 x 10-3 |
1,4 x 10-3 |
3,0 x 10-3 |
4,9 x 10-3 |
8,5 x 10-3 |
Pour le rubidium-82 (82Rb) la dose efficace résultant de l’administration d’une activité maximale de 2220 MBq est de 2,44 mSv.
Pour cette activité de 2200 MBq, les doses de radiations suivantes sont délivrées aux organes critiques : reins : 20,65 mGy, cœur : 8,88 mGy, poumons : 5,77 mGy et pancréas : 5,77 mGy.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
KALDENN (générateur de 82Rb) ne doit être utilisé qu’avec un système de perfusion approprié, muni d’un détecteur de radioactivité intégré.
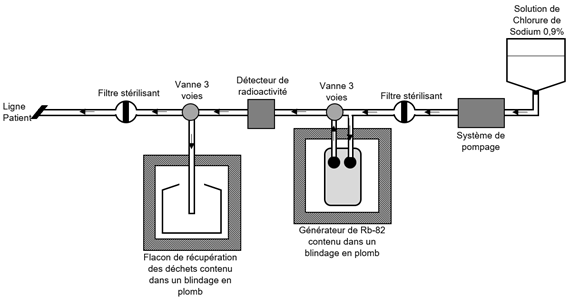
Figure 1 - Schéma de principe de fonctionnement d’un système de perfusion approprié de Rubidium82
Principe de fonctionnement :
Un système de pompage permet de faire passer la solution stérile de chlorure de sodium 0,9% injectable à travers le générateur.
Seule une solution de chlorure de sodium 9 mg/mL injectable sans impureté ni additif peut être utilisée pour l’élution du générateur. L’utilisation de toute autre solution (notamment contenant du calcium, même à l’état de traces, ou des additifs) est absolument proscrite, car elle pourrait entraîner un relargage important du nucléide père 82Sr pouvant potentiellement avoir des conséquences pour le patient.
L’éluat qui sort du générateur contient le rubidium-82. Le détecteur de radioactivité intégré mesure l’activité de l’éluat. Une fois l’activité cible atteinte, une vanne en amont du générateur 82Sr/82Rb permet de détourner le chlorure de sodium 0,9% du générateur de 82Sr/82Rb et de pousser le chlorure de sodium 0,9% supplémentaire, sans ajout de rubidium-82, afin d’amener la dose jusqu’au patient. A partir de ce moment, plus aucune activité n’est envoyée au patient. La valeur de l’activité désirée est reportée par le détecteur de radioactivité intégré.
Pureté radionucléidique et contrôle de la qualité : mesure de l’activité de 82Rb, 82Sr et 85Sr
Avant la première utilisation du jour du générateur, le contrôle de la pureté radionucléidique d’un éluat est impérativement effectué comme suit :
· Un premier éluat de 50 mL est éliminé en prenant les précautions de sécurité adaptées.
· Après régénération de la colonne (15 min), le contrôle de qualité (activité de Rubidium 82Rb et mesure du 82Sr et du 85Sr dans l’éluat) est effectué en respectant fidèlement les directives ci-dessous.
· Les résultats de ce contrôle doivent être conservés.
Elution du générateur KALDENN :
Porter des gants imperméables et une protection efficace lors de la manipulation de la solution de chlorure de rubidium (82Rb).
Appliquer les techniques d’asepsie pendant tout le processus de préparation et d’élution.
Attendre au moins 10 minutes entre chaque élution pour que le 82Rb se régénère.
Eluer uniquement au moyen d’une solution injectable de chlorure de sodium 0,9% injectable sans impureté ni additif.
Toutes les données générées durant le contrôle qualité doivent être conservées. L’ensemble de la procédure doit faire l’objet d’une traçabilité en termes de volume et de l’activité injectée.
Valeurs limites
Le générateur ne doit pas être utilisé si l’une de ces limites d’expiration est franchie :
· une utilisation après la date de péremption,
· un volume d’élution total de 30 L déjà passé dans la colonne depuis le début de l’utilisation du générateur,
· teneur en 82Sr supérieure à 2x10-5 MBq/MBq de 82Rb en fin d’élution,
· teneur en 85Sr supérieure à 2x10-4 MBq/MBq de 82Rb en fin d’élution.
Contrôles supplémentaires
A chaque changement de l’éluant chlorure de sodium 9 mg/mL (connexion d’un nouveau flacon), un nouveau test de contrôle de la qualité de l’éluat doit être réalisé.
Il est également nécessaire d’effectuer un contrôle de la qualité supplémentaire tous les 750 mL d’élution.
Par exemple, si le site clinique a élué moins de 750 mL à partir du générateur pendant la journée, aucun contrôle supplémentaire n’est à effectuer ce jour-là.
Si le lendemain, le même site clinique élue 1600 mL à partir du générateur, ce site clinique aura à réaliser 3 contrôles ce jour-là :
1) le contrôle de routine requis avant l’administration au premier patient,
2) un contrôle à 750 mL d’élution,
3) un contrôle à 1500 mL d’élution.
Les contrôles supplémentaires de la qualité doivent être effectués, à intervalles de 750 mL élué et conformément aux modalités décrites ci-dessus.
Procédure et calculs
La détermination de l’activité de 82Rb et la teneur en 82Sr et 85Sr se fera à l’aide d’un activimètre de type chambre d’ionisation.
Les procédures 1 à 11 ci-dessous doivent être effectuées.
La teneur en chlorure de rubidium 82Rb de la solution injectable se détermine comme suit :
1. Régler l’activimètre sur le canal du 82Rb, comme recommandé par le fabricant, ou utiliser les réglages pour le 60Co et diviser la mesure obtenue par 0,548. Lire la valeur donnée par l’appareil en MBq (mégabecquerel).
2. Une élution est réalisée de manière aseptique à l’aide de 50 mL d’une solution injectable de chlorure de sodium 0,9% sans impureté ni additif. Cette élution est jetée (première élution).
3. Attendre au moins 15 minutes pour que s’effectue la régénération du 82Rb dans le générateur 82Sr/82Rb. Une élution du générateur 82Sr/82Rb est ensuite réalisée à l’aide de 25 ml d’une solution injectable de chlorure de sodium 0,9% sans impureté ni additif avec un débit de 50 ml/minute et recueillie dans un flacon de verre muni d’un septum (ne pas utiliser de flacon en plastique). L’heure exacte (hh :mm :ss) de la fin du processus d’élution (EOE) doit être notée.
4. A l’aide de l’activimètre, déterminer l’activité du 82Rb en corrigeant cette activité par rapport à l’heure de fin du processus d’élution (EOE), noté à l’étape 3. Corriger la valeur lue, depuis l’heure de fin d’élution, à l’aide de la fraction restante correspondant au 82Rb (voir Tableau 4).
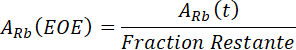
Exemple : si la mesure est effectuée 2,5 minutes après la fin de l’élution, la correction due à la désintégration s’effectue en divisant la valeur indiquée par l’activimètre par 0,250.
Pour calculer la concentration en 82Sr dans l’éluat, procéder comme suit :
5. L’échantillon utilisé pour la détermination de l’activité du 82Rb est laissé dans l’activimètre pendant une heure pour permettre la désintégration complète du 82Rb.
6. L’activité de l’échantillon est mesurée au moyen de l’activimètre réglé sur le canal du 82Rb. La valeur est donnée par l’appareil en MBq (megabecquerel).
7. Lire sur l’étiquette du générateur la proportion de 85Sr/82Sr à la date de calibration. Au moyen du Tableau 2, lire le facteur de correction de la proportion 85Sr/82Sr pour le jour d’utilisation après calibration (Fcor).
Calculer le rapport R au moyen de la formule suivante :
![]()
Avec 85Sr/82Sr à la date de calibration multiplié par le facteur de correction à la date de la mesure (Fcor).
8. Appliquer un facteur de correction (F) de 0,478 pour compenser la contribution du 85Sr à la valeur mesurée.
9. Calculer l’activité de 82Sr dans l’échantillon. Au moyen de l’équation suivante :
![]()
Exemple :
· Valeur mesurée sur l’activimètre (MBq) = 2,96 x 10-2
· Proportion 85Sr/82Sr à la date de calibration : 1,0172
· Jour d’utilisation après la date de calibration : 22
· Facteur de correction à 22 jours selon Tableau 4: 1,46
· R = 1,0172 x 1,46 = 1,48
· Facteur de correction (F) = 0,478
· 82Sr (MBq) = 2,96 x 10-2 /[1 + (1,48 x 0,478)]
· 82Sr (MBq) = 1,734 x 10-2
10. Déterminer la concentration en 82Sr en divisant les MBq de 82Sr par les MBq de 82Rb en fin d’élution.
Exemple :
· 1,734 x10-2 MBq de 82Sr
· 1850 MBq de 82Rb en fin d’élution
· (1.734 x10-2 MBq 82Sr)/(1850 MBq 82Rb) = 9,4 x 10-6 MBq/MBq 82Rb
Dans cet exemple, la teneur en 82Sr est supérieure à la limite d’alerte de 2x10-6 MBq/MBq de 82Rb.
11. Déterminer la teneur en 85Sr en multipliant le résultat obtenu à l’étape 10 par le rapport (R) du 85Sr au 82Sr.
Exemple :
· 9,4 x 10-6 x 1,48 = 1,4 x 10-5 MBq 85Sr/MBq 82Rb
Tableau 2 : Rapport 85Sr/82Sr
|
Jours |
Facteur de correction |
Jours |
Facteur de correction |
|
0* |
1,00 |
31 |
1,70 |
|
1 |
1,02 |
32 |
1,73 |
|
2 |
1,03 |
33 |
1,76 |
|
3 |
1,05 |
34 |
1,79 |
|
4 |
1,07 |
35 |
1,82 |
|
5 |
1,09 |
36 |
1,85 |
|
6 |
1,11 |
37 |
1,88 |
|
7 |
1,13 |
38 |
1,91 |
|
8 |
1,15 |
39 |
1,95 |
|
9 |
1,17 |
40 |
1,98 |
|
10 |
1,19 |
41 |
2,01 |
|
11 |
1,21 |
42 |
2,05 |
|
12 |
1,23 |
43 |
2,08 |
|
13 |
1,25 |
44 |
2,12 |
|
14 |
1,27 |
45 |
2,15 |
|
15 |
1,29 |
46 |
2,19 |
|
16 |
1,31 |
47 |
2,23 |
|
17 |
1,34 |
48 |
2,27 |
|
18 |
1,36 |
49 |
2,30 |
|
19 |
1,38 |
50 |
2,34 |
|
20 |
1,41 |
51 |
2,38 |
|
21 |
1,43 |
52 |
2,43 |
|
22 |
1,46 |
53 |
2,47 |
|
23 |
1,48 |
54 |
2,51 |
|
24 |
1,51 |
55 |
2,55 |
|
25 |
1,53 |
56 |
2,60 |
|
26 |
1,56 |
57 |
2,64 |
|
27 |
1,59 |
58 |
2,69 |
|
28 |
1,61 |
59 |
2,73 |
|
29 |
1,64 |
60 |
2,78 |
|
30 |
1,67 |
|
|
* Date de calibration
Emission de radiations
Le strontium-82 dont la demi-vie est de 25.35 jours (608.4 heures), décroit en rubidium-82 82Rb. Pour corriger la désintégration physique du strontium 82Sr, les fractions restantes à des intervalles choisis après l’heure de calibration sont données dans le Tableau 3.
Tableau 3 : Tableau de désintégration radioactive du Strontium-82
|
Jours |
Fraction restante |
Jours |
Fraction restante |
Jours |
Fraction restante |
|
0* 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 |
1,000 0,973 0,946 0,920 0,895 0,871 0,847 0,824 0,801 0,779 0,758 0,737 0,717 0,697 0,678 0,660 0,642 0,624 0,607 0,591 0,574 |
21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 |
0,559 0,543 0,529 0,514 0,500 0,486 0,473 0,460 0,448 0,435 0,423 0,412 0,401 0,390 0,379 0,369 0,359 0,349 0,339 0,330 0,321 |
42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
0,312 0,304 0,295 0,287 0,279 0,272 0,264 0,257 0,250 0,243 0,237 0,230 0,224 0,218 0,212 0,206 0,200 0,195 0,189 |
*Date de calibration
Pour appliquer une correction du fait de la désintégration physique du rubidium 82Rb, la fraction de chlorure de rubidium 82Rb, solution injectable restante par périodes de 15 secondes, et jusqu’à 600 secondes, est donnée dans le Tableau 4.
Tableau 4 : Tableau de désintégration radioactive du Rubidium-82
|
Seconde |
Fraction restante |
Seconde |
Fraction restante |
Seconde |
Fraction restante |
|
0* |
1,0000 |
210 |
0,1453 |
420 |
0,0211 |
|
15 |
0,8713 |
225 |
0,1266 |
435 |
0,0184 |
|
30 |
0,7591 |
240 |
0,1103 |
450 |
0,0160 |
|
45 |
0,6614 |
255 |
0,0961 |
465 |
0,0140 |
|
60 |
0,5763 |
270 |
0,0837 |
480 |
0,0122 |
|
75 |
0,5021 |
285 |
0,0729 |
495 |
0,0106 |
|
90 |
0,4374 |
300 |
0,0635 |
510 |
0,0092 |
|
105 |
0,3811 |
315 |
0,0554 |
525 |
0,0080 |
|
120 |
0,3321 |
330 |
0,0482 |
540 |
0,0070 |
|
135 |
0,2893 |
345 |
0,0420 |
555 |
0,0061 |
|
150 |
0,2521 |
360 |
0,0366 |
570 |
0,0053 |
|
165 |
0,2196 |
375 |
0,0319 |
585 |
0,0046 |
|
180 |
0,1914 |
390 |
0,0278 |
600 |
0,0040 |
|
195 |
0,1667 |
405 |
0,0242 |
|
|
*Durée écoulée depuis l’élution.
L’épaisseur de demi-atténuation est de 0,7 cm de plomb (Pb). Le Tableau 5 donne une plage de valeurs d’atténuation relative des radiations émises par les radionucléides, atténuation résultant de l’interposition de diverses épaisseurs de plomb. Par exemple, l’interposition d’une épaisseur de Pb de 7,0 cm atténue les radiations émises d’un facteur voisin de 1000.
Tableau 5 : Atténuation des radiations par un blindage en plomb
|
Epaisseur du blindage (Pb, cm) |
Facteur d’atténuation |
|
0,7 2,3 4,7 7,0 9,3 |
0,5 10-1 10-2 10-3 10-4 |
Liste I
Médicament réservé à l’usage hospitalier.
Les produits radiopharmaceutiques ne doivent être utilisés que par des personnes qualifiées. Ils ne peuvent être délivrés qu’à des praticiens ayant obtenu l’autorisation spéciale prévue à l’article R 1333-24 du Code de la Santé Publique.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |