Dernière mise à jour le 01/12/2025
ILUVIEN 190 microgrammes, implant intravitréen avec applicateur
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : S01BA15.
Ce médicament est un anti-inflammatoire stéroïdien (fluocinolone).
L’implant ILUVIEN est un tube minuscule qui est inséré dans l’œil et libère de très faibles quantités de la substance active, l’acétonide de fluocinolone, pendant une durée allant jusqu’à 3 ans. L’acétonide de fluocinolone appartient à un groupe de médicaments appelés corticoïdes.
ILUVIEN est utilisé pour traiter la perte de vision associée à l’œdème maculaire diabétique lorsque les autres traitements disponibles n’ont pas été efficaces. L’œdème maculaire diabétique est une maladie qui affecte certains patients diabétiques et provoque des dommages à la membrane photosensible située à l’arrière de l’œil appelée la macula, qui est responsable de la vision centrale. La substance active (l’acétonide de fluocinolone) aide à diminuer l’inflammation et l’œdème qui s’accumulent dans la macula au cours de cette maladie. ILUVIEN peut ainsi aider à améliorer la perte de vision ou l’empêcher de s’aggraver.
ILUVIEN est utilisé pour prévenir les récidives de l’inflammation de l’arrière de l’œil. Cette inflammation peut provoquer des corps flottants qui se présentent comme des points noirs ou des lignes fines se déplaçant sur ce que vous pouvez voir (« champs de vision »), ou peut provoquer une perte de vision en endommageant la partie de l’œil qui est responsable de la vision des détails, appelée la « macula ». La perte de vision pourrait ne pas s’améliorer sans traitement de l’inflammation. ILUVIEN aide à réduire l’inflammation et le gonflement qu’elle peut provoquer dans la partie arrière de l’œil. Il peut aider à améliorer votre vision ou l’empêcher de s’aggraver. Il peut éviter de futures crises inflammatoires.
Présentations
> plaquette(s) thermoformée(s) de 1 implant(s) avec applicateur(s)
Code CIP : 222 858-1 ou 34009 222 858 1 8
Déclaration de commercialisation : 07/09/2018
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 5877,77 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 5878,79 €
- Taux de remboursement :30%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 22/09/2021 | Extension d'indication | le service médical rendu par ILUVIEN (acétonide de fluocinolone), implant intravitréen est important dans l’extension d’indication de l’AMM à la prévention de la rechute de l’uvéite non-infectieuse récidivante affectant le segment postérieur de l’oeil. |
| Modéré | Avis du 26/06/2013 | Inscription (CT) | Le service médical rendu par ILUVIEN, implant intravitréen, est modéré dans la baisse d’acuité visuelle due à un oedème maculaire diabétique chronique chez des patients adultes lorsque la réponse aux traitements disponibles est jugée insuffisante (photocoagulation au laser, ranibizumab) et malgré l’optimisation de la prise en charge du diabète, dans l'indication de l'AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 22/09/2021 | Extension d'indication | Compte tenu : • de la démonstration dans une étude de phase III, randomisée, en double aveugle, de la supériorité, avec une quantité d’effet importante, d’ILUVIEN (acétonide de fluocinolone) en injection unilatérale par rapport à une injection simulée en termes de pourcentage de récidives à 6 mois chez des adultes atteints d’uvéite non-infectieuse récidivante affectant le segment postérieur de l’oeil (27,6 % avec l’implant intravitréen d’acétonide de fluocinolone versus 90,5 % avec l’injection simulée) . • d’une tolérance similaire à celle observée habituellement avec les corticoïdes péri- ou intraoculaires . mais : • de l’absence de données robustes sur ce critère de jugement au-delà de 6 mois . • de l’absence de données en termes de qualité de vie . • de l’absence de données d’efficacité sur le retraitement par un nouvel implant . • de l’absence de comparaison, pendant au moins 36 mois, à la stratégie actuelle de prise en charge des récidives . la Commission considère qu’ILUVIEN (acétonide de fluocinolone), implant intravitréen n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la prise en charge actuelle, chez l’adulte, des récidives d’uvéites non-infectieuses récidivantes affectant le segment postérieur de l’oeil. |
| IV (Mineur) | Avis du 26/06/2013 | Inscription (CT) | ILUVIEN, implant intravitréen, apporte une ASMR mineure (ASMR IV) dans la stratégie thérapeutique de la baisse d’acuité visuelle due à un oedème maculaire diabétique chronique chez des patients adultes lorsque la réponse aux traitements disponibles est jugée insuffisante (photocoagulation au laser, ranibizumab). |
Autres informations
- Titulaire de l'autorisation : ALIMERA SCIENCES EUROPE LIMITED
- Conditions de prescription et de délivrance :
- liste I
- prescription réservée aux spécialistes et services OPHTALMOLOGIE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 141 215 7
ANSM - Mis à jour le : 19/01/2024
ILUVIEN 190 microgrammes, implant intravitréen avec applicateur
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque implant intravitréen contient 190 microgrammes d’acétonide de fluocinolone.
Pour la liste complète des excipients, voir rubrique 6.1.
Implant intravitréen avec applicateur.
Cylindre de couleur brun clair mesurant environ 3,5 mm x 0,37 mm.
Applicateur avec aiguille 25 G.
4.1. Indications thérapeutiques
ILUVIEN est indiqué dans la prévention de la rechute de l’uvéite non infectieuse recidivante affectant le segment postérieur de l’œil (voir rubrique 5.1).
4.2. Posologie et mode d'administration
La dose recommandée est un implant d’ILUVIEN dans l’œil atteint. L’administration simultanée dans les deux yeux n’est pas recommandée (voir rubrique 4.4).
Chaque implant ILUVIEN libère de l’acétonide de fluocinolone pendant une durée allant jusqu’à 36 mois.
Œdème Maculaire Diabétique
Un autre implant peut être administré après 12 mois si le patient présente une perte d’acuité visuelle ou une augmentation de l’épaisseur rétinienne secondaire à une récidive ou à une aggravation de l’œdème maculaire diabétique (voir rubrique 5.1).
Un retraitement par ILUVIEN ne doit être envisagé que si les bénéfices potentiels sont supérieurs aux risques.
Le traitement par ILUVIEN est réservé aux patients présentant une réponse insuffisante à un traitement antérieur par photocoagulation au laser ou aux autres traitements disponibles pour l’œdème maculaire diabétique.
Uvéite non infectieuse touchant le segment postérieur
Population pédiatrique
Il n’y a pas d’utilisation justifiée de l’acétonide de fluocinolone administré par voie intravitréenne dans la population pédiatrique dans l’indication d’œdème maculaire diabétique (OMD).
La sécurité et l’efficacité n’ont pas été établies pour l’indication uvéite dans la population pédiatrique.
Populations particulières
Aucune adaptation posologique n’est nécessaire chez les patients âgés ou chez les patients présentant une insuffisance rénale ou hépatique.
Mode d'administration
VOIE INTRAVITREENNE UNIQUEMENT.
ILUVIEN ne doit être administré que par voie intravitréenne et par un ophtalmologiste expérimenté dans les injections intravitréennes.
La procédure d’injection intravitréenne doit être réalisée en conditions d’asepsie contrôlées, incluant le port de gants stériles, l’utilisation d’un champ stérile et d’un blépharostat (ou équivalent) stérile. Une anesthésie adéquate et une antisepsie antibactérienne à large spectre doivent être administrées avant l’injection.
La procédure d’injection d’ILUVIEN est la suivante :
1. Un collyre antibiotique peut être administré avant l’intervention à l’appréciation de l’ophtalmologiste traitant.
2. Juste avant l’injection, instiller une goutte d’anesthésique local sur le site d’injection (le quadrant temporal inférieur est recommandé), suivie de l’application d’un coton‑tige imbibé d’anesthésique ou d’une injection sous‑conjonctivale d’un anesthésique approprié.
3. Instiller 2 ou 3 gouttes d’un antiseptique local approprié dans le cul‑de‑sac conjonctival. Les paupières peuvent être nettoyées avec des cotons-tiges imbibés d’un antiseptique local approprié. Placer un blépharostat stérile. Demander au patient de regarder vers le haut et appliquer un coton‑tige imbibé d’un antiseptique approprié sur le site d’injection. Laisser l’antiseptique local sécher pendant 30 à 60 secondes avant l’injection d’ILUVIEN.
4. L’extérieur de la plaquette thermoformée ne doit pas être considéré comme stérile. Une assistant(e) (en conditions non stériles) doit sortir la plaquette thermoformée de la boîte puis examiner la plaquette et le film pour vérifier l’absence de dommage. En cas de dommage, ne pas utiliser l’unité.
Si l’unité peut être utilisée, l’assistant(e) doit retirer le film de la plaquette sans toucher la surface intérieure.
5. Vérifier par la fenêtre de visualisation de l’applicateur préchargé que celui‑ci contient bien l’implant.
6. En portant des gants stériles, retirer l’applicateur de la plaquette thermoformée en ne touchant que la surface stérile et l’applicateur.
Le capuchon de protection de l’aiguille ne doit être retiré que lorsque l’implant ILUVIEN est prêt à être injecté.
Avant l’injection, l’embout de l’applicateur doit être maintenu incliné pour garantir que l’implant est positionné correctement dans l’applicateur.
7. La procédure d’injection doit être effectuée en deux étapes pour limiter la quantité d’air administrée avec l’implant. Avant d’insérer l’aiguille dans l’œil, appuyer sur le bouton et le faire glisser jusqu’au premier arrêt (au niveau des repères noirs incurvés le long de la glissière du bouton). Au premier arrêt, relâcher le bouton, il passera en position UP (HAUT). Si le bouton ne passe pas en position UP, ne pas continuer à utiliser cette unité.
8. Le positionnement optimal de l’implant est la région située sous la papille optique et à l’arrière de l’équateur de l’œil. A l’aide d’un compas, mesurer une distance de 4 mm à partir du limbe dans le quadrant temporal inférieur.
9. Retirer avec précaution le capuchon de protection de l’aiguille et vérifier que la pointe de l’aiguille n’est pas courbée.
10. Déplacer doucement la conjonctive de façon à ce que, après le retrait de l’aiguille, les sites d’insertion conjonctival et scléral de l’aiguille ne soient pas alignés. Prendre des précautions pour éviter tout contact entre l’aiguille et le bord de la paupière ou les cils. Insérer l’aiguille dans l’œil. Pour libérer l’implant, le bouton étant en position UP, faire glisser le bouton vers l’avant jusqu’à l’extrémité de sa glissière et retirer l’aiguille. Remarque : vérifier que le bouton a atteint l’extrémité de la glissière avant de retirer l’aiguille.
11. Retirer le blépharostat et vérifier par ophtalmoscopie indirecte le positionnement de l’implant, la perfusion correcte de l’artère rétinienne et l’absence de toute autre complication. La visualisation de l’implant peut être facilitée en appuyant sur la sclérotique. L’examen doit inclure un contrôle de la perfusion de la tête du nerf optique immédiatement après l’injection. Une mesure immédiate de la pression intraoculaire (PIO) peut être effectuée à l’appréciation de l’ophtalmologiste.
Après l’intervention, les patients doivent être surveillés pour détecter des complications éventuelles telles qu’endophtalmie, augmentation de la pression intraoculaire, décollement de la rétine hémorragies ou décollements vitréens et hypotonie oculaire (observée jusqu’à 8 jours après la fin du traitement). Une biomicroscopie avec tonométrie doit être réalisée dans les deux à sept jours suivant l’injection de l’implant.
Compte tenu de la durée de libération de l’acétonide de fluocinolone (environ 36 mois), il est recommandé de poursuivre ces contrôles au moins une fois par trimestre afin de détecter l’apparition d’éventuelles complications (voir rubrique 4.4).
L’implant intravitréen ILUVIEN est contre-indiqué en cas de glaucome préexistant ou d’infection oculaire ou périoculaire active ou suspectée, incluant la plupart des maladies virales de la cornée et de la conjonctive, dont la kératite épithéliale active à Herpes simplex (kératite dendritique), la vaccine, la varicelle, les infections mycobactériennes et les mycoses.
ILUVIEN est contre-indiqué chez les patients présentant :
· une hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· une uvéite infectieuse
4.4. Mises en garde spéciales et précautions d'emploi
Les injections intravitréennes ont été associées à des endophtalmies, à une augmentation ou diminution de la pression intraoculaire, à undécollement de la rétine et à une hémorragie ou à un décollement vitréen. Les patients doivent être informés qu’ils doivent signaler sans délai tout symptôme évocateur d’une endophtalmie. Un contrôle effectué dans les deux à huit jours suivant l’injection peut permettre la détection et le traitement précoces d’une infection oculaire, d’une diminution ou d’une augmentation de la pression introculaire ou de toute autre complication. Il est recommandé ensuite d’effectuer un contrôle de la pression intraoculaire au moins une fois par trimestre.
L’administration de corticoïdes intravitréens peut provoquer une cataracte, une augmentation de la pression intraoculaire, un glaucome et majorer le risque d’infections secondaires.
La sécurité et l’efficacité d’ILUVIEN administré simultanément dans les deux yeux n’ont pas été étudiées. Il est recommandé de ne pas injecter un implant dans chaque œil lors de la même séance de traitement. Le traitement simultané des deux yeux n’est pas recommandé tant que la réponse oculaire et systémique au premier implant n’est pas connue (voir rubrique 4.2).
Troubles visuels
Des troubles visuels peuvent apparaitre lors d'une corticothérapie par voie systémique ou locale. En cas de vision floue ou d'apparition de tout autre symptôme visuel apparaissant au cours d'une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d'une cataracte, d'un glaucome, ou d'une lésion plus rare telle qu'une choriorétinopathie séreuse centrale, décrits avec l'administration de corticostéroïdes par voie systémique ou locale.
Études de phase III de l’Odème Maculaire Diabétique (études FAME)
Dans les études FAME, une chirurgie de la cataracte a été réalisée chez 80 % des patients phaques traités par l’acétonide de fluocinolone (voir rubrique 4.8). Les patients phaques doivent être surveillés étroitement pour détecter des signes de cataracte après le traitement.
Parmis les patients traités par l’acétonide de fluocinolone, 38 % ont eu besoin d’un traitement hypotonisant (voir rubrique 4.8). L’acétonide de fluocinolone doit être utilisé avec prudence chez les patients ayant une PIO initiale élevée et la PIO doit être surveillée étroitement. En cas d’augmentations de la PIO ne répondant pas aux traitements ou interventions hypotonisants, l’implant ILUVIEN peut être retiré par vitrectomie.
Les données concernant l’effet de l’acétonide de fluocinolone dans l’œil après une vitrectomie sont limitées. La clairance du médicament serait probablement accélérée après une vitrectomie, mais les concentrations à l’état d’équilibre ne devraient pas être modifiées. Cela peut diminuer la durée d’action de l’implant.
Dans le groupe de traitement simulé, 24 % des patients ont reçu à un moment donné des médicaments anticoagulants ou antiplaquettaires versus 27 % des patients traités par ILUVIEN. L’incidence d’hémorragies conjonctivales a été légèrement supérieure chez les patients traités par ILUVIEN de façon concomitante ou dans les 30 jours suivant l’arrêt des médicaments anticoagulants ou antiplaquettaires par rapport aux patients recevant le traitement simulé (0,5 % et 2,7 % respectivement dans les groupes traitement simulé et ILUVIEN). Le seul autre événement rapporté à une incidence plus élevée chez les patients traités par ILUVIEN a été une complication de la chirurgie oculaire (0 % et 0,3 % respectivement dans les groupes traitement simulé et ILUVIEN).
Études de phase III de l’uvéite
Dans les études uvéite, des patients traités par implant intravitréen d’acétonide de fluocinolone ont subi une chirurgie de la cataracte. Les patients phaques doivent être surveillés étroitement afin de détecter des signes de cataracte après le traitement.
De plus, certains patients ont développé une pression intraoculaire élevée qui a nécessité un traitement par des médicaments diminuantt la PIO.
Dans les études, des patients traités par l’acétonide de fluocinolone ont développé une hypotonie quelques jours après le traitement, le plus souvent au jour 1,mais réversible dans la plupart des cas une semaine après l’apparition. Une surveillance des patients présentant une augmentation ou une diminution de la PIO immédiatement ou dans les deux à huit jours suivant les injections est recommandée.
Dans le cadre du traitement de patients atteints d’uvéite, il est très important d’exclure la possibilité de causes infectieuses de l’uvéite avant de commencer le traitement par ILUVIEN.
Il existe un risque de migration de l’implant dans la chambre antérieure, en particulier chez les patients n’ayant pas de capsule postérieure du cristallin ou présentant une anomalie ou une rupture de la capsule postérieure après une chirurgie intraoculaire. En l’absence de traitement, la migration de l’implant peut entraîner un œdème de la cornée et dans les cas sévères, elle pourrait provoquer une lésion cornéenne nécessitant une greffe de cornée. Chez les patients se plaignant de troubles visuels, un examen doit être réalisé pour permettre un diagnostic et une prise en charge précoces de la migration de l’implant.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
4.6. Fertilité, grossesse et allaitement
Grossesse
Allaitement
L’acétonide de fluocinolone administré par voie systémique est excrété dans le lait maternel. Même si l’exposition systémique de la femme qui allaite à l’acétonide de fluocinolone administré par voie intravitréenne devrait être très faible, une décision doit être prise soit d’interrompre l’allaitement soit de s’abstenir du traitement avec ILUVIEN en prenant en compte le bénéfice de l’allaitement pour l’enfant au regard du bénéfice du traitement pour la femme.
Fertilité
Il n’existe pas de données concernant l’effet d’ILUVIEN sur la fertilité. Cependant, des effets sur la fertilité masculine ou féminine sont peu probables dans la mesure où l’exposition systémique à l’acétonide de fluocinolone est très faible après administration par voie intravitréenne.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Œdème Maculaire Diabétique
L’acétonide de fluocinolone administré par voie intravitréenne a été évalué chez 768 patients (375 dans le groupe 0,2 µg/jour/ILUVIEN ; 393 dans le groupe 0,5 µg/jour) présentant un œdème maculaire diabétique dans les études cliniques FAME. Les effets indésirables les plus fréquents ont été : une chirurgie de la cataracte, une cataracte et une augmentation de la pression intraoculaire.
Dans les études de phase III, 38,4 % des patients traités par ILUVIEN ont eu besoin d’un traitement hypotonisant et 4,8 % d’une intervention chirurgicale pour réduire la PIO. L’utilisation d’un traitement hypotonisant a été similaire chez les patients qui avaient reçu deux traitements ou plus par ILUVIEN.
Deux cas d’endophtalmie ont été rapportés chez des patients traités par ILUVIEN dans les études de phase III, soit un taux d’incidence de 0,2 % (2 cas/1 022 injections).
Bien que la majorité des patients des études cliniques FAME n’ait reçu qu’un seul implant (voir rubrique 5.1), les implications pour la tolérance à long terme de la rétention dans l’œil de l’implant non bioérodable ne sont pas connues. Dans les études cliniques FAME, les données à 3 ans montrent que les événements tels que cataracte, augmentation de la pression intraoculaire et corps flottants ont été un peu plus fréquents chez les patients ayant reçu 2 implants ou plus. Cela est considéré comme étant dû à l’augmentation de l’exposition au médicament plutôt qu’à un effet de l’implant lui‑même. Dans les études précliniques, il n’a pas été mis en évidence d’augmentation des problèmes de tolérance autres que des modifications du cristallin chez des lapins ayant reçu 2 à 4 implants en 24 mois. L’implant est composé de polyimide et il est très similaire à une haptique de lentille intraoculaire ; il est donc attendu qu’il reste inerte dans l’œil.
Uvéite non infectieuse affectant le segment postérieur
Le profil de tolérance de l’uvéite non infectieuse affectant le segment postérieur de l’œil est basé sur deux études pivots de 36 mois de l’uvéite (PSV-FAI-001 et PSV-FAI-005). Actuellement, les données sont disponibles sur 36 mois pour l’étude PSV-FAI-001 et sur 12 mois pour l’étude PSV-FAI-005. Les effets indésirables les plus fréquents ont été : une augmentation de la pression intraoculaire, une cataracte et une hémorragie conjonctivale. Les effets indésirables moins fréquents, mais plus graves ont été : une hémorragie papillaire et un décollement de la rétine.
Liste des événements indésirables
Les effets indésirables ci‑dessous ont été jugés comme étant liés au traitement au cours des essais cliniques de phase III (OMD et uvéite) et dans le cadre des déclarations spontanées, sont présentés selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000). Au sein de chaque fréquence de groupe, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
|
Infections et infestations |
Peu fréquent : endophtalmie |
|
Affections du système nerveux |
Peu fréquent : céphalées |
|
Affections oculaires |
Très fréquent :cataracte1, augmentation de la pression intraoculaire2 Fréquent : glaucome3, décollement de la rétine, hémorragie papillaire*, hémorragie vitréenne, baisse de l’acuité visuelle, trouble du champ visuel*, fibrose maculaire*, hémorragie conjonctivale4, vision trouble (voir rubrique 4.4)5, hypotonie oculaire*6, corps flottants du vitré7, cellules dans la chambre antérieure*, opacités du vitré*, sensation de corps étranger dans les yeux*, sécheresse oculaire*, photopsie*, douleur oculaire8. Peu fréquent : occlusion vasculaire rétinienne6, affection du nerf optique, maculopathie, atrophie optique, ulcère conjonctival, néovascularisation de l’iris, exsudats rétiniens, dégénérescence vitréenne, décollement vitréen, décollement choroïdien*, érosion cornéenne*, dépôts cornéens, opacification capsulaire postérieure, adhérences de l’iris, blépharospasme*, œdème de l’œil*10, hyperémie oculaire, amincissement de la sclérotique, écoulement oculaire, prurit oculaire. |
|
Lésions, intoxications et complications liées aux procédures |
Peu fréquent : expulsion de l’implant, implant dans la ligne de vision, complication opératoire, douleur opératoire |
|
Actes médicaux et chirurgicaux |
Très fréquent : opération de la cataracte Fréquent : trabéculectomie, chirurgie de glaucome, vitrectomie, trabéculoplastie Peu fréquent : retrait de l’implant expulsé hors de la sclérotique |
|
Troubles généraux et anomalies au site d'administration |
Peu fréquent : déplacement de dispositif (migration de l’implant), pouvant entrainer un œdème de la cornée. |
*Observées uniquement chez les patients atteints d’uvéite
1 Inclut les termes MedDRA pour cataracte (NOS - sans autre précision), cataracte sous‑capsulaire, cataracte nucléaire et cataracte diabétique.
2 Inclut les termes MedDRA pour augmentation de la pression intraoculaire et hypertension oculaire.
3 Inclut les termes MedDRA pour glaucome, glaucome à angle ouvert, glaucome limite, excavation du nerf optique et augmentation du rapport cup/disc (rapport largeur de l’excavation/largeur de la papille).
4 Inclut les termes MedDRA pour hémorragie conjonctive, hyperémie conjonctivale
5 Inclut les termes MedDRA pour vision trouble et diminution de l’acuité visuelle.
6 Inclut les termes MedDRA pour pression intraoculaire diminuée
7 Inclut les termes MedDRA pour myodesopsie
8 Inclut les termes MedDRA pour douleur oculaire, irritation oculaire et gêne oculaire.
9 Inclut les termes MedDRA pour occlusion de la veine rétinienne, occlusion de l’artère rétinienne et occlusion vasculaire rétinienne.
10 Inclut les termes MedDRA pour œdème de l’œil, œdème conjonctival, œdème de la cornée
Description d’effets indésirables sélectionnés
L’utilisation de corticoïdes au long cours peut provoquer des cataractes et une augmentation de la pression intraoculaire. Les fréquences mentionnées ci‑dessous reflètent les données observées chez l’ensemble des patients inclus dans les études FAME. Les fréquences observées chez les patients présentant un OMD chronique n’ont pas été significativement différentes de celles rapportées dans la population globale.
Études de phase III de l’Oedème Maculaire Diabétique
Dans les études cliniques de phase III, l’incidence de cataracte chez les patients phaques a été d’environ 82 % dans le groupe traité par ILUVIEN et de 50 % dans le groupe recevant le traitement simulé. Une chirurgie de la cataracte a été nécessaire après 3 ans chez 80 % des patients phaques traités par ILUVIEN versus 27 % des patients recevant le traitement simulé ; chez la plupart des patients, la chirurgie a été nécessaire au bout de 21 mois. La cataracte sous‑capsulaire postérieure est le type le plus fréquent de cataracte cortisonique. Pour ce type de cataracte, l’intervention est plus difficile et peut être associée à un risque plus élevé de complications chirurgicales.
Dans les étudesde l’OMD, les patients ayant une PIO initiale > 21 mmHg étaient exclus. L’incidence d’augmentation de la pression intraoculaire a été de 37 % et un traitement hypotonisant a été nécessaire chez 38 % des patients, la moitié d’entre eux ayant besoin d’au moins deux médicaments pour équilibrer la PIO. L’utilisation d’un traitement hypotonisant a été comparable chez les patients ayant été traités à nouveau par un autre implant pendant l’étude. De plus, une intervention chirurgicale ou un traitement au laser pour contrôler la PIO a été nécessaire chez 5,6 % (21/375) des patients qui avaient reçu un implant (trabéculoplastie, 5 patients [1,3 %], trabéculectomie, 10 patients [2,7 %], cycloablation endoscopique, 2 patients [0,5 %], et autres interventions chirurgicales, 6 patients [1,6 %]).
Dans le sous groupe de patients ayant une PIO supérieure à la médiane au début de l’étude (≥ 15 mmHg), un traitement hypotonisant a été nécessaire chez 47 % d’entre eux et le pourcentage d’interventions chirurgicales ou de traitements au laser a augmenté à 7,1 %. Dans ce sous groupe, 5 patients (2,2 %) ont été traités par trabéculoplastie, 7 patients (3,1 %) par trabéculectomie, 2 patients (0,9 %) par cycloablation endoscopique et 4 patients (1,8 %) par d’autres types de chirurgie du glaucome.
Études de phase III de l’uvéite
Tableau 1 : événements indésirables de types PIO, cataracte et hypotonie dans les populations en intention de traiter (ITT) de PSV-FAI-001 et PSV-FAI-005.
|
Population en ITT |
||||
|
PSV-FAI-001 (36 mois) |
PSV-FAI-005 (12 mois) |
|||
|
Insertion IAF |
Injection simulée |
Insertion IAF |
Injection simulée |
|
|
Nombre de patients randomisés |
87 |
42 |
101 |
52 |
|
Durée de l’exposition (jours) moyenne (ET) |
1055 (139,47) |
1029 (191,09) |
354 (37,56) |
354 (37,56) |
|
Médicaments pour diminuer la PIO, n(%) |
37 (42,5) |
14 (33,3) |
51 (50,5) |
27 (51,9) |
|
PIO > 25 mmHg, n(%) |
21 (24,1) |
10 (23,8) |
22 (21,8) |
2 (3,8) |
|
PIO > 30 mmHg, n(%) |
14 (16,1) |
5 (11.9) |
15 (14,9) |
1 (1,9) |
|
Chirurgie pour diminuer la PIO, n(%) |
5 (5,7) |
5 (11,9) |
1 (1,0) |
0 |
|
EI de type PIO, n(%) |
28 (32,2) |
13 (31,0) |
30 (29,7) |
1 (1,9) |
|
Chirurgie de la cataracte, n (%) basé sur les patients phaques) |
31 (73,8) |
5 (23,8) |
11 (18) |
4 (11,4) |
|
EI de type cataracte, n(%) |
37 (42,5) |
10 (23,8) |
29 (47,5) |
11 (31,4) |
|
Hypotonie, n(%) |
9 (10,3) |
5 (11,9) |
13 (12,9) |
0 (0,0) |
ET = écart type ; IAF = implant d’acétonide de fluocinolone
Aucun cas d’endophtalmie n’a été rapporté dans le groupe de l’acétonide de fluocinolone dans les études de phase III de l’uvéite.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
Aucun cas de surdosage n’a été rapporté.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Anti‑inflammatoires, corticoïdes, non associés, code ATC : S01BA15
Les corticoïdes inhibent la réponse inflammatoire à différents agents déclenchants. Ils inhibent la formation d’œdème, le dépôt de fibrine, la dilation capillaire, la migration leucocytaire, la prolifération capillaire, la prolifération des fibroblastes, le dépôt de collagène et la formation de cicatrices fibreuses associés à l’inflammation.
Les corticoïdes agiraient par induction des protéines inhibitrices de la phospholipase A, appelées lipocortines. On suppose que ces protéines contrôlent la biosynthèse des médiateurs puissants de l’inflammation tels que les prostaglandines et les leucotriènes en inhibant la libération de leur précurseur commun, l’acide arachidonique. L’acide arachidonique est libéré des phospholipides membranaires par la phospholipase A2. Il a également été démontré que les corticoïdes diminuent les taux de facteur de croissance de l’endothélium vasculaire (VEGF), une protéine qui augmente la perméabilité vasculaire et provoque l’œdème.
Œdème Maculaire Diabétique
L’efficacité d’ILUVIEN a été évaluée dans deux études multicentriques randomisées en double aveugle, en groupes parallèles, menées chez des patients présentant un œdème maculaire diabétique et ayant antérieurement reçu au moins un traitement par photocoagulation au laser. La durée de suivi était de trois ans pour chaque patient. Au total, 74,4 % des patients ont reçu 1 implant, 21,6 % ont reçu 2 implants, 3,5 % ont reçu 3 implants, 0,5 % ont reçu 4 implants et aucun patient n’a reçu plus de 4 implants. Dans les deux études, le critère principal d’évaluation de l’efficacité était le pourcentage de patients ayant obtenu un gain d’acuité visuelle d’au moins 15 lettres après 24 mois. Dans chacune de ces études, le critère principal a été atteint pour ILUVIEN (voir Figure 1 pour les résultats combinés du critère d’efficacité principal).
Figure 1. Pourcentage de patients ayant obtenu un gain ≥ 15 lettres par rapport au début de l'étude, études FAME combinées
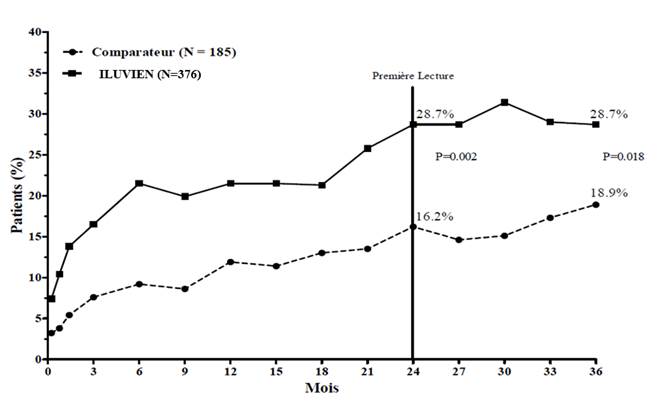
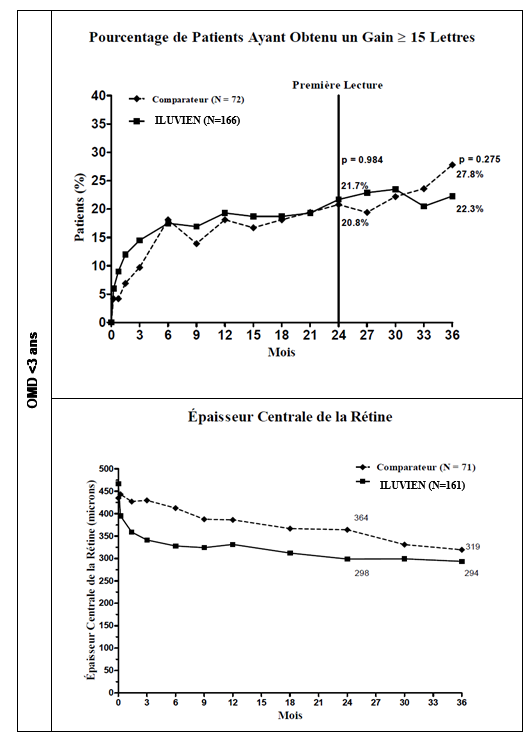
Lorsque l’efficacité a été évaluée en fonction de la durée de la maladie, une réponse bénéfique significative a été observée chez les patients dont l’ancienneté de l’OMD était supérieure à la médiane (≥ 3 ans), tandis que les patients chez lesquels la durée de l’OMD était plus courte n’ont pas présenté de bénéfice supplémentaire par rapport au traitement comparateur en termes d’amélioration de l’acuité visuelle (Figures 2 et 3). Ces données en sous‑groupes étayent l’indication dans le traitement d’OMD chronique (c’est‑à‑dire d’une durée d’au moins 3 ans) qui figure à la rubrique 4.1.
Figure 2 : Comparaison des pourcentages de patients ayant obtenu un gain ≥ 15 lettres de la meilleure acuité visuelle corrigée (MAVC) par rapport à l’entrée dans l'étude et variation moyenne de l’épaisseur centrale de la rétine excessive, par sous‑groupe en fonction de la durée de l’OMD ≥ 3 ans
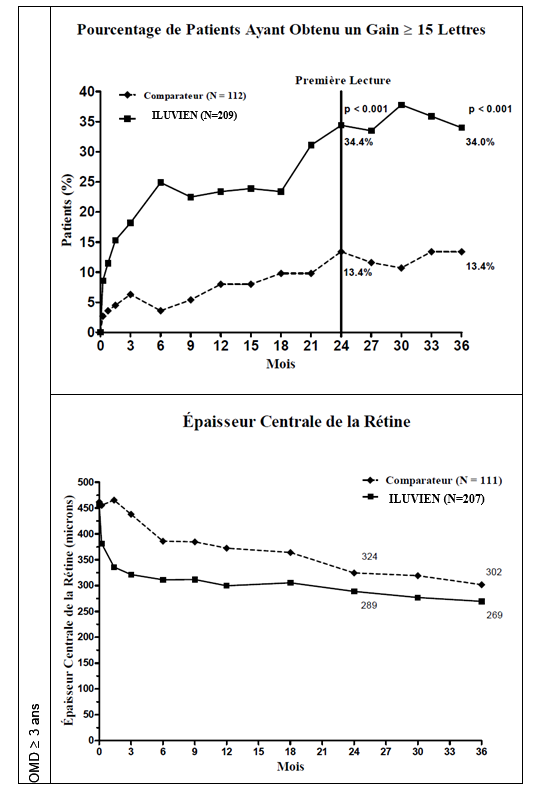
Figure 3 : Comparaison de la variation moyenne de l’épaisseur centrale de la rétine excessive et pourcentage de patients ayant obtenu un gain ≥ 15 lettres de la MAVC par rapport à l’entrée dans l'étude et variation moyenne de l’épaisseur centrale de la rétine excessive, par sous‑groupe en fonction de la durée de l’OMD < 3 ans
Le registre de l’étude IRISS, étude de sécurité post‑autorisation d’une durée de 6 ans (M‑01-12-001), et comprenant les données de 556 patients (695 yeux), a été menée et n’a pas montré d’autres risques que ceux identifiés dans les études FAME.
Uvéite non infectieuse du segment postérieur
Le programme de développement d’ILUVIEN dans l’uvéite non infectieuse affectant le segment postérieur de l’œil comprend deux études de phase III visant à évaluer la sécurité et l’efficacité de 0,2 µg/jour d’acétonide de fluocinolone par rapport à une injection simulée sur une période de 36 mois.
Les deux études sont des études prospectives, randomisées, multicentriques, en double insu, contrôlée par injection simulée, réalisée sur 282 patients au total qui ont reçu un traitement unique par acétonide de fluocinolone (188 patients) ou une injection simulée (94 patients). Les critères d’éligibilité ont été conçus pour recruter des patients atteints de maladies récidivantes ou persistantes. Au début de l’étude, les caractéristiques oculaires des patients participant aux études sont présentées dans le tableau 2 :
Tableau 2 : Caractéristiques oculaires de l’œil étudié au début de l’étude(population en intention de traiter [ITT]) : PSV-FAI-001 et PSV-FAI-005
|
Population en ITT |
||||
|
|
PSV-FAI-001 |
PSV-FAI-005 |
||
|
|
Insertion IAF |
Injection simulée |
Insertion IAF |
Injection simulée |
|
Lettres de MAVC, moyenne (ET) |
66,9 (15,49) |
64,9 (15,53) |
66,4 (15,85) |
63,6 (16,82) |
|
Gravité de la haze vitréen |
48 (55,2) |
21 (50,0) |
37 (36,6) |
14 (27,0) |
|
1/2+ |
39 (44,8) |
21 (50,0) |
64 (63,3) |
38 (73,1) |
|
3/4+ |
0 |
0 |
0 |
0 |
|
Cellules dans la chambre antérieure |
77 (88,5) |
33 (78,6) |
93 (92,0) |
49 (94,3) |
|
1/2+ |
10 (11,5) |
9 (21,4) |
8 (7,9) |
3 (5,8) |
|
3/4+ |
0 |
0 |
0 |
0 |
|
Pression intraoculaire (PIO) Moyenne (ET) |
13,9 (3,12) |
13,6 (3,15) |
13,3 (3,07) |
13,1 (2,60) |
|
Gravité de l’œdème maculaire (μm) |
37 (42,5) |
14 (33,3) |
70 (69,3) |
36 (69,2) |
|
CST ≥ 300 |
48 (55,2) |
27 (64,3) |
30 (29,7) |
14 (26,9) |
CST = central subfield thickness (épaisseur rétinienne dans la zone centrale) ; ET = écart type ; IAF = implant d’acétonide de fluocinolone ; MAVC = meilleure acuité visuelle corrigée
Les données sont des nombres (%) sauf indication contraire.
Le critère de jugement principal de l’efficacité était basé sur la proportion de patients ne présentant pas de récidive d’uvéite entre la randomisation et le 6ème mois, la récidive étant définie comme :
(a) une augmentation ≥2 grades du nombre de cellules par champs au fort grossissement par rapport au début de l’étude ou à toute visite avant 6 mois ;
(b) une augmentation du haze vitréen ≥ 2 grades par rapport au début de l’étude ou à toute visite avant 6 mois ;
(c) une perte de la meilleure acuité visuelle corrigée supérieure ou égale à 15 lettres par rapport au début de l’étude à toute visite avant le mois 6.
Tout critère utilisé pour définir la récidive devait être attribuable uniquement à une uvéite non infectieuse. Un patient n’ayant pas présenté précédemment de récidive telle qu’elle est définie en (a), (b), (c), et ayant pris un stéroïde systémique ou un immunosuppresseur, un stéroïde par injection intra/périoculaire ou un stéroïde topique dans l’œil étudié, à tout moment durantt l’étude et avant le 6 ème mois, a été considéré comme ayant présenté une récidive. La récidive pouvait être traitée à l’aide du traitement standard conformément aux critères définis dans le protocole.
Dans chaque essai clinique de phase III, le critère d’évaluation principal a été atteint. Les tableaux 3 et 4 présentent les résultats du critère de jugement principal d’efficacité comparant la proportion de récidives de l’uvéite dans l’œil de l’étude par rapport au témoin simulé. La figure 4 présente une comparaison du délai jusqu’à la récidive d’uvéite dans ces groupes de traitement.
Tableau 3 : Proportion de patients présentant une récidive d’uvéite dans l’œil étudié dans les 6 mois (population en ITT) : PSV-FAI-001 et PSV-FAI-005
|
Population en ITT |
||||
|
|
PSV-FAI-001 |
PSV-FAI-005 |
||
|
|
Insertion IAF |
Injection simulée |
Insertion IAF |
Injection simulée |
|
Récidive dans les 6 mois, n (%) |
24 (27,6) |
38 (90,5) |
26 (25,7%) |
31 (59,6%) |
|
Aucune récidive dans les 6 mois, n (%) |
63 (72,4) |
4 (9,5) |
75 (74,3%) |
21 (40,4%) |
|
Différence par rapport à l’injection simulée1 |
|
|
||
|
Odds ratio |
24,94 |
4,26 |
||
|
IC à 95 % |
8,04, 77,39 |
2,09, 8,67 |
||
|
Valeur p |
< 0,001 |
< 0,001 |
||
|
Différence par rapport à l’injection simulée2 |
|
|
||
|
Différence en pourcentage |
62,9% |
33,9% |
||
|
IC à 95 % |
(50,0%, 75,8%) |
(18,0%, 49,7%) |
||
|
Valeur p |
< 0,001 |
< 0,001 |
||
1 L’Odds ratio et l’intervalle de confiance à 95 % sont basés sur la méthode de Mantel-Haenszel. La valeur p est issue d’un test du chi-2 avec correction de continuité comparant entre les groupes de traitement le nombre de patients présentant ou ne présentant pas de récidive d’uvéite à 6 mois.
2 La valeur p est issue d’un test du chi-2 de Cochran-Mantel-Haenszel pour mesurer l’association générale comparant entre les groupes de traitement le nombre de patients présentant ou ne présentant pas de récidive d’uvéite à 6 mois.
Tableau 4 : Proportion de patients présentant une récidive d’uvéite dans l’œil étudié dans les 6 mois (population en ITT) : regroupement des données des études Uvéite
|
|
Insertion IAF |
Injection simulée |
|
Récidive dans les 6 mois, n (%) |
50 (26,6) |
69 (73,4) |
|
Aucune récidive dans les 6 mois, n (%) |
138 (73,4) |
25 (26,6) |
|
Différence par rapport au témoin simulé1 |
|
|
|
Odds ratio |
7,62 |
|
|
IC à 95 % |
(4,35, 13,34) |
|
|
Valeur p |
< 0,001 |
|
|
Différence par rapport au témoin simulé2 |
|
|
|
Différence en pourcentage |
46,8 % |
|
|
IC à 95 % |
(35,9 %, 57,8 %) |
|
|
Valeur p |
< 0,001 |
|
1 L’Odds ratio et l’intervalle de confiance à 95 % sont basés sur la méthode de Mantel-Haenszel. La valeur p est issue d’un test du chi-2 avec correction de continuité comparant entre les groupes de traitement le nombre de patients présentant ou ne présentant pas de récidive d’uvéite à 6 mois.
2 La valeur p est issue d’un test du chi-2 de Cochran-Mantel-Haenszel pour mesurer l’association générale comparant entre les groupes de traitement le nombre de patients présentant ou ne présentant pas de récidive d’uvéite à 6 mois.
Figure 4 : Courbe de Kaplan-Meier du délai jusqu’aux premières récidives d’uvéite dans l’œil étudié dans les 6 mois (population en ITT) : regroupement des données des études Uvéite
![]()
![]()
![]()
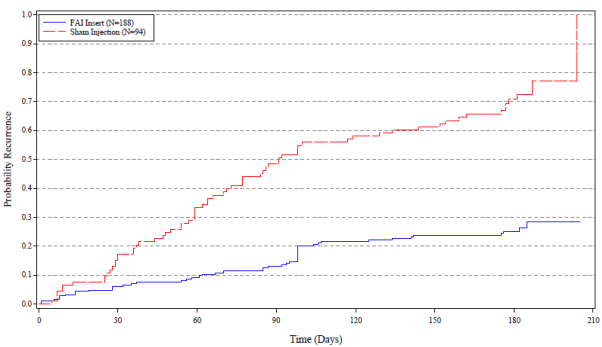
La valeur p (p < 0,001) comparant les deux distributions du délai de récidive d’uvéite est basée sur un test de type log-rank.
Dans la population en ITT, la récidive d’uvéite dans l’œil étudié rapportée à 6 mois était sensiblement (p < 0,001) inférieure dans le groupe ILUVIEN (37,9 %) par rapport au groupe injection simulée (97,6 %) ; l’Odds ratio pour la différence par rapport à l’injection simulée était 67,09 (IC à 95 % : 8,81- 511,06).
La persistance de l’efficacité a été démontrée par les résultats à 36 mois de l’étude de phase III initiée en premier (PSV-FAI-001) (voir le tableau présentant les résultats du critère d’évaluation principal de l’étude PSV-FAI-001 comparant la proportion de récidives d’uvéite dans l’œil étudié par rapport au témoin simulé et la figure relative à la comparaison du délai de la récidive d’uvéite dans ces groupes de traitement).
|
Population en ITT |
||
|
|
Insertion IAF |
Injection simulée |
|
Récidive dans les 36 mois, n (%) |
57 (65,5 %) |
41 (97,6 %) |
|
Aucune récidive dans les 36 mois, n (%) |
30 (34,5 %) |
1 (2,4 %) |
|
Différence par rapport au témoin simulé1 |
|
|
|
Odds ratio |
21,58 |
|
|
IC à 95 % |
(2,83, 164,70) |
|
|
Valeur p |
< 0,001 |
|
|
Différence par rapport au témoin simulé2 |
|
|
|
Différence en pourcentage |
32,1 % |
|
|
IC à 95 % |
(21,1 %, 43,1 %) |
|
|
Valeur p |
< 0,001 |
|
1 L’Odds ratio et l’intervalle de confiance à 95 % sont basés sur la méthode de Mantel-Haenszel. La valeur p est issue d’un test du chi-2 avec correction de continuité comparant entre les groupes de traitement le nombre de patients présentant ou ne présentant pas de récidive d’uvéite à 36 mois.
2 La valeur p est issue d’un test du chi-2 de Cochran-Mantel-Haenszel pour mesurer l’association générale comparant entre les groupes de traitement le nombre de patients présentant ou ne présentant pas de récidive d’uvéite à 36 mois.
Figure 5 : Courbe de Kaplan-Meier du délai jusqu’aux premièresrécidives d’uvéite dans l’œil étudié dans les 36 mois (population en ITT) : PSV-FAI-001
![]()
![]()
![]()
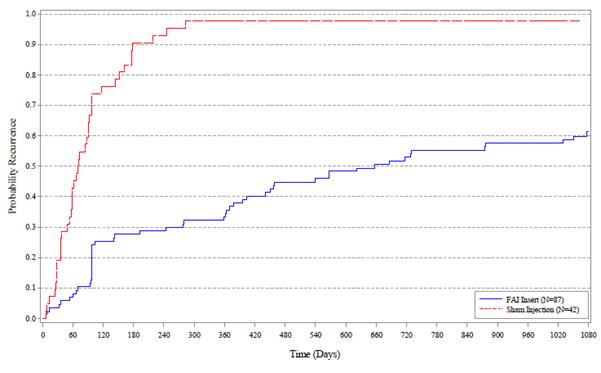 Dans la population en ITT, la récidive d’uvéite dans l’œil étudié dans les 36 mois était significativement inférieure (p < 0,001) dans le groupe ILUVIEN par rapport au groupe de injection simulée.
Dans la population en ITT, la récidive d’uvéite dans l’œil étudié dans les 36 mois était significativement inférieure (p < 0,001) dans le groupe ILUVIEN par rapport au groupe de injection simulée.
Tableau 6 : Nombre de récidives d’uvéite dans l’œil étudié dans les 6 mois (population en ITT) : PSV-FAI-001 et PSV-FAI-005
|
Population en ITT |
||||
|
|
PSV-FAI-001 |
PSV-FAI-005 |
||
|
|
Insertion IAF |
Injection simulée |
Insertion IAF |
Injection simulée |
|
Nombre totale de récidives |
36 |
70 |
59 |
53 |
|
Nombre de patients présentant au moins une récidive |
24 |
38 |
26 |
31 |
|
Nombre de récidives par patient |
|
|
|
|
|
N |
87 |
42 |
101 |
52 |
|
Moyenne (ET) |
0,4 (0,76) |
1,7 (1,07) |
0,6 (1,34) |
1,0 (1,21) |
|
Médiane |
0,0 |
1,0 |
0,0 |
1,0 |
|
Minimum, maximum |
(0,3) |
(0,5) |
(0,9) |
(0,6) |
|
0 |
63 (72,4 %) |
4 (9,5 %) |
75 (74,3 %) |
21 (40,4 %) |
|
1 |
14 (16,1 %) |
18 (42,9 %) |
12 (11,9 %) |
18 (34,6 %) |
|
2 |
8 (9,2 %) |
10 (23,8 %) |
4 (4,0 %) |
8 (15,4 %) |
|
3 |
2 (2,3 %) |
9 (21,4 %) |
7 (6,9 %) |
3 (5,8 %) |
|
4 |
0 (0,0 %) |
0 (0,0 %) |
1 (1,0 %) |
1 (1,9 %) |
|
5 |
0 (0,0 %) |
1 (2,4 %) |
1 (1,0 %) |
0 (0,0 %) |
|
>5 |
0 (0,0 %) |
0 (0,0 %) |
1 (1,0 %) |
1 (1,9 %) |
|
Différence par rapport au témoin simulé1 |
|
|
|
|
|
Estimation |
-1,3 |
-0,4 |
||
|
IC à 95 % |
(-1,62, -0,88) |
(-0,87, 0,00) |
||
|
Valeur p |
< 0,001 |
0,051 |
||
1 La valeur p est issue d’une analyse de variance à un facteur avec le groupe de traitement comme effet fixe comparant le nombre moyen de récidives d’uvéite dans les 36 mois.
Tableau 7 : Nombre de récidives d’uvéite dans l’œil étudié dans les 36 mois (population en ITT) : PSV-FAI-001
|
Population en ITT |
||
|
|
Insertion IAF |
Injection simulée |
|
Nombre total de récidives |
149 |
223 |
|
Nombre de patients présentant au moins une récidive |
57 |
41 |
|
Nombre de récidives par patient |
|
|
|
N |
87 |
42 |
|
Moyenne (ET) |
1,7 (2,42) |
5,3 (3,84) |
|
Médiane |
1,0 |
5,0 |
|
Minimum, maximum |
(0,15) |
(0,15) |
|
0 |
30 (34,5 %) |
1 (2,4 %) |
|
1 |
29 (33,3 %) |
5 (11,9 %) |
|
2 |
7 (8,0 %) |
7 (16,7 %) |
|
3 |
8 (9,2 %) |
4 (9,5 %) |
|
4 |
4 (4,6 %) |
3 (7,1 %) |
|
5 |
2 (2,3 %) |
5 (11,9 %) |
|
>5 |
7 (8,0 %) |
17 (40,5 %) |
|
Différence par rapport au témoin simulé1 |
|
|
|
Estimation |
-3,6 |
|
|
IC à 95 % |
(-4,89, -2,30) |
|
|
Valeur p |
< 0,001 |
|
1 La valeur p est issue d’une analyse de variance à un facteur avec le groupe de traitement comme effet fixe comparant le nombre moyen de récidives d’uvéite dans les 36 mois.
Les patients traités par ILUVIEN ont présenté significativement moins de récidives dans les 36 mois que les patients ayant reçu l’injection simulée (1,7 récidives par rapport à 5,3 récidives, respectivement, p < 0,001).
Tableau 8 : Nombre de traitements complémentaires de l’uvéite dans l’œil étudié dans les 6 mois (population en ITT) : PSV-FAI-001 et PSV-FAI-005
|
Population en ITT |
||||
|
|
PSV-FAI-001 |
PSV-FAI-005 |
||
|
|
Insertion IAF |
Injection simulée |
Insertion IAF |
Injection simulée |
|
Stéroïdes systémiques ou immunosuppresseur |
|
|
|
|
|
Nombre total de récidives |
21 |
24 |
25 |
14 |
|
Nombre de patients présentant au moins une récidive |
13 (14,9 %) |
16 (38,1 %) |
14 (13,9 %) |
11 (21,2 %) |
|
Différence par rapport au témoin simulé1 |
|
|
||
|
Différence en pourcentage |
23,2 % |
7,3 % |
||
|
IC à 95 % |
(6,7 %, 39,6 %) |
(-5,7 %, 20,3 %) |
||
|
Valeur p |
0,003 |
0,249 |
||
|
Injection intra/périoculaire de stéroïde |
|
|
|
|
|
Nombre total de récidives |
5 |
35 |
2 |
19 |
|
Nombre de patients présentant au moins une récidive |
5 (5,7 %) |
24 (57,1 %) |
2 (2 %) |
19 (36,5 %) |
|
Différence par rapport au témoin simulé1 |
|
|
||
|
Différence en pourcentage |
51,4 % |
34,6 % |
||
|
IC à 95 % |
(35,7 %, 67,1 %) |
(21,2 %, 47,9 %) |
||
|
Valeur p |
< 0,001 |
< 0,001 |
||
|
Stéroïde topique |
|
|
||
|
Nombre total de récidives |
17 |
22 |
11 |
17 |
|
Nombre de patients présentant au moins une récidive |
15 (17,2 %) |
18 (42,9 %) |
10 (9,9 %) |
12 (23,1 %) |
|
Différence par rapport au témoin simulé1 |
|
|
||
|
Différence en pourcentage |
25,6 % |
13,2 % |
||
|
IC à 95 % |
(8,7 %, 42,6 %) |
(0,3 %, 26,0 %) |
||
|
Valeur p |
0,002 |
0,028 |
||
1 La valeur p est issue d’un test du chi-2 de Cochran-Mantel-Haenszel pour mesurer l’association générale comparant entre les groupes de traitement le nombre de patients ayant reçu ou pas de traitement complémentaire.
Tableau 9 : Nombre de traitements complémentaires de l’uvéite dans l’œil étudié dans les 36 mois (population en ITT) : PSV-FAI-001
|
Population en ITT |
||
|
|
Insertion IAF |
Injection simulée |
|
Stéroïdes systémiques ou immunosuppresseur |
|
|
|
Nombre total de récidives |
61 |
45 |
|
Nombre de patients présentant au moins une récidive |
30 (34,5 %) |
21 (50,0 %) |
|
Différence par rapport au témoin simulé1 |
|
|
|
Différence en pourcentage |
15,5 % |
|
|
IC à 95 % |
(-2,6 %, 33,6 %) |
|
|
Valeur p |
0,092 |
|
|
Injection intra/périoculaire de stéroïde |
|
|
|
Nombre total de récidives |
23 |
99 |
|
Nombre de patients présentant au moins une récidive |
17 (19,5 %) |
29 (69,0 %) |
|
Différence par rapport au témoin simulé1 |
|
|
|
Différence en pourcentage |
49,5 % |
|
|
IC à 95 % |
(33,2 %, 65,8 %) |
|
|
Valeur p |
< 0,001 |
|
|
Stéroïde topique |
|
|
|
Nombre total de récidives |
40 |
47 |
|
Nombre de patients présentant au moins une récidive |
24 (27,6 %) |
24 (57,1 %) |
|
Différence par rapport au témoin simulé1 |
|
|
|
Différence en pourcentage |
29,6 % |
|
|
IC à 95 % |
(11,9 %, 47,2 %) |
|
|
Valeur p |
0,001 |
|
1 La valeur p est issue d’un test du chi-2 de Cochran-Mantel-Haenszel pour mesurer l’association générale comparant entre les groupes de traitement le nombre de patients ayant reçu ou pas de traitement complémentaire.
Significativement moins de patients traités par ILUVIEN que de patients ayant reçu l’injection simulée ont eu besoin de stéroïdes complémentaires par injection intra/périoculaire (19,5 % par rapport à 69,0 % respectivement, p<0.001) ou de stéroïdes topiques complémentaires (27,6 % par rapport à 57,1 % respectivement, p = 0,001).
Moins de patients ont eu besoin de stéroïdes systémiques complémentaires ou d’un traitement immunosuppresseur complémentaire (34,5 % par rapport à 50,0 % respectivement, p = 0,092).
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec l’acétonide de fluocinolone administré par voie intravitréenne dans tous les sous‑groupes de la population pédiatrique dans le traitement de l’œdème maculaire diabétique (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques
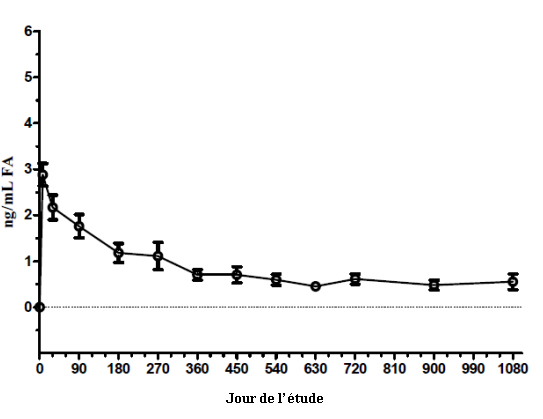
Figure 6 : Concentrations de la FA dans l’humeur aqueuse humaine chez des sujets ayant reçu 1 implant ILUVIEN (Etude FAMOUS)
5.3. Données de sécurité préclinique
Des effets locaux (lésions dégénératives focales des fibres dans les régions polaire postérieure et corticale postérieure du cristallin) ont été observés chez le lapin à des doses d’acétonide de fluocinolone administré par voie intravitréenne supérieures à la dose utilisée en clinique. Des effets locaux (fibrose rétinienne focale) ont également été observés chez des lapins traités avec le dispositif contenant l’acétonide de fluocinolone ou le placebo.
Cette formation de tissu fibreux n’a pas été observée en clinique chez l’homme et il est présumé qu’elle est due à des différences anatomiques entre l’œil de lapin et l’œil humain.
Alcool polyvinylique, tube en polyimide, adhésif siliconé.
Sans objet.
Après première ouverture de l’opercule, utiliser immédiatement.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30°C. Ne pas mettre au réfrigérateur ou congeler.
La plaquette thermoformée scellée ne doit être ouverte qu’immédiatement avant utilisation.
6.5. Nature et contenu de l'emballage extérieur
6.6. Précautions particulières d’élimination et de manipulation
Eliminer l’applicateur en toute sécurité dans un collecteur à aiguilles DASRI.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
ALIMERA SCIENCES EUROPE LIMITED
77 SIR JOHN ROGERSON’s QUAY
DUBLIN 2
IRLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 222 858 1 8 : implant intravitréen avec applicateur sous plaquette thermoformée ; boîte de 1
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament à prescription réservée aux spécialistes en ophtalmologie.
Liste I.
ANSM - Mis à jour le : 19/01/2024
ILUVIEN 190 microgrammes, implant intravitréen avec applicateur
Acétonide de fluocinolone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ILUVIEN 190 microgrammes, implant intravitréen avec applicateur et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ILUVIEN 190 microgrammes, implant intravitréen avec applicateur ?
3. Comment utiliser ILUVIEN 190 microgrammes, implant intravitréen avec applicateur ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ILUVIEN 190 microgrammes, implant intravitréen avec applicateur ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ILUVIEN 190 microgrammes, implant intravitréen avec applicateur ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : S01BA15.
Ce médicament est un anti-inflammatoire stéroïdien (fluocinolone).
L’implant ILUVIEN est un tube minuscule qui est inséré dans l’œil et libère de très faibles quantités de la substance active, l’acétonide de fluocinolone, pendant une durée allant jusqu’à 3 ans. L’acétonide de fluocinolone appartient à un groupe de médicaments appelés corticoïdes.
ILUVIEN est utilisé pour traiter la perte de vision associée à l’œdème maculaire diabétique lorsque les autres traitements disponibles n’ont pas été efficaces. L’œdème maculaire diabétique est une maladie qui affecte certains patients diabétiques et provoque des dommages à la membrane photosensible située à l’arrière de l’œil appelée la macula, qui est responsable de la vision centrale. La substance active (l’acétonide de fluocinolone) aide à diminuer l’inflammation et l’œdème qui s’accumulent dans la macula au cours de cette maladie. ILUVIEN peut ainsi aider à améliorer la perte de vision ou l’empêcher de s’aggraver.
ILUVIEN est utilisé pour prévenir les récidives de l’inflammation de l’arrière de l’œil. Cette inflammation peut provoquer des corps flottants qui se présentent comme des points noirs ou des lignes fines se déplaçant sur ce que vous pouvez voir (« champs de vision »), ou peut provoquer une perte de vision en endommageant la partie de l’œil qui est responsable de la vision des détails, appelée la « macula ». La perte de vision pourrait ne pas s’améliorer sans traitement de l’inflammation. ILUVIEN aide à réduire l’inflammation et le gonflement qu’elle peut provoquer dans la partie arrière de l’œil. Il peut aider à améliorer votre vision ou l’empêcher de s’aggraver. Il peut éviter de futures crises inflammatoires.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ILUVIEN 190 microgrammes, implant intravitréen avec applicateur ?
N’utilisez jamais ILUVIEN 190 microgrammes, implant intravitréen avec applicateur :
· Si vous êtes allergique à la substance active ou à l’un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6,
· Si vous présentez une infection de tout type dans l’œil ou autour de l’œil,
· Si vous souffrez d’un glaucome (tension élevée dans l’œil).
Avertissements et précautions
· Avant l'injection d'ILUVIEN, informez votre médecin si :
o vous prenez des médicaments pour fluidifier le sang,
o vous avez eu dans le passé une infection oculaire à Herpes simplex (ulcère sur l'œil ayant persisté longtemps).
· ILUVIEN est administré en injection dans l'œil. Parfois, l'injection peut provoquer une infection dans l'œil, une douleur oculaire ou une rougeur oculaire, un décollement ou une déchirure de la rétine. Il est important de détecter et de traiter ces affections le plus rapidement possible. Veuillez informer immédiatement votre médecin si vous développez les symptômes suivants après l'injection : augmentation de la douleur ou de la gêne oculaire, aggravation de la rougeur de l'œil, éclairs lumineux et augmentation subite des corps flottants, champ visuel partiellement obstrué, vision floue ou perte de vision, augmentation de la sensibilité à la lumière ou tout autre trouble visuel après votre injection.
· Chez certains patients, la pression dans l'œil (pression intraoculaire) peut augmenter, avec un risque de développement de glaucome. Ce que vous pourriez ne pas remarquer ; par conséquent, votre médecin devra vous surveiller dans le cadre de visites de contrôle à la clinique.
· Chez la majorité des patients qui n'ont pas encore été opérés de la cataracte, une opacification du cristallin naturel de l'œil (cataracte) peut survenir après le traitement par ILUVIEN. Si c'est le cas, votre vision baissera et une intervention chirurgicale sera probablement nécessaire pour éliminer la cataracte. Votre médecin vous aidera è décider quel est le moment le plus approprié pour cette intervention, mais vous devez savoir que tant que vous n'aurez pas été opéré(e), votre vision pourra rester aussi faible, voire plus, qu'avant que vous ayez reçu l'injection d'ILUVIEN.
· L'injection d'ILUVIEN dans les deux yeux simultanément n'a pas été étudiée et n'est pas recommandée. Votre médecin ne doit pas injecter ILUVIEN dans les deux yeux simultanément.
· Il existe un risque de déplacement de l’implant ILUVIEN de l’arrière vers l’avant de l’œil. Ce risque est augmenté si une chirurgie de la cataracte a été réalisée antérieurement. Un signe de déplacement de l’implant vers l’avant de l’œil pourrait être une vision déformée ou d’autres troubles visuels, un gonflement de la surface de l’œil (gonflement de la cornée) ou vous pourriez remarquer une modification de l’aspect de la face avant de votre œil. Si vous remarquez tout signe anormal pouvant vous faire suspecter que l’implant s’est déplacé, parlez-en immédiatement à votre médecin.
· Chez les patients présentant une inflammation à l’arrière de l’œil, la tension dans l’œil peut diminuer, mais cet effet ne dure habituellement que quelques jours après l’injection. Il est possible que vous ne le remarquiez pas ; par conséquent, votre médecin devra vous surveiller dans les 2 à 8 jours et dans le cadre de visites de contrôle à la clinique.
Enfants et adolescents (en dessous de 18 ans)
· L’utilisation d’ILUVIEN chez les enfants et adolescents n’a pas été étudiée et n’est donc pas recommandée.
Autres médicaments et ILUVIEN 190 microgrammes, implant intravitréen avec applicateur
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin.
ILUVIEN 190 microgrammes, implant intravitréen avec applicateur avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Les données concernant l'utilisation d'ILUVIEN chez la femme enceinte ou pendant l’allaitement sont limitées, les risques potentiels sont donc inconnus.
Il n’existe pas de données concernant la fertilité. Cependant, ILUVIEN étant inséré directement dans l’œil, des effets sur la fertilité masculine ou féminine sont peu probables.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant le traitement par ILUVIEN.
Conduite de véhicules et utilisation de machines
Vous pourrez présenter une vision trouble temporaire après le traitement par ILUVIEN. Dans ce cas, vous ne devrez pas conduire ou utiliser des outils ou des machines jusqu’à ce que votre vision soit rétablie.
ILUVIEN 190 microgrammes, implant intravitréen avec applicateur contient :
Sans objet.
3. COMMENT UTILISER ILUVIEN 190 microgrammes, implant intravitréen avec applicateur ?
L’injection d’ILUVIEN sera réalisée par votre ophtalmologiste.
Posologie
ILUVIEN est administré en une injection unique dans l’œil. Par la suite, votre médecin contrôlera régulièrement votre vision.
Avant l’injection, votre médecin instillera un collyre antibactérien et nettoiera soigneusement votre œil pour prévenir une infection. Il appliquera également un anesthésique local pour empêcher que l’injection provoque une douleur.
Avant et après l’injection, votre médecin vous demandera peut-être d’utiliser un collyre antibiotique pour prévenir une infection oculaire éventuelle. Veuillez respecter attentivement ces instructions.
Si vous avez utilisé plus de ILUVIEN 190 microgrammes, implant intravitréen avec applicateur que vous n’auriez dû :
Sans objet.
Si vous oubliez d’utiliser ILUVIEN 190 microgrammes, implant intravitréen avec applicateur :
Sans objet.
Si vous arrêtez d’utiliser ILUVIEN 190 microgrammes, implant intravitréen avec applicateur :
Si l’effet de l’implant disparaît et si votre médecin le recommande, un autre implant pourra être injecté dans votre œil. Cela est possible uniquement si vous avez reçu ILUVIEN pour le traitement d’un œdème maculaire diabétique.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Certains effets indésirables, principalement oculaires, peuvent survenir après l'administration d'ILUVIEN. Parfois, l'injection peut provoquer une infection dans l'œil, une douleur oculaire ou une rougeur oculaire, un décollement ou une déchirure de la rétine. Il est important de détecter et de traiter ces affections le plus rapidement possible. Veuillez informer immédiatement votre médecin si vous développez les symptômes suivants après l'injection : augmentation de la douleur ou de la gêne oculaire, aggravation de la rougeur de l'œil, éclairs lumineux et augmentation brutale des corps flottants, champ visuel partiellement obstrué, perte de vision ou augmentation de la sensibilité á la lumière. Les autres effets indésirables peuvent être une augmentation ou une diminution de la tension dans l'œil ou une opacification du cristallin naturel de l'œil. Le risque d'augmentation de la tension dans l'œil (pression intraoculaire) avec atteinte du nerf optique (glaucome) peut être accru si votre pression intraoculaire avant traitement était supérieure à la pression intraoculaire moyenne.
Votre médecin parlera avec vous de ce risque avant le traitement.
Les symptômes que vous pourriez présenter sont décrits dans la rubrique 2 de cette notice (Avertissements et précautions), ou il est également expliqué ce que vous devez faire si vous présentez ces symptômes.
Les effets indésirables suivants peuvent être observés avec ILUVIEN :
Très fréquent (affectant plus de 1 patient sur 10)
Augmentation de la tension dans l'œil (pression intraoculaire), opacification du cristallin naturel de l'œil (cataracte) ou chirurgie oculaire pour corriger la cataracte.
Fréquent (affectant de 1 à 10 patients sur 100)
Augmentation de la tension dans l'œil avec atteinte du nerf optique (glaucome), décollement de la couche sensible à la lumière de l’arrière de l'œil (décollement de la rétine),saignement dans le blanc de l'œil ou à l'intérieur de l'œil, petites particules ou taches dans le champ visuel (corps flottants), , sensation de regarder à travers de la brume ou du brouillard, diminution de la tension dans l'œil qui peut provoquer une douleur soudaine et une vision floue, perte de votre champ de vision habituel, douleur ou irritation oculaire, baisse de la vision, ou chirurgie oculaire ou intervention pour diminuer l'hypertension oculaire ou pour retirer la substance gélatineuse qui remplit l'arrière de l'œil , augmentation de la quantité de protéines ou de cellules à l’avant de l'œil en raison d’une inflammation, sensation de corps étranger dans l'œil, sécheresse oculaire.
Peu fréquent (affectant moins de 1 patient sur 100)
Obstruction des vaisseaux sanguins à l'arrière de l'œil, développement de nouveaux vaisseaux sanguins dans l'œil, ulcère sur le blanc de l'œil, modifications de la substance gélatineuse qui remplit l'arrière de l'œil, opacification de l'enveloppe qui contient le cristallin de l'œil, rougeur oculaire, démangeaisons ou infection oculaires, amincissement de la membrane blanche externe de l'œil, blessure oculaire due à l'injection du médicament, déplacement imprévu de l'implant dans la partie blanche de l'œil et/ou autres complications de l'injection, déplacement de l’implant ILUVIEN de l’arrière vers l’avant de l’œil , gonflement de la surface de l’œil (gonflement de la cornée), fermeture involontaire des paupières, yeux sensibles et douloureux avec apparition soudaine d’une douleur intense parfois associée avec une vision floue, dépôts sur la couche la plus externe de l'œil, état douloureux de l'œil dû à une égratignure sur la surface de l'œil, gonflement de l'œil.
Les effets indésirables non visuels les plus fréquents rapportés comme pouvant être causés par le médicament ou par l'injection sont des maux de tête.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ILUVIEN 190 microgrammes, implant intravitréen avec applicateur ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte après EXP.
A conserver à une température ne dépassant pas 30°C.
Ne pas mettre au réfrigérateur ou congeler.
La plaquette scellée ne doit être ouverte qu’immédiatement avant utilisation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
Éliminer l’applicateur en toute sécurité dans un collecteur à aiguilles DASRI.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ILUVIEN 190 microgrammes, implant intravitréen avec applicateur
· La substance active est : l’acétonide de fluocinolone.
Chaque implant intravitréen contient 190 microgrammes d’acétonide de fluocinolone.
· L’autre composant est : alcool polyvinylique.
L’implant est un petit tube en polyimide, scellé par de l’adhésif siliconé à une extrémité et par de l’alcool polyvinylique à l’autre extrémité.
Ce médicament se présente sous forme d’un implant intravitéen qui à la forme d’un tube brun clair minuscule (mesurant environ 3,5 mm x 0,37 mm) qui est préchargé dans un applicateur. Boite avec une plaquette thermoformée contenant un implant avec applicateur.
Titulaire de l’autorisation de mise sur le marché
ALIMERA SCIENCES EUROPE LIMITED
77 SIR JOHN ROGERSON’S QUAY
DUBLIN 2
IRLANDE
Exploitant de l’autorisation de mise sur le marché
HORUS PHARMA
22 Allée Camille Muffat
INEDI 5
06200 NICE
block-7, city north business campus
stamullen
co. meath
k32 yd60
irlande
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
Indications thérapeutiques
ILUVIEN est indiqué dans le traitement de
· la perte d’acuité visuelle associée à l’œdème maculaire diabétique chronique lorsque la réponse aux traitements disponibles est jugée insuffisante.
· la prévention de la rechute de l’uvéite récidivante non infectieuse affectant le segment postérieur de l’œil.
Contre-indications
L’implant intravitréen ILUVIEN est contre-indiqué en présence d’un glaucome préexistant ou d’une infection oculaire ou périoculaire active ou suspectée, incluant la plupart des maladies virales de la cornée et de la conjonctive, dont la kératite épithéliale active à Herpès simplex (kératite dendritique), la vaccine, la varicelle, les infections mycobactériennes et les mycoses.
ILUVIEN est contre-indiqué chez les patients présentant
· une hypersensibilité à la substance active ou à l’un des excipients.
· une uvéite infectieuse
Mode d’administration
VOIE INTRAVITREENNE UNIQUEMENT.
ILUVIEN ne doit être administré que par voie intravitréenne et par un ophtalmologiste expérimenté dans les injections intravitréennes.
La procédure d’injection intravitréenne doit être réalisée en conditions d'asepsie contrôlées, incluant le port de gants stériles, l'utilisation d'un champ stérile et d'un blépharostat (ou équivalent) stérile. Une anesthésie adéquate et une antisepsie antibactérienne à large spectre doivent être administrées avant l'injection.
La procédure d’injection d’ILUVIEN est la suivante :
1. Un collyre antibiotique peut être administré avant l'intervention à l'appréciation de l'ophtalmologiste traitant.
2. Juste avant l’injection, instiller une goutte d'anesthésique local sur le site d’injection (le quadrant temporal inférieur est recommandé), suivie de l'application d'un coton-tige imbibé d'anesthésique ou d'une injection sous-conjonctivale d'un anesthésique approprié.
3. Instiller 2 ou 3 gouttes d'un antiseptique local approprié dans le cul-de-sac conjonctival. Les paupières peuvent être nettoyées avec des cotons-tiges imbibés d'un antiseptique local approprié. Placer un blépharostat stérile. Demander au patient de regarder vers le haut et appliquer un coton-tige imbibé d'un antiseptique approprié sur le site d’injection. Laisser l'antiseptique local sécher pendant 30 à 60 secondes avant l’injection d'ILUVIEN.
4. L'extérieur de la plaquette thermoformé ne doit pas être considéré comme stérile. Une assistante (en conditions non stériles) doit sortir la plaquette thermoformée de la boite puis examiner la plaquette et le film pour vérifier l’absence de dommage. En cas de dommage, ne pas utiliser l’unité.
Si l’unité peut être utilisée, l’assistance doit retirer le film de la plaquette sans toucher la surface intérieure.
5. Vérifier par la fenêtre de visualisation de l'applicateur préchargé que celui-ci contient bien l'implant.
6. En portant des gants stériles, retirer l'applicateur de la plaquette thermoformée en ne touchant que la surface stérile et l'applicateur.
Le capuchon de protection de l’aiguille ne doit être retiré que lorsque l’implant ILUVIEN est prêt à être injecté.
Avant l’injection, l’embout de l’applicateur doit être maintenu incliné pour garantir que l’implant est positionné correctement dans l’applicateur.
7. La procédure d’injection doit être effectuée en deux étapes pour limiter la quantité d'air administrée avec l'implant. Avant d'insérer l'aiguille dans l'œil, appuyer sur le bouton et le faire glisser jusqu'au premier arrêt (au niveau des repères noirs incurvés le long de la glissière du bouton). Au premier arrêt, relâcher le bouton, il passera en position UP (HAUT). Si le bouton ne passe pas en position UP, ne pas continuer à utiliser cette unité.
8. Le positionnement optimal de l'implant est la région située sous la papille optique et à l'arrière de l'équateur de l’œil. A l'aide d'un compas, mesurer une distance de 4 mm à partir du limbe dans le quadrant temporal inférieur.
9. Retirer avec précaution le capuchon de protection de l'aiguille et vérifier que la pointe de l’aiguille n’est pas courbée.
10. Déplacer doucement la conjonctive de façon à ce que, après le retrait de l'aiguille, les sites d'insertion conjonctival et scléral de l'aiguille ne soient pas alignés. Prendre des précautions pour éviter tout contact entre l'aiguille et le bord de la paupière ou les cils. Insérer l'aiguille dans l'œil. Pour libérer l'implant, le bouton étant en position UP, faire glisser le bouton vers l'avant jusqu’à l’extrémité de sa glissière et retirer l'aiguille. Remarque : vérifier que le bouton a atteint l’extrémité de la glissière avant de retirer l’aiguille.
11. Retirer le blépharostat et vérifier par ophtalmoscopie indirecte le positionnement de l'implant, la perfusion correcte de l'artère rétinienne et l'absence de toute autre complication. La visualisation de l'implant peut être facilitée en appuyant sur la sclérotique. L'examen doit inclure un contrôle de la perfusion de la tête du nerf optique immédiatement après l’injection. Une mesure immédiate de la pression intraoculaire (PlO) peut être effectuée à l'appréciation de l'ophtalmologiste.
Après l'intervention, les patients doivent être surveillés pour détecter des complications éventuelles telles qu'endophtalmie, augmentation de la pression intraoculaire, décollement de la rétine hémorragies ou décollements vitréens et hypotonie oculaire (observée jusqu’à 8 jours après la fin du traitement). Une biomicroscopie avec tonométrie doit être réalisée dans les deux à sept jours suivant l’injection de l'implant.
Compte tenu de la durée de libération de l'acétonide de fluocinolone (environ 36 mois), il est recommandé de poursuivre ces contrôles au moins une fois par trimestre afin de détecter l'apparition d'éventuelles complications (voir rubrique 4.4).