
ANSM - Mis à jour le : 19/03/2024
FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose
Latanoprost / timolol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose ?
3. Comment utiliser FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose ?
6. Contenu de l’emballage et autres informations.

Classe pharmacothérapeutique Bêta-bloquant ophtalmique – timolol, en association, code ATC : S01ED51
FIXAPOST est indiqué pour faire baisser la pression intraoculaire chez les patients atteints de glaucome à angle ouvert ou d’hypertonie intraoculaire. Ces deux pathologies sont liées à une augmentation de la pression interne de l’œil qui risque éventuellement d’endommager votre vue. Votre médecin prescrira FIXAPOST quand d’autres médicaments n’auront pas agi de manière adéquate.

N’utilisez jamais FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose :
· si vous êtes allergique (hypersensible) au latanoprost, timolol, bêta-bloquant ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous avez souffert ou souffrez actuellement de troubles respiratoires graves tels que de l’asthme, une bronchite chronique obstructive sévère (trouble pulmonaire sévère pouvant entraîner une respiration sifflante, une difficulté à respirer et/ou une toux de longue date),
· si vous présentez des troubles cardiaques graves ou des troubles du rythme cardiaque.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser FIXAPOST si vous avez ou si vous avez eu dans le passé :
· Une maladie coronarienne (dont les symptômes peuvent être une douleur ou une oppression de la poitrine, une difficulté à respirer, ou une suffocation), une insuffisance cardiaque, ou une tension artérielle basse.
· des troubles de la fréquence cardiaque tels que les pulsations cardiaques lentes.
· des problèmes respiratoires, de l’asthme ou une bronchite chronique obstructive.
· des problèmes de circulation sanguine (tels que la maladie ou le syndrome de Raynaud).
· du diabète puisque le timolol peut masquer les signes et les symptômes de glycémie basse.
· un excès d’hormones thyroïdiennes (hyperthyroïdie) puisque le timolol peut en masquer les signes et les symptômes.
· si vous devez subir ou si vous avez subi une intervention au niveau de l’œil (y compris une opération de la cataracte).
· si vous souffrez d’une autre maladie oculaire (douleur au niveau de l’œil, irritation ou inflammation oculaire, vision trouble).
· si vous souffrez d’une sécheresse oculaire.
· si vous portez des lentilles de contact. Vous pouvez utiliser FIXAPOST, à condition de suivre les instructions mentionnées en rubrique 3.
· si vous souffrez d’angine de poitrine (en particulier d’angor de Prinzmetal).
· si vous souffrez de réactions allergiques sévères nécessitant une prise en charge hospitalière.
· si vous avez souffert ou souffrez actuellement d’une infection virale de l’œil due au virus herpès simplex (VHS).
Prévenez votre médecin que vous utilisez FIXAPOST avant une intervention chirurgicale car le timolol peut modifier les effets de certains médicaments utilisés durant l’anesthésie.
Enfants
Sans objet.
Autres médicaments et FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament y compris les médicaments obtenus sans ordonnance.
L’effet de FIXAPOST peut être affecté par les autres thérapeutiques que vous prenez y compris d’autres collyres pour le traitement du glaucome, de même FIXAPOST peut en modifier l’effet. Prévenez votre médecin si vous utilisez ou avez l’intention d’utiliser des médicaments visant à diminuer la pression artérielle, des traitements pour le cœur ou pour le diabète. Informez en particulier votre médecin ou votre pharmacien si vous prenez un des médicaments suivants :
· prostaglandines, analogues des prostaglandines, ou dérivés des prostaglandines ;
· bêta-bloquants ;
· adrénaline ;
· médicaments utilisés dans le traitement de l’hypertension artérielle, tels que des inhibiteurs calciques, la guanethidine, les antiarythmiques, les glycosides digitaliques ou parasympathomimétiques ;
· quinidine (utilisée pour le cœur et pour certaines formes de paludisme) ;
· antidépresseurs connus comme la fluoxétine et la paroxétine
FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose avec des aliments et boissons
Une alimentation normale (boisson et nourriture) n’influence pas les modalités d’utilisation de FIXAPOST.
Grossesse, allaitement et fertilité
N'utilisez pas FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose si vous êtes enceinte ou si vous allaitez.
FIXAPOST peut être excrété dans le lait.
Ni le latanoprost ni le timolol n’a révélé avoir un impact sur la fertilité masculine ou féminine dans les études animales.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Lorsque vous utilisez FIXAPOST vous pouvez avoir une vision trouble pendant un court instant. Si cela vous arrive, vous ne devez pas conduire, utiliser des outils ou des machines jusqu’à ce que votre vision redevienne normale.
FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose contient de l’hydroxystéarate de macrogolglycérol (dérivé de l’huile de ricin) qui peut provoquer des réactions cutanées.

La dose recommandée chez l’adulte (y compris chez le sujet âgé) est d’une goutte dans l’œil (les yeux) à traiter, une fois par jour.
N’utilisez pas FIXAPOST plus d’une fois par jour, votre traitement pourrait être moins efficace si vous l’utilisez plus souvent.
Utilisez FIXAPOST tel que vous l’a indiqué votre médecin jusqu’à ce que votre médecin vous demande d’arrêter.
Si vous utilisez FIXAPOST, votre médecin pourra vous demander d’effectuer des examens complémentaires pour évaluer le fonctionnement de votre cœur et de votre circulation sanguine.
Porteurs de lentilles de contact
Si vous portez des lentilles de contact, retirez-les avant d’utiliser FIXAPOST et ne les remettez que 15 minutes après l’instillation.
Mode d’administration
Ce médicament doit être administré dans l’œil.
Veuillez suivre les instructions suivantes lors de l’utilisation de ce collyre :
1. Lavez-vous les mains et asseyez-vous ou installez-vous confortablement.
2. Ouvrez le sachet contenant les 5 récipients unidose. Inscrivez la date de première ouverture sur le sachet.
3. Détachez un seul récipient unidose de la plaquette.
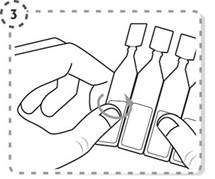
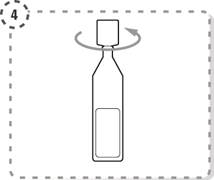
4. Tournez l’extrémité du récipient unidose pour l’ouvrir comme indiqué. Ne touchez pas l’embout du récipient après l’avoir ouvert.
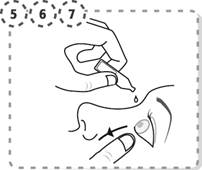
5. Avec vos doigts abaissez doucement la paupière inférieure de l’œil à traiter.
6. Approchez l’embout du récipient unidose de votre œil sans le toucher.
7. Pressez légèrement le récipient unidose afin de faire tomber une goutte dans votre œil, puis relâchez la paupière inférieure.
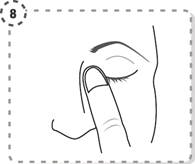
8. Appuyez légèrement avec votre doigt sur le coin interne de l'œil à traiter proche du nez pendant deux minutes tout en gardant l’œil fermé.
9. Répétez cette procédure dans l'autre œil si cela vous a été prescrit par votre médecin. Chaque récipient unidose contient assez de solution pour les deux yeux.
10. Jetez le récipient unidose immédiatement après l’administration. Ne pas le garder pour une utilisation ultérieure. Puisque la stérilité ne peut pas être maintenue après l'ouverture du récipient unidose, un nouveau récipient doit être ouvert avant chaque utilisation.
11. Remettez les récipients unidose non ouverts dans le sachet. Rangez le sachet ouvert dans sa boîte. Les récipients non ouverts doivent être utilisés dans un délai d’un mois suivant l’ouverture du sachet.
Si vous utilisez FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose avec un autre collyre
Attendez au moins 5 minutes entre l’administration de FIXAPOST et celle de l’autre collyre.
Si vous avez utilisé plus de FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose que vous n’auriez dû
Si vous avez mis trop de gouttes dans votre œil, une sensation d'irritation peut apparaître et vos yeux peuvent larmoyer et devenir rouges. Ceci doit disparaître mais si vous êtes inquiet, demandez conseils à votre médecin.
Si vous avalez FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose
En cas d’ingestion accidentelle de FIXAPOST, contactez immédiatement votre médecin. Si vous ingérez une grande quantité de FIXAPOST, vous pouvez vous sentir mal, avoir des maux d’estomac, vous sentir fatigué, présenter des rougeurs et avoir une sensation d’étourdissement, ou commencer à transpirer.
Si vous oubliez d’utiliser FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose
En cas de doute, parlez-en à votre médecin ou à votre pharmacien.
Si vous arrêtez d’utiliser FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose
Sans objet.

De manière générale, vous pouvez continuer à utiliser les gouttes comme d'habitude à moins que les effets ne soient graves. Si vous êtes inquiet, parlez-en à votre médecin ou à votre pharmacien. N'arrêtez pas d'utiliser FIXAPOST sans en parler à votre médecin.
Sont listés ci-dessous les effets indésirables connus liés à l’utilisation de FIXAPOST. L’effet indésirable le plus important est une modification progressive et définitive de la couleur des yeux. Il est aussi possible que FIXAPOST entraîne des modifications importantes du fonctionnement de votre cœur. Si vous remarquez des troubles affectant votre cœur, parlez-en à votre médecin en mentionnant que vous avez utilisé FIXAPOST.
Les effets indésirables suivants ont été rapportés lors de l’utilisation de FIXAPOST :
Très fréquent (peut affecter plus de 1 patient sur 10) :
Une modification de la couleur des yeux par augmentation de la quantité de pigments bruns dans la partie colorée de l’œil appelée l’iris. Si vous avez des yeux de plusieurs couleurs (c'est-à-dire bleu-marron, gris-marron, jaune-marron ou vert-marron) vous avez une plus grande probabilité d’observer ces changements que si vos yeux sont d’une seule couleur (bleu, gris, vert ou brun). Cette modification de la couleur des yeux peut évoluer pendant des années. Cette modification de couleur peut être définitive et peut être plus visible si votre traitement par FIXAPOST ne concerne qu’un seul œil. Il ne semble pas y avoir d’autre problème associé au changement de couleur de l’œil. Le changement de la couleur de l’œil ne se poursuit pas après l’arrêt du traitement par FIXAPOST.
Fréquent (peut affecter jusqu’à 1 patient sur 10) :
Une irritation oculaire (sensation de brûlure, grain de sable, démangeaison, picotement ou sensation de corps étranger) et douleur oculaire.
Peu fréquent (peut affecter jusqu’à 1 patient sur 100) :
· Maux de tête.
· Une rougeur au niveau de l’œil, une infection de l’œil (conjonctivite), une vision trouble, des yeux larmoyants, inflammation de la paupière, une irritation ou une érosion de la surface oculaire.
· Une éruption cutanée ou des démangeaisons (prurit).
· Des nausées, des vomissements.
Autres effets indésirables :
Comme d'autres médicaments appliqués dans les yeux, FIXAPOST (latanoprost et timolol) est absorbé dans le sang. L'incidence des effets indésirables après utilisation du collyre est inférieure à celle observée après une administration de médicaments par voie orale ou par voie injectable.
Bien que n’ayant pas été observés avec FIXAPOST, les effets indésirables suivants ont été observés lors de l’utilisation séparée des deux principes actifs de FIXAPOST (latanoprost et timolol) et pourraient être rapportés lors de l’utilisation de FIXAPOST. Les effets indésirables répertoriés incluent des réactions observées au sein de la classe des bêta-bloquants (par ex., timolol) lorsqu’ils sont utilisés dans le traitement des maladies oculaires :
· Développement d’une infection virale de l’œil due au virus herpès simplex (VHS).
· Réactions allergiques généralisées, y compris gonflement sous la peau pouvant se manifester dans des parties du corps comme le visage ou les membres et pouvant obstruer les voies respiratoires et ainsi provoquer des difficultés à avaler ou à respirer, urticaire ou éruption avec démangeaisons, éruption cutanée localisée ou généralisée, démangeaisons, brusque réaction allergique grave pouvant engager le pronostic vital.
· Taux bas de glucose dans le sang.
· Vertiges.
· Difficulté à dormir (insomnie), dépression, cauchemars, perte de mémoire, hallucination.
· Évanouissement, accident vasculaire cérébral, baisse de l'apport de sang au cerveau, aggravation des signes et symptômes de myasthénie grave (affection musculaire), sensations anormales comme fourmillements, et maux de tête.
· Gonflement au fond de l’œil (œdème maculaire), kyste dans la partie colorée de l’œil (kyste irien), sensibilité à la lumière (photophobie), des yeux d’apparence creuse (creusement du sillon de la paupière).
· Signes et symptômes d'irritation de l'œil (par ex., sensations de brûlure, picotements, démangeaisons, larmoiement, rougeur), inflammation de la paupière, inflammation de la cornée, vision floue et décollement de la couche qui contient les vaisseaux sanguins située sous la rétine, suite à une chirurgie filtrante qui peut entraîner des anomalies de la vision, diminution de la sensibilité de la cornée, sécheresse des yeux, érosion de la cornée (lésion de la couche superficielle du globe oculaire), abaissement de la paupière supérieure (à cause duquel l'œil reste à moitié fermé), vision double.
· Coloration plus foncée de la peau autour des yeux, modifications des cils et du duvet au niveau de la paupière (plus foncés, plus épais, plus longs et en nombre plus important), croissance des cils mal orientée, gonflement péri-orbitaire, inflammation de la partie colorée de l’œil (iritis/uvéite), lésions cicatricielles de la surface de l’œil.
· Sifflements ou bourdonnements d’oreille (tinnitus).
· Angine de poitrine, aggravation de l’angine de poitrine chez les patients ayant déjà une maladie cardiaque.
· Rythme cardiaque ralenti, douleur dans la poitrine, palpitations (perception du rythme cardiaque), œdème (accumulation de liquide), changements du rythme et de la vitesse des battements cardiaques, insuffisance cardiaque congestive (maladie cardiaque avec essoufflement et gonflement des pieds et des jambes en raison d’une accumulation de liquide), un type de trouble du rythme cardiaque, crise cardiaque, insuffisance cardiaque.
· Tension artérielle basse, mauvaise circulation sanguine qui entraîne un engourdissement et une pâleur des doigts et des orteils, mains et pieds froids.
· Essoufflement, rétrécissement des voies respiratoires dans les poumons (surtout chez les patients souffrant d'une maladie préexistante), difficultés à respirer, toux, asthme, aggravation de l'asthme.
· Modification du goût, nausées, indigestion, diarrhée, sécheresse de la bouche, douleur abdominale, vomissements.
· Chute des cheveux, éruption cutanée ayant une apparence de couleur blanche argentée (éruption psoriasiforme) ou aggravation d’un psoriasis, éruption cutanée.
· Douleurs articulaires, douleurs musculaires non causées par l’exercice physique, faiblesse/fatigue musculaire.
· Trouble sexuel, libido diminuée.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.

Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte, le sachet et le récipient unidose. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
Après la première ouverture du sachet : utiliser les récipients unidoses dans un délai d’un mois.
Ecrivez la date de la première ouverture sur le sachet.
Après la première ouverture du récipient unidose : utiliser immédiatement et jeter le récipient unidose après utilisation.
Les récipients unidoses non utilisés doivent être conservés dans le sachet afin de les protéger de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.

Ce que contient FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose 
· Les substances actives sont :
Le latanoprost (50 microgrammes/ml) et le timolol (5,00 mg/ml) sous forme de maléate de timolol.
· Les autres composants sont :
Hydroxystéarate. de macrogolglycérol, sorbitol, macrogol, carbomère, édétate disodique, hydroxyde de sodium (pour ajustement du pH) et eau pour préparations injectables
Qu’est-ce que FIXAPOST 50 microgrammes/mL + 5 mg/mL, collyre en solution en récipient unidose et contenu de l’emballage extérieur 
Ce médicament se présente sous forme de collyre en solution en récipient unidose. C’est une solution légèrement jaune et opalescente sans conservateur, pratiquement exempte de particules, conditionnée en récipient unidose par sachet de 5, chaque récipient unidose contient 0,2 ml de collyre.
Une boîte contient 30 (6x5) ou 90 (18x5) récipients unidoses.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché 
12 RUE LOUIS BLERIOT
63017 CLERMONT-FERRAND CEDEX 2
Exploitant de l’autorisation de mise sur le marché 
37 RUE GEORGES BESSE
63100 CLERMONT-FERRAND
27, RUE DE LA LOMBARDIERE
07100 ANNONAY
OU
LABORATOIRES THEA
12 RUE LOUIS BLERIOT
63017 CLERMONT-FERRAND CEDEX 2
Noms du médicament dans les Etats membres de l'Espace Economique Européen 
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est : 
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |