Dernière mise à jour le 02/02/2026
MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose
Indications thérapeutiques
Classe pharmacothérapeutique : MEDICAMENTS OPHTALMOLOGIQUES, AUTRES ANTI-INFECTIEUX - code ATC : S01AX11.
Ce médicament est un collyre en solution contenant un antibiotique de la famille des quinolones, du groupe des fluoroquinolones : l'ofloxacine.
Ce médicament est indiqué dans le traitement local de certaines infections sévères de l'œil dues à des bactéries pouvant être combattues par cet antibiotique : conjonctivites sévères, kératites (inflammation de la cornée d'origine bactérienne), ulcères de la cornée.
Présentations
> 20 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 0,5 ml
Code CIP : 266 191-2 ou 34009 266 191 2 1
Déclaration de commercialisation : 24/01/2013
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 3,07 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 4,09 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Choix et durée de l'antibiothérapie : Pyélonéphrite aiguë de la femme
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Juillet 2024
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 17/10/2012 | Inscription (CT) | Le service médical rendu par MONOOX 1,5 mg/0,5 ml, collyre, est important dans les indications de l'AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 17/10/2012 | Inscription (CT) | Absence d'amélioration du service médical rendu (ASMR inexistante, V) par rapport aux autres spécialités à base de d'ofloxacine déjà inscrites. |
ANSM - Mis à jour le : 06/05/2025
MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Ofloxacine............................................................................................................................ 1,5 mg
Pour un récipient unidose de 0,5 ml.
Pour la liste complète des excipients, voir rubrique 6.1.
Collyre en solution en récipient unidose.
4.1. Indications thérapeutiques
Il convient de tenir compte des recommandations officielles concernant l'utilisation appropriée des antibactériens.
4.2. Posologie et mode d'administration
La posologie usuelle est de 2 gouttes 4 fois par jour dans l'œil ou les yeux atteints.
Un traitement de plus de 15 jours doit nécessiter un nouvel avis ophtalmologique.
Mode d’administration
Voie ophtalmique.
EN INSTILLATION OCULAIRE.
Il doit être recommandé au patient de se laver les mains soigneusement avant et après l'instillation, et lors de l’instillation ne pas toucher l'oeil, les paupières ou d'autres surfaces avec l'extrémité de l'unidose.
Le passage systémique peut être réduit par une occlusion nasolacrymale ou par la fermeture des paupières pendant 2 minutes. Cette méthode peut contribuer à diminuer les effets indésirables systémiques et à augmenter l’efficacité locale.
L'efficacité d'un collyre peut être perturbée par l'instillation simultanée d'un autre collyre. En cas de traitement concomitant par un deuxième collyre, il convient d'attendre 15 minutes avant son instillation. Les pommades ophtalmiques doivent être administrées en dernier.
Ce médicament NE DOIT JAMAIS ETRE UTILISE en cas de :
· hypersensibilité à l'ofloxacine ou à un autre médicament de la famille des quinolones,
· hypersensibilité à l'un des excipients de ce collyre,
· allaitement (voir rubrique 4.6).
4.4. Mises en garde spéciales et précautions d'emploi
Le collyre ne doit pas être injecté, ni avalé.
Le collyre ne doit pas être utilisé en injection péri- ou intra-oculaire.
Les données sont insuffisantes pour établir l'efficacité et la sécurité d'emploi de collyre à base d'ofloxacine à 0,3 % dans le traitement des conjonctivites chez le nouveau-né.
En l'absence d'évaluation, l'utilisation de collyre à base d'ofloxacine est déconseillée chez les nouveau-nés ayant une conjonctivite néonatale due à Neisseria gonorrhoeae ou due à Chlamydia trachomatis. Ceux-ci doivent recevoir un traitement approprié, comme un traitement systémique des infections dues à Neisseria gonorrhoeae ou à Chlamydia trachomatis.
L'utilisation de ce collyre doit tenir compte d'un risque de passage rhinopharyngé pouvant contribuer à l'émergence et à la diffusion de la résistance bactérienne. Comme toutes les présentations pharmaceutiques d'antibiotique, une utilisation prolongée peut favoriser une émergence de bactéries résistantes.
Hypersensibilité
Des réactions d'hypersensibilité graves et parfois fatales (choc anaphylactique), dont certaines survenant après l'administration de la première dose, ont été observées chez des patients traités par quinolones administrées par voie générale. Certaines réactions étaient accompagnées de collapsus cardio-vasculaire, perte de connaissance, fourmillements, œdème pharyngé ou facial, dyspnée, urticaire et démangeaisons. Peu de patients seulement avaient des antécédents connus de réactions d'hypersensibilité.
Aussi, le traitement par ce médicament doit être interrompu dès les premiers signes d'éruption cutanée ou de toute autre réaction d'hypersensibilité.
Affections oculaires
Des publications non-cliniques et cliniques ont rapporté l'apparition de perforation cornéenne chez des patients atteints d'ulcère ou d'abcès cornéen après traitement antibiotique local à base de fluoroquinolone. Cependant, des facteurs confondants significatifs ont été mis en évidence dans la plupart de ces cas tels que l'âge avancé, la présence de multiples ulcères, des affections oculaires associées (ex. syndrome de l'œil sec), des maladies systémiques inflammatoires (ex. arthrite rhumatoïde), et l'utilisation concomitante de stéroïdes par voie ophtalmique ou d'anti-inflammatoires non-stéroïdiens. Par conséquent, il est nécessaire de recommander la prudence par rapport au risque de perforation cornéenne lors du traitement par fluoroquinolone des patients atteints d'ulcère ou d'abcès cornéen.
Allongement de l’intervalle QT
L’utilisation des fluoroquinolones, dont MONOOX, doit être faite avec prudence chez les patients présentant des facteurs de risque connus pour allonger l’intervalle QT, tels que :
· un syndrome du QT long congénital,
· un traitement concomitant avec des médicaments connus pour allonger l’intervalle QT (ex. : les antiarythmiques de classe IA et III, les antidépresseurs tricycliques, les macrolides, les antipsychotiques),
· un déséquilibre électrolytique non-corrigé (ex. : hypokaliémie, hypomagnésémie),
· une maladie cardiaque (ex. : insuffisance cardiaque, infarctus du myocarde, bradycardie).
Les patients âgés et les femmes peuvent être plus sensibles aux médicaments prolongeant l'intervalle QT. De ce fait, l'utilisation des fluoroquinolones dont MONOOX, doit se faire avec prudence dans ces populations (voir rubriques 4.5, 4.8 et 4.9).
Tendinites et ruptures des tendons
Une inflammation et une rupture d’un tendon peuvent survenir avec un traitement systémique par une fluoroquinolone, incluant l’ofloxacine, en particulier chez les patients âgés et chez ceux traités de façon concomitante par des corticostéroïdes. Par conséquent, la prudence est de rigueur et le traitement par MONOOX doit être interrompu dès les premiers signes d’inflammation du tendon (voir rubrique 4.8).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Médicaments connus pour allonger l’intervalle QT
MONOOX comme les autres médicaments de la famille des fluoroquinolones, doit être utilisé avec prudence chez les patients recevant des médicaments connus pour allonger l’intervalle QT (tels que les antiarythmiques de classe IA et III, les antidépresseurs tricycliques, les macrolides et les antipsychotiques) (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement
Grossesse
Bien que les études effectuées chez l'animal n'aient pas mis en évidence d'effet tératogène, les données cliniques sur l'utilisation de l'ofloxacine par voie systémique sont encore insuffisantes.
Des atteintes articulaires ont été décrites chez des enfants traités par des quinolones, mais à ce jour, aucun cas d'arthropathie secondaire à une exposition in utero n'est rapporté.
En conséquence, l'utilisation de ce médicament ne doit être envisagée au cours de la grossesse que si nécessaire.
L'administration de ce médicament fait contre-indiquer l'allaitement, en raison du passage des fluoroquinolones dans le lait maternel et du risque articulaire pour le nouveau-né allaité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Des réactions graves après utilisation d’ofloxacine par voie systémique sont rares et la plupart des symptômes sont réversibles. Comme une faible quantité d’ofloxacine est absorbée par voie systémique après administration locale, les effets indésirables rapportés après utilisation systémique peuvent éventuellement apparaître.
Les effets indésirables rapportés après utilisation d’ofloxacine à partir des cas provenant d’essai clinique ou après commercialisation sont classés par classes de systèmes d’organes et listés ci-dessous comme : Très fréquent (≥1/10) ; Fréquent (≥1/100, <1/10) ; Peu fréquent (≥1/1 000, <1/100) ; Rare (≥1/10 000, <1/1 000) ; Très rare (<1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
Affection du système immunitaire
Fréquence indéterminée : réaction d’hypersensibilité
Affections oculaires
Fréquence indéterminée : Sensation de brûlure ou de picotement local.
Fréquence indéterminée : Œdème périorbitaire (incluant œdème palpébral)
Affections cardiaques
Fréquence indéterminée : Arythmie ventriculaire, Torsades de pointes (rapportés plus particulièrement chez des patients présentant des facteurs de risque d’allongement de l’intervalle QT), Allongement de l’intervalle QT confirmé par l’ECG (voir rubriques 4.4 et 4.9).
Affection de la peau et du tissus sous – cutané
Fréquence indéterminée : Syndrome de Stevens-Johnson, nécrolyse épidermique toxique
Affections musculosquelettiques et du tissu conjonctif
Fréquence indéterminée : Troubles tendineux
Des cas de ruptures des tendons de l’épaule, de la main, du tendon d’Achille ou d’autres tendons nécessitant une réparation chirurgicale ou entraînant une invalidité prolongée ont été rapportés chez des patients recevant un traitement systémique par fluoroquinolones. Les études et l’expérience post commercialisation avec les quinolones administrées par voie systémique indiquent que le risque de présenter ces ruptures peut être augmenté chez les patients recevant des corticostéroïdes, en particulier chez les patients âgés et pour les tendons soumis à de fortes tensions, dont le tendon d’Achille (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En cas d'administration locale excessive, laver abondamment avec du sérum physiologique stérile.
En cas de surdosage, un traitement symptomatique doit être mis en place. Une surveillance par ECG doit être effectuée en raison de la possibilité d’allongement de l’intervalle QT.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
L'ofloxacine est un antibiotique de synthèse appartenant à la famille des quinolones, du groupe des fluoroquinolones. Son activité est fortement bactéricide par inhibition de l'ADN-gyrase bactérienne empêchant la synthèse de l'ADN chromosomique bactérien.
SPECTRE D'ACTIVITE ANTI-BACTERIENNE
Les concentrations critiques séparent les souches sensibles des souches de sensibilité intermédiaire, et ces dernières, des résistantes :
S ≤ 1 mg/l et R > 4 mg/l
La prévalence de la résistance acquise peut varier en fonction de la géographie et du temps pour certaines espèces. Il est donc utile de disposer d’informations sur la prévalence de la résistance locale, surtout pour le traitement d’infections sévères. Ces données ne peuvent apporter qu’une orientation sur les probabilités de la sensibilité d’une souche bactérienne à cet antibiotique.
Lorsque la variabilité de la prévalence de la résistance en France est connue pour une espèce bactérienne, elle est indiquée dans le tableau ci-dessous :
|
Catégories |
Fréquence de résistance acquise en France (> 10%) (valeurs extrêmes) |
|
ESPÈCES SENSIBLES |
|
|
Aérobies à Gram positif |
|
|
Bacillus anthracis* |
|
|
Staphylococcus méti-S |
|
|
Aérobies à Gram négatif |
|
|
Acinetobacter (essentiellement Acinetobacter baumannii) |
50 - 75 % |
|
Branhamella catarrhalis |
|
|
Bordetella pertussis |
|
|
Campylobacter |
|
|
Citrobacter freundii |
15 - 25 % |
|
Enterobacter cloacae |
15 - 25 % |
|
Escherichia coli |
0 - 10 % |
|
Haemophilus influenzae |
|
|
Klebsiella oxytoca |
0 - 11 % |
|
Klebsiella pneumoniae |
0 - 25 % |
|
Legionella |
|
|
Morganella morganii |
|
|
Neisseria |
|
|
Pasteurella |
|
|
Proteus mirabilis |
0 - 10 % |
|
Proteus vulgaris |
|
|
Providencia |
45 - 70 % |
|
Pseudomonas aeruginosa |
45 - 85 % |
|
Salmonella |
|
|
Serratia |
40 - 45 % |
|
Shigella |
|
|
Vibrio |
|
|
Yersinia |
|
|
Anaérobies |
|
|
Mobiluncus |
|
|
Propionibacterium acnes |
|
|
Autres |
|
|
Mycoplasma hominis |
|
|
ESPÈCES MODÉRÉMENT SENSIBLES (in vitro de sensibilité intermédiaire) |
|
|
Aérobies à Gram positif |
|
|
Corynébactéries |
|
|
Streptococcus |
|
|
Streptococcus pneumoniae |
|
|
Autres |
|
|
Chlamydiae |
|
|
Mycoplasma pneumoniae |
|
|
Ureaplasma urealyticum |
|
|
ESPÈCES RÉSISTANTES |
|
|
Aérobies à Gram positif |
|
|
Entérocoques |
|
|
Listeria monocytogenes |
|
|
Nocardia asteroïdes |
|
|
Staphylococcus méti-R** |
|
|
Anaérobies |
|
|
À l'exception de Mobiluncus et Propionibacterium acnes |
|
* La fréquence de résistance à la méticilline est environ de 30 à 50 % de l’ensemble des staphylocoques et se rencontre surtout en milieu hospitalier.
** Bacillus anthracis : aucune étude animale d’infection expérimentale dans la maladie du charbon n’a été réalisée.
Mycobactéries atypiques : l’ofloxacine a in vitro une activité modérée sur certaines espèces de mycobactéries : Mycobacterium tuberculosis, Mycobacterium fortuitum, moindre sur Mycobacterium kansasii et encore moindre sur Mycobacterium avium.
Remarque : ce spectre correspond à celui des formes systémiques de l'ofloxacine. Avec les présentations pharmaceutiques locales, les concentrations obtenues in situ sont très supérieures aux concentrations plasmatiques. Quelques incertitudes demeurent sur la cinétique des concentrations in situ, sur les conditions physico-chimiques locales qui peuvent modifier l'activité de l'antibiotique et sur la stabilité du produit in situ.
5.2. Propriétés pharmacocinétiques
Les études effectuées chez l'homme ont confirmé la cinétique favorable de l'ofloxacine dans l'humeur aqueuse et dans les larmes.
5.3. Données de sécurité préclinique
3 ans.
6.4. Précautions particulières de conservation
A conserver dans l’emballage d’origine à l’abri de la lumière.
Stabilité après ouverture : après usage, le récipient unidose doit être jeté.
Ne pas utiliser un récipient unidose déjà entamé.
6.5. Nature et contenu de l'emballage extérieur
0,5 ml en récipient unidose en polyéthylène basse densité (PEBD).
Barrette de 5 récipients unidoses conditionnée dans un sachet (polyester/PEBD/Aluminium/Copolymer/PEBD/PEBD ou papier/PE/aluminium/ionomer).
Boîtes de 20, 30, 60 ou 100 récipients unidoses.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
22 ALLEE CAMILLE MUFFAT
INEDI 5
06200 NICE
[Tel, fax, e-Mail : à compléter ultérieurement par le titulaire]
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 266 191 2 1 : 0,5 ml en récipient unidose. Boîte de 20.
· 34009 266 192 9 9 : 0,5 ml en récipient unidose. Boîte de 30.
· 34009 583 312 4 4 : 0,5 ml en récipient unidose. Boîte de 60.
· 34009 583 313 0 5 : 0,5 ml en récipient unidose. Boîte de 100.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 06/05/2025
MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose
Ofloxacine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose ?
3. Comment utiliser MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : MEDICAMENTS OPHTALMOLOGIQUES, AUTRES ANTI-INFECTIEUX - code ATC : S01AX11.
Ce médicament est un collyre en solution contenant un antibiotique de la famille des quinolones, du groupe des fluoroquinolones : l'ofloxacine.
Ce médicament est indiqué dans le traitement local de certaines infections sévères de l'œil dues à des bactéries pouvant être combattues par cet antibiotique : conjonctivites sévères, kératites (inflammation de la cornée d'origine bactérienne), ulcères de la cornée.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose ?
· allergie à l'ofloxacine ou à un autre médicament de la famille des quinolones,
· allergie à l'un des composants de ce collyre,
· si vous allaitez (voir rubrique « Grossesse et allaitement »).
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Faites attention avec MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose :
Le collyre ne doit pas être injecté, ni avalé.
Les données sont insuffisantes pour recommander l'utilisation de ce collyre dans le traitement des conjonctivites chez le nouveau-né.
Lors de l'instillation, ne pas toucher l'œil, les paupières ou d'autres surfaces avec l'extrémité du récipient unidose.
Le traitement par ce médicament doit être interrompu dès les premiers signes d'éruption cutanée ou de toute autre réaction d'hypersensibilité.
Il faut être prudent lors de l’utilisation de ce type de médicament si :
· vous êtes né(e) ou avez des antécédents familiaux d’allongement de l’intervalle QT (mesuré à l’ECG, enregistrement de l’activité électrique du cœur),
· vous présentez un déséquilibre des sels minéraux du sang (en particulier des concentrations faibles en potassium ou magnésium dans le sang),
· vous avez un rythme cardiaque lent (appelé bradycardie),
· vous avez un cœur faible (insuffisance cardiaque),
· vous avez des antécédents de crises cardiaques (infarctus du myocarde),
· vous êtes une femme ou une personne âgée,
· vous prenez également d’autres médicaments qui provoquent des modifications anormales de l’ECG (voir rubrique « Autres médicaments et MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose»).
Des cas de gonflement et de rupture des tendons sont survenus chez des personnes prenant des fluoroquinolones par voie orale ou intraveineuse, en particulier chez les patients âgés et chez ceux traités en même temps par des corticostéroïdes. Arrêtez de prendre MONOOX si vous développez une douleur ou un gonflement au niveau des tendons (tendinite).
Précautions d'emploi
Ne pas prolonger le traitement au-delà de la date prévue sur l'ordonnance.
En l'absence d'amélioration rapide ou en cas d'apparition de symptômes anormaux, consulter votre médecin.
Ce médicament ne contient pas de conservateur. Aussi tout récipient unidose doit être jeté après utilisation, et ne doit pas être conservé pour une utilisation ultérieure.
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN
Enfants
Sans objet.
Autres médicaments et MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose
Vous devez informer votre médecin si vous prenez, avez récemment pris ou pourriez prendre des médicaments qui peuvent modifier votre rythme cardiaque comme les médicaments appartenant au groupe des anti-arythmiques (ex : la quinidine, l’hydroquinidine, le disopyramide, l’amiodarone, le sotalol, le dofetilide, l’ibutilide), les antidépresseurs tricycliques, certains antibiotiques (appartenant au groupe des macrolides), certains antipsychotiques.
AFIN D'EVITER D'EVENTUELLES INTERACTIONS ENTRE PLUSIEURS MEDICAMENTS, même s'il s'agit d'un médicament obtenu sans ordonnance, IL FAUT SIGNALER SYSTEMATIQUEMENT TOUT AUTRE TRAITEMENT EN COURS A VOTRE MEDECIN OU A VOTRE PHARMACIEN.
MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
Ce médicament ne sera utilisé pendant la grossesse que sur les conseils de votre médecin.
Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin car lui seul peut juger de la nécessité de le poursuivre.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Allaitement
L'administration de ce médicament fait contre-indiquer l'allaitement, en raison du passage du produit dans le lait maternel.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
La vision peut être brouillée de façon passagère après l'administration du produit dans l'œil. Attendez d'avoir retrouvé une vision normale avant de conduire un véhicule ou d'utiliser des machines.
MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose contient
Sans objet.
3. COMMENT UTILISER MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose ?
Posologie
Ce médicament vous a été personnellement prescrit dans une situation précise :
· il ne peut être adapté à un autre cas ;
· ne pas le réutiliser sans avis médical ;
· ne pas le conseiller à une autre personne.
A titre indicatif, la posologie usuelle est la suivante :
2 gouttes 4 fois par jour dans l'œil ou les yeux atteints.
DANS TOUS LES CAS SE CONFORMER STRICTEMENT A L'ORDONNANCE DE VOTRE MEDECIN.
Mode et voie d'administration
1. Lavez-vous soigneusement les mains.
2. Ouvrez le sachet et prenez la barrette d’unidoses.
3. Détachez une unidose de la bande (Figure 1).
4. Remettez les autres unidoses dans l’emballage et refermez le sachet en repliant le bord.
Conservez le sachet dans la boîte en carton.
5. Pour ouvrir l’unidose, faites tourner sa pointe. Veillez à ne pas toucher l’extrémité de l’unidose après l’ouverture (Figure 2).
6. Penchez la tête en arrière (Figure 3).
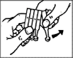
7. Tirez la paupière inférieure vers le bas, avec le doigt, et prenez l’unidose dans l’autre main.
Appuyez doucement sur l’unidose et faites tomber une goutte dans l’œil (Figure 4).
8. Fermez les yeux et appuyez pendant 1 à 2 minutes sur l’angle interne de l’œil, avec la pointe du doigt, afin d’empêcher la goutte de passer dans la gorge par le canal lacrymal. Ainsi, la majeure partie de la goutte reste bien dans l’œil (Figure 5). Le cas échéant, répétez les étapes 6 à 8 pour l’autre œil.
9. Jetez l’unidose après l’emploi.
|
|
|
|
|
|
|
Fig. 1 |
Fig. 2 |
Fig. 3 |
Fig. 4 |
Fig. 5 |
Si vous utilisez un autre collyre ou une pommade ophtalmique, attendez au moins 15 minutes entre chaque médicament. Les pommades ophtalmiques doivent être administrées en dernier.
Fréquence et moment auxquels le médicament doit être administré
Habituellement 4 fois par jour.
Se conformer à la prescription de votre médecin.
Durée du traitement
Un traitement de plus de 15 jours doit nécessiter un nouvel avis ophtalmologique.
Pour être efficace, ce médicament doit être utilisé régulièrement aux doses prescrites, et aussi longtemps que votre médecin vous l'aura conseillé.
La disparition des symptômes ne signifie pas que vous êtes complètement guéri. L'éventuelle impression de fatigue, n'est pas due au traitement mais à l'infection elle-même. Le fait de réduire ou de suspendre votre traitement serait sans effet sur cette impression et retarderait votre guérison.
DANS TOUS LES CAS SE CONFORMER STRICTEMENT A L'ORDONNANCE DE VOTRE MEDECIN.
Si vous avez utilisé plus de MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose que vous n’auriez dû
En cas d'administration locale excessive, lavez abondamment l'œil avec du sérum physiologique.
Consultez immédiatement votre médecin ou votre pharmacien.
Une surveillance et un traitement symptomatique peuvent vous être proposés.
Si vous oubliez d’utiliser MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose
N'utilisez pas de dose double pour compenser la dose que vous avez oublié d'utiliser.
Si vous arrêtez d’utiliser MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables graves :
Arrêtez d’utiliser MONOOX immédiatement et contacter votre médecin.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Réactions allergiques
· Des éruptions cutanées pouvant mettre en jeu le pronostic vital (syndrome de Stevens-Johnson, nécrolyse épidermique toxique) ont été rapportées lors de l'utilisation de MONOOX apparaissant initialement sur le tronc sous la forme de taches rougeâtres ayant l'aspect de cibles ou de plaques de forme ronde avec une cloque en leur centre.
Les effets indésirables suivants peuvent également se produire :
Vous devez voir un médecin s’ils deviennent gênants ou durent longtemps.
Fréquence indéterminée: (ne peut être estimée sur la base des données disponibles)
Effets indésirables affectant les yeux :
· Sensation de brûlure ou de picotement local.
· Gonflement autour des yeux (dont gonflement des paupières).
Effets indésirables affectant le cœur :
· Rythme cardiaque anormalement rapide,
· Rythme cardiaque irrégulier engageant le pronostic vital,
· Altération du rythme cardiaque (appelé « prolongement de l’intervalle QT » et visible à l’électrocardiogramme (ECG), appareil qui permet l’enregistrement de l’activité électrique du cœur).
Effets indésirables affectant les muscles et le squelette :
· Trouble tendineux
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et sur le récipient unidose après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver dans l’emballage d’origine à l’abri de la lumière.
Stabilité après ouverture : après usage, le récipient unidose doit être jeté.
Ne pas utiliser un récipient unidose déjà entamé.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient MONOOX 1,5 mg/0,5 ml, collyre en solution en récipient unidose
· La substance active est :
Ofloxacine...................................................................................................................... 1,5 mg
Pour un récipient unidose de 0,5 ml.
· Les autres composants sont :
Chlorure de sodium, acide chlorhydrique (pour ajustement du pH), hydroxyde de sodium (pour ajustement du pH), eau pour préparations injectables.
Ce médicament se présente sous forme de collyre en solution en récipient unidose.
Boîte de 20, 30, 60 ou 100.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
22 ALLEE CAMILLE MUFFAT
INEDI 5
06200 NICE
Exploitant de l’autorisation de mise sur le marché
22 ALLEE CAMILLE MUFFAT
INEDI 5
06200 NICE
WERKSSTRASSE 3
92551 STULLN
ALLEMAGNE
LABORATOIRE UNITHER
ESPACE INDUSTRIEL NORD
151 RUE ANDRE DUROUCHEZ
CS 28028 AMIENS, 80084
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseil d’éducation sanitaire :
QUE SAVOIR SUR LES ANTIBIOTIQUES ?
Les antibiotiques sont efficaces pour combattre les infections dues aux bactéries. Ils ne sont pas efficaces contre les infections dues aux virus.
Aussi, votre médecin a choisi de vous prescrire cet antibiotique parce qu’il convient précisément à votre cas et à votre maladie actuelle.
Les bactéries ont la capacité de survivre ou de se reproduire malgré l’action d’un antibiotique. Ce phénomène est appelé résistance : il rend certains traitements antibiotiques inactifs.
La résistance s’accroît par l’usage abusif ou inapproprié des antibiotiques.
Vous risquez de favoriser l’apparition de bactéries résistantes et donc de retarder votre guérison ou même de rendre inactif ce médicament, si vous ne respectez pas :
· la dose à prendre,
· les moments de prise,
· et la durée de traitement.
En conséquence, pour préserver l’efficacité de ce médicament :
1 - N’utilisez un antibiotique que lorsque votre médecin vous l’a prescrit.
2 - Respectez strictement votre ordonnance.
3 - Ne réutilisez pas un antibiotique sans prescription médicale même si vous pensez combattre une maladie apparemment semblable.
4 - Ne donnez jamais votre antibiotique à une autre personne, il n’est peut-être pas adapté à sa maladie.
5 - Une fois votre traitement terminé, rapportez à votre pharmacien toutes les boîtes entamées pour une destruction correcte et appropriée de ce médicament.