Dernière mise à jour le 02/02/2026
VAXIGRIP suspension injectable en seringue préremplie. Vaccin grippal trivalent (inactivé, à virion fragmenté)
Indications thérapeutiques
Classe pharmacothérapeutique : vaccins contre la grippe - code ATC : J07BB02.
VAXIGRIP est un vaccin.
Ce vaccin, qui vous est administré ou administré à votre enfant à partir de l’âge de 6 mois, vous aide à vous protéger ou à protéger votre enfant de la grippe.
Lorsqu’une personne reçoit le vaccin VAXIGRIP, le système immunitaire (le système de défense naturelle de l’organisme) développe sa propre protection (anticorps) contre la maladie. Lorsqu'il est administré au cours de la grossesse, le vaccin aide à protéger la femme enceinte mais aide aussi à protéger son (ses) enfant(s), à partir de la naissance jusqu’à près de 6 mois d’âge grâce à la transmission de la protection de la mère à l'enfant pendant la grossesse (voir également les rubriques 2 et 3).
Aucun des composants du vaccin ne peut causer la grippe.
VAXIGRIP doit être utilisé selon les recommandations officielles.
La grippe est une maladie qui peut se propager rapidement et qui est causée par différentes souches de virus qui peuvent changer chaque année. En raison du changement potentiel des souches circulant chaque année et de la durée de protection prévue du vaccin, il est recommandé de se faire vacciner tous les ans. Le plus grand risque de contracter la grippe se situe pendant les mois les plus froids, entre octobre et mars. Si vous ou votre enfant n'avez pas été vacciné durant l'automne, il est encore possible de l’être jusqu'au printemps car vous ou votre enfant courrez le risque de contracter la grippe jusqu'à cette période. Votre médecin pourra vous recommander le meilleur moment pour vous faire vacciner.
VAXIGRIP est destiné à vous protéger, ou à protéger votre enfant, contre les trois souches de virus contenues dans le vaccin, environ 2 à 3 semaines après l’injection.
De plus, si vous ou votre enfant êtes exposé à la grippe juste avant ou juste après la vaccination, vous ou votre enfant pouvez encore développer la maladie, la période d’incubation de la grippe étant de quelques jours.
Le vaccin ne vous protègera pas, vous ou votre enfant, des rhumes, même si certains des symptômes ressemblent à ceux de la grippe.
Composition en substances actives
-
Solution ( Composition pour une dose de 0,5 mL )
- > virus de la grippe inactivé, fragmenté, souche A/Victoria/4897/2022 (H1N1)pdm09 - souche analogue (A/Victoria/4897/2022, IVR-238) 15 microgrammes d'hémagglutinine
- > virus de la grippe inactivé, fragmenté, A/Croatia/10136RV/2023 (H3N2)-souche analogue (A/Croatia/10136RV/2023, X-425A) 15 microgrammes d'hémagglutinine
- > virus de la grippe fragmenté, inactivé, souche B/Austria/1359417/2021 - souche analogue (B/Michigan/01/2021, type sauvage) 15 microgrammes d'hémagglutinine
Présentations
> 1 seringue préremplie avec aiguille en verre de 0,5 mL
Code CIP : 34009 303 060 0 0
Déclaration de commercialisation : 05/09/2025
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 11,75 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 12,77 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 12/02/2025 | Inscription (CT) | Le service médical rendu par VAXIGRIP (vaccin grippal trivalent, inactivé, à virion fragmenté) est important dans la prévention de la grippe chez l’adulte et l’enfant à partir de 6 mois, selon les recommandations de la HAS en vigueur datant du 6 février 2025. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 12/02/2025 | Inscription (CT) | La Commission considère que VAXIGRIP (vaccin grippal trivalent, inactivé, à virion fragmenté) n’apporte pas d’amélioration du service médical rendu (ASMR V), chez les adultes et les enfants à partir de 6 mois pour lesquels la vaccination est recommandée, par rapport aux autres vaccins recommandés dans la prévention de la grippe saisonnière. |
ANSM - Mis à jour le : 03/06/2025
VAXIGRIP suspension injectable en seringue préremplie
Vaccin grippal trivalent (inactivé, à virion fragmenté).
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Virus de la grippe (inactivé, fragmenté) des souches suivantes* :
.................................................................................................................... 15 microgrammes HA**
A/Croatia/10136RV/2023 (H3N2)-souche analogue (A/Croatia/10136RV/2023, X-425A).........................
.................................................................................................................... 15 microgrammes HA**
B/Austria/1359417/2021-souche analogue (B/Michigan/01/2021, type sauvage)...................................
.................................................................................................................... 15 microgrammes HA**
Pour une dose de 0,5 mL.
*cultivées sur œufs embryonnés de poules provenant d’élevages sains
**hémagglutinine
Ce vaccin est conforme aux recommandations de l'OMS (dans l'Hémisphère Nord) et à la décision de l’Union Européenne pour la saison 2025/2026.
Pour la liste complète des excipients, voir rubrique 6.1.
VAXIGRIP peut contenir des traces d’œuf, comme l’ovalbumine, des traces de néomycine, de formaldéhyde et d’octoxinol-9, utilisés lors du procédé de fabrication (voir rubrique 4.3).
Le vaccin, après avoir été agité doucement, est un liquide incolore et opalescent.
4.1. Indications thérapeutiques
· l’immunisation active des adultes, incluant les femmes enceintes, et des enfants à partir de l’âge de 6 mois.
· la protection passive des nourrissons âgés de moins de 6 mois et nés de femmes vaccinées pendant leur grossesse (voir rubriques 4.4, 4.6 et 5.1).
VAXIGRIP doit être utilisé sur la base des recommandations officielles sur la vaccination contre la grippe.
4.2. Posologie et mode d'administration
Adultes : une dose de 0,5 mL.
Population pédiatrique
· Enfants âgés de 6 mois à 17 ans : une dose de 0,5 mL.
Chez les enfants âgés de moins de 9 ans n'ayant pas été vaccinés auparavant, une seconde dose de 0,5 mL devra être injectée après un intervalle d'au moins 4 semaines.
· Nourrissons âgés de moins de 6 mois : la sécurité et l'efficacité de l’administration de VAXIGRIP (immunisation active) n'ont pas été établies. Aucune donnée n'est disponible.
Concernant la protection passive : une dose de 0,5 mL administrée à une femme enceinte peut protéger les nourrissons de la naissance à près de 6 mois d’âge (voir rubriques 4.4, 4.6 et 5.1).
Mode d’administration
Ce vaccin est administré de préférence par voie intramusculaire bien qu’il puisse également être administré par voie sous‑cutanée.
L’injection intramusculaire se fait de préférence dans la partie antérolatérale de la cuisse (ou le muscle deltoïde si la masse musculaire est suffisante) chez les enfants âgés de 6 à 35 mois, ou dans le muscle deltoïde chez les enfants à partir de 36 mois et chez les adultes.
Précautions à prendre avant la manipulation ou l’administration du médicament
Pour les instructions de préparation du médicament avant administration, voir rubrique 6.6.
4.4. Mises en garde spéciales et précautions d'emploi
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Comme pour tous les vaccins injectables, il est recommandé de disposer d’un traitement médical approprié et de surveiller le sujet, dans l’éventualité d’une réaction anaphylactique suite à l’administration du vaccin.
La vaccination doit être différée chez les patients atteints de maladie fébrile aiguë jusqu’à ce que la fièvre disparaisse.
VAXIGRIP ne doit en aucun cas être administré par voie intravasculaire.
Thrombocytopénie et troubles de la coagulation :
Comme avec tous les autres vaccins administrés par voie intramusculaire, le vaccin doit être administré avec précaution chez les sujets présentant une thrombocytopénie ou des troubles de la coagulation, car des saignements peuvent survenir suite à une administration intramusculaire chez ces sujets.
Syncope :
Une syncope (évanouissement), en réaction psychogène à l’injection avec une aiguille, peut survenir après, voire avant, toute vaccination. Des mesures doivent être mises en place pour prévenir toute blessure due à l’évanouissement et prendre en charge les réactions syncopales.
VAXIGRIP vise à conférer une protection contre les souches de virus grippal à partir desquelles le vaccin a été préparé.
Comme pour tout vaccin, la vaccination avec VAXIGRIP peut ne pas protéger toutes les personnes vaccinées.
Concernant la protection passive, les nourrissons âgés de moins de 6 mois nés de femmes vaccinées au cours de leur grossesse peuvent ne pas être tous protégés (voir rubrique 5.1).
La réponse en anticorps chez les patients présentant une immunodépression congénitale ou acquise peut être insuffisante.
Teneur en potassium et sodium :
Ce médicament contient moins de 1 mmol (39 mg) de potassium et moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans potassium » et « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
VAXIGRIP pourrait être administré en même temps que d’autres vaccins si nécessaire. Des données montrant que VAXIGRIP peut être administré en même temps que d’autres vaccins sont disponibles pour les vaccins suivants : un vaccin polysaccharidique contre le pneumocoque, un vaccin diphtérique, tétanique, coquelucheux et poliomyélitique (dTcaP, Repevax) et un vaccin contre le zona. Si VAXIGRIP est administré en même temps qu’un autre vaccin, des sites d’injection distincts et des seringues différentes doivent être utilisés.
La réponse immunitaire peut être réduite si le patient est sous traitement immunosuppresseur.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les femmes enceintes présentent un risque élevé de complications dues à la grippe, dont un travail et un accouchement prématurés, une hospitalisation et un décès : les femmes enceintes devraient recevoir un vaccin grippal.
VAXIGRIP peut être utilisé à tous les stades de la grossesse.
Les données de sécurité disponibles pour les vaccins grippaux inactivés sont plus importantes pour les deuxième et troisième trimestres que pour le premier trimestre de grossesse. Les données mondiales d’utilisation des vaccins grippaux inactivés, incluant VAXIGRIP et VAXIGRIPTETRA (vaccin grippal quadrivalent inativé), n’indiquent pas d’issues anormales pour le fœtus et pour la mère, attribuables au vaccin.
Ceci est cohérent avec les résultats observés dans une étude clinique dans laquelle VAXIGRIP et VAXIGRIPTETRA ont été administrés chez des femmes enceintes au cours du deuxième ou du troisième trimestre (116 grossesses exposées et 119 naissances vivantes pour Vaxigrip et 230 grossesses exposées et 231 naissances vivantes pour VAXIGRIPTETRA).
Les données de quatre études cliniques menées avec VAXIGRIP administré chez des femmes enceintes au cours du deuxième ou du troisième trimestre (plus de 5000 grossesses exposées et plus de 5000 naissances vivantes suivies jusqu’à environ 6 mois après l’accouchement) n'indiquent pas d’issues anormales pour le fœtus, le nouveau-né, le nourrisson et la mère, attribuables au vaccin.
Au cours des études cliniques menées en Afrique du Sud et au Népal, il n'y avait pas de différence significative entre les groupes VAXIGRIP et placebo concernant les évènements pouvant affecter le fœtus, le nouveau-né, le nourrisson et la mère (dont les fausses couches, les mort-nés, les naissances prématurées et le faible poids à la naissance).
Au cours d’une étude clinique menée au Mali, il n'y avait pas de différence significative entre les groupes VAXIGRIP et contrôle (vaccin conjugué quadrivalent contre le méningocoque) concernant le taux de naissances prématurées, le taux d’enfants mort-nés, et le taux d’enfants de faible poids à la naissance / petit poids pour l’âge gestationnel.
Pour plus d'informations, voir les rubriques 4.8 et 5.1.
Allaitement
VAXIGRIP peut être administré en cas d’allaitement.
Fertilité
Aucune donnée sur la fertilité n’est disponible chez l’homme. Une étude effectuée chez l’animal avec VAXIGRIPTETRA n’a pas mis en évidence d’effets délétères sur la fertilité des femelles.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de tolérance
Le profil de tolérance de VAXIGRIP est basé sur des données de 46 études cliniques au cours desquelles environ 17 900 participants âgés de 6 mois ou plus ont reçu VAXIGRIP ou VAXIGRIPTETRA, et des données provenant de la surveillance après commercialisation.
La plupart des effets indésirables sont en général survenus dans les 3 jours suivant la vaccination et se sont spontanément résolus dans les 1 à 3 jours suivant leur apparition. L’intensité de la plupart de ces effets était légère à modérée.
Pour toutes les populations, y compris la totalité du groupe des enfants âgés de 6 à 35 mois, l’effet indésirable le plus fréquemment rapporté après la vaccination était la douleur au site d’injection.
Liste tabulée des effets indésirables
Les événements indésirables sont classés en fonction de leur fréquence selon la convention suivante :
Très fréquent (≥ 1/10) ;
Fréquent (≥ 1/100 à < 1/10) ;
Peu fréquent (≥1/1 000 à < 1/100) ;
Rare (≥ 1/10 000 à < 1/1 000) ;
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Adultes et personnes âgées
Le profil de tolérance se base sur les données provenant :
· d’études cliniques réalisées chez plus de 8000 adultes (5064 pour VAXIGRIP, 3040 pour VAXIGRIPTETRA) et plus de 5800 personnes âgées, de plus de 60 ans (4468 pour VAXIGRIP, 1392 pour VAXIGRIPTETRA),
· de la surveillance après commercialisation à travers le monde dans la population générale.
Chez les adultes, les effets indésirables les plus fréquemment rapportés après la vaccination étaient : douleur au site d’injection (52,8 %), céphalées (27,8 %), myalgies (23,0 %) et malaise (19,2 %).
Chez les personnes âgées, les effets indésirables les plus fréquemment rapportés après la vaccination étaient : douleur au site d’injection (25,8 %), céphalées (15,6 %) et myalgies (13,9 %).
Tableau 1 : Effets indésirables rapportés chez les adultes et les personnes âgées
|
Classes de systèmes d’organes (SOC) / Effets indésirables |
Fréquence |
|
Affections hématologiques et du système lymphatique |
|
|
Lymphadénopathie (1) |
Peu fréquent |
|
Thrombocytopénie transitoire |
Indéterminée* |
|
Affections du système immunitaire |
|
|
Réactions allergiques telles qu’hypersensibilité (2), dermatite atopique (2), urticaire (2, 3), douleur oropharyngée, asthme (1), rhinite allergique (2), rhinorrhée (1), conjonctivite allergique (2), prurit (2), bouffées de chaleur (5) |
Peu fréquent |
|
Réactions allergiques telles que angioedème (2,3), gonflement du visage, érythème, rash, bouffée congestive (5), éruption buccale (5), paresthésie orale (5), irritation de la gorge, dyspnée (2,3), éternuements, obstruction nasale (2), congestion des voies respiratoires supérieures (2), hyperhémie oculaire (2), dermatite allergique (2), prurit généralisé (2) |
Rare |
|
Réactions allergiques telles que rash érythémateux, réaction anaphylactique, choc |
Indéterminée* |
|
Troubles du métabolisme et de la nutrition |
|
|
Diminution de l’appétit |
Rare |
|
Affections du système nerveux |
|
|
Céphalées |
Très fréquent |
|
Sensation vertigineuse (4), somnolence (4) |
Peu fréquent |
|
Hypoesthésie (2), paresthésie |
Rare |
|
Névralgie, convulsions, encephalomyélite, névrite, syndrome de Guillain Barré |
Indéterminée* |
|
Affections vasculaires |
|
|
Vascularites telles que purpura de Henoch-Schönlein, avec atteinte rénale transitoire dans certains cas |
Indéterminée* |
|
Affections gastro-intestinales |
|
|
Diarrhées, nausées |
Peu fréquent |
|
Douleurs abdominales (2), vomissements |
Rare |
|
Affections de la peau et du tissu sous-cutané |
|
|
Hyperhidrose (1) |
Peu fréquent |
|
Affections musculo-squelettiques et systémiques |
|
|
Myalgies |
Très fréquent |
|
Arthralgies (1) |
Peu fréquent |
|
Troubles généraux et anomalies au site d'administration |
|
|
Douleur au site d’injection, malaise (6) |
Très fréquent |
|
Fièvre (7), frissons, érythème au site d’injection, induration au site d’injection, gonflement au site d’injection |
Fréquent |
|
Asthénie (1), fatigue, ecchymose au site d’injection, prurit au site d’injection, chaleur au site d’injection, gêne au site d’injection |
Peu fréquent |
|
Symptômes pseudo-grippaux, exfoliation au site d’injection (5), hypersensibilité au site d’injection (2) |
Rare |
(1) Rare chez les personnes âgées
(2) Rapporté lors des études cliniques chez l’adulte
(3) Indéterminée chez les personnes âgées
(4) Rare chez les adultes
(5) Rapporté lors des études cliniques chez les personnes agées
(6) Fréquent chez les personnes âgées
(7) Peu fréquent chez les personnes âgées
(*) Effets indésirables rapportés après la commercialisation de VAXIGRIP ou VAXIGRIPTETRA
Population pédiatrique
Le profil de tolérance se base sur les données provenant :
· d’études cliniques réalisées chez 1247 enfants âgés de 3 à 8 ans (363 pour VAXIGRIP, 884 pour VAXIGRIPTETRA) et chez 725 enfants/adolescents âgés de 9 à 17 ans (296 pour VAXIGRIP, 429 pour VAXIGRIPTETRA),
· d’une étude clinique réalisée chez 1981 enfants âgés de 6 à 35 mois (367 pour VAXIGRIP, 1614 pour VAXIGRIPTETRA),
· de la surveillance après commercialisation à travers le monde dans la population générale.
En fonction de leurs antécédents de vaccination, les enfants âgés de 6 mois à 8 ans ont reçu une ou deux doses de VAXIGRIP ou VAXIGRIPTETRA. Les enfants / adolescents âgés de 9 à 17 ans ont reçu une dose.
Chez les enfants âgés de 6 mois à 8 ans, le profil de tolérance était similaire après la première et la seconde injection, avec une tendance à une moindre incidence des effets indésirables après la seconde injection par rapport à la première chez les enfants âgés de 6 à 35 mois.
Chez les enfants âgés de 3 à 8 ans, les effets indésirables les plus fréquemment rapportés après la vaccination étaient : douleur au site d’injection (59,1 %), malaise (30,7 %), érythème au site d’injection (30,3 %), myalgies (28,5 %), céphalées (25,7 %), gonflement au site d’injection (22,1 %), l’induration au site d’injection (17,6 %) et frissons (11,2 %).
· Dans la sous-population d’enfants âgés de 6 à 23 mois, les effets indésirables les plus fréquemment rapportés après la vaccination étaient : irritabilité (34,9 %), pleurs anormaux (31,9 %), perte d’appétit (28,9 %), somnolence (19,2 %) et vomissements (17,0 %).
· Dans la sous-population d’enfants âgés de 24 à 35 mois, les effets indésirables les plus fréquemment rapportés après la vaccination étaient : malaise (26,8 %), myalgies (14,5 %), céphalées (11,9%).
Tableau 2: Effets indésirables rapportés chez les enfants et adolescents âgés de 6 mois à 17 ans.
|
Classes de systèmes d’organes (SOC) / Effets indésirables |
Fréquence |
|||
|
Enfants 6 - 35 mois d’âge |
Enfants 3 - 8 ans d’âge |
Enfants et adolescents 9 - 17 ans d’âge |
||
|
6 - 23 mois d’âge |
24 - 35 mois d’âge |
|||
|
Affections hématologiques et du système lymphatique |
|
|
|
|
|
- Lymphadénopathie |
Indéterminée* |
Peu fréquent |
Indéterminée* |
|
|
- Thrombocytopénie |
Indéterminée* |
Peu fréquent |
Indéterminée* |
|
|
Affections du système immunitaire |
|
|
|
|
|
- Réactions allergiques telles que: |
|
|
|
|
|
· Douleur oropharyngée |
- |
Peu fréquent |
- |
|
|
· Hypersensibilité |
Peu fréquent |
- |
- |
|
|
· Rash |
- |
Peu fréquent |
Peu fréquent |
|
|
· Urticaire |
Indéterminée* |
Peu fréquent |
Peu fréquent |
|
|
· Prurit |
Indéterminée* |
Peu fréquent |
Indéterminée* |
|
|
· Prurit généralisé, rash papuleux |
Rare |
- |
- |
|
|
· Rash érythémateux, dyspnée, réaction anaphylactique, angioedème, choc |
Indéterminée* |
Indéterminée* |
Indéterminée* |
|
|
Troubles du métabolisme et de la nutrition |
|
|
|
|
|
- Diminution de l’appétit |
Très fréquent |
Rare |
- |
- |
|
Affections psychiatriques |
|
|
|
|
|
- Pleurs anormaux |
Très fréquent |
- |
- |
- |
|
- Irritabilité |
Très fréquent |
Rare |
- |
- |
|
- Agitation |
- |
Peu fréquent |
- |
|
|
- Gémissements |
- |
Peu fréquent |
- |
|
|
Affections du système nerveux |
|
|||
|
- Céphalée |
- |
Très fréquent |
Très fréquent |
Très fréquent |
|
- Somnolence |
Très fréquent |
- |
- |
- |
|
- Sensation vertigineuse |
- |
Peu fréquent |
Peu fréquent |
|
|
- Névralgie, névrite et Syndrome de Guillain-Barré |
- |
Indéterminée* |
Indéterminée* |
|
|
- Paresthésie, convulsions, encéphalomyélite |
Indéterminée* |
Indéterminée* |
Indéterminée* |
|
|
Affections vasculaires |
|
|
|
|
|
- Vascularites telles que purpura de Henoch-Schönlein avec atteinte rénale transitoire dans certains cas |
Indéterminée* |
Indéterminée* |
Indéterminée* |
|
|
Affections gastro-intestinales |
|
|
|
|
|
- Diarrhées |
Fréquent |
Peu fréquent |
Peu fréquent |
|
|
- Douleurs abdominales |
- |
Peu fréquent |
- |
|
|
- Vomissements |
Très fréquent |
Peu fréquent |
Peu fréquent |
- |
|
Affections musculo-squelettiques et systémiques |
|
|
|
|
|
- Myalgies |
Rare |
Très fréquent |
Très fréquent |
Très fréquent |
|
- Arthralgies |
- |
Peu fréquent |
- |
|
|
Troubles généraux et anomalies au site d'administration |
|
|
|
|
|
Réactions au site d’injection |
|
|
|
|
|
- Douleur / sensibilité au site d’injection, érythème au site d’injection |
Très fréquent |
Très fréquent |
Très fréquent |
|
|
- Gonflement au site d’injection |
Fréquent |
Très fréquent |
Très fréquent |
|
|
- Induration au site d’injection |
Fréquent |
Très fréquent |
Fréquent |
|
|
- Ecchymose au site d’injection |
Fréquent |
Fréquent |
Fréquent |
|
|
- Prurit au site d’injection |
Rare |
Peu fréquent |
Peu fréquent |
|
|
- Chaleur au site d’injection |
- |
Peu fréquent |
Peu fréquent |
|
|
- Gêne au site d’injection |
- |
- |
Peu fréquent |
|
|
- Rash au site d’injection |
Rare |
- |
- |
|
|
Réactions systémiques |
|
|
|
|
|
- Malaise |
Rare |
Très fréquent |
Très fréquent |
Très fréquent |
|
- Frissons |
- |
Fréquent |
Très fréquent |
Très fréquent |
|
- Fièvre |
Très fréquent |
Fréquent |
Fréquent |
|
|
- Fatigue |
- |
Peu fréquent |
Peu fréquent |
|
|
- Asthénie |
- |
- |
Peu fréquent |
|
|
- Pleurs |
- |
Peu fréquent |
- |
|
|
- Syndrome pseudo-grippal |
Rare |
- |
- |
|
(*) Effets indésirables rapportés après commercialisation de VAXIGRIP ou VAXIGRIPTETRA
Autres populations particulières
Bien qu'un nombre limité de sujets présentant des comorbidités ait été inclus, les études menées chez des patients présentant des comorbidités telles que la transplantation rénale, ou des patients asthmatiques n’ont montré aucune différence majeure en termes de profil de tolérance de VAXIGRIP et VAXIGRIPTETRA dans ces populations.
Femme enceintes
Au cours des études cliniques menées avec VAXIGRIP en Afrique du Sud et au Mali chez des femmes enceintes (voir rubriques 4.6 et 5.1), les fréquences des réactions locales et systémiques sollicitées, rapportées dans les 7 jours suivant l’administration du vaccin, étaient comparables à celles rapportées pour la population adulte au cours des études cliniques. Au cours de l’étude clinique menée en Afrique du Sud, les réactions locales étaient plus fréquentes dans le groupe VAXIGRIP que dans le groupe placebo, aussi bien dans les cohortes séronégatives pour le VIH que dans les cohortes séropositives. Il n’y avait pas d’autres différences significatives concernant les réactions sollicitées entre les groupes VAXIGRIP et placebo dans les deux cohortes.
Au cours d’une étude clinique menée avec VAXIGRIP et VAXIGRIPTETRA en Finlande chez des femmes enceintes (voir rubriques 4.6 et 5.1), les fréquences des réactions locales et systémiques sollicitées, étaient comparables à celles rapportées pour la population adulte (à l’exclusion des femmes enceintes) au cours des études cliniques menées avec VAXIGRIP et VAXIGRIPTETRA, même si elles étaient plus élevées pour certaines réactions indésirables (douleur au site d'injection, érythème au site d’injection, malaise, frissons, maux de tête, myalgies).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Des cas d’administration d’une dose plus importante que la dose recommandée (surdosage) ont été rapportés avec VAXIGRIP. Lorsque des effets indésirables étaient rapportés, ils correspondaient au profil de tolérance de VAXIGRIP décrit en rubrique 4.8.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : vaccins contre la grippe, code ATC : J07BB02.
Mécanisme d’action
VAXIGRIP confère une immunisation active contre trois souches virales de la grippe (deux sous-types A et un type B) contenues dans le vaccin.
VAXIGRIP induit la production d’anticorps humoraux dirigés contre les hémagglutinines dans les 2 à 3 semaines. Ces anticorps neutralisent les virus grippaux.
Chez les nourrissons âgés de moins de 6 mois nés de femmes vaccinées avec VAXIGRIP pendant la grossesse, la protection est due au transfert transplacentaire de ces anticorps neutralisants.
Il n’existe aucune corrélation entre les taux spécifiques de titres en anticorps après vaccination avec des vaccins grippaux inactivés, mesurés par inhibition de l’hémagglutination (IHA) et la protection contre la grippe, mais les titres en anticorps IHA ont été utilisés comme mesure de l’activité vaccinale. Lors d’études chez l’homme, des titres en anticorps IHA ≥ 1/40 ont été associés à une protection contre la grippe chez jusqu’à 50 % des sujets.
Les virus grippaux étant en constante évolution, les souches virales sélectionnées pour les vaccins sont revues tous les ans par l’OMS.
La vaccination annuelle contre la grippe est recommandée en raison de la durée de l’immunité conférée par le vaccin et parce que les souches de virus grippal en circulation peuvent changer d’une année à l’autre.
Efficacité
Les données d’efficacité du VAXIGRIP sont disponibles chez les femmes enceintes et les nourrissons âgés de moins de 6 mois nés de femmes enceintes vaccinées (protection passive).
Aucune étude d’efficacité n’a été réalisée avec VAXIGRIP chez les enfants et les adolescents âgés de 9 ans à 17 ans, chez les adultes et chez les personnes âgées.
Chez les enfants âgés de 6 à 35 mois et de 3 à 8 ans (immunisation active), l’efficacité de VAXIGRIP est basée sur l’extrapolation de l’efficacité de VAXIGRIPTETRA.
· Nourrissons âgés de moins de 6 mois nés de femmes vaccinées au cours de leur grossesse (protection passive) :
Les nourrissons âgés de moins de 6 mois présentent un risque élevé de grippe, résultant en un taux élevé d'hospitalisation. Cependant, les vaccins grippaux ne sont pas indiqués pour l’immunisation active de ce groupe d'âge.
L’efficacité chez les nourrissons nés de femmes ayant reçu une seule dose de 0,5 mL de VAXIGRIP pendant le deuxième ou le troisième trimestre de grossesse a été démontrée au cours des études cliniques.
L’efficacité de VAXIGRIP chez les nourrissons nés de femmes vaccinées au cours du premier trimestre de grossesse n’a pas été étudiée au cours de ces études. Si la vaccination antigrippale est considérée nécessaire au cours du premier trimestre de grossesse, elle ne doit pas être reportée (voir rubrique 4.6).
Au cours des études cliniques de phase IV, randomisées et contrôlées, menées au Mali, au Népal et en Afrique du Sud, environ 5000 femmes enceintes ont reçu VAXIGRIP et environ 5000 femmes enceintes ont reçu un placebo ou un vaccin contrôle (vaccin conjugué quadrivalent contre le méningocoque), au cours du deuxième ou du troisième trimestre de grossesse. L’efficacité vaccinale dans la prévention de la grippe biologiquement confirmée chez les femmes enceintes a été évaluée comme critère secondaire dans ces trois études.
Les études menées au Mali et en Afrique du Sud ont démontré l’efficacité de VAXIGRIP dans la prévention de la grippe chez les femmes enceintes suite à leur vaccination au cours de ces trimestres de grossesse (voir tableau 3). Dans l'étude menée au Népal, l'efficacité de VAXIGRIP dans la prévention de la grippe chez les femmes enceintes suite à leur vaccination au cours de ces trimestres de grossesse n'a pas été démontrée.
Tableau 3 : Taux d’attaque de la grippe et efficacité de VAXIGRIP contre la grippe biologiquement confirmée chez les femmes enceintes
|
|
|
Taux d’attaque de la grippe (Quel que soit le type A ou B) |
Efficacité de Vaxigrip % (IC 95 %) |
|
|
|
Vaxigrip |
Contrôle* |
|
|
|
Mali |
0,5 (11/2108) |
1,9 (40/2085) |
70,3 (42,2 ; 85,8) |
|
|
|
Vaxigrip |
Placebo |
|
|
|
Afrique du Sud |
1,8 (19/1062) |
3,6 (38/1054) |
50,4 (14,5 ; 71,2) |
|
* Vaccin contre le méningoccoque
N : Nombre de femmes enceintes incluses dans l'analyse
n: nombre de sujets présentant une grippe biologiquement confirmée
IC : intervalle de confiance
Au cours des mêmes études cliniques de phase IV, randomisées et contrôlées, menées au Mali, au Népal et en Afrique du Sud, 4530 des 4898 (92 %) nourrissons nés de femmes ayant reçu VAXIGRIP au cours du deuxième ou du troisième trimestre de grossesse, et 4532 des 4868 (93 %) nourrissons nés de femmes ayant reçu un placebo ou un vaccin contrôle (vaccin conjugué quadrivalent contre le méningocoque) au cours du deuxième ou du troisième trimestre de grossesse (voir tableau 4) ont été suivis jusqu’à l’âge d’environ 6 mois.
Ces études ont confirmé l’efficacité de VAXIGRIP dans la prévention de la grippe chez les nourrissons nés de femmes vaccinées au cours de ces trimestres de grossesse, de la naissance jusqu’à l’âge d’environ 6 mois.
Les femmes au premier trimestre de leur grossesse n'ont pas été incluses dans ces études ; l'efficacité de VAXIGRIP chez les nourrissons nés de femmes vaccinées au cours du premier trimestre de leur grossesse n’a donc pas pu être évaluée.
Tableau 4 : Taux d’attaque de la grippe et efficacité de VAXIGRIP contre la grippe biologiquement confirmée chez les nourrissons nés de femmes vaccinées au cours de leur grossesse
|
|
|
Taux d’attaque de la grippe (Quel que soit le type A ou B) |
Efficacité de Vaxigrip % (IC 95 %) |
|
|
|
Vaxigrip |
Contrôle* |
|
|
|
Mali |
2,4 (45/1866) |
3,8 (71/1869) |
37,3 (7,6 ; 57,8) |
|
|
|
Vaxigrip |
Placebo |
|
|
|
Népal |
4,1 (74/1820) |
5,8 (105/1826) |
30,0 (5 ; 48) |
|
|
Afrique du Sud |
1,9 (19/1026) |
3,6 (37/1023) |
48,8 (11,6 ; 70,4) |
|
* Vaccin contre le méningoccoque
N : Nombre de nourissons inclus dans l'analyse
n: nombre de sujets présentant une grippe biologiquement confirmée
IC : intervalle de confiance
Les données d'efficacité indiquent une diminution avec le temps, après la naissance, de la protection des nourrissons nés de femmes vaccinées au cours de leur grossesse.
Au cours de l’étude clinique menée en Afrique du Sud, l'efficacité du vaccin était plus élevée chez les nourrissons âgés de 8 semaines ou moins (85,8 % [IC 95 % : 38,3 ; 98,4]) et diminuait avec le temps ; l'efficacité du vaccin était de 25,5 % (IC 95 % : -67,9 ; 67,8) chez les nourrissons âgés de 8 à 16 semaines et de 30,4 % (IC 95 % : -154,9 ; 82,6) chez les nourrissons âgés de 16 à 24 semaines.
Au cours de l’étude clinique menée au Mali, l’efficacité de VAXIGRIP tendait également à être plus élevée chez les nourrissons au cours des quatre premiers mois suivant la naissance, avec une efficacité plus faible au cours du 5ème mois et une baisse marquée au cours du 6ème mois où la protection n'est plus évidente.
La prévention de la grippe ne peut être attendue que si les nourrissons sont exposés aux souches incluses dans le vaccin administré à la mère.
· Enfants âgés de 6 à 35 mois (immunisation active) :
Une étude randomisée contre placebo a été menée dans 4 régions (Afrique, Asie, Amérique Latine et Europe) au cours de 4 saisons grippales, chez plus de 5400 enfants âgés de 6 à 35 mois ayant reçu deux doses (0,5 mL) de VAXIGRIPTETRA (N=2722), ou un placebo (N = 2717) à 28 jours d’intervalle pour évaluer l’efficacité de VAXIGRIPTETRA dans la prévention de la grippe biologiquement confirmée, causée par une souche A et/ou B, quelle qu’elle soit, et causée par des souches similaires à celles du vaccin (déterminées par séquençage).
La grippe biologiquement confirmée était définie comme un syndrome pseudo-grippal [apparition d’une fièvre ≥ 38°C (qui persiste au moins 24 heures) en même temps qu’au moins un des symptômes suivants : toux, congestion nasale, rhinorrhée, pharyngite, otite, vomissements ou diarrhées], biologiquement confirmée par réaction en chaîne par polymérase-transcriptase inverse (RT-PCR [Reverse Transcriptase Polymerase Chain Reaction]) et/ou culture virale.
Tableau 5 : taux d’attaque de la grippe et efficacité de VAXIGRIPTETRA contre la grippe biologiquement confirmée chez les enfants âgés de 6 à 35 mois
|
|
VAXIGRIPTETRA |
Placebo |
Efficacité |
||
|
|
N |
Taux d’attaque de la grippe (%) |
n |
Taux d’attaque (%) |
% (IC bilatéral à 95 %) |
|
Grippe biologiquement confirmée causée par : |
|
|
|
|
|
|
- N’importe quelle grippe de type A ou B |
122 |
4,72 |
255 |
9,84 |
52,03 (40,24 ; 61,66) |
|
- Souches virales similaires à celles contenues dans le vaccin |
26 |
1,01 |
85 |
3,28 |
69,33 (51,93 ; 81,03) |
N : nombre d’enfants analysés (population totale)
n : nombre d’enfants remplissant les critères énumérés
IC : intervalle de confiance
De plus, une analyse complémentaire prédéfinie a montré que VAXIGRIPTETRA prévenait 56,6 % (IC à 95 % : 37,0 ; 70,5) des grippes sévères biologiquement confirmées dues à n’importe quelle souche, et 71,7 % (IC à 95 % : 43,7 ; 86,9) des grippes sévères biologiquement confirmées dues à des souches similaires à celles du vaccin. En outre, les sujets ayant reçu VAXIGRIPTETRA avaient 59,2 % (IC à 95 % : 44,4 ; 70,4) moins de risques de présenter une grippe nécessitant une consultation médicale que les sujets ayant reçu le placebo.
Les grippes sévères biologiquement confirmées étaient définies comme des syndromes pseudo-grippaux biologiquement confirmés par RT-PCR et/ou culture virale avec au moins un des éléments suivants :
· fièvre > 39,5°C pour les sujets âgés de moins de 24 mois ou ≥ 39,0°C pour les sujets âgés de 24 mois et plus,
· et/ou au moins un symptôme significatif d’un syndrome pseudo-grippal empêchant l’activité quotidienne (toux, congestion nasale, rhinorrhée, pharyngite, otite, vomissements, diarrhées),
· et/ou un des événements suivants : otite moyenne aiguë, infection aiguë des voies respiratoires inférieures (pneumonie, bronchiolite, bronchite, croup), hospitalisation.
Enfants âgés de 3 à 8 ans (immunisation active) :
D’après les réponses immunitaires observées chez les enfants âgés de 3 à 8 ans, l’efficacité de VAXIGRIP dans cette population devrait être au moins similaire à l’efficacité observée chez les enfants de 6 à 35 mois (voir « Enfants âgés de 6 à 35 mois » (immunisation active) ci-dessus et « Immunogénicité de VAXIGRIP » ci-dessous).
Immunogénicité
Des études cliniques menées chez des adultes âgés de 18 à 60 ans, chez des personnes âgées de plus de 60 ans, chez des enfants âgés de 3 à 8 ans et chez des enfants âgés de 6 à 35 mois ont évalué la réponse immunitaire de VAXIGRIP (TIV) et VAXIGRIPTETRA (QIV) en ce qui concerne la moyenne géométrique des titres (MGT) en anticorps IHA à Jour 21 (pour les adultes) et à Jour 28 (pour les enfants), le taux de séroconversion IHA (multiplication par 4 de la valeur inverse du titre ou augmentation d’un titre indétectable [< 10] jusqu’à une valeur inverse du titre ≥ 40), et la Moyenne géométrique des rapports individuels des titres (MGRT) IHA (titres post-/pré-vaccinaux).
Une étude clinique menée chez des adultes âgés de 18 à 60 ans et chez des enfants âgés de 9 à 17 ans a décrit la réponse immunitaire de VAXIGRIP et VAXIGRIPTETRA en ce qui concerne la MGT en anticorps IHA à Jour 21. Une autre étude clinique menée chez des enfants âgés de 9 à 17 ans a décrit la réponse immunitaire de VAXIGRIPTETRA.
Une étude clinique menée chez des femmes enceintes a décrit la réponse immunitaire de de VAXIGRIP et VAXIGRIPTETRA en ce qui concerne la MGT en anticorps IHA à Jour 21, le taux de séroconversion IHA et la MGRT IHA, après une dose administrée au cours du deuxième ou du troisième trimestre de la grossesse. Dans cette étude, le transfert transplacentaire a été évalué à l'aide des MGTs en anticorps IHA du sang maternel, du sang de cordon et le ratio sang de cordon / sang maternel, à l'accouchement.
De manière générale, VAXIGRIP a induit une réponse immunitaire contre les 3 souches grippales contenues dans le vaccin.
Chez les enfants âgés 3 ans et plus, chez les adultes y compris les femmes enceintes et chez les personnes âgées, VAXIGRIP était aussi immunogène que VAXIGRIPTETRA pour les souches communes.
La persistance des anticorps a été évaluée chez les adultes, les personnes âgées et les enfants âgés de 6 mois à 35 mois. La durée de l’immunité induite par la vaccination est au moins de 12 mois.
Adultes et personnes âgées
Au cours d’une étude clinique, la réponse immunitaire a été évaluée chez des adultes âgés de 18 à 60 ans et des personnes âgées de plus de 60 ans ayant reçu une dose de 0,5 mL de VAXIGRIP ou de VAXIGRIPTETRA.
Les résultats d’immunogénicité par la méthode IHA chez les adultes âgés de 18 à 60 ans et les personnes âgées de plus de 60 ans sont présentés dans le Tableau 6.
Tableau 6 : résultats d’immunogénicité chez les adultes âgés de 18 à 60 ans et chez les personnes âgées de plus de 60 ans, 21 jours après la vaccination avec VAXIGRIP ou VAXIGRIPTETRA
|
Adultes âgés de 18 à 60 ans |
Personnes âgées de plus de 60 ans |
||||
|
Souche d’antigène |
TIV alternatif (a) N=140 |
TIV autorisé (b) N=138 |
QIV |
TIV alternatif (a) (B Victoria) N=138 |
TIV autorisé (b) (B Yamagata) N=137 |
QIV |
|
|
MGT (IC à 95 %) |
|||||
|
A (H1N1) (c)(d) |
685 (587 ; 800) |
608 (563 ; 657) |
|
268 (228 ; 314) |
219 (199 ; 241) |
|
|
A (H3N2) (c) |
629 (543 ; 728) |
498 (459 ; 541) |
|
410 (352 ; 476) |
359 (329 ; 391) |
|
|
B (Victoria) |
735 (615 ; 879) |
- |
708 (661 ; 760) |
301 (244 ; 372) |
- |
287 (265 ; 311) |
|
B (Yamagata) |
- |
1735 (1490 ; 2019) |
1715 (1607; 1830) |
- |
697 (593 ; 820) |
655 (611 ; 701) |
|
|
% de SC (IC à 95 %) (e) |
|||||
|
A (H1N1) (c)(d) |
65,1 (59,2 ; 70,7) |
64,1 (60,7 ; 67,4) |
|
50,2 (44,1 ; 56,2) |
45,6 (42,1 ; 49,0) |
|
|
A (H3N2) (c) |
73,4 (67,8 ; 78,5) |
66,2 (62,9 ; 69,4) |
|
48,5 (42,5 ; 54,6) |
47,5 (44,1 ; 51,0) |
|
|
B (Victoria) |
70,0 (61,7 ; 77,4) |
- |
70,9 (67,7 ; 74,0) |
43,5 (35,1 ; 52,2) |
- |
45,2 (41,8 ; 48,7) |
|
B (Yamagata) |
- |
60,9 (52,2 ; 69,1) |
63,7 (60,3 ; 67,0) |
- |
38,7 (30,5 ; 47,4) |
42,7 (39,3 ; 46,2) |
|
|
MGRT (IC à 95 %) (f) |
|||||
|
A (H1N1) (c)(d) |
10,3 (8,35 ; 12,7) |
9,77 (8,69 ; 11,0) |
|
6,03 (4,93 ; 7,37) |
4,94 (4,46 ; 5,47) |
|
|
A (H3N2) (c) |
14,9 (12,1 ; 18,4) |
10,3 (9,15 ; 11,5) |
|
5,79 (4,74 ; 7,06) |
5,60 (5,02 ; 6,24) |
|
|
B (Victoria) |
11,4 (8,66 ; 15,0) |
- |
11,6 (10,4 ; 12,9) |
4,60 (3,50 ; 6,05) |
- |
4,61 (4,18 ; 5,09) |
|
B (Yamagata) |
- |
6,08 (4,79 ; 7,72) |
7,35 (6,66 ; 8,12) |
- |
4,11 (3,19 ; 5,30) |
4,11 (3,73 ; 4,52) |
N=nombre de sujets pour lesquels des données sur le critère de jugement considéré sont disponibles
MGT : Moyenne géométrique des titres ; IC : Intervalle de confiance ;
(a) TIV alternatif contenant A/Californie/7/2009 (H1N1), A/Texas/50/2012 (H3N2) et B/Brisbane/60/2008 (lignée Victoria)
(b) TIV autorisé en 2014-2015 contenant A/California/7/2009 (H1N1), A/Texas/50/2012 (H3N2) et B/Massachusetts/2/2012 (lignée Yamagata)
(c) Le groupe TIV groupé comprend les participants vaccinés avec un TIV alternatif ou un TIV autorisé, N=278 pour les adultes âgés de 18 à 60 ans et N=275 pour les personnes âgées de plus de 60 ans
(d) N = 833 pour le groupe QIV chez les adultes âgés de 18 à 60 ans ; N=832 pour le groupe QIV chez les personnes âgées de plus de 60 ans
(e) SC : séroconversion ou augmentation significative : pour les sujets présentant un titre pré-vaccinal < 10 (1/dil), proportion de sujets présentant un titre post-vaccinal ≥ 40 (1/dil) et pour les sujets présentant un titre pré-vaccinal ≥ 10 (1/dil), proportion de sujets présentant une multiplication par 4 ou plus du titre pré- à post-vaccinal
(f) MGRT : Moyenne géométrique des rapports individuels des titres (titres post-/pré-vaccinaux)
Femmes enceintes et transfert transplacentaire
Au cours d’une étude clinique, un total de 116 femmes enceintes a reçu VAXIGRIP et 230 femmes enceintes ont reçu VAXIGRIPTETRA au cours du deuxième ou du troisième trimestre de la grossesse (entre 20 et 32 semaines de grossesse).
Les résultats d'immunogénicité par la méthode IHA, chez les femmes enceintes, 21 jours après la vaccination avec VAXIGRIP et VAXIGRIPTETRA, sont présentés dans le tableau 7.
Tableau 7 : résultats d’immunogénicité par la méthode IHA chez les femmes enceintes, 21 jours après la vaccination avec VAXIGRIP ou VAXIGRIPTETRA
|
Souche d’antigène |
TIV N=109 |
QIV |
|
|
MGT (IC à 95 %) |
|
|
A (H1N1)* |
638 (529; 769) |
525 (466; 592) |
|
A (H3N2)* |
369 (283; 483) |
341 (286; 407) |
|
B1 (Victoria)* |
697 (569; 855) |
568 (496; 651) |
|
B2 (Yamagata)* |
- |
993 (870; 1134) |
|
|
≥ 4 fois plus n (%) (a) |
|
|
A (H1N1)* |
41,3 (31,9 ; 51,1) |
38,0 (31,5 ; 44,8) |
|
A (H3N2)* |
62,4 (52,6 ; 71,5) |
59,3 (52,4 ; 65,9) |
|
B1 (Victoria)* |
60,6 (50,7; 69,8) |
61,1 (54.3; 67,7) |
|
B2 (Yamagata)* |
- |
59,7 (52,9 ; 66,3) |
|
|
MGRT (IC à 95 %) (b) |
|
|
A (H1N1)* |
5,26 (3,66 ; 7,55) |
3,81 (3,11 ; 4,66) |
|
A (H3N2)* |
9,23 (6,56 ; 13,0) |
8,63 (6,85 ; 10,9) |
|
B1 (Victoria)* |
9,62 (6,89 ; 13,4) |
8,48 (6,81 ; 10,6) |
|
B2 (Yamagata)* |
- |
6,26 (5,12 ; 7,65) |
N=nombre de sujets pour lesquels des données sur le critère de jugement considéré sont disponibles
MGT : Moyenne géométrique des titres ; IC : Intervalle de confiance
* A/H1N1 : A/Michigan/45/2015 (H1N1)pdm09 - souche analogue ;
A/H3N2 : A/Hong Kong/4801/2014 (H3N2) - souche analogue ;
B1 : B/Brisbane/60/2008 - souche analogue (B/ lignée Victoria) : cette souche était incluse dans la composition du TIV ;
B2 : B/Phuket/3073/2013 - souche analogue (B/ lignée Yamagata) : cette souche n’était as incluse dans la composition du TIV.
(a) SC : séroconversion ou augmentation significative : pour les sujets présentant un titre pré-vaccinal < 10 (1/dil), proportion de sujets présentant un titre post-vaccinal ≥ 40 (1/dil) et pour les sujets présentant un titre pré-vaccinal ≥ 10 (1/dil), proportion de sujets présentant une multiplication par 4 ou plus du titre pré- à post-vaccinal
(b) MGRT : Moyenne géométrique des rapports individuels des titres (titres post-/pré-vaccinaux)
Une analyse descriptive d’immunogénicité par la méthode IHA, à l'accouchement, dans un échantillon de sang de la mère (BL03M) et dans un échantillon de sang de cordon (BL03B) et du transfert transplacentaire (BL03B / BL03M) est présentée dans le tableau 8.
Tableau 8 : Analyse descriptive d’immunogénicité par la méthode IHA avec VAXIGRIP ou VAXIGRIPTETRA à l’accouchement
|
Souche d’antigène |
TIV N=89 |
QIV |
|
|
|
BL03M (Sang maternel) |
||
|
A (H1N1)* |
411 (332 ; 507) |
304 (265 ; 349) |
|
|
A (H3N2)* |
186 (137 ; 250) |
178 (146 ; 218) |
|
|
B1 (Victoria)* |
371 (299 ; 461) |
290 (247 ; 341) |
|
|
B2 (Yamagata)* |
- |
547 (463 ; 646) |
|
|
|
BL03B (Sang de cordon) |
||
|
A (H1N1)* |
751 (605 ; 932) |
576 (492 ; 675) |
|
|
A (H3N2)* |
324 (232 ; 452) |
305 (246 ; 379) |
|
|
B1 (Victoria)* |
608 (479 ; 772) |
444 (372 ; 530) |
|
|
B2 (Yamagata)* |
- |
921 (772 ; 1099) |
|
|
|
Transfert transplacentaire : BL03B / BL03MT** |
||
|
A (H1N1)* |
1,83 (1,64 ; 2,04) |
1,89 (1,72 ; 2,08) |
|
|
A (H3N2)* |
1,75 (1,55 ; 1,97) |
1,71 (1,56 ; 1,87) |
|
|
B1 (Victoria)* |
1,64 (1,46 ; 1,85) |
1,53 (1,37 ; 1,71) |
|
|
B2 (Yamagata)* |
- |
1,69 (1,54 ; 1,85) |
|
|
|
|
|||
N=nombre de sujets pour lesquels des données sur le critère de jugement considéré sont disponibles : les femmes qui ont reçu QIV ou TIV, ayant accouchées au moins 2 semaines après l'injection et avec du sang de cordon et du sang de la mère disponibles à l’accouchement.
MGT : Moyenne géométrique des titres ; IC : Intervalle de confiance
* A/H1N1 : A/Michigan/45/2015 (H1N1) pdm09 - souche analogue ;
A/H3N2 : A/Hong Kong/4801/2014 (H3N2) - souche analogue ;
B1 : B/Brisbane/60/2008 - souche analogue (B/ lignée Victoria) : cette souche était incluse dans la composition du TIV ;
B2 : B/Phuket/3073/2013 - souche analogue (B/ lignée Yamagata) : cette souche n’était pas incluse dans la composition du TIV
** Si une mère a X bébés, les valeurs de ses titres sont comptées X fois
À l'accouchement, le niveau d'anticorps plus élevé dans l'échantillon de sang de cordon par rapport à l'échantillon de sang maternel est cohérent avec le transfert d'anticorps transplacentaire de la mère vers le fœtus suivant la vaccination des femmes par VAXIGRIP ou VAXIGRIPTETRA au cours du deuxième ou du troisième trimestre de la grossesse.
Ces données sont cohérentes avec la protection passive démontrée chez les nourrissons de la naissance à environ 6 mois d’âge nés de femmes vaccinées au cours du deuxième ou du troisième trimestre de grossesse avec VAXIGRIP dans des études menées au Mali, au Népal et en Afrique du Sud (voir la sous-rubrique « Efficacité »).
Population pédiatrique
· Enfants âgés de 9 à 17 ans :
Sur un total de 55 enfants âgés de 9 à 17 ans ayant reçu une dose de VAXIGRIP et de 429 enfants ayant reçu une dose de VAXIGRIPTETRA, la réponse immunitaire dirigée contre les souches contenues dans le vaccin était similaire à la réponse immunitaire induite chez les adultes âgés de 18 à 60 ans.
· Enfants âgés de 3 à 8 ans :
Au cours d’une étude clinique, la réponse immunitaire a été décrite chez des enfants âgés de 3 à 8 ans ayant reçu soit une dose, soit deux doses de 0,5 mL de VAXIGRIP ou VAXIGRIPTETRA, en fonction de leurs antécédents de vaccination grippale.
Les enfants ayant reçu un schéma à une ou deux doses de VAXIGRIP ou VAXIGRIPTETRA ont présenté une réponse immunitaire similaire après la dernière dose de chacun des schémas.
Les résultats d’immunogénicité évaluée 28 jours après la dernière injection au moyen de la méthode IHA sont présentés dans le tableau 9 :
· Enfants âgés de 6 à 35 mois :
Au cours d’une étude clinique, la réponse immune a été décrite chez des enfants âgés de 6 à 35 mois ayant reçu deux doses de 0,5 mL de VAXIGRIP ou VAXIGRIPTETRA.
Les résultats d’immunogénicité évaluée 28 jours après la dernière injection au moyen de la méthode IHA sont présentés dans le tableau 9.
Tableau 9 : résultats d’immunogénicité chez les enfants âgés de 6 à 35 mois et âgés de 3 à 8 ans, 28 jours après la dernière injection de VAXIGRIP ou VAXIGRIPTETRA
|
Enfants âgés de 6 à 35 mois |
Enfants âgés de 3 à 8 ans |
||||
|
Souche d’antigène |
TIV alternatif (a) N=172 |
TIV autorisé (b) (c) N=178 |
QIV |
TIV alternatif (a) N=176 |
TIV autorisé (b) N=168 |
QIV |
|
|
MGT (IC à 95 %) |
|||||
|
A (H1N1) (d) |
637 (500 ; 812) |
628 (504 ; 781) |
641 (547 ; 752) |
1141 (1006 ; 1295) |
971 (896 ; 1052) |
|
|
A (H3N2) (d) |
1021 (824 ; 1266) |
994 (807 ; 1224) |
1071 (925 ; 1241) |
1746 (1551 ; 1964) |
1568 (1451 ; 1695) |
|
|
B (Victoria) (e) |
835 (691 ; 1008) |
- |
623 (550 ; 706) |
1120 (921 ; 1361) |
- |
1050 (956; 1154) |
|
B (Yamagata) (f) (g) |
- |
1009 (850 ; 1198) |
1010 (885 ; 1153) |
- |
1211 (1003 ; 1462) |
1173 (1078 ; 1276) |
|
|
% de SC (IC à 95 %) (e) |
|||||
|
A (H1N1) (d) |
87,2 (81,3 ; 91,8) |
90,4 (85,1; 94,3) |
90,3 (86,7 ; 93,2) |
65,7 (60,4 ; 70,7) |
65,7 (62,4 ; 68,9) |
|
|
A (H3N2) (d) |
88,4 (82,6 ; 92,8) |
87,6 (81,9; 92,1) |
90,3 (86,7 ; 93,2) |
67,7 (62,5 ; 72,6) |
64,8 (61,5 ; 68,0) |
|
|
B (Victoria) (e) |
99,4 (96,8 ; 100,0) |
- |
98,8 (97,0 ; 99,7) |
90,3 (85,0 ; 94,3) |
- |
84,8 (82,3 ; 87,2) |
|
B (Yamagata) (f) (g) |
- |
99,4 (96,9 ; 100,0) |
96,8 (94,3 ; 98,4) |
- |
89,9 (84,3 ; 94,0) |
88,5 (86,2 ; 90,6) |
|
|
MGRT (IC à 95 %) (f) |
|||||
|
A (H1N1) (d) |
35,3 (27,4 ; 45,5) |
40,6 (32,6 ; 50,5) |
36,6 (30,8 ; 43,6) |
7,65 (6,54; 8,95) |
6,86 (6,24 ; 7,53) |
|
|
A (H3N2) (d) |
44,1 (33,1 ; 58,7) |
37,1 (28,3 ; 48,6) |
42,6 (35,1 ; 51,7) |
7,61 (6,69; 9,05) |
7,49 (6,72; 8,35) |
|
|
B (Victoria) (e) |
114 (94,4 ; 138) |
- |
100 (88,9 ; 114) |
17,8 (14,5 ; 22,0) |
- |
17,1 (15,5 ; 18,8) |
|
B (Yamagata) (f) (g) |
- |
111 (91,3 ; 135) |
93,9 (79,5 ; 111) |
- |
30,4 (23,8 ; 38,4) |
25,3 (22,8 ; 28,2) |
N= nombre de sujets pour lesquels des données sur le critère de jugement considéré sont disponibles
MGT : Moyenne géométrique des titres ; IC : Intervalle de confiance ;
(a) TIV alternatif contenant A/Californie/7/2009 (H1N1), A/Texas/50/2012 (H3N2) et B/Brisbane/60/2008 (lignée Victoria)
(b) TIV autorisé en 2014-2015 contenant A/California/7/2009 (H1N1), A/Texas/50/2012 (H3N2) et B/Massachusetts/2/2012 (lignée Yamagata)
(c) Dose de 0,5 mL chez les enfants âgés de 6 à 35 mois
(d) Pour les enfants âgés de 3 à 8 ans : Le groupe TIV groupé comprend les participants vaccinés avec un TIV alternatif ou un TIV autorisé, N=344
(e) N=169 pour le groupe Vaxigrip (B Victoria) chez les enfants âgés de 3 à 8 ans
(f) N=862 pour le groupe QIV chez les enfants âgés de 3 à 8 ans
(g) Pour le groupe TIV alternatif (B Victoria) : N = 171 pour les enfants âgés de 6 à 35 mois ; N = 175 pour les enfants âgés de 3 à 8 ans
(h) SC : séroconversion ou augmentation significative : pour les sujets présentant un titre pré-vaccinal < 10 (1/dil), proportion de sujets présentant un titre post-vaccinal ≥ 40 (1/dil) et pour les sujets présentant un titre pré-vaccinal ≥ 10 (1/dil), proportion de sujets présentant une multiplication par 4 ou plus du titre post-vaccinal
(i) MGRT : Moyenne géométrique des rapports individuels des titres (titres post-/pré-vaccinaux)
Ces données d’immunogénicité apportent des informations supplémentaires soutenant les données d’efficacité disponibles chez les enfants âgés de 6 à 35 mois (voir Rubrique « Efficacité »).
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
· Chlorure de sodium
· Chlorure de potassium
· Phosphate disodique dihydraté
· Phosphate monopotassique
· Eau pour préparations injectables
1 an.
6.4. Précautions particulières de conservation
6.5. Nature et contenu de l'emballage extérieur
· 0,5 mL de suspension en seringue préremplie (verre de type I) avec aiguille attachée munie d’un bouchon-piston (élastomère bromobutyle) – boîte de 1 ou de 10.
· 0,5 mL de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (élastomère bromobutyle) et d’un capuchon de protection :
o Boîte de 1 ou 10 seringue(s) préremplie(s) sans aiguille(s).
o Boîte de 1 ou 10 seringue(s) préremplie(s) avec aiguille(s) séparée(s) (acier inoxydable).
o Boîte de 1 ou 10 seringue(s) préremplie(s) avec aiguille(s) séparée(s) (acier inoxydable) avec un bouclier de sécurité (polycarbonate)
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Le vaccin doit être amené à température ambiante avant utilisation.
Agiter avant emploi.
Préparation pour administration :
La seringue contenant la suspension injectable doit être inspectée visuellement avant administration. En cas de présence de particules étrangères, de fuite, d'activation prématurée du piston ou d'embout défectueux, jetez la seringue préremplie.
La seringue est destinée à un usage unique et ne doit pas être réutilisée
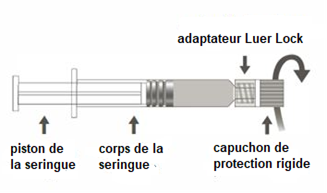
Instructions d’utilisation de la seringue préremplie Luer Lock.
Figure A : seringue Luer Lock avec un capuchon de protection rigide
|
|
|
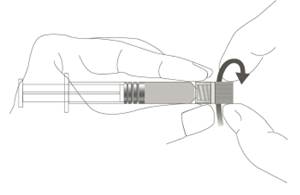
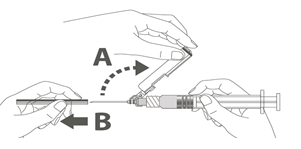
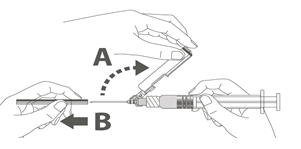
Étape 1 : En tenant l’adaptateur Luer lock d’une main (éviter de tenir le piston ou le corps de la seringue), dévisser le capuchon de protection en le tournant. |
|
|
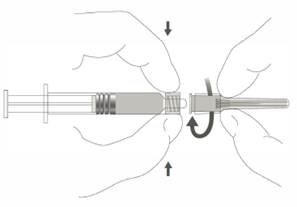
Étape 2 : Pour fixer l’aiguille à la seringue, visser doucement l’aiguille à l’adaptateur Luer lock jusqu’à sentir une légère résistance. |
|
Suivre les étapes 1 et 2 ci-dessus pour préparer la seringue Luer Lock et la fixation de l’aiguille.
|
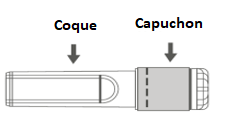
Figure B : Aiguille sécurisée (à l’intérieur de la coque) |
Figure C : Composants de l’aiguille sécurisée (préparée pour l’utilisation) |
|
|
|
|
Étape 3 : Retirer la coque de l’aiguille sécurisée en tirant tout droit. L’aiguille est recouverte par le bouclier de sécurité et le protège-aiguille. |
|
|
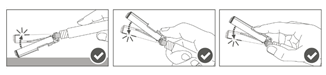
Étape 4 : A : soulever le boculier de sécurité en l’écartant de l’aiguille et en le poussant vers le corps de la seringue selon l’angle indiqué. B : Retirez le protège-aiguille en tirant tout droit. |
|
|
Étape 5 : Une fois l'injection terminée, verrouiller (activer) avec une seule main le bouclier de sécurité à l'aide de l'une des trois (3) techniques illustrées : activation à l’aide d’une surface, du pouce ou de l’index. Remarque : L'activation est vérifiée par un « clic » sonore et/ou tactile. |
|
|
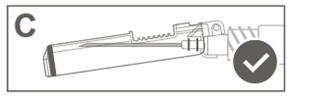
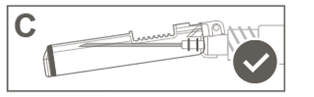
Étape 6: Inspecter visuellement l’activation du bouclier de sécurité. Le bouclier de sécurité doit être entièrement verrouillé (activé), comme indiqué sur l’image C. |
|
|
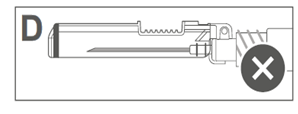
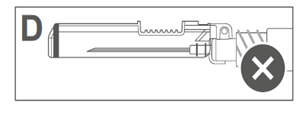
L’image D indique que le bouclier de sécurité n'est PAS complètement verrouillé (non activé). |
|
|
Attention : Ne pas essayer de déverrouiller (désactiver) le dispositif de sécurité en forçant l'aiguille à sortir du bouclier de sécurité.> |
|
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
82 AVENUE RASPAIL
94250 GENTILLY
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 303 060 1 7 : 0,5 mL de suspension en seringue préremplie (verre de type I) avec aiguille attachée munie d’un bouchon-piston (élastomère bromobutyle) – boîte de 10.
· 34009 303 060 2 4 : 0,5 mL de suspension en seringue préremplie (verre de type I) sans aiguille munie d’un bouchon-piston (élastomère bromobutyle) – boîte de 1.
· 34009 303 060 3 1 : 0,5 mL de suspension en seringue préremplie (verre de type I) sans aiguille munie d’un bouchon-piston (élastomère bromobutyle) – boîte de 10.
· 34009 303 060 4 8 : 0,5 mL de suspension en seringue préremplie (verre de type I) avec aiguille séparée munie d’un bouchon-piston (élastomère bromobutyle) – boîte de 1.
· 34009 303 060 5 5 : 0,5 mL de suspension en seringue préremplie (verre de type I) avec aiguille séparée munie d’un bouchon-piston (élastomère bromobutyle) – boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 03/06/2025
VAXIGRIP suspension injectable en seringue préremplie
Vaccin grippal trivalent (inactivé, à virion fragmenté)
Veuillez lire attentivement cette notice avant de vous faire vacciner, vous ou votre enfant, car elle contient des informations importantes pour vous.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce vaccin vous a été personnellement prescrit à vous ou à votre enfant. Ne le donnez pas à d’autres personnes.
· Si vous ou votre enfant ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que VAXIGRIP, suspension injectable en seringue préremplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser VAXIGRIP, suspension injectable en seringue préremplie ?
3. Comment utiliser VAXIGRIP, suspension injectable en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver VAXIGRIP, suspension injectable en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE VAXIGRIP, suspension injectable en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : vaccins contre la grippe - code ATC : J07BB02.
VAXIGRIP est un vaccin.
Ce vaccin, qui vous est administré ou administré à votre enfant à partir de l’âge de 6 mois, vous aide à vous protéger ou à protéger votre enfant de la grippe.
Lorsqu’une personne reçoit le vaccin VAXIGRIP, le système immunitaire (le système de défense naturelle de l’organisme) développe sa propre protection (anticorps) contre la maladie. Lorsqu'il est administré au cours de la grossesse, le vaccin aide à protéger la femme enceinte mais aide aussi à protéger son (ses) enfant(s), à partir de la naissance jusqu’à près de 6 mois d’âge grâce à la transmission de la protection de la mère à l'enfant pendant la grossesse (voir également les rubriques 2 et 3).
Aucun des composants du vaccin ne peut causer la grippe.
VAXIGRIP doit être utilisé selon les recommandations officielles.
La grippe est une maladie qui peut se propager rapidement et qui est causée par différentes souches de virus qui peuvent changer chaque année. En raison du changement potentiel des souches circulant chaque année et de la durée de protection prévue du vaccin, il est recommandé de se faire vacciner tous les ans. Le plus grand risque de contracter la grippe se situe pendant les mois les plus froids, entre octobre et mars. Si vous ou votre enfant n'avez pas été vacciné durant l'automne, il est encore possible de l’être jusqu'au printemps car vous ou votre enfant courrez le risque de contracter la grippe jusqu'à cette période. Votre médecin pourra vous recommander le meilleur moment pour vous faire vacciner.
VAXIGRIP est destiné à vous protéger, ou à protéger votre enfant, contre les trois souches de virus contenues dans le vaccin, environ 2 à 3 semaines après l’injection.
De plus, si vous ou votre enfant êtes exposé à la grippe juste avant ou juste après la vaccination, vous ou votre enfant pouvez encore développer la maladie, la période d’incubation de la grippe étant de quelques jours.
Le vaccin ne vous protègera pas, vous ou votre enfant, des rhumes, même si certains des symptômes ressemblent à ceux de la grippe.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER VAXIGRIP, suspension injectable en seringue préremplie ?
Pour être certain que VAXIGRIP vous est adapté ou est adapté à votre enfant, il est important d’indiquer à votre médecin ou à votre pharmacien si l’un des points ci-dessous vous concerne vous ou votre enfant.
Si vous ne comprenez pas quelque chose, demandez à votre médecin ou votre pharmacien de vous expliquer.
N’utilisez jamais VAXIGRIP, suspension injectable en seringue préremplie :
· Si vous ou votre enfant êtes allergique :
o aux substances actives ou
o à l’un des autres composants de ce vaccin (mentionnés dans la rubrique 6), ou
o à tout constituant pouvant être présent en très petites quantités comme les œufs (ovalbumine ou protéines de poulet), la néomycine, le formaldéhyde ou l’octoxinol-9.
Avertissements et précautions
Adressez-vous à votre médecin ou votre pharmacien avant d’utiliser VAXIGRIP.
Avant la vaccination, vous devez dire à votre médecin si vous ou votre enfant :
· avez une faible réponse immunitaire (immunodéficience ou prise de médicaments affectant le système immunitaire),
· souffrez de troubles de la coagulation ou êtes facilement sujet aux bleus.
Si vous ou votre enfant avez une maladie aiguë avec une fièvre, la vaccination doit être différée jusqu’à ce que la fièvre disparaisse.
Votre médecin décidera si vous ou votre enfant devez être vacciné.
Un évanouissement peut survenir (surtout chez les adolescents) après, voire avant, toute injection avec une aiguille. Aussi, parlez-en à votre médecin ou votre infirmier/ère si vous ou votre enfant vous êtes évanoui lors d'une précédente injection.
Comme pour tous les vaccins, VAXIGRIP peut ne pas protéger complètement toutes les personnes vaccinées.
Les enfants âgés de moins de 6 mois nés de femmes vaccinées au cours de leur grossesse peuvent ne pas être tous protégés.
Enfants
L’utilisation de VAXIGRIP n’est pas recommandée chez les enfants âgés de moins de 6 mois.
Autres médicaments et VAXIGRIP, suspension injectable en seringue préremplie
Informez votre médecin ou votre pharmacien si vous ou votre enfant recevez, avez récemment reçu ou pourriez recevoir un autre vaccin ou un autre médicament.
· VAXIGRIP peut être administré en même temps que d’autres vaccins, mais sur des sites d’injections séparés.
· La réponse immunologique peut être diminuée en cas de traitements immunosuppresseurs tels que les corticostéroïdes, les médicaments cytotoxiques ou la radiothérapie.
VAXIGRIP, suspension injectable en seringue préremplie avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte, demandez conseil à votre médecin ou pharmacien avant d’utiliser ce médicament.
VAXIGRIP peut être utilisé à tous les stades de la grossesse.
VAXIGRIP peut être utilisé pendant l'allaitement.
Votre médecin ou votre pharmacien sera en mesure de décider si vous devez recevoir VAXIGRIP.
Conduite de véhicules et utilisation de machines
VAXIGRIP n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
VAXIGRIP, suspension injectable en seringue préremplie contient du potassium et du sodium
Ce médicament contient moins d’1 mmol de potassium (39 mg) et de sodium (23 mg) par dose, c'est-à-dire qu’il est pratiquement sans potassium et sans sodium.
3. COMMENT UTILISER VAXIGRIP, suspension injectable en seringue préremplie ?
Posologie
Les adultes reçoivent une dose de 0,5 mL.
Utilisation chez les enfants et les adolescents
Les enfants à partir de l'âge de 6 mois à 17 ans reçoivent une dose de 0,5 mL.
Si votre enfant est âgé de moins de 9 ans et n'a pas été vacciné auparavant contre la grippe, une seconde dose de 0,5 mL devra être injectée après un intervalle d'au moins 4 semaines.
Si vous êtes enceinte, la dose de 0,5 mL qui vous est administrée au cours de votre grossesse peut protéger votre enfant dès sa naissance jusqu’à près de 6 mois d’âge. Demandez plus d’information à votre médecin ou à votre pharmacien.
Comment VAXIGRIP est administré
Votre médecin ou votre infirmier/ère administrera la dose recommandée de vaccin par une injection dans le muscle ou sous la peau.
Si vous ou votre enfant avez reçu plus de VAXIGRIP, suspension injectable en seringue préremplie que vous n’auriez dû
Dans certains cas, une dose plus importante que la dose recommandée a été a été administrée par inadvertance.
Dans ces cas, lorsque des effets indésirables étaient rapportés, ils correspondaient à ce qui est décrit suivant l’administration de la dose recommandée (voir rubrique 4).
Si vous ou votre enfant oubliez d’utiliser VAXIGRIP, suspension injectable en seringue préremplie
Sans objet.
Si vous ou votre enfant arrêtez d’utiliser VAXIGRIP, suspension injectable en seringue préremplie
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce produit, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce vaccin est susceptible d'avoir des effets indésirables, bien que tous n’y soient pas sujets.
En cas de réaction allergique, contactez immédiatement votre médecin ou un professionnel de santé ou veuillez-vous rendre immédiatement aux urgences de l'hôpital le plus proche.
Réactions allergiques
Elles peuvent survenir immédiatement après l’administration du vaccin et mettre la vie en danger.
Les symptômes peuvent inclure :
· Eruption cutanée, démangeaisons, difficultés à respirer, essoufflement, gonflement du visage, des lèvres, de la gorge ou de la langue, une tension basse, un rythme cardiaque rapide et un pouls lent, une peau froide et moite, des sensations vertigineuses, une faiblesse ou évanouissement (réaction anaphylactique, angioedème, choc).
D’autres symptômes peuvent inclure :
· Zones de démangeaisons, de peau rouge, enflée et craquelée (dermatite atopique), rougeur et chaleur au niveau du visage, bouffée de chaleur, sang dans le blanc de l’oeil (hyperhémie oculaire), rougeur et irritation de l’œil (conjonctivite), irritation de la gorge, mal de gorge, irritation à l’intérieur du nez, nez qui coule, éternuements, nez, sinus et gorge encombrés, engourdissement ou sensation de fourmillements dans la bouche (paresthésie orale), éruption dans la bouche (éruption buccale), asthme.
Ces réactions allergiques ont été rapportées comme peu fréquentes (pouvant affecter jusqu’à 1 personne sur 100) à rares (pouvant affecter jusqu’à 1 personne sur 1 000).
Effets indésirables supplémentaires chez les adultes et personnes âgés
Très fréquent (pouvant affecter plus d’une personne sur 10)
· Maux de tête, douleurs musculaires, malaise (1), douleur au site d’injection
(1) Fréquent chez les personnes âgées
Fréquent (pouvant affecter jusqu’à une personne sur 10)
· Fièvre (2), frissons, réactions au site d’injection : rougeur (érythème), durcissement (induration), gonflement
(2) Peu fréquent chez les personnes âgées
Peu fréquent (pouvant affecter jusqu’à une personne sur 100)
· Gonflement des ganglions du cou, des aisselles ou de l’aine (lymphadénopathies) (3), faiblesse inhabituelle (3), fatigue, somnolence (4), sensation vertigineuse (4), augmentation de la transpiration (hyperhidrose) (3), douleurs articulaires (1), diarrhées, nausées, réactions au site d’injection : bleu, démangeaisons, chaleur (1), gêne
(3) Rare chez les personnes âgées (4) Rare chez les adultes
Rare (pouvant affecter jusqu’à une personne sur 1 000)
· Engourdissement ou sensation de fourmillements (paresthésie), vomissements, diminution de l’appétit, maladie ressemblant à la grippe
· Diminution de la sensibilité (hypoesthésie), douleurs abdominales, allergie au site d’injection : observés seulement chez les adultes
· Peau qui pèle (exfoliation) au site d’injection : observé seulement chez les personnes âgées
Effets indésirables supplémentaires chez les enfants âgés de 3 à 17 ans
Très fréquent (pouvant affecter plus d’une personne sur 10)
· Maux de tête, douleurs musculaires, malaise, frissons, réactions au site d’injection : douleur, rougeur, gonflement, durcissement (5)
(5) Fréquent chez les enfants âgés de 9 à 17 ans.
Fréquent (pouvant affecter jusqu’à une personne sur 10)
· Fièvre, bleu au site d’injection
Peu fréquent (pouvant affecter jusqu’à une personne sur 100)
· Fatigue, sensation vertigineuse, diarrhées, réactions au site d’injection, démangeaisons, chaleur
· Gonflement des ganglions du cou, des aisselles ou de l’aine, douleurs abdominales, vomissements, agitation, gémissements, douleurs articulaires, pleurs : observés seulement chez les enfants âgées de 3 à 8 ans
· Réduction du nombre de certains éléments du sang appelés plaquettes ; un faible nombre de celles-ci peut se traduire par des bleus ou saignements excessifs (thrombocytopénie) : observé seulement chez un enfant âgé de 3 ans
· Faiblesse inhabituelle, inconfort au site d’injection : observés seulement chez les enfants âgés de 9 à 17 ans
Effets indésirables supplémentaires chez les enfants âgés de 6 à 35 mois
Très fréquent (pouvant affecter plus d’une personne sur 10)
· Irritabilité(6), vomissement(7), douleurs musculaires(8), malaise(8), fièvre, diminution de l’appétit(6), réactions au site d’injection : sensibilité, rougeur
· Pleurs inhabituels, somnolence : observés chez les enfants âgés moins de 24 mois
· Maux de tête : observés chez les enfants âgés de 24 mois et plus
(6) Rare chez les enfants âgés de 24 à 35 mois.
(7) Peu fréquent chez les enfants âgés de 24 à 35 mois.
(8) Rare chez les enfants âgés de 6 à 23 mois.
Fréquent (pouvant affecter jusqu’à une personne sur 10)
· Diarrhées, réactions au site d’injection : durcissement (induration), bleu, gonflement
· Frissons : observés seulement chez les enfants âgés de 24 mois et plus
Rare (pouvant affecter jusqu’à une personne sur 1 000)
· Maladie ressemblant à la grippe, réactions au site d’injection : démangeaisons, éruptions cutanées
Chez les enfants de 6 mois à 8 ans qui reçoivent 2 doses, les effets secondaires sont similaires après la première dose et après la deuxième dose. Chez les enfants de 6 à 35 mois, les effets secondaires peuvent être moins nombreux après la deuxième dose.
La plupart des effets indésirables sont en général survenus dans les 3 jours suivant la vaccination et ont disparu dans les 3 jours sans traitement. L’intensité de la plupart de ces effets indésirables était légère à modérée.
La fréquence des effets indésirables suivants est indéterminée (ne peut être estimée sur la base des données disponibles) dans la population générale sauf dans la population pour laquelle l’effet indésirable est listé ci-dessus :
· Gonflement des glandes du cou, des aisselles ou de l'aine
· Engourdissement ou sensation de fourmillements (paresthésie), douleur siégeant sur le trajet du nerf (névralgie) (9), convulsions, troubles neurologiques pouvant se traduire par une raideur du cou, de la confusion, des engourdissements, des douleurs et une faiblesse des membres, une perte de l'équilibre, une perte des réflexes, une paralysie d'une partie ou de tout le corps (encéphalomyélite, névrite (9) et syndrome de Guillain-Barré (9))
· Inflammation des vaisseaux sanguins (vascularite) pouvant se traduire par des éruptions cutanées et dans de très rares cas par des problèmes rénaux transitoires
· Réduction temporaire du nombre de certains éléments du sang appelés plaquettes ; un faible nombre de celles-ci peut se traduire par des bleus ou saignements excessifs (thrombocytopénie transitoire)
(9) Non rapporté chez les enfants de 6 à 35 mois
Déclaration des effets secondaires
Si vous ou votre enfant ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER VAXIGRIP, suspension injectable en seringue préremplie ?
Tenir ce vaccin hors de la vue et de la portée des enfants.
N’utilisez pas ce vaccin après la date de péremption indiquée sur la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler. Conserver la seringue dans l’emballage extérieur à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient VAXIGRIP, suspension injectable en seringue préremplie
· Les substances actives sont : virus de la grippe, (inactivé, fragmenté) des souches suivantes* :
A/Victoria/4897/2022 (H1N1)pdm09-souche analogue (A/Victoria/4897/2022, IVR-238)...................
.............................................................................................................. 15 microgrammes HA**
A/Croatia/10136RV/2023 (H3N2)-souche analogue (A/Croatia/10136RV/2023, X-425A)...................
.............................................................................................................. 15 microgrammes HA**
B/Austria/1359417/2021-souche analogue (B/Michigan/01/2021, type sauvage).............................
.............................................................................................................. 15 microgrammes HA**
Pour une dose de 0,5 mL
*Cultivées sur œufs embryonnés de poules provenant d’élevages sains
**Hémagglutinine
Ce vaccin est conforme aux recommandations de l'OMS (Organisation Mondiale de la Santé) (dans l'Hémisphère Nord) et à la décision de l’Union Européenne pour la saison 2025/2026.
· Les autres composants sont : une solution tampon contenant du chlorure de sodium, du phosphate disodique dihydraté, du phosphate monopotassique, du chlorure de potassium, de l'eau pour préparations injectables.
Des constituants tels que les œufs (ovalbumine, protéines de poulet), la néomycine, le formaldéhyde et l’octoxinol-9 peuvent être présents en très petites quantités (voir rubrique 2).
Le vaccin, après avoir été agité doucement, est un liquide opalescent, incolore.
VAXIGRIP est une suspension injectable en seringue préremplie de 0,5 mL, avec aiguille attachée, avec aiguille séparée ou aiguille sécurisée séparée, ou sans aiguille, en boîte de 1 ou 10.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
SANOFI WINTHROP INDUSTRIE
82 AVENUE RASPAIL
94250 GENTILLY
Exploitant de l’autorisation de mise sur le marché
SANOFI WINTHROP INDUSTRIE
82 AVENUE RASPAIL
94250 GENTILLY
SANOFI WINTHROP INDUSTRIE
1541 AVENUE MARCEL MERIEUX
69280 MARCY L’ETOILE
OU
SANOFI WINTHROP INDUSTRIE
VOIE DE L’INSTITUT
PARC INDUSTRIEL D’INCARVILLE
B.P 101
27100 VAL DE REUIL
OU
SANOFI-AVENTIS ZRT
IMMEUBLE DC5
CAMPONA UTCA 1.
1225, BUDAPEST XXII
HONGRIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
La dernière information approuvée sur ce produit est disponible < en scannant le QR code sur l'emballage extérieur à l’aide d’un appareil mobile ou > sur l'URL suivante : https://vaxigrip-nh.info.sanofi >
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Comme pour tous les vaccins injectables, il est recommandé de disposer d'un traitement médical approprié et de surveiller le sujet dans l'éventualité, d'une réaction anaphylactique suite à l'administration du vaccin.
Le vaccin doit être amené à température ambiante avant utilisation.
Agiter avant emploi. Inspecter visuellement avant d’administrer.
Le vaccin ne doit pas être utilisé si des particules étrangères sont présentes dans la suspension.
Il ne doit pas être mélangé avec d’autres médicaments dans la même seringue.
Ce vaccin ne doit pas être injecté directement dans un vaisseau sanguin.
Voir aussi la rubrique 3. Comment utiliser VAXIGRIP, suspension injectable en seringue préremplie ?
< Préparation et administration :
Instructions d’utilisation de l'aiguille sécurisée avec la seringue préremplie Luer Lock :
|
Figure A : Aiguille sécurisée (à l’intérieur de la coque) |
Figure B : Composants de l’aiguille sécurisée (préparée pour l’utilisation) |
|
|
|
|
Étape 1 : Pour fixer l’aiguille à la seringue, retirer le capuchon pour exposer l’embase de l'aiguille et visser doucement l’aiguille à l’adaptateur Luer lock jusqu’à sentir une légère résistance. |
|
|
Étape 2 : Retirer la coque de l’aiguille sécurisée en tirant tout droit. L’aiguille est recouverte par le bouclier de sécurité et le protège-aiguille. |
|
|
Étape 3 : A : soulever le boculier de sécurité en l’écartant de l’aiguille et en le poussant vers le corps de la seringue selon l’angle indiqué. B : Retirez le protège-aiguille en tirant tout droit. |
|
|
Étape 4 : Une fois l'injection terminée, verrouiller (activer) avec une seule main le bouclier de sécurité à l'aide de l'une des trois (3) techniques illustrées : activation à l’aide d’une surface, du pouce ou de l’index. Remarque : L'activation est vérifiée par un « clic » sonore et/ou tactile. |
|
|
Étape 5: Inspecter visuellement l’activation du bouclier de sécurité. Le bouclier de sécurité doit être entièrement verrouillé (activé), comme indiqué sur l’image C. |
|
|
L’image D indique que le bouclier de sécurité n'est PAS complètement verrouillé (non activé). |
|
|
Attention : Ne pas essayer de déverrouiller (désactiver) le dispositif de sécurité en forçant l'aiguille à sortir du bouclier de sécurité. > |
|
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.