Dernière mise à jour le 08/01/2026
EMYLIF 50 mg, film orodispersible
Indications thérapeutiques
La substance active contenue dans EMYLIF est le riluzole qui agit sur le système nerveux.
EMYLIF est prescrit chez les patients adultes atteints de sclérose latérale amyotrophique (SLA).
La SLA est une forme de maladie du motoneurone qui affecte les cellules nerveuses responsables de l’envoi d’instructions aux muscles, ce qui entraîne une faiblesse musculaire, une atrophie musculaire et une paralysie.
La destruction des cellules nerveuses dans les maladies du motoneurone peut être provoquée par une quantité trop importante de glutamate (un messager chimique) dans le cerveau et la moelle épinière. EMYLIF bloque la libération de glutamate, ce qui peut contribuer à empêcher la destruction des cellules nerveuses.
Veuillez consulter votre médecin pour des informations complémentaires sur la SLA et les raisons pour lesquelles ce médicament vous a été prescrit.
Présentations
> 56 sachet(s) complexe polyester aluminium de 1 film
Code CIP : 34009 302 643 5 5
Déclaration de commercialisation : 20/09/2023
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 138,33 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 139,35 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 18/01/2023 | Inscription (CT) | Le service médical rendu par EMYLIF (riluzole) est important dans l’indication de l’AMM, au même titre que les autres spécialités à base de riluzole. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 18/01/2023 | Inscription (CT) | Cette spécialité est un hybride qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité de référence RILUTEK 50 mg, comprimé pelliculé (rilu-zole) et à ses génériques déjà inscrits. |
Autres informations
- Titulaire de l'autorisation : ZAMBON SPA
- Conditions de prescription et de délivrance :
- liste I
- médicament nécessitant une surveillance particulière pendant le traitement
- prescription initiale annuelle réservée à certains spécialistes
- prescription réservée aux spécialistes et services NEUROLOGIE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 948 187 4
ANSM - Mis à jour le : 04/06/2025
EMYLIF 50 mg, film orodispersible
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Riluzole............................................................................................................................. 50,00 mg
Pour 1 film orodispersible.
Excipients à effet notoire : fructose (2 mg par film orodispersible), jaune orangé S (E110)
Pour la liste complète des excipients, voir rubrique 6.1.
Film orodispersible.
Film fin orange, de forme rectangulaire (32 mm x 22 mm), à dissolution orale, portant la mention « R50 » imprimée en blanc sur une face.
4.1. Indications thérapeutiques
EMYLIF est indiqué dans le traitement de la sclérose latérale amyotrophique (SLA) chez les adultes (voir rubrique 5.1).
EMYLIF n’a pas démontré d’efficacité dans les stades avancés de la SLA.
4.2. Posologie et mode d'administration
Le traitement par riluzole ne doit être instauré que par des praticiens spécialistes expérimentés dans la prise en charge des maladies du motoneurone.
Posologie
Populations à risque
Insuffisants rénaux
L’usage du riluzole n’est pas recommandé chez les patients insuffisants rénaux en raison de l’absence d’étude à dose répétée réalisée chez ce type de patients (voir rubrique 4.4).
Personnes âgées
Compte tenu des données pharmacocinétiques, il n’y a pas de recommandation particulière pour l’utilisation du riluzole dans cette population.
Insuffisants hépatiques
Voir rubriques 4.3, 4.4 et 5.2.
Population pédiatrique
La sécurité d’emploi et l’efficacité d’EMYLIF pour le traitement de la SLA dans la population pédiatrique n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
EMYLIF est destiné à une administration par voie orale.
· Les mains doivent être propres et sèches avant toute manipulation d’EMYLIF afin que le film orodispersible ne colle pas aux doigts.
· Plier le sachet en aluminium le long de la ligne continue située sur sa partie supérieure.
· Tout en maintenant le haut du sachet plié sur la ligne continue, déchiré au niveau de la fente le long de la flèche sur le côté du sachet pour l’ouvrir.
· Retirer le film orodispersible EMYLIF du sachet en aluminium. Chaque sachet contient une dose d’EMYLIF.
· Le film EMYLIF ne doit pas être plié.
· Placer le film EMYLIF sur le dessus de la langue. Le film adhérera à la langue et commencera à se dissoudre.
· Une fois la bouche fermée, la salive est normalement avalée au fur et à mesure qu’EMYLIF se dissout.
· EMYLIF ne doit pas être pris avec des liquides, mâché ou recraché.
· Le patient ne doit pas parler pendant la dissolution d’EMYLIF.
· Après l’administration d’EMYLIF, les mains doivent être lavées.
· Après l’administration d’EMYLIF, il est recommandé de faire preuve de prudence en cas de prise de nourriture (voir rubrique 4.4).
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Maladie hépatique ou taux de transaminases supérieur à 3 fois la limite supérieure de la normale avant la mise en route du traitement.
· Femme enceinte ou allaitante.
4.4. Mises en garde spéciales et précautions d'emploi
Insuffisance hépatique
Le riluzole doit être utilisé avec prudence chez les patients ayant des antécédents de dysfonctionnement hépatique, ou chez les patients présentant une légère élévation des transaminases sériques (ALAT/SGPT; ASAT/SGOT jusqu’à 3 fois la limite supérieure de la normale), de la bilirubine et/ou des gamma-glutamyl transférases (GGT). Une perturbation de plusieurs paramètres hépatiques (en particulier taux de bilirubine élevé) doit faire déconseiller l’utilisation de riluzole (voir rubrique 4.8).
Du fait du risque d’hépatite, le taux de transaminases sériques, dont les ALAT (SGPT), doit être contrôlé avant la mise sous traitement et pendant la durée du traitement par le riluzole. Les ALAT doivent être dosées tous les mois pendant les 3 premiers mois, puis tous les 3 mois pendant la première année et périodiquement ensuite. Ce suivi devra être plus fréquent chez les patients dont le taux d’ALAT s'élève sous traitement.
Le traitement par le riluzole devra être interrompu si les taux d’ALAT augmentent jusqu’à 5 fois la limite supérieure de la normale ou au-delà. Les effets d'une réduction posologique ou d'une réadministration ultérieure chez les patients dont le taux de ALAT a atteint ou dépassé 5 fois la limite supérieure de la normale, ne sont pas connus.
Toute réadministration du riluzole chez ces patients est donc déconseillée.
Neutropénie
Les patients doivent être avertis qu’il convient d’informer leur médecin de toute maladie fébrile. La survenue d’une maladie fébrile doit entraîner un contrôle de la numération formule sanguine et une interruption du traitement par riluzole en cas de neutropénie (voir rubrique 4.8).
Pneumopathie interstitielle
Des cas de pneumopathie interstitielle, dont certains sévères, ont été rapportés chez des patients traités par le riluzole (voir rubrique 4.8). Une radiographie pulmonaire doit être effectuée en cas d'apparition de symptômes respiratoires tels qu’une toux sèche et/ou une dyspnée, et l'administration du riluzole doit être arrêtée immédiatement si des aspects suggèrent une pneumopathie interstitielle (opacités pulmonaires diffuses bilatérales par exemple). Dans la majorité des cas rapportés, les symptômes ont disparu après l’arrêt du médicament et un traitement symptomatique.
Insuffisance rénale
Aucune étude à doses répétées n’a été réalisée chez les patients ayant une insuffisance rénale (voir rubrique 4.2).
Hypoesthésie buccale
Dans une étude à dose unique menée chez des sujets sains, une hypoesthésie buccale transitoire légère a été rapportée. Le délai médian d’apparition était de 1 minute après l’administration et la durée médiane de 40 minutes. En cas de survenue d’une hypoesthésie buccale, la prudence est recommandée jusqu’à l’amélioration des symptômes en cas de prise de nourriture (voir rubrique 4.2).
La sécurité de déglutition d’EMYLIF n’a pas été évaluée chez les patients présentant une sialorrhée ou une dysphagie grave. La prudence s’impose lors de l’administration d’EMYLIF chez ces patients.
Fructose : ce médicament contient 2 mg de fructose par film orodispersible. Le fructose peut abîmer les dents.
Ce médicament contient du Jaune orangé S (E110), qui peut provoquer des réactions allergiques.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Il n'y a pas eu d'études cliniques évaluant les interactions du riluzole avec d'autres médicaments.
Des études in vitro utilisant des préparations à base de microsomes hépatiques humains suggèrent que le CYP 1A2 est la principale isoenzyme impliquée dans le métabolisme oxydatif initial du riluzole. Les inhibiteurs du CYP 1A2 (dont la caféine, le diclofénac, le diazépam, la nicergoline, la clomipramine, l’imipramine, la fluvoxamine, la phénacétine, la théophylline, l’amitriptyline et les quinolones) peuvent potentiellement diminuer le taux d’élimination du riluzole, tandis que les inducteurs du CYP 1A2 (dont la fumée de cigarette, la nourriture fumée au charbon de bois, la rifampicine et l’oméprazole) pourraient augmenter le taux d’élimination du riluzole.
4.6. Fertilité, grossesse et allaitement
Grossesse
EMYLIF est contre-indiqué en cas de grossesse (voir rubriques 4.3 et 5.3).
Il n’y a pas d’expérience clinique d’utilisation du riluzole chez la femme enceinte.
Allaitement
EMYLIF est contre-indiqué chez la femme qui allaite (voir rubriques 4.3 et 5.3).
Le passage du riluzole dans le lait maternel humain n'est pas connu.
Fertilité
Les études de fertilité chez le rat ont mis en évidence une légère altération des fonctions de reproduction et de la fertilité aux doses de 15 mg/kg/jour (supérieures à la dose thérapeutique), ceci étant probablement dû aux effets de sédation et de léthargie.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les patients doivent être informés du risque d’étourdissements ou de vertiges ; la conduite de véhicule et l’utilisation de machines leurs seront déconseillés en cas de survenue de ces effets.
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
Résumé du profil de sécurité
Dans les essais cliniques de phase III conduits chez les patients atteints de SLA traités par riluzole, les effets indésirables les plus fréquemment rapportés ont été l’asthénie, les nausées et les anomalies des paramètres biologiques hépatiques.
Tableau récapitulatif des effets indésirables
Les effets indésirables sont indiqués ci-dessous et classés par fréquence selon les conventions suivantes : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
|
Très fréquent |
Fréquent |
Peu fréquent |
Fréquence indéterminée |
|
Affections hématologiques et du système lymphatique |
|
|
Anémie |
Neutropénie sévère (voir rubrique 4.4) |
|
Affections du système immunitaire |
|
|
Réaction anaphylactique, angioœdème |
|
|
Affections du système nerveux |
Hypoesthésie buccale |
Céphalées, étourdissements, paresthésie buccale et somnolence |
|
|
|
Affections cardiaques |
|
Tachycardie |
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Pneumopathie interstitielle (voir rubrique 4.4) |
|
|
Affections gastro-intestinales |
Nausées |
Diarrhée, douleur abdominale, vomissements |
Pancréatite |
|
|
Affections de la peau et du tissu sous-cutané |
|
|
|
Rash |
|
Affections hépatobiliaires |
Anomalies des paramètres biologiques hépatiques |
|
|
Hépatite |
|
Troubles généraux et anomalies au site d’administration |
Asthénie |
Douleurs |
|
|
Description des effets indésirables
Affections hépatobiliaires
L’élévation des alanines aminotransférases apparaissait généralement dans les trois premiers mois du traitement par riluzole. Elle a été habituellement transitoire et leur niveau est revenu à une valeur inférieure à 2 fois la limite supérieure de la normale après 2 à 6 mois malgré la poursuite du traitement. Ces élévations peuvent être associées à un ictère. Chez les patients des études cliniques (n=20) présentant une élévation des ALAT supérieure à 5 fois la limite supérieure de la normale (LSN), le traitement a été interrompu et leur niveau est revenu à une valeur inférieure à 2 fois la LSN dans les 2 à 4 mois dans la plupart des cas (voir rubrique 4.4).
Les données d’études indiquent que les patients asiatiques peuvent être plus susceptibles de présenter des anomalies des tests biologiques hépatiques - 3,2% (194/5995) des patients asiatiques et 1,8% (100/5641) des patients caucasiens.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Des cas isolés de symptômes psychiatriques et neurologiques, encéphalopathie toxique aiguë s’accompagnant d’un état stuporeux, coma et méthémoglobinémie ont été observés.
En cas de surdosage, le traitement est symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : AUTRES MEDICAMENTS DU SYSTEME NERVEUX, code ATC : N07XX02
Mécanisme d’action
Bien que la pathogenèse de la SLA ne soit pas totalement élucidée, il semble que le glutamate (principal neurotransmetteur excitateur du système nerveux central) joue un rôle dans la mort cellulaire liée à la maladie.
Le riluzole agirait par inhibition de processus glutamatergiques. Le mécanisme d’action est incertain.
Efficacité et sécurité clinique
Dans un essai randomisé, 155 patients ont reçu soit du riluzole à la dose de 100 mg/jour (50 mg deux fois par jour), soit du placebo et ont été suivis pendant une durée de 12 à 21 mois. La survie, définie par : patient vivant, non intubé pour ventilation mécanique assistée et non trachéotomisé, a été significativement augmentée chez les patients recevant le riluzole comparativement au groupe placebo. La médiane de survie a été de 17,7 mois pour les patients recevant le riluzole contre 14,9 mois pour le groupe placebo.
Dans une étude dose-réponse, 959 patients atteints de SLA ont été randomisés en quatre groupes : riluzole 50, 100 ou 200 mg/jour et placebo, et ont été suivis pendant 18 mois. Chez les patients traités par 100 mg/jour de riluzole, la survie a été significativement augmentée par rapport à celle des patients recevant le placebo. L'effet du riluzole à la dose de 50 mg/jour n'a pas été statistiquement différent du placebo, l’effet du riluzole à la dose de 200 mg/jour a été comparable à l’effet observé avec 100 mg/jour. La médiane de survie a été d’environ 16,5 mois pour les patients recevant le riluzole 100 mg/jour contre 13,5 mois pour le groupe placebo.
Dans un essai en groupe parallèle, réalisé en vue d’évaluer l’efficacité et la tolérance du riluzole chez des malades à un stade avancé de la maladie, la durée de survie et les fonctions motrices n’ont pas été significativement différentes dans le groupe recevant le riluzole et dans le groupe placebo. Dans cette étude, la majorité des patients avaient une capacité vitale inférieure à 60 %.
Dans un essai randomisé en double-aveugle contre placebo, réalisé en vue d'évaluer l'efficacité et la tolérance du riluzole chez des patients japonais, 204 malades ont reçu soit du riluzole à la dose de 100 mg/ jour (50 mg deux fois par jour), soit du placebo et ont été suivis pendant 18 mois. Dans cette étude, l'efficacité a été évaluée sur l'incapacité à se déplacer seul, sur l'atteinte fonctionnelle des membres supérieurs, la trachéotomie, le recours à la ventilation assistée, l'alimentation par sonde gastrique ou la mort. La survie sans trachéotomie dans le groupe de patients traités par riluzole n'a pas été significativement différente de celle du groupe placebo. Cependant, la puissance de cette étude à détecter des différences entre les groupes de traitements était faible. Une méta-analyse incluant cette étude et celles décrites plus haut montre un effet du riluzole par rapport au placebo moins marqué sur la survie, mais les différences sont toujours statistiquement significatives.
5.2. Propriétés pharmacocinétiques
Les propriétés pharmacocinétiques du riluzole ont été évaluées après administration orale d'une dose unique allant de 25 à 300 mg et après administration orale réitérée de doses allant de 25 mg à 100 mg deux fois par jour chez des volontaires sains de sexe masculin. Les concentrations plasmatiques augmentent de façon linéaire avec la dose et le profil cinétique est indépendant de la dose. Après administration répétée (50 mg de riluzole 2 fois par jour pendant 10 jours), la concentration plasmatique du riluzole inchangé double et l'état d’équilibre est atteint en moins de 5 jours.
Absorption
Le riluzole est rapidement absorbé après administration orale et les concentrations plasmatiques maximales sont atteintes en 60 à 90 minutes (Cmax = 173 ± 72 (DS) ng/ml). Environ 90 % de la dose sont absorbés. La biodisponibilité absolue du riluzole est de 60 % ± 18 %.
La prise de nourriture riche en graisses réduit la vitesse et le niveau d'absorption du riluzole (diminution de la Cmax de 44 % et de l'aire sous la courbe de 17 %).
Une étude de bioéquivalence a montré que l'exposition au riluzole en comprimés à 50 mg était équivalente à celle du riluzole en film orodispersible à 50 mg (Rapport Cmax : 117,05 % ; IC 90 % : 110,43 - 124,06 % ; Rapport ASC0-t : 111,82 ; IC 90 % : 108,25 - 115,50 ; Rapport ASC0-inf : 111,83 ; IC 90 % : 108,19 - 115,59).
Distribution
Le riluzole se distribue largement dans l’ensemble de l’organisme et traverse la barrière hémato-encéphalique. Son volume de distribution est d’environ 245 ± 69 L (3,4 L/kg). La liaison aux protéines plasmatiques est d’environ 97 % ; le riluzole étant lié principalement à l’albumine sérique et aux lipoprotéines.
Biotransformation
Le riluzole sous forme inchangée est le composant principal retrouvé dans le plasma. Il est fortement métabolisé par le cytochrome P 450 puis subit une glucuronidation. Des études in vitro sur préparations de cellules de foie humain ont montré que le cytochrome P 450 1A2 est la principale isoenzyme impliquée dans le métabolisme du riluzole. Les métabolites identifiés dans les urines sont trois dérivés phénoliques et un dérivé uréido. Du riluzole inchangé est également retrouvé.
La voie métabolique principale du riluzole est une oxydation initiale par le cytochrome P 450 1A2, donnant le N-hydroxy-riluzole (RPR112512), principal métabolite actif du riluzole. Ce métabolite est rapidement glucuronoconjugué en dérivés O- et N- glucuronides.
Elimination
La demi-vie d'élimination est de 9 à 15 heures. Le riluzole est éliminé principalement dans les urines.
L'excrétion urinaire totale représente environ 90 % de la dose. Les glucuronides représentent plus de 85 % des métabolites retrouvés dans les urines. Seulement 2 % d’une dose de riluzole sont retrouvés sous forme inchangée dans les urines.
Populations à risque
Insuffisants rénaux
Après administration orale d’une dose unique de 50 mg de riluzole, il n’y a pas de différence significative entre les paramètres cinétiques obtenus chez des patients insuffisants rénaux modérés ou sévères (clairance de la créatinine comprise entre 10 et 50 ml.min-1) et des volontaires sains.
Personnes âgées
Les paramètres pharmacocinétiques de riluzole ne sont pas modifiés après administration répétée (50 mg de riluzole deux fois par jour pendant 4 jours et demi) chez les personnes âgées (> 70 ans).
Insuffisants hépatiques
Après administration orale d'une dose unique de 50 mg de riluzole, l’ASC de riluzole est multipliée environ par 1,7 chez les patients insuffisants hépatiques chroniques légers et environ par 3 chez les patients insuffisants hépatiques chroniques modérés.
Origine ethnique
Une étude clinique a été conduite chez 16 adultes volontaires sains, de sexe masculin, d’origine japonaise et caucasienne afin d’évaluer la pharmacocinétique du riluzole et de son métabolite N- hydroxyriluzole après administration orale bi-quotidienne répétée pendant 8 jours. Le groupe d’origine japonaise a montré une plus faible exposition au riluzole (Cmax 0,85 [IC 90% 0,68-1,08] et une ASCinf 0,88 [IC 90% 0,69-1,13]) que le groupe caucasien et une exposition similaire au métabolite. La signification clinique de ces résultats demeure inconnue.
5.3. Données de sécurité préclinique
Aucun potentiel carcinogène n’a été démontré chez le rat et la souris avec le riluzole.
Les études standards de génotoxicité réalisées avec le riluzole ont été négatives. Deux études in vitro réalisées avec le principal métabolite actif du riluzole ont donné des résultats positifs. Sept autres études plus approfondies réalisées in vitro ou in vivo n’ont pas mis en évidence de potentiel génotoxique pour ce métabolite. Sur la base de ces données, et en tenant compte des études négatives sur la carcinogénicité du riluzole chez la souris et le rat, l’effet génotoxique de ce métabolite est considéré comme dénué de signification clinique chez l’homme.
Des réductions des paramètres de la lignée rouge et/ou des altérations des paramètres biologiques hépatiques ont été notées de façon inconstante dans les études de toxicité subaiguë et chronique effectuées chez le rat et le singe. Chez le chien, une anémie hémolytique a été observée.
Dans une étude de toxicité conduite chez le rat, une absence de corps jaune ovarien a été notée avec une incidence plus grande dans le groupe traité que dans le groupe témoin. Cette observation isolée n’a été enregistrée dans aucune autre étude ou espèce.
Ces données ont toutes été observées pour des doses 2 à 10 fois supérieures à la dose thérapeutique de 100 mg/jour.
Chez la rate gestante, un passage du 14C-riluzole à travers la barrière placentaire vers le fœtus a été mis en évidence. Chez le rat, le riluzole entraîne une diminution du taux de grossesses et du nombre d'implantations pour des niveaux d’exposition systémique au moins 2 fois supérieurs à l’exposition systémique à la dose thérapeutique chez l’homme. Aucune malformation n’a été observée au cours des études de reproduction chez l’animal.
Chez la rate allaitante, le 14C-riluzole passe dans le lait maternel.
Film orodispersible :
Encre blanche :
Eau purifiée, dioxyde de titane (E171), propylèneglycol (E1520), hypromellose (E464), alcool isopropylique, alcool SDA 3A (éthanol et méthanol).
Présence de traces de l’antioxydant butylhydroxytoluène (BHT, E321).
Sans objet.
18 mois.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30°C.
6.5. Nature et contenu de l'emballage extérieur
Le conditionnement primaire est un sachet, qui sera ouvert et enlevé avant l’application. Le sachet est composé de deux couches identiques d’un complexe polyester/aluminium.
Chaque boîte contient 14, 28, 56, 98, 112, 140 sachets.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
ZAMBON S.P.A
VIA LILLO DEL DUCA 10
20091 BRESSO (MI)
ITALIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 643 5 5 : film orodispersible en sachet (complexe Polyester/Aluminium). Boîte de 56.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I
Médicament nécessitant une surveillance particulière pendant le traitement.
Médicament soumis à prescription initiale annuelle réservée à certains spécialistes.
Prescription réservée aux spécialistes et services Neurologie.
ANSM - Mis à jour le : 04/06/2025
EMYLIF 50 mg, film orodispersible
Riluzole
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que EMYLIF 50 mg, film orodispersible et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre EMYLIF 50 mg, film orodispersible ?
3. Comment prendre EMYLIF 50 mg, film orodispersible ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver EMYLIF 50 mg, film orodispersible ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE EMYLIF 50 mg, film orodispersible ET DANS QUELS CAS EST-IL UTILISE ?
La substance active contenue dans EMYLIF est le riluzole qui agit sur le système nerveux.
EMYLIF est prescrit chez les patients adultes atteints de sclérose latérale amyotrophique (SLA).
La SLA est une forme de maladie du motoneurone qui affecte les cellules nerveuses responsables de l’envoi d’instructions aux muscles, ce qui entraîne une faiblesse musculaire, une atrophie musculaire et une paralysie.
La destruction des cellules nerveuses dans les maladies du motoneurone peut être provoquée par une quantité trop importante de glutamate (un messager chimique) dans le cerveau et la moelle épinière. EMYLIF bloque la libération de glutamate, ce qui peut contribuer à empêcher la destruction des cellules nerveuses.
Veuillez consulter votre médecin pour des informations complémentaires sur la SLA et les raisons pour lesquelles ce médicament vous a été prescrit.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE EMYLIF 50 mg, film orodispersible ?
Ne prenez jamais EMYLIF 50 mg, film orodispersible :
· Si vous êtes allergique au riluzole ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· Si vous avez une maladie du foie ou des taux sanguins augmentés de certaines enzymes hépatiques (transaminases),
· Si vous êtes enceinte ou que vous allaitez.
Avertissements et précautions
Adressez-vous à votre médecin avant de prendre EMYLIF.
· Si vous avez une maladie du foie : jaunissement de la peau ou du blanc des yeux (jaunisse), démangeaisons généralisées, nausées, vomissements,
· Si vous avez une maladie des reins,
· Si vous avez de la fièvre, ceci peut être dû à une diminution du nombre des globules blancs qui peut augmenter le risque d’infection,
· Si vous souffrez de salivation excessive ou de graves difficultés de déglutition.
Si l’une des situations citées ci-dessus s’applique à votre cas ou si vous avez des doutes, prévenez votre médecin qui décidera de ce qu’il faut faire.
Enfants et adolescents
Si vous êtes âgés de moins de 18 ans, l’utilisation d’EMYLIF n’est pas recommandée, car il n’y a pas d’information disponible dans cette population.
Autres médicaments et EMYLIF 50 mg, film orodispersible
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
EMYLIF 50 mg, film orodispersible avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Vous ne DEVEZ PAS prendre EMYLIF si vous êtes enceinte ou pensez l’être ou si vous allaitez.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Ne conduisez pas ou n’utilisez pas de machines si vous avez des vertiges ou si vous vous sentez étourdis après avoir pris ce médicament.
EMYLIF 50 mg, film orodispersible contient du fructose et du jaune orangé S (E110)
Ce médicament contient 2 mg de fructose par film orodispersible. Le fructose peut abîmer les dents.
Ce médicament contient du jaune orangé S (E110), qui peut provoquer des réactions allergiques.
3. COMMENT PRENDRE EMYLIF 50 mg, film orodispersible ?
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
La dose recommandée est de un film orodispersible, deux fois par jour.
Le film orodispersible doit être pris par voie orale, toutes les 12 heures, tous les jours au même moment de la journée (par exemple le matin et le soir).
Après avoir pris ce médicament, vous pouvez ressentir une réduction de la sensibilité buccale après 1 minute. Faites attention en prenant de la nourriture jusqu’à ce que cette sensation disparaisse, ce qui prend généralement environ 40 minutes.
Mode d’administration :
Les instructions concernant la prise par voie orale sont détaillées ci-dessous.
|
Étape 1. Avant de prendre EMYLIF |
|
|
· Assurez-vous que vos mains sont propres et sèches avant de manipuler EMYLIF afin que le film ne colle pas à vos doigts. |
|
|
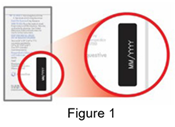
· Vérifiez la date de péremption imprimée sur le sachet en aluminium avant son utilisation comme illustré sur la Figure 1. Ne pas utiliser EMYLIF après sa date de péremption. |
|
|
Étape 2. Ouvrez le sachet |
|
|
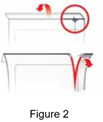
· Pliez le sachet en aluminium le long de la ligne continue située sur le haut du sachet, comme illustré à la Figure 2. |
|
|
· Tout en maintenant le haut du sachet plié sur la ligne continue, déchirez la fente le long de la flèche sur le côté du sachet pour l’ouvrir. |
|
|
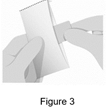
Étape 3. Retirez le film |
|
|
· Retirez le film EMYLIF du sachet en aluminium. Chaque sachet contient une dose d’EMYLIF. |
|
|
· Ne pas plier le film EMYLIF. |
|
|
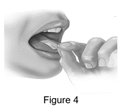
Étape 4. Placez le film sur la langue |
|
|
· Placez le film EMYLIF sur le dessus de la langue comme illustré sur la Figure 4. Le film adhérera à la langue et commencera à se dissoudre. |
|
|
Étape 5. Fermez la bouche et avalez votre salive normalement |
|
|
· Fermez la bouche comme indiqué sur la Figure 5 et avalez votre salive normalement ; EMYLIF se dissout en 3 minutes. |
|
|
· Ne pas prendre EMYLIF avec des liquides. |
|
|
· Ne pas mâcher, cracher ou parler pendant la dissolution d’EMYLIF. |
|
|
Étape 6. Après l’administration d’EMYLIF, les mains doivent être lavées. |
|
Si vous avez pris plus de EMYLIF 50 mg, film orodispersible que vous n’auriez dû :
Si vous avez pris trop de film orodispersible, contactez immédiatement votre médecin ou le service d’urgence de l’hôpital le plus proche.
Si vous oubliez de prendre EMYLIF 50 mg, film orodispersible :
Si vous oubliez de prendre une dose, ne prenez pas la dose oubliée et prenez la dose suivante au moment habituel.
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
Si vous arrêtez de prendre EMYLIF 50 mg, film orodispersible :
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
IMPORTANT
Informez immédiatement votre médecin
· Si vous avez de la fièvre (augmentation de la température corporelle) : EMYLIF peut provoquer une diminution du nombre des globules blancs. Votre médecin pourra demander un examen de sang pour vérifier le nombre de globules blancs, des cellules importantes pour combattre les infections.
· Si vous manifestez l’un des symptômes suivants : jaunissement de la peau ou du blanc des yeux (jaunisse), démangeaisons généralisées, nausées, vomissements. Ces signes peuvent indiquer une maladie du foie (hépatite). Votre médecin peut devoir demander des examens sanguins réguliers pendant le traitement avec EMYLIF afin d'éviter l’apparition de ces problèmes.
· Si vous présentez de la toux ou des difficultés respiratoires, cela peut indiquer une maladie pulmonaire (appelée pneumonie interstitielle).
Autres effets indésirables
Effets indésirables très fréquents d’EMYLIF (pouvant affecter plus de 1 personne sur 10) :
· fatigue
· nausées
· augmentation des taux sanguins de certaines enzymes du foie (transaminases)
· réduction de la sensibilité buccale
Effets secondaires fréquents d’EMYLIF (pouvant affecter jusqu’à 1 personne sur 10) :
· étourdissements
· sensations d’engourdissement ou de picotement de la bouche
· vomissements
· somnolence
· augmentation du rythme cardiaque
· diarrhée
· maux de tête
· douleur abdominale
· douleurs
Effets secondaires peu fréquents d’EMYLIF (pouvant affecter jusqu’à 1 personne sur 100) :
· anémie
· réactions allergiques
· inflammation du pancréas (pancréatite)
Effets secondaires de fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Eruptions cutanées
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER EMYLIF 50 mg, film orodispersible?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le sachet et la boîte après l’abréviation « EXP ». La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 30°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient EMYLIF 50 mg, film orodispersible
· La substance active est :
Riluzole............................................................................................................................ 50 mg
Pour un film orodispersible
· Les autres composants sont :
Résine polacrilex, pullulane (E1204), xylitol (E967), hypromellose (E464), glycérol (E422), mono-oléate de glycérol, sucralose (E955), fructose, macrogol, arôme miel, gomme xanthane, arôme citron, jaune orangé S (E110), encre blanche (eau purifiée, dioxyde de titane (E171), propylèneglycol (E1520), hypromellose (E464), alcool isopropylique, éthanol et méthanol).
Traces de l’antioxydant butylhydroxytoluène (E321).
Qu’est-ce que EMYLIF 50 mg, film orodispersible et contenu de l’emballage extérieur
Film orodispersible :
Fin film orange, de forme rectangulaire (32 mm x 22 mm) à dissolution orale, portant la mention « R50 » imprimée en blanc sur une face.
EMYLIF est disponible en boîtes de 14, 28, 56, 98, 112, 140 films orodispersibles, à prendre par voie orale.
Chaque boîte contient 14, 28, 56, 98, 112, 140 sachets.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
ZAMBON S.P.A
VIA LILLO DEL DUCA 10
20091 BRESSO (MI)
ITALIE
Exploitant de l’autorisation de mise sur le marché
ZAMBON FRANCE S.A.
13 RUE RENE JACQUES
92138 ISSY-LES-MOULINEAUX CEDEX
ZAMBON S.P.A.
VIA DELLA CHIMICA, 9
36100 VICENZA
ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).