Dernière mise à jour le 13/10/2025
PROGIRON 25 mg, solution injectable en seringue préremplie
Indications thérapeutiques
Classe pharmacothérapeutique : Système génito-urinaire et hormones sexuelles ; Progestatifs ; Dérivés pregnène-4., Code ATC : G03DA04.
PROGIRON contient de la progestérone. La progestérone est une hormone sexuelle féminine naturellement présente dans le corps humain. Ce médicament agit sur la muqueuse utérine pour favoriser la grossesse et la mener à terme.
PROGIRON est indiqué chez les femmes souffrant de troubles liés à un déficit en progestérone dans le cadre d’un programme d’assistance médicale à la procréation (AMP) et qui ne peuvent utiliser ou tolérer les préparations vaginales.
Présentations
> 7 seringues préremplies en verre siliconé de 1,112 mL
Code CIP : 34009 302 774 1 6
Déclaration de commercialisation : 03/02/2025
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 01/08/2025
PROGIRON 25 mg, solution injectable en seringue préremplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque seringue préremplie (1,112 mL) contient 25 mg de progestérone (22,48 mg/mL).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en seringue préremplie.
Solution claire et incolore, essentiellement sans particules visibles.
La solution a une osmolalité d'environ 250 mosmol/kg et un pH compris entre 5 et 8.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Adultes
Une injection quotidienne de 25 mg à partir du jour de prélèvement des ovocytes, habituellement jusqu’à 12 semaines d’une grossesse confirmée.
PROGIRON étant indiqué uniquement chez les femmes en âge de procréer, il n’y a pas de recommandations posologiques chez l’enfant et chez la personne âgée.
PROGIRON est administré par voie sous-cutanée (25 mg) par la patiente elle-même après instruction ou par un professionnel de santé ou un médecin.
Populations particulières
Sujets âgés
Aucunes données cliniques n’ont été rapportées chez les patientes au-delà de 65 ans.
Patientes souffrant d’insuffisance rénale ou hépatique
Aucune étude sur l’utilisation de PROGIRON n’a été conduite chez les patientes souffrant d’insuffisance rénale ou hépatique.
Population pédiatrique
L’efficacité et la sécurité d’emploi de PROGIRON chez l'enfant de 0 à 18 ans n'ont pas été établies.
PROGIRON n’est pas indiqué chez l’enfant ou la personne âgée dans la supplémentation de la phase lutéale dans le cadre d’un programme d’assistance médicale à la procréation (AMP) chez la femme stérile.
Mode d’administration
Le traitement avec PROGIRON doit être instauré sous la surveillance d’un médecin ayant l’expérience du traitement de stérilité.
PROGIRON est administré par voie sous-cutanée.
Choisir une zone du corps appropriée (devant de la cuisse, bas du ventre), désinfecter la zone avec un coton, pincer fermement la peau entre ses doigts et enfoncer l’aiguille avec un angle de 45° à 90°. Le produit doit être injecté doucement pour éviter d’abîmer les tissus.
Chaque seringue préremplie est destinée à une injection à usage unique.
PROGIRON ne doit pas être utilisé dans les cas suivants :
· Hypersensibilité à la progestérone ou à l’un des excipients mentionnés à la rubrique 6.1.
· Saignement vaginal non diagnostiqué.
· Avortement manqué ou grossesse extra-utérine
· Dysfonctionnement ou maladies hépatiques sévères.
· Cancer connu ou suspecté du sein ou de l’appareil génital.
· Accident tromboembolique artériel ou veineux, ou thrombophlébite sévère, en cours ou antécédents.
· Porphyrie.
· Antécédent de jaunisse idiopathique, prurit sévère ou pemphigoïde gravidique pendant la grossesse.
4.4. Mises en garde spéciales et précautions d'emploi
PROGIRON doit être arrêté en cas de survenue de l’une des pathologies suivantes : infarctus du myocarde, troubles cérébrovasculaires, thromboembolie artérielle ou veineuse, thrombophlébite, ou thrombose rétinienne.
Des précautions doivent être prises chez les patientes présentant des troubles hépatiques légers à modérés.
La prudence est recommandée chez les patientes présentant un dysfonctionnement rénal modéré à sévère, car une accumulation de cyclodextrines peut se produire.
Les patientes ayant souffert de dépression doivent être suivies étroitement. La suspension du traitement doit être envisagée si les symptômes s’aggravent.
La progestérone pouvant provoquer un certain degré de rétention d’eau, les pathologies qui pourraient être affectées par ce phénomène (par exemple, l’épilepsie, la migraine, l’asthme, les troubles cardiaques ou rénaux) nécessitent une surveillance étroite.
Une diminution de la sensibilité à l’insuline et par conséquent de la tolérance au glucose a été observée chez un petit nombre de patients prenant des associations estroprogestatives. Le mécanisme de cette diminution n’est pas connu. Pour cette raison, les patients diabétiques doivent être étroitement surveillés au cours d’un traitement progestatif (voir rubrique 4.5).
L’utilisation de stéroïdes sexuels peut également accroître le risque de lésions vasculaires au niveau de la rétine. Pour prévenir ces complications, la prudence est recommandée chez les patientes de plus de 35 ans, les fumeuses et chez celles ayant des facteurs de risque d’athérosclérose. L’utilisation doit être arrêtée en cas d’accidents ischémiques transitoires, d’apparition brutale de céphalées sévères ou de troubles de la vision liés à un œdème papillaire ou une hémorragie de la rétine.
Un arrêt brutal de la prise de progestérone peut entraîner anxiété, humeur maussade, et une sensibilité accrue aux crises d’épilepsie.
Avant de commencer un traitement avec PROGIRON, les causes de l’infertilité ou des complications survenant pendant la grossesse doivent avoir été évaluées par un médecin pour la patiente et son partenaire.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Certains médicaments connus pour leur effet inducteur du cytochrome P450-3A4 hépatique (par exemple rifampicine, carbamazépine, griséofulvine, phénobarbital, phénytoïne ou millepertuis (Hypericum perforatum, produit à base de plantes) peuvent augmenter l’élimination de la progestérone et ainsi diminuer sa biodisponibilité.
Par opposition, le kétoconazole et d’autres inhibiteurs du cytochrome P450-3A4 peuvent diminuer l’élimination de la progestérone et ainsi augmenter sa biodisponibilité.
La progestérone pouvant perturber le contrôle du diabète, un ajustement de la posologie du traitement antidiabétique peut être nécessaire (voir rubrique 4.4).
Les progestatifs peuvent inhiber le métabolisme de la ciclosporine, entraînant une élévation des concentrations plasmatiques de la ciclosporine et un risque de toxicité.
L’effet de produits injectables concomitants sur l’exposition à la progestérone par PROGIRON n’a pas été évalué. L’utilisation concomitante avec d’autres médicaments n’est pas recommandée.
4.6. Fertilité, grossesse et allaitement
Grossesse
PROGIRON est indiqué dans la supplémentation de la phase lutéale dans le cadre d’un programme d’assistance médicale à la procréation (AMP) chez la femme stérile.
Il existe des données limitées et non concluantes sur le risque d’anomalies congénitales, incluant les anomalies génitales chez les enfants de sexe masculin ou féminin suite à une exposition intra-utérine pendant la grossesse. Les taux d’anomalies congénitales, avortements spontanés et grossesses extra-utérines observés pendant l’étude clinique ont été comparables au taux d’évènements attendus dans la population générale, cependant l’exposition totale était trop faible pour que l’on puisse en tirer des conclusions.
La progestérone est excrétée dans le lait maternel et PROGIRON ne doit pas être administré pendant l’allaitement.
Fertilité
PROGIRON est indiqué dans le traitement de certaines formes de stérilité (voir détails en rubrique 4.1).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables rapportés dans les études cliniques conduites avec PROGIRON sont des réactions au site d’administration, troubles vulvo-vaginaux et au niveau des seins. Le tableau ci-dessous classe les principaux effets indésirables chez les femmes traitées par PROGIRON dans l’étude clinique pivot. Les données sont présentées par classe des systèmes d’organe (MedDRA) et fréquence.
|
Classe des systèmes d’organe (MedDRA) |
Très fréquent (≥ 1/10) |
Fréquent (de ≥ 1/100 à < 1/10) |
Peu fréquent (de ≥ 1/1000 à < 1/100) |
|
Affections psychiatriques |
|
|
Changements d’humeur |
|
Affections du système nerveux |
|
Céphalées |
Vertiges, Somnolence |
|
Affections gastro-intestinales |
|
Distension abdominale Douleurs abdominales Nausées Vomissements Constipation |
Troubles gastro-intestinaux |
|
Affections de la peau et du tissu sous-cutané |
|
|
Prurit Eruption cutanée |
|
Affections des organes de reproduction et du sein |
Spasme utérin Hémorragie vaginale |
Tensions mammaires Douleurs mammaires Perte vaginale Prurit vulvo-vaginal Gêne vulvo-vaginale Inflammation vulvo-vaginale Syndrome d’hyperstimulation ovarienne (SHO) |
Troubles mammaires |
|
Troubles généraux et anomalies au site d’administration |
Réaction locale au point d’injection* |
Hématome au point d’injection Induration au point d’injection Fatigue |
Sensation de chaleur, Malaise Douleur |
*Réactions locales au point d’injection telles qu’irritation, douleur, prurit et gonflement.
Effets liés à la classe
Les troubles suivants, bien que non reportés par les patientes dans les études cliniques conduites avec PROGIRON ont été décrits avec d’autres produits dans cette classe de médicaments.
|
Classe des systèmes d’organe (MedDRA) |
|
|
Affections psychiatriques |
Dépression |
|
Affections du système nerveux |
Insomnie |
|
Affections hépato-biliaires |
Jaunisse |
|
Affections des organes de reproduction et du sein |
Troubles menstruels Syndrome de type prémenstruel |
|
Affections de la peau et du tissu sous-cutané |
Urticaire, Acné, Hirsutisme, Alopécie |
|
Troubles généraux et anomalies au site d’administration |
Prise de poids Réactions anaphylactiques |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
L’administration de progestérone à une posologie trop élevée peut entraîner la somnolence.
En cas de surdosage, il convient d’arrêter PROGIRON, d’initier un traitement symptomatique et une prise en charge appropriés.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
La progestérone est un stéroïde naturel qui est sécrété par les ovaires, le placenta et les glandes surrénales.
En présence d’une imprégnation estrogénique adéquate, la progestérone transforme l’endomètre prolifératif en endomètre sécrétoire. La progestérone est nécessaire afin d’augmenter la réceptivité de l'endomètre pour l'implantation d'un embryon. Une fois l'embryon implanté, la progestérone agit pour maintenir la grossesse.
Efficacité et sécurité clinique
Les taux de grossesse en cours après 10 semaines de supplémentation de la phase lutéale avec PROGIRON, à raison de 25 mg/jour (N= 318) chez des patientes ayant bénéficié d’un transfert d’embryon dans une étude en phase III, étaient de 29,25% (95% CI : 24,25 – 34,25).
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec PROGIRON dans tous les sous-groupes de la population pédiatrique (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques
Les concentrations sériques de progestérone ont augmenté suite une administration par voie sous-cutanée (s.c) de 25 mg de PROGIRON à 12 femmes post-ménopausées en bonne santé. Une heure après l’administration d'une seule dose sous-cutanée, la Cmax moyenne était de 50,7 ± 16,3 ng / mL. La concentration sérique de progestérone a diminué de façon mono-exponentielle, et après douze heures suivant l'administration, la concentration moyenne était de 6,6 ± 1,6 ng / mL. La concentration sérique minimale, 1,4 ± 0,5 ng / mL, a été atteinte à la 96ème heure. L'analyse pharmacocinétique a démontré la linéarité des trois doses sous-cutanées testées (25 mg, 50 mg et 100 mg).
Après administration répétée de 25 mg par jour par voie sous-cutanée, les concentrations de l'état d'équilibre ont été atteintes en 2 jours de traitement environ avec PROGIRON. La concentration sérique minimale de 4,8 ± 1,1 ng/mL a été observée avec une ASC de 346,9 ± 41,9 ng*h/mL au 11ème jour.
Distribution
Chez l'homme, 96-99% de la progestérone est lié aux protéines sériques comme l'albumine (50-54%) ou la corticosteroid binding globulin (CBG) (43-48%), et le reste est libre dans le plasma. En raison de sa liposolubilité, la progestérone passe de la circulation sanguine vers les cellules cibles par diffusion passive
Biotransformation
La progestérone est principalement métabolisée par le foie et en grande partie en prégnandiols et prégnénolones. Prégnanediols et prégnénolones sont conjugués dans le foie en métabolites glucuronides et sulfates. Les métabolites de la progestérone qui sont excrétés dans la bile peuvent être dé-conjugués et ensuite métabolisés dans l’intestin par la réduction, la déshydroxylation et l’épimérisation.
Élimination
La progestérone est éliminée par voie rénale et biliaire.
5.3. Données de sécurité préclinique
Les études de tolérance locale et de toxicité à doses répétées réalisées avec PROGIRON ont confirmé le profil de sécurité du produit.
Evaluation des risques pour l'environnement (ERA)
Des études d'évaluation du risque environnemental ont montré que la progestérone peut présenter un risque pour l'environnement aquatique (voir section 6.6).
Phosphate disodique
Sodium dihydrogénophosphate dihydraté
Eau pour préparations injectables
2 ans
6.4. Précautions particulières de conservation
Ne pas réfrigérer ni congeler.
A conserver dans l’emballage extérieur d’origine, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Seringue en verre incolore siliconé munie d’une aiguille en acier inoxydable piquetée, fermée à une extrémité par un capuchon et à l'autre extrémité par un bouchon à piston en bromobutyle siliconé. Chaque boîte en carton contient 7 ou 14 seringues préremplies.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
La solution est à usage unique.
La solution ne doit pas être administrée si elle n’est pas claire et incolore.
Ce médicament peut présenter un risque pour l'environnement (voir section 5.3).
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
PARC DE SOPHIA ANTIPOLIS
Les TROIS MOULINS, 280 RUE DE GOA
06600 ANTIBES
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 774 1 6 : Seringue préremplie (verre) contenant 1,112 mL. Boîte de 7.
· 34009 302 774 2 3 : Seringue préremplie (verre) contenant 1,112 mL. Boîte de 14.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 01/08/2025
PROGIRON 25 mg, solution injectable en seringue préremplie
Progestérone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que PROGIRON 25 mg, solution injectable en seringue préremplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser PROGIRON 25 mg, solution injectable en seringue préremplie ?
3. Comment utiliser PROGIRON 25 mg, solution injectable en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver PROGIRON 25 mg, solution injectable en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE PROGIRON 25 mg, solution injectable en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Système génito-urinaire et hormones sexuelles ; Progestatifs ; Dérivés pregnène-4., Code ATC : G03DA04.
PROGIRON contient de la progestérone. La progestérone est une hormone sexuelle féminine naturellement présente dans le corps humain. Ce médicament agit sur la muqueuse utérine pour favoriser la grossesse et la mener à terme.
PROGIRON est indiqué chez les femmes souffrant de troubles liés à un déficit en progestérone dans le cadre d’un programme d’assistance médicale à la procréation (AMP) et qui ne peuvent utiliser ou tolérer les préparations vaginales.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER PROGIRON 25 mg, solution injectable en seringue préremplie ?
N’utilisez jamais PROGIRON 25 mg, solution injectable en seringue préremplie :
· si vous êtes allergique à la progestérone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous présentez des saignements vaginaux (en dehors des règles) qui n’ont pas été traités par votre médecin.
· si vous avez fait une fausse couche et que votre médecin suspecte des tissus résiduels dans l’utérus.
· si vous avez une grossesse extra-utérine.
· si vous souffrez ou avez souffert de troubles hépatiques sévères.
· si vous avez un cancer du sein ou un cancer de l’appareil reproducteur.
· si vous avez ou avez déjà développé des caillots sanguins au niveau des jambes, des poumons, des yeux ou de n’importe quelle autre partie du corps.
· si vous souffrez d’une maladie du sang qui s’appelle la porphyrie (troubles congénitaux ou non de certaines enzymes).
· si au cours de votre grossesse, vous avez souffert de jaunisse (coloration jaune des yeux ou de la peau en raison de problèmes hépatique), démangeaisons sévères et/ou cloques sur la peau.
· si vous avez moins de 18 ans.
Avertissements et précautions
Si l’un des signes suivants survient pendant votre traitement, adressez-vous immédiatement à votre médecin qui pourrait décider d’interrompre le traitement. Informez immédiatement votre médecin si ces signes surviennent quelques jours après la dernière injection :
· Crise cardiaque (douleurs dans la poitrine, ou douleur dans le dos et/ou douleur intense et élancement dans l’un des bras ou les deux, souffle coupé brutalement, transpiration, vertige, étourdissements, nausées, palpitations).
· Accident vasculaire cérébral (maux de tête sévères ou vomissements, vertiges, malaise, altération de la vision ou de la parole, faiblesse ou perte de sensation au niveau du bras ou de la jambe).
· Caillots sanguins au niveau des yeux ou toute autre partie du corps (douleur dans les yeux, douleur ou gonflement de la cheville, du pied ou de la main).
· Dépression qui s’aggrave.
· Maux de tête sévères, altération de la vision.
Avant d’utiliser PROGIRON informez votre médecin si vous souffrez ou avez souffert d’une de ces pathologies, car vous serez suivi pendant votre traitement :
· Troubles hépatiques (légers à modérés)
· Epilepsie
· Migraine
· Asthme
· Troubles cardiaques ou rénaux
· Diabète
· Dépression.
Enfants et adolescents
Ce médicament ne doit pas être utilisé par des enfants ou des adolescents.
Autres médicaments et PROGIRON 25 mg, solution injectable en seringue préremplie
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris des médicaments obtenus sans ordonnance et des médicaments à base de plantes. Certains médicaments peuvent interagir avec PROGIRON. Par exemple :
· Carbamazépine (médicament pour traiter certains types de crises d’épilepsie)
· Rifampicine (médicament antibiotique)
· Griséofulvine (médicament antifongique)
· Phénytoïne et Phénobarbital (médicaments pour traiter l’épilepsie)
· Médicaments à base de plantes contenant du millepertuis
· Ciclosporine (médicament pour traiter certains types d’inflammation et les patients transplantés)
· Médicaments pour le traitement du diabète
· Kétoconazole (médicament antifongique)
Ne pas prendre PROGIRON en même temps que d’autres médicaments injectables.
PROGIRON 25 mg, solution injectable en seringue préremplie avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
· PROGIRON peut être utilisé pendant les trois premiers mois de la grossesse.
· Ce médicament ne doit pas être utilisé pendant l’allaitement.
Conduite de véhicules et utilisation de machines
Il est déconseillé de conduire ou d’utiliser des machines si vous ressentez une somnolence et/ou des vertiges en prenant PROGIRON.
PROGIRON 25 mg, solution injectable en seringue préremplie contient du sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER PROGIRON 25 mg, solution injectable en seringue préremplie ?
La dose recommandée est d’une injection de 25 mg par jour jusqu’à 12 semaines de grossesse confirmée (c’est à dire 10 semaines de traitement).
PROGIRON doit être injecté sous la peau (par voie sous-cutanée).
Vous pourrez faire l’injection de 25 mg de PROGIRON vous-même par voie sous-cutanée, après avis de votre médecin ou d’un professionnel de santé et après qu’il vous en aura fait la démonstration.
Avant que vous puissiez vous injecter vous-même PROGIRON, les conseils suivants vous seront dispensés :
· Conseils pour pratiquer les injections sous-cutanées.
· Où injecter votre médicament.
· Comment prendre votre traitement.
Avant de vous injecter vous-même PROGIRON, lisez attentivement les instructions suivantes :
Les étapes d’une auto-administration/auto-injection sont :
A. Préparation de votre injection
B. Contrôle de la boîte contenant les produits
C. Injection
D. Elimination des produits utilisés
Ces étapes sont détaillées ci-dessous.
A. Préparation de votre injection
Il est important que tous les accessoires utilisés soient aussi propres que possible, en commençant par un lavage des mains soigneux et un séchage des mains avec une serviette propre.
Choisissez une surface de travail propre pour votre injection.
Les accessoires suivants ne sont pas fournis avec votre médicament. Votre médecin ou votre pharmacien vous les fournira :
· Deux tampons imbibés d’alcool
· Un récipient contenant les déchets (pour éliminer en toute sécurité la seringue préremplie etc.)
B. Contrôle de la boîte contenant les produits
· Ne pas utiliser le produit si l'emballage est ouvert ou endommagé.
· Assurez-vous que les seringues préremplies de PROGIRON contiennent la solution.
· Assurez-vous que la date de péremption est toujours valide sur la seringue préremplie de PROGIRON. N’utilisez pas les produits périmés.
C. Injection
· Votre médecin ou un professionnel de santé vous aura déjà montré où injecter PROGIRON (par ex. ventre ou partie haute de la cuisse).
· Utilisez un tampon imbibé d’alcool et nettoyez soigneusement la partie du corps où l’injection sera réalisée, et laissez sécher.
· Retirez le bouchon. Une fois le capuchon retiré, ne laissez pas l'aiguille toucher quoi que ce soit. Cela permet de s'assurer que l'aiguille reste propre (stérile).
· Tenez la seringue avec l'aiguille dirigée vers le haut et appuyez doucement sur le piston jusqu'à ce que tout l'air soit sorti de la seringue et qu'au moins une goutte de solution sorte de la pointe de l'aiguille.
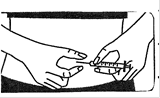
· Tenez la seringue d’une seule main. Avec l’autre main, pincez doucement la peau au point d’injection entre le pouce et l’index.
|
|
· Enfoncez d’un coup sec l’aiguille dans la peau, de manière à former un angle droit. |
· Enfoncez l’aiguille sous la peau. N’injectez pas directement dans une veine.
· Injectez la solution en poussant doucement et fermement afin de diffuser toute la solution sous la peau. Injectez toute la solution.
· Relâchez la peau et retirez l’aiguille.
· Nettoyez la peau au point d’injection avec un coton imbibé d’alcool et effectuez un massage en suivant un mouvement circulaire.
Chaque seringue préremplie est à usage unique.
D. Elimination des produits utilisés
· Lorsque vous avez terminé votre injection, jetez la seringue préremplie dans le récipient prévu à cet effet.
Si vous avez utilisé plus de PROGIRON 25 mg, solution injectable en seringue préremplie que vous n’auriez dû :
Consultez immédiatement votre médecin ou votre pharmacien.
En cas de surdosage, les vertiges font partie des effets qui peuvent survenir.
Si vous oubliez d’utiliser PROGIRON 25 mg, solution injectable en seringue préremplie :
Prenez-le comme prévu lorsque vous vous en êtes rendu compte. Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre. Contactez votre médecin.
Si vous arrêtez d’utiliser PROGIRON 25 mg, solution injectable en seringue préremplie :
N’arrêtez pas PROGIRON sans en informer votre médecin ou votre pharmacien. Un arrêt brutal de PROGIRON peut entraîner une augmentation de l’anxiété, une humeur maussade et accroître le risque de déclencher une crise d’épilepsie.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’information à votre médecin ou votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Vous devez cesser la prise de médicament et consulter immédiatement votre médecin si les effets suivants surviennent :
· Hyperstimulation ovarienne (symptômes incluant des douleurs dans le bas de l’estomac, sensation de déshydratation et nausées, élimination de petites quantités d’urines concentrées et prise de poids),
· Dépression,
· Jaunissement de la peau et du blanc des yeux (jaunisse),
· Réaction allergique grave pouvant entraîner des difficultés à respirer, un gonflement du visage et de la gorge ou une éruption cutanée grave (choc anaphylactique).
Effets indésirables très fréquents : pouvant affecter plus d’1 patient sur 10
· Douleurs, rougeurs, démangeaisons, irritation ou gonflement au site d'injection
· Spasme de la muqueuse utérine
· Saignements vaginaux.
Effets indésirables fréquents : pouvant affecter plus d’1 patient sur 100 mais moins d’1 patient sur 10
· Maux de tête
· Ventre ballonné
· Douleurs à l’estomac
· Constipation
· Nausées et vomissements
· Tensions et/ou douleur des seins
· Pertes vaginales
· Irritation accompagnée de picotements et de démangeaisons au niveau de la paroi vaginale et de la zone qui l’entoure
· Induration autour du site d’injection
· Ecchymoses au point d’injection
· Fatigue (fatigue extrême, épuisement, léthargie).
Effets indésirables peu fréquents : pouvant affecter plus d’1 patient sur 1 000 mais moins d’1 patient sur 100 :
· Modification de l’humeur
· Vertiges
· Somnolence
· Troubles de l’estomac et de l’intestin (par exemple, gêne et/ou tension au niveau de l’estomac, gaz, spasmes douloureux et nausées)
· Éruptions cutanées (par exemple, rougeur et échauffement de la peau, bosses qui démangent ou papules, ou une peau sèche, craquelée, avec des cloques ou gonflée)
· Gonflement des seins et/ou élargissement à la poitrine
· Bouffées de chaleur
· Sensation générale de malaise ou se sentir « de mauvaise humeur »
· Douleur.
Fréquence indéterminée : la fréquence ne peut pas être estimée à partir des données disponibles
Les troubles suivants, bien que non reportés par les patients dans les études cliniques conduites avec PROGIRON ont été décrits avec d’autres progestatifs : incapacité à dormir (insomnie), troubles prémenstruels ou symptômes de type prémenstruel, urticaire, acné, pilosité excessive (hirsutisme), chute de cheveux (alopécie), prise de poids.
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER PROGIRON 25 mg, solution injectable en seringue préremplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Ne pas réfrigérer ni congeler.
A conserver dans l'emballage extérieur d'origine, à l'abri de la lumière.
N'utilisez pas ce médicament après la date de péremption indiquée sur la boîte et l'étiquette de la seringue préremplie après EXP.
N’utilisez pas ce médicament si vous remarquez que la solution est trouble ou contient des particules.
Chaque seringue préremplie est à usage unique.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient PROGIRON 25 mg, solution injectable
· La substance active est : progestérone.
Chaque seringue préremplie (1,112 mL) contient 25 mg de progestérone (22,48 mg/mL).
· Les autres composants sont :
Hydroxypropylbétadex, phosphate disodique, sodium dihydrogénophosphate dihydraté, eau pour préparations injectables.
Qu’est-ce que PROGIRON 25 mg, solution injectable et contenu de l’emballage extérieur
PROGIRON se présente sous forme d’une solution claire et incolore pour injection en seringue préremplie, dans une seringue en verre.
Chaque étui contient 7 ou 14 seringues préremplies.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
PARC DE SOPHIA ANTIPOLIS
Les TROIS MOULINS, 280 RUE DE GOA
06600 ANTIBES
Exploitant de l’autorisation de mise sur le marché
PARC DE SOPHIA ANTIPOLIS
Les TROIS MOULINS, 280 RUE DE GOA
06600 ANTIBES
IBSA FARMACEUTICI ITALIA SRL
VIA MARTIRI DI CEFALONIA 2
26900 LODI
ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).