Dernière mise à jour le 02/02/2026
FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable
Indications thérapeutiques
Classe pharmacothérapeutique : ANTIINFECTIEUX INTESTINAUX, ANTIBIOTIQUES- code ATC : A07AA07
Ce médicament est indiqué dans les cas suivants :
· traitement de certains cas de candidoses digestives,
· traitement complémentaire de candidoses vaginales et cutanées,
· prévention des candidoses chez certains sujets (immunodéprimés, prématurés).
Ce médicament ne doit pas être utilisé pour traiter des candidoses généralisées.
Présentations
> 1 flacon(s) en verre brun de 40 ml avec adaptateur avec seringue doseuse pour administration orale
Code CIP : 346 242-2 ou 34009 346 242 2 3
Déclaration de commercialisation : 15/03/2000
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 4,85 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 5,87 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 07/06/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par FUNGIZONE reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 22/04/2025
FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Amphotéricine B....................................................................................................................... 10 g
Pour 100 ml de suspension buvable.
Excipient(s) à effet notoire : Sodium, metabisulfite de sodium (E223), parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), benzoate de sodium (E211), éthanol, alcool benzylique.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
· Traitement complémentaire des candidoses vaginales et cutanées, dans le but d'obtenir la stérilisation d'une candidose intestinale associée.
· Prévention des candidoses chez les sujets à très haut risque: prématurés, immunodéprimés, malades soumis à une chimiothérapie antinéoplasique.
4.2. Posologie et mode d'administration
Population pédiatrique
Nourrissons et enfants : 50 mg/kg/24 heures, soit une dose de 1 ml pour 2 kg/24 heures.
La dose quotidienne sera administrée en 2 ou 3 prises, de préférence en dehors des repas. Le traitement sera poursuivi pendant 15 à 21 jours même si la guérison clinique intervient plus précocement.
La suspension peut aussi être utilisée sous forme de bain de bouche dans les candidoses buccales (3 à 4 prises par jour).
Mode d’administration
Une seringue doseuse pour administration orale graduée de 3ml avec un adaptateur à fixer sur le flacon est fournie avec ce dernier.
La seringue doseuse pour administration orale est graduée par paliers de 0,1 ml.
Précautions à prendre avant l’administration du médicament : Bien agiter avant l’emploi. (voir rubrique 6.6)
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
L’amphotéricine B administrée par voie orale ne doit pas être utilisée dans le traitement des candidoses systémiques.
4.4. Mises en garde spéciales et précautions d'emploi
Il est souhaitable de traiter simultanément tout foyer associé à Candida, reconnu pathogène.
Ce médicament contient des parahydroxybenzoates et leurs esters
Peut provoquer des réactions allergiques (éventuellement retardées).
Ce médicament contient des sulfites, y compris métabisulfites
Peut, dans de rares cas, provoquer des réactions d’hypersensibilité sévères et des bronchospasmes.
Ce médicament contient de l’acide benzoïque (E210) et des benzoates
Ce médicament contient 80 mg du benzoate de sodium (E211) par flacon (40 ml) équivalent à 2 mg/ml. L’augmentation de la bilirubinémie suite à son déplacement grâce à l’albumine peut accroître le risque d’ictère néonatal pouvant se transformer en ictère nucléaire (dépôts de bilirubine non conjuguée dans le tissu cérébral.
Ce médicament contient du sodium
Ce médicament contient 105.2 mg de sodium par flacon (40 ml), ce qui équivaut à 5.26% de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte.
Ce médicament contient de l’éthanol
Ce médicament contient 4 mg d'alcool (éthanol) par 1 ml équivalent à 400 mg/100 ml (0.4% p/v). La quantité contenue dans 20 ml de ce médicament équivaut à moins de 2 ml de bière ou 1 ml de vin. La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
Ce médicament contient de l’alcool benzylique
Ce médicament contient moins de 12 mg d’alcool benzylique par flacon de 40 ml. L’alcool benzylique peut provoquer des réactions allergiques.
L’alcool benzylique est associé à un risque d’effets secondaires graves y compris des problèmes respiratoires (appelés ≪ syndrome de suffocation ≫) chez les jeunes enfants.
Ne pas utiliser chez le nouveau-né (jusqu’à 4 semaines) sauf recommandation contraire de votre médecin.
Ne pas utiliser pendant plus d’une semaine chez les jeunes enfants (moins de 3 ans), sauf avis contraire de votre médecin ou de votre pharmacien.
Doit être utilisé avec prudence pendant la grossesse ou l’allaitement. De grandes quantités d’alcool benzylique peuvent s’accumuler dans votre corps et entrainer des effets secondaires (appelés ≪ acidose métabolique ≫).
Les volumes élevés doivent être utilisés avec prudence et en cas de nécessité uniquement, en particulier chez les personnes atteintes d’insuffisance hépatique ou rénale en raison du risque d’accumulation et de toxicité (acidose métabolique).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations à prendre en compte
Lors de l’administration de l’amphotéricine B, les topiques gastro-intestinaux, antiacides et adsorbants doivent être pris séparément avec un intervalle de plus de 2 heures si possible car ils peuvent diminuer l’action thérapeutique de I’amphotéricine B.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études chez l’animal n’ont pas mis en évidence d’effet tératogène.
Il n’existe pas actuellement de données en nombre suffisant pour évaluer un éventuel effet malformatif ou fœtotoxique de l’amphotéricine B lorsqu’elle est administrée pendant la grossesse.
L’absorption par la muqueuse digestive est quasi nulle.
Cependant, ce médicament contient de l’alcool benzylique pouvant passer le placenta et le risque tératogène de l’alcool benzylique n’a pas été étudié. De plus, chez la femme enceinte, il existe un risque d’accumulation et de toxicité de l’alcool benzylique pouvant entraîner une acidose métabolique (voir rubrique 4.4).
Compte tenu de ces données, l’utilisation de FUNGIZONE NOURRISSONS ET ENFANTS 10 % suspension buvable ne doit être envisagée, au cours de la grossesse, que si nécessaire.
Le passage de l’amphotéricine B dans le lait humain n’est pas connu. Néanmoins, en raison de l’absorption intestinale négligeable de l’amphotéricine B par voie orale, il est peu probable que les enfants allaités soient affectés.
Cependant, ce médicament contient de l’alcool benzylique qui est susceptible de passer dans le lait maternel humain et un risque chez le nouveau-né ne peut être exclu. De plus, chez la femme allaitante, il existe un risque d’accumulation et de toxicité de l’alcool benzylique pouvant entraîner une acidose métabolique (voir rubrique 4.4).
En conséquence, l’utilisation de FUNGIZONE NOURRISSONS ET ENFANTS 10 % suspension buvable ne doit être envisagée, au cours de l’allaitement, que si nécessaire.
Fertilité
Aucune donnée sur la fertilité n’est disponible.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
Classification MedDRA des effets indésirables
Les effets indésirables suivants ont été observés pendant le traitement par FUNGIZONE :
très fréquent : ³ 1/10
fréquent: ³1/100 ;< 1/10
peu fréquent: ³ 1/1000 ;< 1/100
rare: ³1/10000 ;< 1/1000
très rare : < 1/10000
fréquence indéterminée: ne peut être estimée sur la base des données disponibles
|
Classe de système organes |
Fréquence |
Dénomination MedDRA |
|
Affections gastro-intestinales |
Fréquent |
Nausées, vomissement |
|
Peu fréquent |
Diarrhées |
|
|
Rare |
Glossite, coloration dentaire* |
|
|
Affections du système immunitaire |
Indéterminé |
Réactions allergiques |
* Un jaunissement passager des dents, pouvant être estompé par le brossage, peut survenir.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Il existe peu de données disponibles relatives au surdosage d’amphotéricine B par voie orale.
Sachant que I’amphotéricine B n’est pratiquement pas absorbée par la muqueuse digestive saine, un surdosage ne devrait pas conduire à une toxicité systémique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTIINFECTIEUX INTESTINAUX, ANTIBIOTIQUES, code ATC : A07AA07
Le principe actif de ce produit est l'amphotéricine B, antibiotique antifongique de la famille des polyènes, extrait de cultures de Streptomyces nodosus.
Spectre d'action antifongique :
Son spectre d'activité in vitro s'étend à de nombreux champignons pathogènes, agents des mycoses profondes ou superficielles. Son action in vivo s'exerce surtout sur les levures du genre Candida.
Ce produit agit par contact direct (fongistatique et fongicide si la concentration est élevée), ce qui explique son efficacité dans les candidoses des muqueuses digestives. Elle n'a aucune action antibactérienne ou antivirale.
5.2. Propriétés pharmacocinétiques
L'amphotéricine B n'est pratiquement pas absorbée par la muqueuse digestive.
Elle exerce localement son action anticandidosique.
5.3. Données de sécurité préclinique
*Composition de l'arôme Curaçao : L’arôme curaçao est composé d’éléments aromatiques1 (préparations aromatisantes et substances aromatisantes conformes à la directive CE 1334/2008 et d’autres ingrédients1 (alcool benzylique, citrate de triéthyle, alpha-tocophérol et méthyleugénol).
(1) Par ordre décroissant de poids.
**Composition de l'arôme Passiflore : mélange d'alcoolats, d'alcoolatures, d'extraits divers additionnés d'esters, d'aldéhydes, de phénols, de lactones et d'aldéhydes phénols dans l'alcool éthylique et le propylène glycol.
***Composition de l'arôme Cannelle : Cinnamaldéhyde, acétate de propylène glycol, acétal de cynnamaldéhyde, eugénol, propylène glycol et alcool éthylique.
2 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
Flacon de 40 ml de verre brun de type III, muni d'une capsule de bouchage métallique.
Une seringue doseuse pour administration orale graduée de 3 ml avec un adaptateur à fixer sur le flacon est fournie avec ce dernier.
La seringue doseuse pour administration orale est graduée par paliers de 0,1 ml
6.6. Précautions particulières d’élimination et de manipulation
Bien agiter avant l’emploi.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Une fois le traitement terminé, rapportez à votre pharmacien toutes les boîtes entamées y compris la seringue doseuse pour administration orale ainsi que le flacon pour une destruction correcte et appropriée de ce médicament.
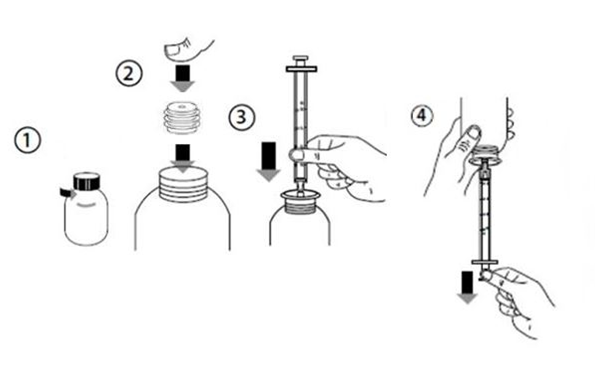
Mode d’utilisation de la seringue doseuse pour administration orale
Agiter le flacon fermé contenant la suspension avant chaque utilisation
|
|
|
1. Ouvrir le flacon de FUNGIZONE en tournant le bouchon dans le sens inverse des aiguilles d’une montre (1) 2. Insérer l’adaptateur de seringue doseuse pour administration orale sur le goulot du flacon (2) 3. Fixer la seringue doseuse pour administration orale dans l’adaptateur (3) 4. Retourner le flacon avec la seringue doseuse pour administration orale en position tête en bas et remplir la seringue doseuse pour administration orale avec une petite quantité de FUNGIZONE en tirant sur le piston (4) 5. Puis repousser le piston vers le haut afin d’éliminer les bulles qui auraient pu se former. Enfin, tirer à nouveau le piston vers le bas jusqu’à la graduation correspondant à la quantité en millilitres (ml) prescrite par le médecin. 6. Retourner à nouveau le flacon avec la seringue doseuse pour administration orale tête en haut. Retirer la seringue doseuse pour administration orale du flacon. 7. Le médicament peut être administré directement dans la bouche à partir de la seringue doseuse pour administration orale. Le patient doit rester droit pendant l’administration. Pointer la seringue doseuse pour administration orale sur la face interne de la joue; administrer lentement la suspension dans la bouche du patient. 8. Laver la seringue doseuse pour administration orale avec de l’eau et la laisser sécher avant de la réutiliser. Replacer la seringue pour administration orale dans la boite, avec le flacon de FUNGIZONE 9. Refermer le flacon en vissant le bouchon tout en laissant l’adaptateur sur le flacon, prêt pour l’administration suivante |
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
ZIEGELHOF 24
17489 GREIFSWALD
ALLEMAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 346 242 2 3 : 40 ml en flacon (verre brun) et une seringue doseuse pour administration orale de 3 ml (polyéthylène).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 22/04/2025
FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable
Amphotéricine B
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable ?
3. Comment prendre FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : ANTIINFECTIEUX INTESTINAUX, ANTIBIOTIQUES- code ATC : A07AA07
Ce médicament est indiqué dans les cas suivants :
· traitement de certains cas de candidoses digestives,
· traitement complémentaire de candidoses vaginales et cutanées,
· prévention des candidoses chez certains sujets (immunodéprimés, prématurés).
Ce médicament ne doit pas être utilisé pour traiter des candidoses généralisées.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable ?
Ne prenez jamais FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable :
si vous êtes allergique à l’amphotéricine B ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable.
L'action du médicament dans le tube digestif peut être diminuée par l'huile de paraffine, les pansements digestifs ou d’autres médicaments en faisant écran entre le médicament et la paroi interne du tube digestif.
Enfants
Voir rubrique 3 ci-dessous.
Autres médicaments et FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
L’absorption intestinale de l’amphotericine B, principe actif contenu dans FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable, est négligeable.
Cependant FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable contient de l’alcool benzylique, un conservateur susceptible de traverser le placenta (voir FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable contient de l’acide benzoïque (E210) et des benzoates).
Ce médicament ne sera utilisé pendant la grossesse que sur les conseils de votre médecin. Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin car lui seul peut juger de la nécessité de le poursuivre.
Allaitement
L’absorption intestinale de l’amphotericine B, principe actif contenu dans FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable, est négligeable et le passage de l’amphotéricine B dans le lait humain n’est pas connu.
FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable contient de l’alcool benzylique, un conservateur susceptible de passer dans le lait maternel (voir FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable contient de l’acide benzoïque (E210) et des benzoates).
Ce médicament ne sera utilisé pendant la grossesse que sur les conseils de votre médecin.
Conduite de véhicules et utilisation de machines
Sans objet.
FUNGIZONE NOURRISSONS ET ENTFANTS 10 %, suspension buvable contient du parahydroxybenzoate et leurs esters
Peut provoquer des réactions allergiques (éventuellement retardées).
FUNGIZONE NOURRISSONS ET ENTFANTS 10 %, suspension buvable contient des sulfites, y compris métabisulfites
Peut, dans de rares cas, provoquer des réactions d’hypersensibilité sévères et des bronchospasmes.
FUNGIZONE NOURRISSONS ET ENTFANTS 10 %, suspension buvable contient de l’acide benzoïque (E210) et des benzoates
Ce médicament contient 80 mg du benzoate de sodium (E211) par flacon (40 ml) équivalent à 2 mg/ml.
Le benzoate de sodium (E211) peut accroître le risque ictère (jaunissement de la peau et des yeux) chez les nouveau-nés (jusqu’à 4 semaines).
FUNGIZONE NOURRISSONS ET ENTFANTS 10 %, suspension buvable contient du sodium
Ce médicament contient 105.2 mg de sodium (composant principal du sel de cuisine/table) par flacon (40 ml). Cela équivaut à 5.26% de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
FUNGIZONE NOURRISSONS ET ENTFANTS 10 %, suspension buvable contient de l’éthanol
Ce médicament contient 4 mg d'alcool (éthanol) par 1 ml équivalent à 400 mg/100 ml (0.4% p/v). La quantité en 20 ml de ce médicament équivaut à moins de 2 ml de bière ou 1 ml de vin.
La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
Ce médicament contient de l’alcool benzylique
Ce médicament contient moins de 12 mg d’alcool benzylique par flacon de 40 ml. L’alcool benzylique peut provoquer des réactions allergiques.
L’alcool benzylique est associé à un risque d’effets secondaires graves y compris des problèmes respiratoires (appelés ≪ syndrome de suffocation ≫) chez les jeunes enfants.
Ne pas utiliser chez le nouveau-né (jusqu’à 4 semaines) sauf recommandation contraire de votre médecin.
Ne pas utiliser pendant plus d’une semaine chez les jeunes enfants (moins de 3 ans), sauf avis contraire de votre médecin ou de votre pharmacien.
Demandez conseil à votre médecin ou à votre pharmacien si vous êtes enceinte ou si vous allaitez.
De grandes quantités d’alcool benzylique peuvent s’accumuler dans votre corps et entrainer des effets secondaires (appelés ≪ acidose metabolique ≫).
Demandez conseil à votre medecin ou à votre pharmacien si vous souffrez d’une maladie du foie ou du rein. De grandes quantités d’alcool benzylique peuvent s’accumuler dans votre corps et entrainer des effets secondaires (appelés ≪acidose métabolique ≫).
3. COMMENT PRENDRE FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable ?
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin.
Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Nourrissons et Enfants : la dose recommandée est de 1 ml pour 2 kg/24 heures
La dose quotidienne prescrite par votre médecin sera administrée en 2 ou 3 prises, de préférence en dehors des repas.
Utiliser la seringue doseuse pour administration orale fournie dans la boite.
La suspension peut être utilisée sous forme de bain de bouche.
Modalités d'administration
Voie orale.
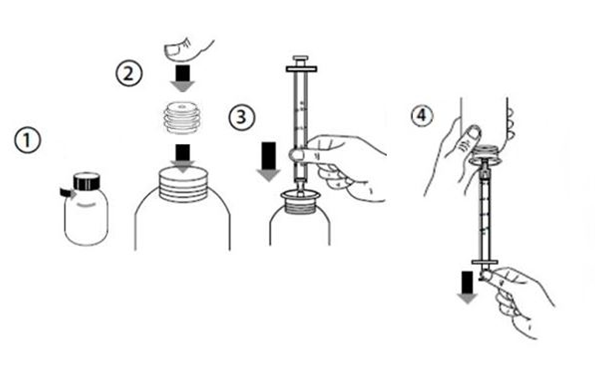
Instructions d’utilisation de la seringue doseuse pour administration orale
Une seringue doseuse pour administration orale graduée de 3ml avec un adaptateur à fixer sur le flacon est fournie avec ce dernier.
La seringue doseuse pour administration orale est graduée par paliers de 0,1 ml.
Agiter le flacon fermé contenant la suspension avant chaque utilisation
|
1. Ouvrir le flacon de FUNGIZONE en tournant le bouchon dans le sens inverse des aiguilles d’une montre (1) 2. Insérer l’adaptateur de seringue pour administration orale sur le goulot du flacon (2) 3. Fixer la seringue pour administration orale dans l’adaptateur (3) 4. Retourner le flacon avec la seringue doseuse pour administration orale en position tête en bas et remplir la seringue doseuse pour administration orale avec une petite quantité de FUNGIZONE en tirant sur le piston (4) 5. Puis repousser le piston vers le haut afin d’éliminer les bulles qui auraient pu se former. Enfin, tirer à nouveau le piston vers le bas jusqu’à la graduation correspondant à la quantité en millilitres (ml) prescrite par le médecin. 6. Retourner à nouveau le flacon avec la seringue pour administration orale tête en haut. Retirer la seringue pour administration orale du flacon. 7. Le médicament peut être administré directement dans la bouche à partir de la seringue pour administration orale. Le patient doit rester droit pendant l’administration. Pointer la seringue pour administration orale sur la face interne de la joue ; administrer lentement la suspension dans la bouche du patient. 8. Laver la seringue doseuse pour administration orale avec de l’eau et la laisser sécher avant de la réutiliser. Replacer la seringue pour administration orale dans la boite, avec le flacon de FUNGIZONE 9. Refermer le flacon en vissant le bouchon tout en laissant l’adaptateur sur le flacon, prêt pour l’administration suivante |
Si vous avez pris plus de FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable que vous n’auriez dû
Sans objet.
Si vous oubliez de prendre FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable
Si vous arrêtez de prendre FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables fréquents (pouvant affecter jusqu’à 1 personne sur 10) :
Nausées, vomissements.
Effets indésirables peu fréquents (pouvant affecter jusqu’à 1 personne sur 100) :
Diarrhées.
Effets indésirables rares (pouvant affecter jusqu’à 1 personne sur 1000) :
Glossite (inflammation de la langue), jaunissement passager des dents pouvant être estompé par le brossage.
Effets indésirables dont la fréquence est inconnue :
Risque d'allergie
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
Une fois le traitement terminé, rapportez à votre pharmacien toutes les boîtes entamées y compris la seringue doseuse pour administration orale ainsi que le flacon pour une destruction correcte et appropriée de ce médicament.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FUNGIZONE NOURRISSONS ET ENFANTS 10 %, suspension buvable
La substance active est :
Amphotéricine B....................................................................................................................... 10g
Pour 100 ml de suspension buvable.
Les autres composants sont :
Saccharine sodique, phosphate disodique dodécahydraté, phosphate monosodique dihydraté, chlorure de potassium, alcool éthylique à 95 %, glycérol, carmellose sodique, acide citrique anhydre, metabisulfite de sodium (E 223), erythrosine (E 127), parahydroxybenzoate de méthyle (E 218), parahydroxybenzoate de propyle (E 216), benzoate de sodium (E 211), arôme curaçao, arôme passiflore, arôme cannelle, eau purifiée, alcool benzylique, voir rubrique 2 pour plus d’informations.
Ce médicament se présente sous forme de suspension buvable.
Flacon de 40 ml avec seringue doseuse pour administration orale de 3 ml.
Titulaire de l’autorisation de mise sur le marché
ZIEGELHOF 24
17489 GREIFSWALD
ALLEMAGNE
Exploitant de l’autorisation de mise sur le marché
68 Rue Marjolin
92300 Levallois-Perret
HAUPT PHARMA WOLFRATSHAUSEN GMBH
PLAFFENRIEDER STRASSE 5
82515 WOLFRATSHAUSEN
Allemagne
TEMMLER ITALIA S.R.L.
(AENOVA GROUP)
VIA DELLE INDUSTRIE 2
20061 CARUGATE (MI)
ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).