Dernière mise à jour le 02/02/2026
AETOXISCLEROL 3 % (60 mg/2 mL), solution injectable
Indications thérapeutiques
Classe pharmacothérapeutique - Agents sclérosants pour injection locale – code ATC C05BB02
AETOXISCLEROL contient du lauromacrogol 400 en tant que principe actif.
Ce produit fait partie d’une classe de médicaments appelés agents sclérosants. Les agents sclérosants sont des agents chimiques qui, lorsqu’ils sont injectés dans la veine atteinte, font gonfler les parois veineuses pour qu’elles adhèrent entre elles. Cela empêche la circulation du sang en transformant la veine en tissu cicatriciel. Au bout de quelques semaines, la veine disparaît.
Différentes concentrations d’AETOXISCLEROL sont utilisées pour le traitement des veines selon leur diamètre et leur localisation. La concentration AETOXISCLEROL 3% est indiquée dans la sclérose des varices de moyen et gros calibre.
AETOXISCLEROL ne peut être utilisé que chez les adultes. Ce dosage à 3% peut être administré sous forme liquide ou sous forme de mousse.
Présentations
> 5 ampoule(s) en verre de 2 ml
Code CIP : 347 753-0 ou 34009 347 753 0 7
Déclaration de commercialisation : 01/11/1998
Cette présentation est agréée aux collectivités
> 2 ampoule(s) en verre de 2 ml
Code CIP : 34009 303 119 6 7
Déclaration de commercialisation : 03/11/2025
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 06/06/2012 | Réévaluation SMR | Le service médical rendu par cette spécialité est modéré dans les indications de l'AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 25/06/2025
AETOXISCLEROL 3% (60 mg/2 mL), solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Lauromacrogol 400. ......................................................................................................................... 60.00 mg
Pour une ampoule de 2 mL.
Excipient à effet notoire : éthanol à 96 pour cent : 84 mg par ampoule
Pour la liste complète des excipients, voir rubrique 6.1.
pH de la solution : 6.5 - 8.0
4.1. Indications thérapeutiques
AETOXISCLEROL est indiqué chez les adultes
Sclérose des varices de moyen et gros calibre.
4.2. Posologie et mode d'administration
Posologie
Le choix de la concentration en lauromacrogol doit s’effectuer en fonction du type et du diamètre des varices à scléroser (voir rubrique 4.1). Pour les varices non visibles, le diamètre doit être mesuré par échographie.
Les volumes préconisés s’entendent indépendamment du poids du patient et ce quelle que soit la forme pharmaceutique injectée, liquide ou mousse.
Le nombre d’injections est évalué par le praticien, en fonction du diamètre et de la longueur de la varice à traiter. Etant donné que le volume à injecter par séance est limité, que ce soit en liquide ou en mousse, le traitement peut nécessiter plusieurs séances.
Voir également la rubrique 4.3 Contre-indications et la rubrique 4.4 Mises en garde spéciales et précautions d'emploi avant d’initier le traitement.
Administration sous forme liquide
Le volume total recommandé est de 1 à 4 mL de solution injectable par séance, répartis en plusieurs sites d’injection, en respectant des volumes de 0,1 à 2 mL maximum par site d’injection.
Ne pas dépasser le volume maximal de 4 mL de liquide injecté par séance.
Administration sous forme mousse
Le volume total recommandé est de 2 à 10 mL de mousse injectable par séance, répartis en plusieurs sites d’injection, en respectant des volumes de mousse de 0,1 à 2 mL maximum par site d’injection.
Ne pas dépasser le volume maximal de 10 mL de mousse injectée par séance
La composition de la mousse est de [1 unité de volume d’AETOXISCLEROL plus 4 unités de volume d’air stérile] soit 5 unités de volume de mousse préparée.
|
|
Volume recommandé par site d’injection |
Volume maximal par séance |
||
|
Forme pharmaceutique |
Liquide |
Mousse* |
Liquide |
Mousse |
|
AETOXISCLEROL 3% (60 mg/2 mL) |
de 0.1 mL à 2 mL |
de 0.1 mL à 2 mL |
4 mL correspondant à 2 ampoules soit |
10 mL correspondant à |
*Le volume est la somme des composants liquide + air.
** Une ampoule d’AETOXISCLEROL 3% permet 3 préparations de 2,5 mL de mousse sclérosante soit 7,5 mL de mousse sclérosante lorsque le kit de préparation de la mousse fourni est utilisé (voir rubrique 6.6).
Population pédiatrique
Aucune donnée n’est disponible.
Mode d’administration
Voie intraveineuse (IV) stricte.
En cas d’administration sous forme liquide bien s’assurer de la position de l’aiguille dans la varice idéalement sous contrôle échographique et administrer en petites quantités sur plusieurs sites d’injection le long de la veine si nécessaire.
En cas d’administration sous forme mousse, sous contrôle échographique, bien s’assurer de la position de l’aiguille dans la varice, et administrer la mousse sclérosante en petites quantités sur plusieurs sites d’injection le long de la veine si nécessaire. La survenue d’un spasme témoigne de l’action de la mousse. Vérifier que le remplissage du segment à traiter est complet. Si besoin, compléter par une injection plus bas.
Précautions à prendre lors de la manipulation d’AETOXISCLEROL
· ne pas diluer en cas d’administration sous forme liquide ou avant la préparation de la mousse
· respecter des conditions d’asepsie strictes lors de la préparation du produit à administrer et lors de son administration
· inspecter visuellement les ampoules avant utilisation, les solutions contenant des particules ne doivent pas être utilisées.
Pour les instructions concernant la préparation du médicament avant administration voir rubrique 6.6
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1
· Foramen ovale perméable (FOP) symptomatique connu
· Patient présentant un risque élevé de thrombose : thrombophilie familiale, cancer évolutif, patient immobilisé ou alité de façon prolongée quelle qu’en soit la cause, patient présentant des facteurs de risque cumulés tels que : tabagisme, contraception hormonale, traitement hormonal substitutif, hypertension artérielle, obésité, etc
· Antécédent d’épisode (ou maladie) thrombo-embolique de type thrombose superficielle aigüe, thrombose veineuse profonde, embolie pulmonaire, infarctus, accident vasculaire ischémique
· Artériopathie oblitérante
· Antécédent de chirurgie de moins de 3 mois
· Varices induites par une tumeur pelvienne ou abdominale (sauf si la tumeur a été retirée)
· Incompétence valvulaire significative au niveau du réseau veineux profond
· Veines superficielles de très gros calibre présentant des communications importantes avec le réseau veineux profond
· Phlébite migrante
· Affection systémique non contrôlée (diabète de type I, thyréotoxicose, tuberculose, asthme, tumeur, infection systémique, troubles de dyscrasie sanguine, affection respiratoire aigüe, affection cutanée)
· Erysipèles et lymphangite au niveau de la zone à traiter
· Infection aigüe
4.4. Mises en garde spéciales et précautions d'emploi
Concernant spécifiquement la sclérothérapie à la mousse ces praticiens doivent être formés aux bonnes pratiques de préparation et d’administration de la mousse sclérosante (voir rubrique 6.6).
Des réactions allergiques (notamment des réactions anaphylactiques) ayant été observées le praticien doit être préparé à la survenue possible d'une réaction anaphylactique et doit être prêt à la traiter convenablement. Le matériel de réanimation d'urgence doit être immédiatement disponible et le praticien formé à son utilisation.
Précautions à prendre avant l’initiation du traitement
Avant d’initier le traitement, le praticien doit informer le patient des risques graves que présente la technique envisagée : réactions anaphylactiques, évènements thromboemboliques, troubles du rythme cardiaque, réactions neurologiques et risques de nécrose tissulaire.
Le praticien doit rechercher les facteurs de risque du patient en l’interrogeant sur l’ensemble des contre-indications listées en rubrique 4.3 ainsi que sur les mises en garde listées dans ce paragraphe « Précautions à prendre avant l’initiation du traitement ».
Risques allergiques
Une attention particulière doit être portée aux patients présentant une forte prédisposition aux allergies.
Afin de s’assurer de l’absence d’allergie et de la bonne tolérance du lauromacrogol, lors de l’initiation du traitement, il est nécessaire de commencer la première séance par l'administration d'une dose test de 0.1 mL sous forme liquide et de garder le patient en observation pendant 15 minutes avant de débuter le traitement.
Risques thrombo-emboliques et risques vasculaires
Chez les patients sans antécédent personnel mais à haut risque thromboembolique la balance bénéfice-risque d’une sclérothérapie doit être soigneusement évaluée et discutée avec le patient (voir également les cas de contre-indications en rubrique 4.3.).
Une extrême prudence est recommandée en cas d'utilisation chez les patients atteints d’affections artérielles sous-jacentes, notamment en cas d’'athérosclérose périphérique sévère ou de thromboangéite oblitérante (maladie de Buerger).
En raison du risque d'extension de thrombose dans le système veineux profond, il est indispensable d'évaluer soigneusement la continence valvulaire avant toute injection et d’injecter lentement de faibles quantités de produit dans la varice (pas plus de 2 mL de liquide ou de mousse par point d’injection).
La perméabilité des veines profondes doit être évaluée par une méthode non invasive telle que l'échographie duplex. La sclérothérapie veineuse ne doit pas être réalisée si une incontinence valvulaire significative ou une insuffisance veineuse profonde est détectée, lors des épreuves de Trendelenburg ou de Perthes, ou lors d’une phlébographie par exemple.
Si l'insuffisance veineuse est associée à un lymphoedème, l'injection sclérosante peut aggraver la douleur et l'inflammation locale pendant plusieurs jours ou plusieurs semaines.
Propriétés arythmogènes du lauromacrogol
Du fait des propriétés arythmogènes du lauromacrogol, il existe une possibilité de collapsus cardio-vasculaire lié au passage systémique du produit. Une attention particulière, doit être portée dans le cas de patients souffrant d’arythmie ventriculaire ou d’un syndrome du QT.
Foramen Ovale Permeable (FOP)
La présence d'un FOP peut favoriser la survenue de graves effets artériels indésirables, du fait de la circulation possible de produit, de bulles ou de particules dans la partie droite du cœur. Par conséquent, la recherche d’un FOP est conseillée avant la sclérothérapie de varices chez les patients ayant des antécédents d’HTAP (Hypertension Artérielle Pulmonaire).
L’utilisation d’AETOXISCLEROL est contre-indiquée chez les patients porteurs d’un FOP connu symptomatique (voir rubrique 4.3).
L’utilisation d’AETOXISCLEROL n’est pas recommandée chez les patients porteurs d’un FOP connu mais asymptomatique. En cas d’administration, il convient d'utiliser des volumes plus faibles que ceux préconisés en rubrique 4.2 et d'éviter tout effort à glotte fermée (manœuvre de Valsalva) pendant les minutes qui suivent l'injection.
Troubles neurologiques
Les patients atteints d'un FOP ou de migraine avec aura se sont avérés être plus susceptibles de souffrir d'effets indésirables neurologiques temporaires, tels que des troubles visuels et une migraine, en particulier après des injections avec de la mousse sclérosante.
La sclérothérapie n’est pas recommandée si le patient a ressenti des troubles visuels, psychiques ou neurologiques au décours d’une précédente séance de sclérothérapie.
Chez les patients migraineux, il convient d’utiliser des volumes plus faibles que ceux préconisés en rubrique 4.2.
Les troubles visuels et ou neurologiques du type scotomes, migraines sont rapportés plus fréquemment avec la forme mousse qu’avec la forme liquide.
Précautions à prendre au moment de l’injection
Risques d’extravasation et risque d’injection intra-artérielle – Risque de nécrose tissulaire
Toute injection en dehors d’une veine peut provoquer une nécrose grave. De même, une injection intra-artérielle est particulièrement grave et peut avoir pour conséquence de larges nécroses musculaires ou cutanées, voire la nécessité d’une amputation. Il est impératif de faire preuve d’une grande prudence lors du positionnement de l'aiguille par voie intraveineuse et d’utiliser le volume minimal efficace à chaque site d’injection. L’échoguidage est recommandé afin d'éviter des extravasations et des injections intra-artérielles.
Une extrême prudence est recommandée en cas d’injection au niveau du pied et de la zone malléolaire du fait du risque accru d'injection accidentelle intra-artérielle. Seule la spécialité AETOXISCLEROL 0,50% (10 mg/2 mL) sous forme liquide peut être utilisée pour la sclérose des varicosités et des varices du pied et de la région périmalléolaire.
Lors du traitement de varices tronculaires, l’injection de mousse doit être effectuée à une distance minimum de 8 à 10 cm par rapport à la crosse, compte tenu du risque de passage d’un bolus de mousse dans le système veineux profond.
Risque de pigmentation
L'objectif de la sclérothérapie est de parvenir à la destruction optimale de la paroi du vaisseau avec la concentration minimale de produit sclérosant nécessaire pour le résultat clinique souhaité, une quantité et/ou une concentration trop importante risquant d’entraîner une pigmentation.
Une pigmentation peut être favorisée en cas d’épanchement sanguin au niveau du site d’injection (en particulier lors du traitement des veines superficielles de petit calibre avec les spécialités AETOXISCLEROL 0,25% (5 mg/2 mL) ou 0,50% (10 mg/2 mL) sous forme liquide et quand la compression n'est pas utilisée.
Surveillance post-injection
Pendant et dans les minutes qui suivent l’administration (15 minutes), il est impératif de surveiller les manifestations évocatrices d’une hypersensibilité (rougeur cutanée et conjonctivale, prurit, toux, difficulté respiratoire, ) et les manifestations neurologiques (scotomes, amaurose, migraine avec aura, paresthésie, déficit focalisé).
La mise en place d’une compression adaptée après le traitement d’une durée à apprécier par le praticien, peut également être envisagée pour réduire le risque de thrombose veineuse profonde.
Il est recommandé de réaliser un examen de suivi clinique et échographique dans un délai suffisant d’environ 1 mois, afin de contrôler l’efficacité du traitement et la survenue d’éventuels effets indésirables. En effet, des cas de thrombose veineuse profonde et d’embolie pulmonaire ont été rapportés après sclérothérapie de varices superficielles, jusqu’à 12 semaines après le traitement sclérosant.
Excipients
Ce médicament contient 84 mg d'alcool (éthanol) par ampoule. La quantité en volume de ce médicament équivaut à moins de 3 ml de bière ou 1 ml de vin. La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule, c.-à-d. qu’il est essentiellement « sans sodium ».
Ce médicament contient moins de 1 mmol (39 mg) de potassium par ampoule, c.-à-d. qu’il est essentiellement « sans potassium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
L’association aux bêta-bloquants risque de réduire les réactions cardiovasculaires de compensation en cas de choc anaphylactique.
4.6. Fertilité, grossesse et allaitement
Grossesse
La sécurité d’emploi au cours de la grossesse n'est pas établie. A ce jour, il n’existe pas ou peu de données sur l'administration d’AETOXISCLEROL chez la femme enceinte. Les études animales de reprotoxicité sont insuffisantes. Le traitement ne peut être initié qu’après la grossesse.
AETOXISCLEROL ne doit être utilisé qu'en cas de nécessité, pour le soulagement symptomatique, si les bénéfices potentiels l'emportent sur les risques potentiels pour le foetus.
On ne sait pas si le lauromacrogol 400 est excrété dans le lait maternel. La prudence est recommandée lorsqu’il est administré chez les femmes qui allaitent.
Fertilité
On ne sait pas si le lauromacrogol 400 affecte la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables les plus fréquemment rapportés sont : douleur au point d’injection, urticaire, thrombophlébite superficielle et pigmentation cutanée temporaire après traitement. Très rarement, une décoloration permanente peut persister le long du segment de veine sclérosée. L’ulcération peut se produire suite à l’extravasation du médicament. Il est important d'utiliser la plus faible quantité et/ou concentration possible pour scléroser la veine car la plupart des effets secondaires les plus fréquents sont dus à une concentration trop élevée (voir rubrique 4.2).
Très rarement, l’injection intra-artérielle est à l'origine d'une nécrose tissulaire importante, pouvant aller jusqu’à l’amputation.
Les effets indésirables les plus graves sont le choc anaphylactique, l'embolie pulmonaire, l’accident vasculaire cérébral et l’arrêt cardiaque ; des décès ont pu être rapportés chez des patients recevant du lauromacrogol.
Les effets indésirables rapportés avec la forme mousse sont les mêmes que ceux rapportés avec la forme liquide. Les troubles visuels et ou neurologiques du type scotomes, migraines sont rapportés plus fréquemment avec la forme mousse qu’avec la forme liquide.
Les effets indésirables sont indiqués ci-dessous par classe organique.
|
Système organe |
Effets indésirables |
|
Affections du système immunitaire |
Choc anaphylactique, angioedème, urticaire, asthme |
|
Affections du système nerveux |
Céphalées, migraine, aphasie, ataxie, hypoesthésie orale, hémiparésie, paresthésie, perte de conscience, état confusionnel, vertiges, accident ischémique transitoire (AIT), accident vasculaire cérébral (AVC), dysgueusie |
|
Affections oculaires |
Phosphènes, scotomes, amaurose |
|
Affections cardiaques |
Palpitations, arythmie, tachycardie, bradycardie, arrêt cardiaque, cardiomyopathie provoquée par le stress Du fait des propriétés arythmogènes du lauromacrogol, possibilité de collapsus cardio-vasculaire lié au passage systémique du produit |
|
Affections vasculaires |
Néovascularisation |
|
Thrombophlébite superficielle, phlébite |
|
|
Thrombose veineuse profonde |
|
|
Embolie pulmonaire |
|
|
Syncope vasovagale |
|
|
Vascularite, vascularite leucocytoclasique |
|
|
Spasme artériel |
|
|
Collapsus circulatoire |
|
|
Affections respiratoires, thoraciques et médiastinales |
Dyspnée, sensation d’oppression, toux |
|
Affections gastro-intestinales |
Nausée, vomissement |
|
Affections de la peau et du tissu sous-cutané |
Hyperpigmentation de la peau, ecchymose |
|
Dermatite allergique, urticaire de contact, érythème |
|
|
Hypertrichose (dans la zone traitée) |
|
|
Troubles généraux et accidents liés au site d’administration |
Douleur au point d’injection (court terme), thrombose au point d’injection (caillots sanguins intravariqueux locaux), hématome au point d’injection |
|
Induration, œdème Des réactions locales à type de nécrose en particulier au niveau de la peau et des tissus sous-jacents (et dans quelques rares cas, au niveau des nerfs), ont été observées dans le traitement des varices des jambes après l’injection par inadvertance dans les tissus environnants (injection paraveineuse). Le risque est accru avec l’augmentation des concentrations d’Aetoxisclérol et des volumes injectés. |
|
|
Fièvre, bouffées de chaleur, asthénie, malaise |
|
|
Affections musculosquelettiques et du tissu conjonctif |
Extrémités douloureuses |
|
Investigations |
Pression artérielle anormale |
|
Lésions et intoxications |
Lésion du nerf |
Les patients atteints d'un foramen ovale perméable (FOP) se sont avérés être plus susceptibles de souffrir d’effets indésirables neurologiques temporaires, tels que des troubles visuels et des migraines, en particulier après des injections avec de la mousse sclérosante.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
L’utilisation d’une concentration plus élevée que celle recommandée (voir rubrique 4.2) peut conduire à une pigmentation et/ou une nécrose tissulaire locale.
L’injection d’un volume trop important peut induire des effets indésirables systémiques (voir rubrique 4.4).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le lauromacrogol 400 est un agent sclérosant. L'injection intraveineuse induit la formation d’un thrombus. Cela entraîne généralement l’occlusion de la veine au niveau du site d’injection. La formation de tissu fibreux qui en résulte est à l'origine de l'oblitération veineuse partielle ou totale qui peut ou non être permanente.
Efficacité et sécurité clinique de la mousse sclérosante
La sclérothérapie à la mousse Aetoxisclérol repose sur des études cliniques contrôlées et des études cas-témoins utilisant une mousse d’Aetoxisclérol, homogène, à fines bulles et visqueuse.
Dans une étude multicentrique randomisée réalisée en ouvert (étude ESAF), 106 patients présentant une varice de la veine saphène interne ont été traités soit par Aetoxisclerol 3% sous forme de mousse, élaborée à l’aide du kit EasyFoam® de formation de mousse, soit avec Aetoxisclerol 3 % sous forme liquide. Le critère d’évaluation primaire a été la disparition d’un reflux de plus 0,5 seconde, mesurée par écho-doppler 3 cm au-dessous de la jonction saphéno-fémorale 3 mois après la dernière injection.
Après l’injection de mousse d’Aetoxisclerol, un pourcentage significativement supérieur de patients (69 %) a atteint le critère d’évaluation par rapport au groupe contrôle (27 %).
Les critères d’évaluation secondaire (occlusion de la veine, temps de reflux, temps de remplissage, satisfaction des patients, etc ) ont également été améliorés sous traitement par Aetoxisclerol mousse.
Le nombre de séances de traitement nécessaire pour atteindre un résultat thérapeutique a été en moyenne de 1,3 dans le groupe Aetoxisclerol mousse contre 1,6 dans le groupe contrôle.
Il n’a pas été observé de différences entre les 2 groupes concernant l’incidence des effets indésirables.
5.2. Propriétés pharmacocinétiques
La demi-vie est courte (1,6 heures). L’élimination est rapide dans les fèces et les urines.
5.3. Données de sécurité préclinique
Le lauromacrogol 400 a provoqué dans toutes les espèces étudiées une hématurie. À partir d’une posologie de 4 mg par kg de poids corporel par jour, il a été observé chez les rats mâles après une administration quotidienne pendant 7 jours consécutifs une augmentation du poids du foie, et à partir d’une posologie de 14 mg/kg/jour une augmentation des concentrations d’ALAT et d’ASAT.
Mutagénicité
Le test d’Ames ainsi que le test du micronoyau in vivo chez la souris ont donné des résultats négatifs. Dans le test d’aberrations chromosomiques in vitro, le lauromacrogol 400 a induit des polyploïdies dans les cellules de mammifères. Toutefois, dans le cadre d’une utilisation clinique, aucun potentiel génotoxique cliniquement significatif n’est à attendre.
Toxicité sur la reproduction
L’administration intraveineuse quotidienne de lauromacrogol 400 pendant plusieurs semaines ou au cours de l’organogenèse n’a pas induit chez le rat d’effet sur la fertilité des mâles et des femelles ou sur le développement embryonnaire précoce. Elle n’a pas non plus induit ni chez le rat ni chez le lapin d’effet tératogène, seuls des effets embryotoxiques et foetotoxiques (augmentation de la mortalité embryonnaire et foetale, diminution du poids des foetus) ont été observés à des doses toxiques pour la mère. Pendant une durée d’utilisation au cours de l’organogenèse limitée à des intervalles de 4 jours consécutifs, aucune toxicité maternelle ni embryonnaire ou foetale n’est survenue (chez le lapin).
Le développement périnatal et postnatal, le comportement et la reproduction n’ont pas été altérés chez des rats dont les mères ont reçu pendant la fin de la gestation et pendant la lactation du lauromacrogol 400 par voie intraveineuse tous les 2 jours. Le lauromacrogol 400 traverse la barrière placentaire chez le rat.
Avant ouverture de l’ampoule : 3 ans
Après ouverture de l’ampoule : Le produit doit être utilisé immédiatement. Si la totalité du produit n’est pas utilisée au cours de la séance, le produit résiduel doit être jeté.
6.4. Précautions particulières de conservation
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Ampoule de 2 mL (verre de type I). L’ampoule présente une barre de cassure.
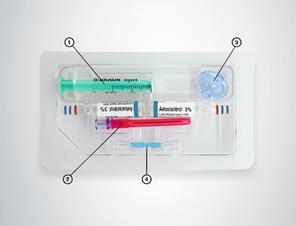
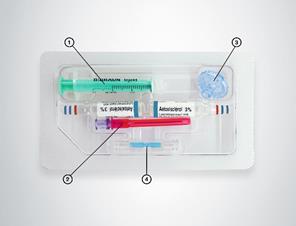
Boîte de 5 ampoules ou boîte de 2 ampoules ou boîte de 2 ampoules (verre) de 2 mL + kit de préparation de la mousse sclérosante (1 seringue luer-lock non siliconée de 3 mL, une aiguille filtrante (filtre de 5 micromètres) pour prélever le sclérosant, un connecteur et un filtre à air de porosité 0,2 micromètre).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur
Les informations suivantes sont destinées exclusivement aux professionnels de santé
L’utilisation d’AETOXISCLEROL doit être réservée aux praticiens expérimentés en anatomie veineuse, diagnostic et traitement des pathologies affectant le système veineux et préalablement formés à la technique d'injection.
Concernant spécifiquement la sclérothérapie à la mousse ces praticiens doivent être formés aux bonnes pratiques de préparation et d’administration de la mousse sclérosante
Des réactions allergiques (notamment des réactions anaphylactiques) ayant été observées, le médecin doit être préparé à la survenue possible d'une réaction anaphylactique et doit être prêt à la traiter convenablement. Le matériel de réanimation d'urgence doit être immédiatement disponible et le praticien formé à son utilisation.
Avant d’initier le traitement, le praticien doit informer le patient des risques graves que présente la technique envisagée : réactions anaphylactiques, évènements thromboemboliques, troubles du rythme cardiaque, réactions neurologiques et risques de nécrose tissulaire.
Le praticien doit rechercher les facteurs de risque du patient en l’interrogeant sur l’ensemble des contre-indications listées en rubrique 4.3 ainsi que sur les mises en garde listées en rubrique 4.4 dans le paragraphe « Précautions à prendre avant l’initiation du traitement ».
Afin de s’assurer de l’absence d’allergie et de la bonne tolérance du lauromacrogol, lors de l’initiation du traitement, il est nécessaire de commencer la première séance par l'administration d'une dose test de 0.1 mL sous forme liquide et de garder le patient en observation pendant 15 minutes avant de débuter le traitement.
Précautions à prendre lors de la manipulation et de l’administration d’AETOXISCLEROL sous forme liquide
Pour le choix de la concentration, le choix de la posologie et les quantités maximales à administrer par site d’injection et par séance de sclérothérapie voir la rubrique 4.2 Posologie et mode d’administration.
Ne pas diluer avant administration.
Respecter des conditions d’asepsie strictes lors de la préparation du produit à administrer et lors de son administration.
Inspecter visuellement les ampoules avant utilisation, les solutions contenant des particules ne doivent pas être utilisées.
Voie intraveineuse stricte
Pour l’injection au patient utiliser des aiguilles très fines et des seringues non siliconées coulissant bien et de manipulation aisée.
Bien s’assurer de la position de l’aiguille dans la varice idéalement sous contrôle échographique et administrer en petites quantités sur plusieurs sites d’injection le long de la veine si nécessaire.
Précautions à prendre lors de la manipulation et de l’administration d’AETOXISCLEROL sous forme mousse
Pour le choix de la concentration, le choix de la posologie et les quantités maximales à administrer par site d’injection et par séance de sclérothérapie voir la rubrique 4.2 Posologie et mode d’administration – Voir également le Guide Prescripteur en vigueur.
Ne pas diluer avant la préparation de la mousse.
Respecter des conditions d’asepsie strictes lors de la préparation du produit à administrer et lors de son administration.
Inspecter visuellement les ampoules avant utilisation, les solutions contenant des particules ne doivent pas être utilisées.
Voie intraveineuse stricte
Pour l’injection au patient utiliser des aiguilles fines (diamètre au moins 25G) et des seringues non siliconées coulissant bien et de manipulation aisée.
Sous contrôle échographique, bien s’assurer de la position de l’aiguille dans la varice, et administrer la mousse sclérosante en petites quantités sur plusieurs sites d’injection le long de la veine si nécessaire. La survenue d’un spasme témoigne de l’action de la mousse. Vérifier que le remplissage du segment à traiter est complet. Si besoin, compléter par une injection plus bas.
Préparation de la mousse sclérosante
Plusieurs techniques peuvent être utilisées pour préparer la mousse. Ces techniques consistent à mélanger la solution sclérosante avec de l’air stérile, en effectuant des passages répétés à travers
2 seringues reliées entre elles par un système de connexion soit à 2 voies soit à 3 voies.
1 - Concentration en AETOXISCLEROL requise
La mousse ne peut être préparée qu’avec les dosages en AETOXISCLEROL à 1%, 2% ou 3%.
2 - Choix du volume des seringues
Les seringues doivent être de manipulation aisée et être adaptées au volume de préparation souhaité, de préférence celui du volume maximal de mousse par point d’injection (correspondant à 2 mL de mousse).
3 - Ratio sclérosant / air
La composition de la mousse doit être de [1 unité de volume d’AETOXISCLEROL plus 4 unités de volume d’air stérile] soit 5 unités de volume de mousse préparée.
L’utilisation d’un filtre de porosité 0,2 μm est indispensable pour l’obtention d’une mousse stérile à partir de l’air ambiant.
4 - Raccords
Les raccords doivent permettre un verrouillage des seringues entre elles et une mise en pression lors de la préparation de la mousse.
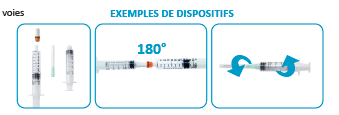
Le connecteur 2 voies est le plus fréquemment employé (connecteur double «femelle-femelle luer lock» à usage unique type connecteurs Kreussler ou Didactic) mais il existe également des connecteurs 3 voies.
|
|
Dispositif 2 voies
|
|
|
Dispositif 3 voies |
5 - Mouvements de va-et-vient du contenu des seringues
Le mouvement consiste en la transition de tout le contenu de la seringue n°1 dans la seringue n°2 puis de tout le contenu de la seringue n°2 dans la seringue n°1. Ce mouvement peut être réalisé avec ou sans compression.
6 - Qualité macroscopique d’une mousse pour injection intraveineuse
Vérifiez systématiquement l’aspect de la mousse préalablement à l’injection au patient.
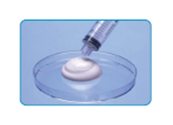
La mousse doit être compacte, homogène, sans bulle visible à l’oeil nu (ce qui signe des bulles d’air d’un diamètre < 0,3 mm). Un aspect dit « de crème Chantilly » signe une mousse suffisamment dense et de qualité pouvant être immédiatement administrée.
En cas de bulles d’air visibles à l’œil nu, la mousse doit être jetée et une nouvelle préparation réalisée.
|
|
Bonne mousse (aspect homogène, air non visible)
Mauvaise mousse (2 zones dans la seringue et bulles d’air apparentes) |
|
|
Aspect dit « de crème Chantilly » |
7 - Durée de la préparation
Du premier au dernier va-et-vient il doit s’écouler une dizaine de secondes.
8 - Temps maximal de conservation de la mousse
La mousse doit être injectée au maximum 60 secondes après le début de sa préparation. Après 60 secondes, la mousse résiduelle doit être jetée. En effet les bulles d’air coalescent entre elles au cours du temps, leur diamètre devenant incompatible avec une administration intraveineuse. Au-delà de 60 secondes il est impératif en cas de séance de sclérothérapie prolongée, de préparer une nouvelle quantité de mousse.
Mode d’emploi du kit Aetoxisclérol 3% fourni
Un kit, operculé et stérilisé est fourni comprenant une seringue luer-lock, non siliconée de 3 mL, une aiguille filtrante (filtre de 5 micromètres) pour prélever le sclérosant, un connecteur et un filtre à air de porosité 0,2 micromètre.
|
2.Filtre à air 3.Connecteur 4.Aiguille filtrante
|
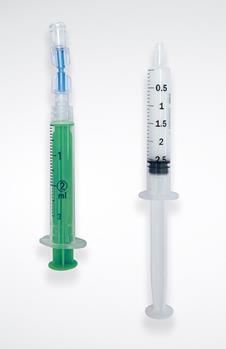
Préparation des éléments en conditions aseptiques Sortir de leur pochette tous les éléments du kit : seringue N°1, aiguille filtrante, connecteur et filtre à air. Préparer également une seconde seringue non siliconée pour l’injection (seringue N°2) ainsi qu’une aiguille pour l’administration, toutes 2 non fournies dans le kit. |
|
Raccord sur seringue non siliconée N°1
|
Prélèvement de l’air Prendre la seringue du kit (seringue N°1) et fixer le connecteur à son embout. Fixer le filtre sur la deuxième extrémité du connecteur. Vérifier que tous les éléments sont fermement connectés. Aspirer dans la seringue N°1 2,0 mL d’air (pour préparer 2,5 mL de mousse). |
|
Seringue N°2 non siliconée + aiguille filtrante
Etape de prélèvement dans l’ampoule |
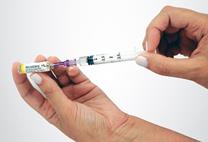
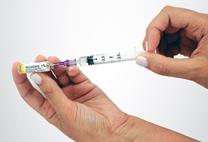
Prélèvement de l’agent sclérosant Fixer l’aiguille du kit à l’embout de la seringue N°2 et prélever exactement 0,5 mL d'Aetoxisclérol sans faire de bulle. Si présence d’air, l’expulser prudemment de la seringue. Attention : si la quantité d’Aetoxisclérol prélevée diffère des 0,5 mL recommandés, les propriétés physiques de la mousse seront modifiées. Il sera alors difficile de préparer une mousse de qualité standardisée. |
|
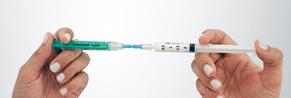
|
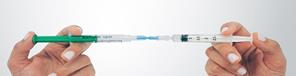
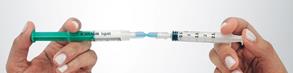
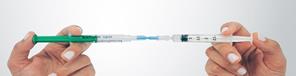
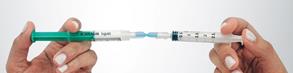
Préparation de la mousse Déconnecter le filtre du connecteur et connecter, immédiatement à sa place, la seringue N°2 avec le sclérosant en veillant à ne pas faire entrer d’air dans aucune des deux seringues. Maintenir des deux mains l’ensemble seringues – connecteur en tenant une seringue dans chaque main, le pouce placé sur son piston. Transférer rapidement, en une dizaine de secondes et par au moins 10 allers-retours, le contenu complet (2,5 mL de mousse) d’une seringue à l’autre. Créer une pression dans le système en limitant la course du piston d’une des deux seringues à la graduation 1,5 mL. |
|
Bonne mousse Mauvaise mousse |
Contrôle de la qualité de la mousse Se référer au paragraphe précédent point 6 « Qualité macroscopique d’une mousse pour injection intraveineuse »
|
|
|
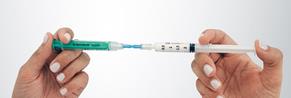
Déconnection du kit Faire passer toute la mousse préparée dans la seringue N°2 et la déconnecter du connecteur avant administration immédiatement au patient. |
|
Sous réserve de changer la seringue N°2 qui a servi à l’injection, il est possible de réutiliser la seringue N°1, le connecteur femelle/femelle et le filtre 0,2 micromètre pour préparer à nouveau 2,5 mL de mousse sclérosante pour compléter le traitement chez le même patient. Une ampoule de 2 mL d’Aetoxisclérol® 3% permet 3 préparations de 2,5 mL de mousse sclérosante. |
|
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
CHEMISCHE FABRIK KREUSSLER & CO GMBH
RHEINGAUSTRASSE 87-93
65203 WIESBADEN
ALLEMAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 347 753 0 7: 2 ml en ampoule (verre). Boîte de 5.
· 34009 303 119 6 7 : 2 ml en ampoule (verre). Boîte de 2.
· 34009 303 210 6 5 : 2 ampoules (verre) de 2 mL+ kit de préparation de la mousse sclérosante (1 seringue luer-lock non siliconée de 3 mL, une aiguille filtrante (filtre de 5 micromètres) pour prélever le sclérosant, un connecteur et un filtre à air de porosité 0,2 micromètre).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 25/06/2025
AETOXISCLEROL 3% (60 mg/2 mL), solution injectable
Lauromacrogol 400
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que AETOXISCLEROL 3% (60 mg/2 mL), solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser AETOXISCLEROL 3% (60 mg/2 mL), solution injectable ?
3. Comment utiliser AETOXISCLEROL 3% (60 mg/2 mL), solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver AETOXISCLEROL 3% (60 mg/2 mL), solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE AETOXISCLEROL 3% (60 mg/2 mL), solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - Agents sclérosants pour injection locale – code ATC C05BB02
AETOXISCLEROL contient du lauromacrogol 400 en tant que principe actif.
Ce produit fait partie d’une classe de médicaments appelés agents sclérosants. Les agents sclérosants sont des agents chimiques qui, lorsqu’ils sont injectés dans la veine atteinte, font gonfler les parois veineuses pour qu’elles adhèrent entre elles. Cela empêche la circulation du sang en transformant la veine en tissu cicatriciel. Au bout de quelques semaines, la veine disparaît.
Différentes concentrations d’AETOXISCLEROL sont utilisées pour le traitement des veines selon leur diamètre et leur localisation. La concentration AETOXISCLEROL 3% est indiquée dans la sclérose des varices de moyen et gros calibre.
AETOXISCLEROL ne peut être utilisé que chez les adultes. Ce dosage à 3% peut être administré sous forme liquide ou sous forme de mousse.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER AETOXISCLEROL 3% (60 mg/2 mL), solution injectable ?
N’utilisez jamais AETOXISCLEROL 3% (60 mg/2 mL), solution injectable dans les cas suivants :
· si vous êtes allergique au lauromacrogol 400 ou à l'un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 de cette notice
· si vous avez une anomalie connue d’une cloison du cœur (foramen ovale perméable symptomatique connu).
· si vous avez un risque élevé de thrombose (risque de développement de caillots sanguins dans vos veines ou artères) notamment en cas de troubles sanguins héréditaires tels que la thrombophilie, ou si vous souffrez d’un cancer, ou si vous êtes immobilisés ou alités de façon prolongée et ce quelle qu’en soit la cause ou si vous présentez plusieurs facteurs de risque cumulés tels que:
o tabagisme
o prise d’une contraception hormonale (« la pilule », par ex.) ou d’un traitement hormonal substitutif (THS)
o hypertension artérielle
o obésité
· si vous avez eu un épisode thrombo-embolique (caillot qui obstrue un vaisseau sanguin) dans les veines superficielles ou profondes (notamment dans les membres inférieurs), dans le cœur (infarctus), dans les poumons (embolie pulmonaire), au niveau du cerveau (accident vasculaire ischémique cérébral)
· si vous avez une artère obstruée
· si vous avez subi une intervention chirurgicale depuis moins de 3 mois
· si vous avez des varices causées par des tumeurs pelviennes ou abdominales, sauf si la tumeur a été retirée
· si vous avez des problèmes de fermeture des valves dans les veines profondes (insuffisance valvulaire)
· si vous êtes atteint d’un syndrome dit de phlébite migrante
· si vous avez une maladie non contrôlée, tel le diabète de type I, des problèmes de thyroïde, la tuberculose, de l’asthme, une affection respiratoire aigüe, un empoisonnement du sang, ou de récents problèmes de peau
· si vous avez des lésions cutanées (érysipèles) ou une inflammation des vaisseaux lymphatiques (lymphangite) au niveau de la zone à traiter
· si vous êtes atteint d’une infection de quelque nature que ce soit
Avertissements et précautions
AETOXISCLEROL ne doit être administré que par un médecin expérimenté en anatomie veineuse, diagnostic et traitement des pathologies affectant le système veineux et préalablement formé à la technique d’injection. De plus concernant spécifiquement la sclérothérapie à la mousse ces praticiens doivent être formés aux bonnes pratiques de préparation et d’administration de la mousse sclérosante.
Avant d’initier le traitement votre médecin devra vous informer des risques d’effets indésirables graves liés au traitement tels un choc d'origine allergique (ou réaction anaphylactique), la formation de caillots dans votre organisme (ou évènement thrombo-embolique), des réactions neurologiques (fortes migraines) et des risques de nécrose tissulaire pouvant conduire jusqu’à l’amputation.
Votre médecin vous posera également des questions relatives à votre état de santé et évaluera avec vous et pour vous, la balance bénéfice-risque d’une sclérothérapie par AETOXISCLEROL au regard des contre-indications absolues listées ci-dessus et des précautions d’emploi présentées ci-après.
Adressez-vous à votre médecin avant d’utiliser AETOXISCLEROL en cas de :
· forte prédisposition aux allergies, votre médecin pourra décider de vous faire une dose test d’AETOXISCLEROL avant de commencer la séance de sclérothérapie
· hyperactivité bronchique, difficultés respiratoires, asthme
· prédisposition élevée à un risque thrombo-embolique et risque vasculaire
· affection cardiaque type arythmie ventriculaire
· anomalie connue mais asymptomatique d’une cloison du cœur (foramen ovale perméable) surtout si vous souffrez ou avez des antécédents d'hypertension artérielle pulmonaire
· athérosclérose (maladie de vos artères ou de vos veines)
· inflammation grave ou caillots dans les artères et les veines des mains et des pieds (maladie de Buerger)
· migraine, ou si vous avez ressenti des troubles visuels, psychiques ou neurologiques au décours d’une précédente séance de sclérothérapie
Pendant et dans les minutes qui suivent l'injection, votre médecin surveillera les manifestations évocatrices d'une allergie (rougeur cutanée ou de l'œil, démangeaison, toux, difficulté à respirer ) et les manifestations neurologiques (troubles visuels, migraine avec aura, sensation de fourmillements, déficit neurologique).
A la suite de la séance de sclérothérapie votre médecin vous demandera de revenir le voir pour une visite de suivi.
Enfants et adolescents
AETOXISCLEROL n’est pas indiqué chez l’enfant et l’adolescent.
Autres médicaments et AETOXISCLEROL 3% (60 mg/2 mL), solution injectable
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament y compris des médicaments obtenus sans ordonnance.
AETOXISCLEROL 3% (60 mg/2 mL), solution injectable avec des aliments, boissons et de l’alcool
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
On ne dispose pas d'informations sur l'utilisation d’AETOXISCLEROL chez les femmes enceintes. AETOXISCLEROL ne doit pas être utilisé pendant la grossesse sauf en cas de stricte nécessité. Votre médecin décidera si ce traitement vous convient.
On ne sait pas si AETOXISCLEROL est excrété dans le lait maternel. Si vous allaitez, le médecin décidera si AETOXISCLEROL peut être utilisé.
Conduite de véhicules et utilisation de machines
Sans objet.
AETOXISCLEROL 3% (60 mg/2 mL), solution injectable contient de l’éthanol à 96 pour cent, du sodium et du potassium :
Ce médicament contient 84 mg d'alcool (éthanol) par ampoule. La quantité en volume de ce médicament équivaut à moins de 3 ml de bière ou 1 ml de vin. La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule, c.-à-d. qu’il est essentiellement « sans sodium ».
Ce médicament contient moins de 1 mmol (39 mg) de potassium par ampoule, c.-à-d. qu’il est essentiellement « sans potassium ».
3. COMMENT UTILISER AETOXISCLEROL 3% (60 mg/2 mL), solution injectable ?
Vous ne devez en aucun cas essayer de vous injecter AETOXISCLEROL par vous-même. Ce produit doit toujours être administré par un médecin expérimenté en anatomie veineuse préalablement formé à la technique d’injection pour sclérothérapie ainsi qu’aux bonnes pratiques de préparation et d’administration de la mousse sclérosante.
En raison du volume limité de sclérosant autorisé par séance, des séances répétées de sclérothérapie peuvent être nécessaires.
Après avoir été traité par AETOXISCLEROL, veuillez suivre les conseils de votre médecin.
Si vous avez utilisé plus de AETOXISCLEROL 3% (60 mg/2 mL), solution injectable que vous n’auriez dû :
Sans objet.
Si vous oubliez d’utiliser AETOXISCLEROL 3% (60 mg/2 mL), solution injectable :
Sans objet.
Si vous arrêtez d’utiliser AETOXISCLEROL 3% (60 mg/2 mL), solution injectable :
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Effets indésirables graves
Si vous ressentez l’un des effets graves suivants pendant l’injection le traitement par AETOXISCLEROL devra être arrêté, mais si un de ces effets indésirables survient après l’injection contactez immédiatement votre médecin ou rendez-vous au service des urgences le plus proche.
Certains effets indésirables tels que des palpitations, une hypotension, une difficulté à respirer, une toux et de fortes démangeaisons sont susceptibles d’être le signe d’un choc anaphylactique qui est une forme très grave de réaction allergique extrêmement rare mais qui doit être traitée immédiatement, sinon elle peut être fatale.
Une élévation du rythme cardiaque, une sensation d'oppression thoracique, une douleur thoracique, un malaise avec perte de connaissance ou un essoufflement sont susceptibles d’être les signes d’un arrêt cardiaque.
Des effets indésirables de formation de caillots de sang dans les veines et les artères (thromboses) peuvent survenir, comme par exemple un AVC ou accident vasculaire cérébral (un caillot sanguin au niveau du cerveau), une embolie pulmonaire (un caillot au niveau des poumons) ou une thrombophlébite (un caillot de sang dans une veine). Les principaux signes d’alerte sont une sensation d'oppression thoracique, une douleur thoracique, un essoufflement, une élévation de la fréquence cardiaque, des palpitations, un trouble transitoire de la vision, des troubles de la parole, un malaise avec perte de connaissance, une migraine avec ou sans aura, des maux de tête, des fourmillements ou picotements dans les extrémités des mains et des jambes pouvant aller vers une paralysie, une douleur du mollet associée ou non à un gonflement ou à une rougeur. Pour éviter ce type d’effet indésirable très grave, ce produit est contre-indiqué chez les patients qui présentent un risque de formation de caillots dans les veines et les artères.
Des réactions locales à type de nécrose, en particulier au niveau de la peau et des tissus sous-jacents (et dans quelques rares cas, au niveau des nerfs) ont été observées dans le traitement des varices des jambes après injection par inadvertance dans les tissus environnants (injection paraveineuse).
Effets indésirables fréquents
Les effets indésirables les plus fréquents sont la douleur au niveau du site d'injection, une peau rouge avec des démangeaisons (urticaire), une décoloration temporaire de la peau, une thrombophlébite superficielle (caillot de sang dans une veine superficielle).
Les effets indésirables suivants ont été observés.
· Affections du système immunitaire :
Choc anaphylactique (difficulté respiratoire soudaine, vertiges, chute de la tension), angioœdème (gonflements soudains, notamment de la face, des paupières, des lèvres ou du larynx), urticaire, asthme.
· Affections du système nerveux :
Maux de tête, migraine, troubles du langage (aphasie), troubles de coordination (ataxie), sensation de bouche engourdie, troubles sensitifs localisés (hémiparésie, paresthésie), perte de conscience, état confusionnel, vertiges, accident vasculaire cérébral (AVC), accident ischémique transitoire (AIT), troubles du goût (dysgueusie).
· Affections oculaires :
Troubles visuels (sensation de lumière ou apparition de tâches, diminution brutale et temporaire de la vision)
· Affections cardiaques
Palpitations, troubles du rythme cardiaque, accélération du rythme cardiaque, diminution du rythme cardiaque, arrêt cardiaque, cardiomyopathie provoquée par le stress. En raison des effets potentiels du produit sur le rythme cardiaque, possibilité de chute brutale de la pression artérielle.
· Affections vasculaires :
Apparition de vaisseaux sanguins dans la zone de sclérose qui n'étaient pas visibles avant le traitement (néovascularisation), caillot de sang dans une veine superficielle (thrombophlébite superficielle), inflammation veineuse (phlébite), thrombose veineuse profonde, embolie pulmonaire, malaise, perte de connaissance (syncope vasovagale), inflammation de la paroi du vaisseau (vascularite), spasme (constriction) d’une artère, chute brutale de la pression artérielle.
· Affections respiratoires, thoraciques et médiastinales :
Détresse respiratoire (dyspnée), sensation d'oppression, toux.
· Affections gastro-intestinales :
Nausée, vomissement.
· Affections de la peau et du tissu sous-cutané :
Coloration de la peau (hyperpigmentation), hémorragie cutanée (ecchymose), réaction cutanée allergique (dermatite), urticaire de contact, rougeur (érythème), poussée excessive de poils (hypertrichose) dans la zone traitée.
· Troubles généraux et accidents liés au site d'administration :
Douleur à court terme au point d'injection, thrombose au point d'injection (caillots sanguins intravariqueux locaux), hématome au point d’injection, mort du tissu local (nécrose), induration, œdème, fièvre, bouffée de chaleur, asthénie, malaise.
· Affections musculosquelettiques et du tissu conjonctif
Extrémités douloureuses
· Investigations :
Tension artérielle anormale (élévation ou diminution).
· Lésions et intoxications :
Lésion d'un nerf.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER AETOXISCLEROL 3% (60 mg/2 mL), SOLUTION INJECTABLE ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage. La date de péremption fait référence au dernier jour de ce mois.
Pas de précautions particulières de conservation.
Usage unique.
Après ouverture : le produit doit être utilisé immédiatement. Si la totalité du produit n’est pas utilisée au cours de la séance, le produit résiduel doit être jeté.
N’utilisez pas ce médicament si vous remarquez des particules dans la solution.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient AETOXISCLEROL 3% (60 mg/2 mL), solution injectable
· La substance active est :
Lauromacrogol 400 .......................................................................................................... .60,00 mg
Pour une ampoule de 2 mL.
· Les autres composants sont :
· Hydrogénophosphate de sodium dihydraté, dihydrogénophosphate de potassium, éthanol 96 pour cent, eau pour préparations injectables.
Qu’est-ce que AETOXISCLEROL 3% (60 mg/2 mL), solution injectable et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution injectable. Boîte de 5 ampoules ou boîte de 2 ampoules ou boîte de 2 ampoules (verre) de 2 mL + kit de préparation de la mousse sclérosante (1 seringue luer-lock non siliconée de 3 mL, une aiguille filtrante (filtre de 5 micromètres) pour prélever le sclérosant, un connecteur et un filtre à air de porosité 0,2 micromètre).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
CHEMISCHE FABRIK KREUSSLER & CO GMBH
RHEINGAUSTRASSE 87-93
65203 WIESBADEN
ALLEMAGNE
Exploitant de l’autorisation de mise sur le marché
LABORATOIRE KREUSSLER PHARMA
18 AVENUE PARMENTIER
75011 PARIS
FRANCE
CHEMISCHE FABRIK KREUSSLER & CO. GMBH
RHEINGAUSTRASSE 87-93
65203 WIESBADEN
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé
Veuillez consulter le Résumé des Caractéristiques du Produit (RCP) pour plus de détails sur ce produit.
L’utilisation d’AETOXISCLEROL doit être réservée aux praticiens expérimentés en anatomie veineuse, diagnostic et traitement des pathologies affectant le système veineux et préalablement formés à la technique d'injection.
Concernant spécifiquement la sclérothérapie à la mousse ces praticiens doivent être formés aux bonnes pratiques de préparation et d’administration de la mousse sclérosante.
Des réactions allergiques (notamment des réactions anaphylactiques) ayant été observées, le médecin doit être préparé à la survenue possible d'une réaction anaphylactique et doit être prêt à la traiter convenablement. Le matériel de réanimation d'urgence doit être immédiatement disponible et le praticien formé à son utilisation.
Avant d’initier le traitement, le praticien doit informer le patient des risques graves que présente la technique envisagée : réactions anaphylactiques, évènements thromboemboliques, troubles du rythme cardiaque, réactions neurologiques et risques de nécrose tissulaire.
Le praticien doit rechercher les facteurs de risque du patient en l’interrogeant sur l’ensemble des contre-indications listées en rubrique 4.3 ainsi que sur les mises en garde listées en rubrique 4.4 dans le paragraphe « Précautions à prendre avant l’initiation du traitement ».
Afin de s’assurer de l’absence d’allergie et de la bonne tolérance du lauromacrogol, lors de l’initiation du traitement, il est nécessaire de commencer la première séance par l'administration d'une dose test de 0.1 mL sous forme liquide et de garder le patient en observation pendant 15 minutes avant de débuter le traitement.
Précautions à prendre lors de la manipulation et de l’administration d’AETOXISCLEROL sous forme liquide
Le volume total recommandé est de 1 à 4 mL de solution injectable par séance, répartis en plusieurs sites d’injection, en respectant des volumes de 0,1 à 2 mL maximum par site d’injection.
Ne pas dépasser le volume maximal de 4 mL de liquide injecté par séance.
Ne pas diluer avant administration.
Respecter des conditions d’asepsie strictes lors de la préparation du produit à administrer et lors de son administration.
Inspecter visuellement les ampoules avant utilisation, les solutions contenant des particules ne doivent pas être utilisées.
Voie intraveineuse stricte
Pour l’injection au patient utiliser des aiguilles très fines et des seringues non siliconées coulissant bien et de manipulation aisée.
Bien s’assurer de la position de l’aiguille dans la varice idéalement sous contrôle échographique et administrer en petites quantités sur plusieurs sites d’injection le long de la veine si nécessaire.
Précautions à prendre lors de la manipulation et de l’administration d’AETOXISCLEROL sous forme mousse
Le volume total recommandé est de 2 à 10 mL de mousse injectable par séance, répartis en plusieurs sites d’injection, en respectant des volumes de mousse de 0,1 à 2 mL maximum par site d’injection.
Ne pas dépasser le volume maximal de 10 mL de mousse injectée par séance.
Ne pas diluer avant la préparation de la mousse.
Respecter des conditions d’asepsie strictes lors de la préparation du produit à administrer et lors de son administration.
Inspecter visuellement les ampoules avant utilisation, les solutions contenant des particules ne doivent pas être utilisées.
Voie intraveineuse stricte
Pour l’injection au patient utiliser des aiguilles fines (diamètre au moins 25G) et des seringues non siliconées coulissant bien et de manipulation aisée.
Sous contrôle échographique, bien s’assurer de la position de l’aiguille dans la varice, et administrer la mousse sclérosante en petites quantités sur plusieurs sites d’injection le long de la veine si nécessaire. La survenue d’un spasme témoigne de l’action de la mousse. Vérifier que le remplissage du segment à traiter est complet. Si besoin, compléter par une injection plus bas.
Préparation de la mousse sclérosante
Plusieurs techniques peuvent être utilisées pour préparer la mousse. Ces techniques consistent à mélanger la solution sclérosante avec de l’air stérile, en effectuant des passages répétés à travers
2 seringues reliées entre elles par un système de connexion soit à 2 voies soit à 3 voies.
1 - Concentration en AETOXISCLEROL requise
La mousse ne peut être préparée qu’avec les dosages en AETOXISCLEROL à 1%, 2% ou 3%.
2 - Choix du volume des seringues
Les seringues doivent être de manipulation aisée et être adaptées au volume de préparation souhaité, de préférence celui du volume maximal de mousse par point d’injection (correspondant à 2 mL de mousse).
3 - Ratio sclérosant / air
La composition de la mousse doit être de [1 unité de volume d’AETOXISCLEROL plus 4 unités de volume d’air stérile] soit 5 unités de volume de mousse préparée.
L’utilisation d’un filtre de porosité 0,2 μm est indispensable pour l’obtention d’une mousse stérile à partir de l’air ambiant.
4 - Raccords
Les raccords doivent permettre un verrouillage des seringues entre elles et une mise en pression lors de la préparation de la mousse.
Le connecteur 2 voies est le plus fréquemment employé (connecteur double «femelle-femelle luer lock» à usage unique type connecteurs Kreussler ou Didactic) mais il existe également des connecteurs 3 voies.
|
|
Dispositif 2 voies
|
|
|
Dispositif 3 voies |
5 - Mouvements de va-et-vient du contenu des seringues
Le mouvement consiste en la transition de tout le contenu de la seringue n°1 dans la seringue n°2 puis de tout le contenu de la seringue n°2 dans la seringue n°1. Ce mouvement peut être réalisé avec ou sans compression.
6 - Qualité macroscopique d’une mousse pour injection intraveineuse
Vérifiez systématiquement l’aspect de la mousse préalablement à l’injection au patient.
La mousse doit être compacte, homogène, sans bulle visible à l’oeil nu (ce qui signe des bulles d’air d’un diamètre < 0,3 mm). Un aspect dit « de crème Chantilly » signe une mousse suffisamment dense et de qualité pouvant être immédiatement administrée.
En cas de bulles d’air visibles à l’œil nu, la mousse doit être jetée et une nouvelle préparation réalisée.
|
|
Bonne mousse (aspect homogène, air non visible)
Mauvaise mousse (2 zones dans la seringue et bulles d’air apparentes) |
|
|
Aspect dit « de crème Chantilly » |
7 - Durée de la préparation
Du premier au dernier va-et-vient il doit s’écouler une dizaine de secondes.
8 - Temps maximal de conservation de la mousse
La mousse doit être injectée au maximum 60 secondes après le début de sa préparation. Après 60 secondes, la mousse résiduelle doit être jetée. En effet les bulles d’air coalescent entre elles au cours du temps, leur diamètre devenant incompatible avec une administration intraveineuse. Au-delà de 60 secondes il est impératif en cas de séance de sclérothérapie prolongée, de préparer une nouvelle quantité de mousse.
Mode d’emploi du kit Aetoxisclérol 3% fourni
Un kit, operculé et stérilisé est fourni comprenant une seringue luer-lock, non siliconée de 3 mL, une aiguille filtrante (filtre de 5 micromètres) pour prélever le sclérosant, un connecteur et un filtre à air de porosité 0,2 micromètre.
|
2.Filtre à air 3.Connecteur 4.Aiguille filtrante
|
Préparation des éléments en conditions aseptiques Sortir de leur pochette tous les éléments du kit : seringue N°1, aiguille filtrante, connecteur et filtre à air. Préparer également une seconde seringue non siliconée pour l’injection (seringue N°2) ainsi qu’une aiguille pour l’administration, toutes 2 non fournies dans le kit. |
|
Raccord sur seringue non siliconée N°1
|
Prélèvement de l’air Prendre la seringue du kit (seringue N°1) et fixer le connecteur à son embout. Fixer le filtre sur la deuxième extrémité du connecteur. Vérifier que tous les éléments sont fermement connectés. Aspirer dans la seringue N°1 2,0 mL d’air (pour préparer 2,5 mL de mousse). |
|
Seringue N°2 non siliconée + aiguille filtrante
Etape de prélèvement dans l’ampoule |
Prélèvement de l’agent sclérosant Fixer l’aiguille du kit à l’embout de la seringue N°2 et prélever exactement 0,5 mL d'Aetoxisclérol sans faire de bulle. Si présence d’air, l’expulser prudemment de la seringue. Attention : si la quantité d’Aetoxisclérol prélevée diffère des 0,5 mL recommandés, les propriétés physiques de la mousse seront modifiées. Il sera alors difficile de préparer une mousse de qualité standardisée. |
|
|
Préparation de la mousse Déconnecter le filtre du connecteur et connecter, immédiatement à sa place, la seringue N°2 avec le sclérosant en veillant à ne pas faire entrer d’air dans aucune des deux seringues. Maintenir des deux mains l’ensemble seringues – connecteur en tenant une seringue dans chaque main, le pouce placé sur son piston. Transférer rapidement, en une dizaine de secondes et par au moins 10 allers-retours, le contenu complet (2,5 mL de mousse) d’une seringue à l’autre. Créer une pression dans le système en limitant la course du piston d’une des deux seringues à la graduation 1,5 mL. |
|
Bonne mousse Mauvaise mousse |
Contrôle de la qualité de la mousse Se référer au paragraphe précédent point 6 « Qualité macroscopique d’une mousse pour injection intraveineuse »
|
|
|
Déconnection du kit Faire passer toute la mousse préparée dans la seringue N°2 et la déconnecter du connecteur avant administration immédiatement au patient. |
|
Sous réserve de changer la seringue N°2 qui a servi à l’injection, il est possible de réutiliser la seringue N°1, le connecteur femelle/femelle et le filtre 0,2 micromètre pour préparer à nouveau 2,5 mL de mousse sclérosante pour compléter le traitement chez le même patient. Une ampoule de 2 mL d’Aetoxisclérol® 3% permet 3 préparations de 2,5 mL de mousse sclérosante. |
|

 1.Seringue N°1
1.Seringue N°1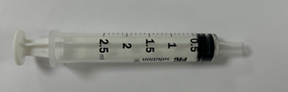 Seringue N°2 non fournie
Seringue N°2 non fournie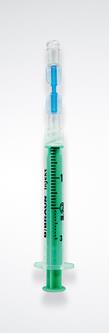
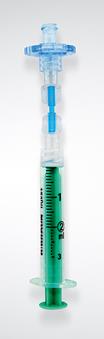






 1.Seringue N°1
1.Seringue N°1 Seringue N°2 non fournie
Seringue N°2 non fournie