Dernière mise à jour le 02/02/2026
NETAXEN 1 mg/3 mg par ml, collyre en solution en récipient unidose
Indications thérapeutiques
NETAXEN contient deux médicaments : la nétilmicine et la dexaméthasone.
· La nétilmicine est un antibiotique qui tue les bactéries.
· La dexaméthasone est un corticoïde qui diminue l’inflammation.
NETAXEN est utilisé chez les adultes pour tuer les bactéries et diminuer l’inflammation oculaire lorsque les yeux sont gonflés, irrités et probablement infectés par des bactéries.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien à la fin du traitement.
Présentations
> 4 sachets de 5 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 0,3 ml
Code CIP : 34009 302 010 0 8
Déclaration de commercialisation : 19/02/2025
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 10/01/2023
NETAXEN 1 mg/3 mg par ml, collyre en solution en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un mL contient :
4,55 mg de sulfate de nétilmicine équivalant à 3 mg de nétilmicine.
1,32 mg de phosphate disodique de dexaméthasone équivalant à 1 mg de dexaméthasone.
Chaque récipient unidose contient :
1,36 mg de sulfate de nétilmicine équivalant à 0,9 mg de nétilmicine.
0,4 mg de phosphate disodique de dexaméthasone équivalant à 0,3 mg de dexaméthasone.
Excipients à effet notoire : phosphate monosodique monohydraté 1,47 mg, phosphate disodique dodécahydraté 10 mg.
Pour la liste complète des excipients, voir rubrique 6.1.
Collyre en solution en récipient unidose.
Solution limpide incolore ou légèrement jaune.
pH : 6,7 à 7,7
Osmolalité : 0,270 à 0,330 Osmol/kg.
4.1. Indications thérapeutiques
Lors de la prescription de NETAXEN, il convient de tenir compte des recommandations officielles concernant l’utilisation appropriée des antibactériens.
4.2. Posologie et mode d'administration
Voie ophtalmique.
Adultes (y compris les sujets âgés)
Instiller une goutte dans le cul‑de‑sac conjonctival de l’œil ou des yeux à traiter quatre fois par jour ou conformément à la prescription médicale.
L’occlusion du canal lacrymo‑nasal ou la fermeture des paupières pendant deux minutes permet de réduire l’absorption systémique. Cela peut diminuer les effets indésirables systémiques et augmenter l’activité locale.
Population pédiatrique
La sécurité et l’efficacité de NETAXEN chez les enfants et adolescents âgés de moins de 18 ans n’ont pas encore été établies.
Aucune donnée n’est disponible.
Chez les enfants et adolescents, le médicament ne doit être prescrit qu’après une évaluation attentive du rapport bénéfice‑risque et doit être administré sous surveillance médicale étroite.
Mode d’administration
Avant utilisation, vérifier que le récipient unidose est intact.
1. Se laver les mains et s’asseoir en position confortable.
2. Ouvrir le sachet en aluminium contenant les récipients unidose.
3. Détacher un récipient unidose de la bande et replacer les récipients non ouverts dans le sachet.
![]()
4. Ouvrir en tournant la partie supérieure sans tirer. Ne pas toucher l’embout après avoir ouvert le récipient.

5. Pencher la tête en arrière.
6. Avec le doigt, tirer doucement la paupière inférieure de l’œil à traiter vers le bas.
7. Retourner le récipient unidose et placer l’embout du récipient près de l’œil, mais sans qu’il touche l’œil. Ne pas toucher l’œil ou la paupière avec l’embout du récipient.

8. Presser le récipient unidose de façon à instiller une seule goutte puis relâcher la paupière inférieure.
9. Fermer l’œil et appuyer avec le doigt sur le coin interne de l’œil traité pendant deux minutes.
10. Répéter l’instillation dans l’autre œil conformément à la prescription médicale.
11. Eliminer le récipient unidose après utilisation.
NETAXEN collyre en récipient unidose doit être utilisé immédiatement après l’ouverture du récipient.
Après l’administration, le récipient unidose et toute solution restante doivent être éliminés.
Précautions à prendre avant la manipulation ou l’administration du médicament
L’utilisation de lentilles de contact en cas d’infection ou d’inflammation oculaire superficielle est fortement déconseillée.
Les patients doivent être informés qu’en cas de manipulation incorrecte, les collyres peuvent être contaminés par des bactéries, ce qui peut entraîner des infections oculaires. L’utilisation d’un collyre contaminé peut provoquer une atteinte oculaire grave et une perte de vision ultérieure.
En cas d’utilisation de plusieurs médicaments ophtalmiques, ceux‑ci doivent être administrés en respectant un intervalle d’au moins 10 minutes. Les pommades ophtalmiques doivent être appliquées en dernier.
Durée du traitement
La durée de traitement habituelle peut aller de 5 à 14 jours.
Le médicament contient un corticoïde ; par conséquent, son utilisation est contre‑indiquée en cas de :
1) hypertension oculaire ;
2) kératite herpétique ou autres infections oculaires à Herpes simplex ;
3) infections virales de la cornée et de la conjonctive ;
4) infections oculaires fongiques ;
5) infections oculaires mycobactériennes.
4.4. Mises en garde spéciales et précautions d'emploi
NETAXEN est à usage ophtalmique uniquement et ne doit pas être administré par voie orale ni introduit dans la chambre antérieure de l’œil.
La pression intraoculaire doit être surveillée régulièrement en cas de traitement d’une durée de plus de 15 jours.
Une utilisation de longue durée peut entraîner une hypertension oculaire/un glaucome avec l’atteinte du nerf optique et les défauts d’acuité et de champ visuels en résultant.
L’utilisation prolongée de corticoïdes peut entraîner :
1) le développement d’une cataracte sous‑capsulaire postérieure ;
2) des retards de cicatrisation ;
3) une diminution de la réponse de l’hôte et donc un risque accru d’infections oculaires secondaires, en particulier fongiques ou virales.
Dans les infections oculaires aiguës purulentes, l’administration de corticoïdes peut masquer ou exacerber l’infection. Des cas de perforation ont été rapportés avec l’utilisation de corticoïdes topiques chez des patients présentant des affections provoquant un amincissement de la cornée ou de la sclérotique.
Une sensibilité aux aminosides administrés par voie topique peut survenir chez certains patients. Dans ce cas, le traitement doit être arrêté.
Ce médicament contient de la dexaméthasone ; il doit être utilisé avec précaution chez les patients présentant un glaucome et son utilisation doit être envisagée avec prudence chez les patients ayant des antécédents familiaux de glaucome.
Ce médicament contient des phosphates, ce qui peut provoquer des dépôts cornéens ou une opacité cornéenne en cas d’administration topique. Il doit être utilisé avec précautions chez les patients présentant des lésions de la cornée et recevant une polymédication par d’autres médicaments ophtalmiques contenant des phosphates (voir rubrique 4.5).
En l’absence d’amélioration clinique significative en quelques jours ou en cas d’apparition d’une irritation ou d’une sensibilisation, le traitement doit être arrêté et un traitement approprié doit être instauré.
Troubles visuels
Des troubles visuels peuvent être observés lors d’une corticothérapie par voie systémique ou topique. Si un patient présente des symptômes tels que vision floue ou autres troubles visuels, il est recommandé de l’adresser à un ophtalmologiste pour une investigation des causes possibles, qui peuvent être une cataracte, un glaucome ou des maladies rares telles que la choriorétinopathie séreuse centrale (CRSC) qui a été décrite après l’utilisation de corticoïdes systémiques et topiques.
Population pédiatrique
L’utilisation de NETAXEN chez les enfants et adolescents n’est pas recommandée (voir rubrique 4.2).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée avec NETAXEN.
Des informations sur chacun des composants sont présentées ci‑dessous.
Nétilmicine
Il n’a pas été rapporté d’interactions significatives avec d’autres médicaments lors de l’utilisation de la nétilmicine collyre en solution.
L’administration concomitante d’autres antibiotiques potentiellement néphrotoxiques et ototoxiques (même topique, en particulier par voie intracavitaire), peut majorer le risque de ces effets.
Une augmentation éventuelle de la néphrotoxicité de certains aminosides a été rapportée après l’administration concomitante ou ultérieure d’autres médicaments potentiellement néphrotoxiques tels que : cisplatine, polymyxine B, colistine, viomycine, streptomycine, vancomycine, autres aminosides et certaines céphalosporines (céphaloridine) ou diurétiques puissants tels que l’acide éthacrynique et le furosémide en raison de leurs effets sur les reins.
L’administration concomitante ou séquentielle de ces médicaments avec la nétilmicine doit être évitée.
In vitro, l’association d’un aminoside et d’une bêta‑lactamine (pénicillines ou céphalosporines) peut entraîner une inactivation réciproque significative.
Une diminution de la demi‑vie ou de la concentration plasmatique de l’aminoside a été observée chez des patients atteints d’insuffisance rénale et chez certains patients ayant une fonction rénale normale, même lorsque l’aminoside et l’antibiotique de type pénicilline étaient administrés par deux voies différentes.
Dexaméthasone
Le risque d’hypertension oculaire associé à une corticothérapie de longue durée est augmenté en cas d’utilisation concomitante d’anticholinergiques, en particulier d’atropine et de composés apparentés, chez les patients prédisposés au glaucome aigu par fermeture de l’angle.
Les inhibiteurs du CYP3A4 (dont le ritonavir et le cobicistat) peuvent diminuer la clairance de la dexaméthasone, ce qui peut entraîner une augmentation des effets de celle‑ci et une insuffisance surrénalienne ou un syndrome de Cushing. L’association doit être évitée, sauf si le bénéfice est supérieur au risque accru d’effets indésirables systémiques des corticoïdes ; dans ce cas, les patients doivent être surveillés afin que les effets indésirables systémiques des corticoïdes puissent être détectés.
Le risque de dépôts cornéens ou d’opacité cornéenne peut être majoré chez les patients présentant des lésions de la cornée et recevant une polymédication par d’autres produits ophtalmiques contenant des phosphates.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données cliniques sur l’utilisation de NETAXEN chez la femme enceinte.
Les études effectuées chez l’animal ont mis en évidence une tératogénicité de la dexaméthasone.
Il est préférable d’éviter l’utilisation de NETAXEN pendant la grossesse.
Allaitement
Les données concernant l’excrétion de la dexaméthasone ou de la nétilmicine ou de leurs métabolites dans le lait maternel après une administration par voie ophtalmique sont insuffisantes.
Un risque pour les nouveau‑nés/nourrissons ne peut être exclu.
NETAXEN ne doit pas être utilisé pendant l’allaitement.
Fertilité
Il n’existe pas de données concernant l’effet de NETAXEN sur la fertilité humaine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
NETAXEN a une influence modérée sur l’aptitude à conduire des véhicules et à utiliser des machines.
L’instillation du collyre peut provoquer une vision floue transitoire. Les patients doivent attendre la disparition de cet effet pour conduire des véhicules ou utiliser des machines.
Les effets indésirables rapportés sont présentés ci‑dessous par classe de systèmes d’organes MedDRA. Les données disponibles ne sont pas suffisantes pour permettre de déterminer la fréquence de chacun des effets indésirables mentionnés (fréquence indéterminée).
Affections oculaires
· augmentation de la pression intraoculaire (après 15 à 20 jours d’administration par voie topique chez les patients prédisposés ou présentant un glaucome) ;
· développement d’une cataracte sous‑capsulaire postérieure ;
· vision trouble;
· apparition ou aggravation d’infections à Herpes simplex ou d’infections fongiques ;
· retard de cicatrisation.
Affections du système immunitaire
· hypersensibilité oculaire : hyperémie conjonctivale, sensation de brûlure, prurit.
Affections endocriniennes
· syndrome de Cushing ;
· freinage surrénalien (voir rubrique 4.4).
Quelques rares cas de calcification cornéenne ont été signalés en association avec l’utilisation de gouttes contenant des phosphates chez certains patients atteints de cornée gravement endommagées.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Il n’a jamais été rapporté de cas de surdosage.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
NETAXEN contient deux substances actives : la dexaméthasone et la nétilmicine.
Dexaméthasone
Mécanisme d’action
La dexaméthasone est un corticoïde ayant une activité anti‑inflammatoire puissante, 25 fois supérieure à celle de l’hydrocortisone. Comme tous les corticoïdes, elle agit principalement en inhibant la libération d’acide arachidonique, qui est le précurseur des plus importants médiateurs de l’inflammation, les prostaglandines et les leucotriènes.
L’efficacité de la dexaméthasone dans le traitement des états inflammatoires de l’œil est bien établie.
Effets pharmacodynamiques
Les corticoïdes exercent leurs effets anti‑inflammatoires par l’inhibition de l’expression des molécules d’adhésion des cellules de l’endothélium vasculaire et de cytokines. Cela entraîne une diminution de l’expression des médiateurs pro‑inflammatoires et l’inhibition de l’adhésion des leucocytes circulants à l’endothélium vasculaire, ce qui empêche leur migration dans les tissus oculaires inflammatoires.
La dexaméthasone présente une activité anti‑inflammatoire notable avec une activité minéralocorticoïde moindre par rapport à certains autres corticoïdes et c’est l’un des agents anti‑inflammatoires les plus puissants.
Nétilmicine
Mécanisme d’action
La nétilmicine est un antibiotique aminoside à large spectre puissant, rapidement bactéricide. Elle exerce son effet principal sur les cellules bactériennes en inhibant la synthèse et l’assemblage des polypeptides sur l’unité 30S du ribosome. Dans cette association, la nétilmicine confère une protection antibactérienne contre les bactéries sensibles.
Effets pharmacodynamiques
Le tableau 1 présente les valeurs seuils des CMI, en distinguant les microorganismes sensibles des microorganismes modérément sensibles (intermédiaires) et les microorganismes intermédiaires des microorganismes résistants, selon les données EUCAST.
La prévalence de la résistance peut varier selon les régions et au cours du temps pour certaines espèces ; et des informations locales sur la résistance sont nécessaires, en particulier lors du traitement d’infections sévères. Si nécessaire, l’avis d’un expert doit être demandé lorsque la prévalence locale de la résistance est telle que l’utilité de l’agent dans au moins certains types d’infections est douteuse. Les informations ci‑dessous ne fournissent qu’une orientation approximative sur la probabilité qu’une bactérie soit sensible à la nétilmicine contenue dans NETAXEN.
Les définitions des concentrations critiques classifiant les isolats comme sensibles ou résistants sont utiles pour prédire l’efficacité clinique des antibiotiques administrés par voie systémique. Cependant, lorsque l’antibiotique est administré par voie topique à des concentrations très élevées directement sur le site de l’infection, les définitions des concentrations critiques peuvent ne pas s’appliquer. Les infections par la plupart des isolats qui seraient classés comme résistants selon les concentrations critiques pour un antibiotique administré par voie systémique sont traitées efficacement par voie topique.
La fréquence de résistance globale aux aminosides peut aller jusqu’à 50 % de tous les staphylocoques dans certains pays européens.
Tableau 1 Valeurs seuils des CMI cliniques en fonction des espèces (EUCAST 2012)
|
Microorganisme |
Valeurs seuils des CMI cliniques (mg/mL) |
||
|
S (≤) |
R (≥) |
ECOFF |
|
|
Enterobacteriaceae |
2 |
4 |
2 |
|
Pseudomonas |
4 |
4 |
4 |
|
Acinetobacter |
4 |
4 |
NR |
|
Staphylococcus |
1 |
1 |
1 |
|
Staphylocoques à coagulase négative |
1 |
1 |
NR |
|
Enterococcus |
DI |
DI |
NR |
|
Streptococcus A, B, C et G |
NR |
NR |
NR |
|
Streptococcus pneumoniae |
NR |
NR |
NR |
|
Viridans Streptococci |
NR |
NR |
NR |
|
Haemophilus influenzae |
DI |
DI |
NR |
|
Moraxella catarrhalis |
DI |
DI |
NR |
|
Neisseria gonorrhea |
NR |
NR |
NR |
|
Neisseria meningitidis |
NR |
NR |
NR |
|
Bactéries anaérobies à Gram positif à l’exception de Clostridium difficile |
NR |
NR |
NR |
|
Bactéries anaérobies à Gram négatif |
NR |
NR |
NR |
|
Concentration critique non liée à l’espèce |
2 |
4 |
NR |
|
Notes : S = sensible. R = résistant. ECOFF = seuil épidémiologique harmonisé pour la surveillance de la résistance. DI = données insuffisantes pour établir que l’espèce en question est une bonne cible pour un traitement avec ce médicament. NR = non rapportée. |
|||
Des études in vitro ont montré que la nétilmicine est active contre la plupart des souches des pathogènes oculaires courants et des bactéries de la flore cutanée courantes. Le tableau 2 présente une liste des niveaux de sensibilité à la nétilmicine pour un total de 767 isolats bactériens provenant d’échantillons oculaires cliniques prélevés en France (FR), Allemagne (DE), Italie (IT), Pologne (PL), Slovaquie (SK), Espagne (ES) et au Royaume‑Uni (UK), et montre le niveau global de sensibilité de la flore oculaire courante à l’antibiotique.
Tableau 2 Données de sensibilité fréquente à la nétilmicine in vitro issues d’isolats européens
|
|
Sensible |
Intermédiaire |
Résistant |
CMI50 (µg/mL) |
CMI90 (µg/mL) |
|||
|
Microorganisme |
[n] |
[%] |
[n] |
[%] |
[n] |
[%] |
||
|
S. aureus |
252 |
100 |
0 |
0 |
0 |
0 |
0,25 |
0,5 |
|
S. aureus (à coagulase negative) |
302 |
96,5 |
10 |
3,2 |
1 |
0,3 |
0,06 |
4 |
|
S. epidermidis |
216 |
95,6 |
9 |
4 |
1 |
0,4 |
0,05 |
4 |
|
S. pneumoniae |
|
|
|
|
|
|
4 |
8 |
|
H. influenzae |
|
|
|
|
|
|
0,25 |
0,5 |
|
Ps. Aeruginosa |
39 |
100 |
0 |
0 |
0 |
0 |
4 |
4 |
Autres informations
La résistance croisée entre les aminosides (par exemple gentamicine, tobramycine et nétilmicine) est due à la spécificité des enzymes modificatrices nucléotidyltransférases (ANT) et acétyltransférases (ACC). Cependant, la résistance croisée diffère entre les antibiotiques aminosides en raison de la spécificité variable des différentes enzymes modificatrices. Le mécanisme de résistance aux aminosides acquise le plus fréquent est l’inactivation de l’antibiotique par des enzymes modificatrices dont les gènes sont portés par des plasmides et des transposons.
5.2. Propriétés pharmacocinétiques
Absorption
Des concentrations intraoculaires thérapeutiques de dexaméthasone sont atteintes après instillation dans le sac conjonctival. Les concentrations maximales dans la cornée et l’humeur aqueuse sont atteintes en 1 à 2 heure(s). La demi‑vie plasmatique de la dexaméthasone est d’environ 3 heures.
Distribution
L’exposition systémique est faible après l’instillation de NETAXEN.
Les concentrations plasmatiques maximales de la dexaméthasone après l’administration topique de la dernière dose sont de 220 à 888 picogrammes/mL (moyenne, 555 ± 217 pg/mL) après l’instillation d’une goutte de NETAXEN dans chaque œil quatre fois par jour pendant deux jours consécutifs.
Biotransformation
Après l’instillation, le phosphate sodique de dexaméthasone fait l’objet d’une réaction d’hydrolyse catalysée par des enzymes présentes dans le film lacrymal et la cornée et est transformé en partie en alcool de dexaméthasone liposoluble.
Elimination
La dexaméthasone est éliminée extensivement sous forme de métabolites.
Nétilmicine
Absorption
Comme tous les aminosides, la nétilmicine est peu lipophile ; par conséquent, sa pénétration dans la chambre antérieure de l’œil est faible après une administration locale.
Distribution
Des études menées chez l’homme ont montré qu’après une instillation unique, la concentration de nétilmicine dans les larmes est généralement de 256 microgrammes/mL après 5 minutes, de 182 microgrammes/mL après 10 minutes, de 94 microgrammes/mL après 20 minutes et de 27 microgrammes/mL après une heure.
Biotransformation
La nétilmicine n’est pas métabolisée après administration par voie ophtalmique.
Elimination
Comme les autres aminosides, la nétilmicine est éliminée principalement sous forme inchangée par voie rénale.
5.3. Données de sécurité préclinique
Les données de sécurité préclinique sont issues principalement d’informations publiées.
Dexaméthasone
Dans les études effectuées chez l’animal (lapin et rat), la dexaméthasone a été bien tolérée après administration par voie topique pendant une durée allant jusqu’à six mois.
Les symptômes de toxicité de la dexaméthasone observés chez différentes espèces animales après administration orale sont liés aux effets des corticoïdes et comprennent le freinage de l’axe hypothalamo‑hypophyso‑surrénalien et une légère anémie.
Des signes de toxicité ont été observés dans l’estomac, le foie, les surrénales et l’hypophyse, les poumons et la rate des animaux.
Dans les études en administration par voie topique, la majorité de ces anomalies étaient absentes ou rares.
Les données actuelles n’indiquent pas de propriétés génotoxiques cliniquement pertinentes des glucocorticoïdes.
Dans les études chez l’animal, des résorptions fœtales et des fentes palatines ont été observées après l’administration de corticoïdes. Chez le lapin, les corticoïdes ont provoqué des résorptions fœtales et de nombreuses anomalies de la tête, des oreilles, des membres et du palais. De plus, une inhibition de la croissance intra‑utérine et des modifications du développement fonctionnel du système nerveux central ont été rapportées.
Nétilmicine
Les antibiotiques de la classe des aminosides peuvent avoir des effets néphrotoxiques et ototoxiques sévères, dont certains peuvent être irréversibles. Les études de fertilité, de tératogénicité et du développement postnatal menées avec la nétilmicine chez le rat et le lapin n’ont pas mis en évidence de toxicité significative de la nétilmicine, en particulier après une administration par voie ophtalmique. Dans une étude de la tolérance oculaire effectuée chez le lapin, il n’a pas été observé de lésions au niveau de la conjonctive et de la cornée ni de lésions du fond de l’œil et les réflexes oculaires n’ont pas été affectés.
Association fixe
Des résultats similaires à ceux résumés ci‑dessus pour chaque substance active ont été observés dans les études effectuées chez le lapin avec l’association fixe.
Evaluation du risque environnemental
La concentration prédite dans l’environnement (PEC)eaux de surface pour la dexaméthasone et la nétilmicine est calculée sur la base d’une dose clinique maximale de 8 gouttes du médicament sur une période de 24 heures.
Une goutte contient 0,05 mg de dexaméthasone et 0,15 mg de nétilmicine. Les valeurs PECeaux de surface calculées résultant de l’administration du collyre sont de 0,002 microgrammes/L et 0,006 microgrammes/L pour la dexaméthasone et la nétilmicine respectivement. Ces valeurs sont inférieures à la limite d’action de 5 % (0,01 microgramme/L) et il est donc improbable que la quantité de dexaméthasone et de nétilmicine délivrée lors d’une utilisation normale représente un risque pour l’environnement aquatique.
Phosphate monosodique monohydraté
Phosphate disodique dodécahydraté
Eau purifiée.
Le médicament ne contient pas de conservateur.
Durée de conservation après première ouverture : après l’administration, le récipient unidose doit être éliminé, même s’il n’a été utilisé qu’en partie.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30 °C.
Conserver les récipients unidose dans le sachet à l’abri de la lumière et de l’humidité.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Récipients unidose de 0,3 mL en polyéthylène basse densité (PEBD) emballés dans un sachet en aluminium contenant 5 récipients unidose.
Boîtes de 15 ou 20 récipients unidose.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
VIA ERCOLE PATTI, 36
95025 ACI S. ANTONIO (CT)
ITALIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 009 9 5 : 0,3 mL en récipient unidose. Boîte de 15.
· 34009 302 010 0 8 : 0,3 mL en récipient unidose. Boîte de 20.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I
ANSM - Mis à jour le : 10/01/2023
NETAXEN 1 mg/3 mg par ml, collyre en solution en récipient unidose
Nétilmicine/Dexaméthasone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu’est‑ce que NETAXEN 1 mg/3 mg par ml, collyre en solution en récipient unidose et dans quel cas est‑il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser NETAXEN 1 mg/3 mg par ml, collyre en solution en récipient unidose ?
3. Comment utiliser NETAXEN 1 mg/3 mg par ml, collyre en solution en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver NETAXEN 1 mg/3 mg par ml, collyre en solution en récipient unidose
6. Contenu de l’emballage et autres informations
1. QU’EST-CE QUE NETAXEN 1 mg/3 mg par ml, collyre en solution en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
NETAXEN contient deux médicaments : la nétilmicine et la dexaméthasone.
· La nétilmicine est un antibiotique qui tue les bactéries.
· La dexaméthasone est un corticoïde qui diminue l’inflammation.
NETAXEN est utilisé chez les adultes pour tuer les bactéries et diminuer l’inflammation oculaire lorsque les yeux sont gonflés, irrités et probablement infectés par des bactéries.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien à la fin du traitement.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER NETAXEN 1 mg/3 mg par ml, collyre en solution en récipient unidose ?
NETAXEN peut être utilisé chez les adultes, y compris les personnes âgées.
Son utilisation n’est pas recommandée chez les enfants et adolescents âgés de moins de 18 ans.
N’utilisez jamais NETAXEN :
· si vous êtes allergique à la nétilmicine, à la dexaméthasone, aux antibiotiques appelés « aminosides » tels que : tobramycine, kanamycine, amikacine, gentamicine, etc.) ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6) ;
· si votre médecin vous a informé(e) que la pression dans votre œil est trop élevée ;
· si vous pensez que vous pouvez présenter une infection virale ou fongique dans ou autour de l’œil ;
· si vous avez ou avez eu dans le passé une infection oculaire causée par le virus Herpes simplex (HSV) ;
· si votre médecin vous a informé(e) que vous présentez une infection oculaire causée par une bactérie de la famille des mycobactéries.
Avertissements et précautions
Adressez‑vous à votre médecin ou pharmacien avant d’utiliser NETAXEN.
Adressez‑vous à votre médecin si vous présentez une prise de poids et un gonflement au niveau de l’abdomen et du visage, car ce sont généralement les premières manifestations d’une affection appelée syndrome de Cushing. Une diminution de la fonction des glandes surrénales peut survenir après l’arrêt d’un traitement intensif ou de longue durée par NETAXEN. Consultez votre médecin et n’arrêtez pas le traitement de vous‑même. Ces risques sont particulièrement élevés chez les enfants et chez les patients traités par des médicaments appelés ritonavir et cobicistat.
En cas de vision floue ou d’autres troubles visuels, contactez votre médecin.
Si vous utilisez NETAXEN pendant une longue durée
· la pression dans votre œil (pression intraoculaire) pourrait augmenter, ce qui peut endommager les nerfs présents dans l’œil et entraîner des problèmes de vision. Si vous utilisez NETAXEN pendant plus de 15 jours, votre pression intraoculaire devra être contrôlée régulièrement par votre médecin ;
· vous pourriez développer une cataracte ;
· la cicatrisation d’une plaie pourrait être plus longue ;
· votre organisme pourrait ne pas combattre aussi bien que d’habitude d’autres types d’infections oculaires telles que des infections fongiques ou virales ;
· en cas d’utilisation de corticoïdes, les infections oculaires très purulentes peuvent s’aggraver ou il peut être plus difficile d’identifier le type de bactérie responsable de l’infection ;
· le corticoïde contenu dans NETAXEN pourrait provoquer un amincissement de la surface de l’œil et donc des perforations ;
· vous pourriez devenir allergique à l’antibiotique contenu dans le collyre.
Informez votre médecin avant d’utiliser NETAXEN
· si vous avez un glaucome ou si un membre de votre famille a présenté un glaucome ;
· si vous avez une affection de la cornée ;
· si vous prenez d’autres médicaments contenant des phosphates. Il sera nécessaire que votre médecin contrôle votre cornée à intervalles réguliers.
Enfants et adolescents
L’utilisation de NETAXEN chez les enfants ou adolescents (âgés de moins de 18 ans) n’est pas recommandée.
Pour usage externe uniquement
NETAXEN ne doit être appliqué que sur la surface de l’œil. Ce médicament ne doit jamais être injecté ou ingéré.
Autres médicaments et NETAXEN
NETAXEN peut interagir avec d’autres médicaments. Informez votre médecin ou pharmacien si vous utilisez ou avez récemment utilisé un médicament ophtalmique ou tout autre médicament, y compris des médicaments obtenus sans ordonnance. Vous pouvez quand même utiliser NETAXEN avec d’autres médicaments ophtalmiques, mais vous devez suivre les instructions figurant à la rubrique 3.
En particulier, informez votre médecin ou votre pharmacien si vous prenez :
· tout autre antibiotique, notamment : polymyxine B, colistine, viomycine, streptomycine, vancomycine et céfaloridine. L’utilisation simultanée d’autres antibiotiques avec NETAXEN peut augmenter le risque de troubles rénaux, de troubles de l’audition ou diminuer l’efficacité de l’autre antibiotique ;
· cisplatine, un médicament anticancéreux ;
· diurétiques (médicaments qui diminuent la rétention d’eau) tels que l’acide éthacrynique et le furosémide ;
· anticholinergiques (médicaments qui diminuent les sécrétions par les glandes) tels que l’atropine ;
· ritonavir ou cobicistat, car ces médicaments peuvent augmenter la quantité de dexaméthasone dans le sang ;
· d’autres médicaments contenant des phosphates. Votre médecin contrôlera votre cornée à intervalles réguliers.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Utilisation pendant la grossesse
Il est préférable de ne pas utiliser NETAXEN pendant la grossesse, sauf si votre médecin le juge nécessaire.
Utilisation pendant l’allaitement
NETAXEN ne doit pas être utilisé pendant l’allaitement.
Conduite de véhicules et utilisation de machines
Votre vision peut devenir floue temporairement après l’instillation de NETAXEN. Dans ce cas, vous ne devez pas conduire ni utiliser des outils ou machines tant que votre vision n’est pas redevenue claire.
NETAXEN contient des phosphates
Ce médicament contient 0,18 mg de phosphates par goutte équivalant à 3,66 mg/mL. Si vous souffrez de dommages sévères de la cornée (couche transparente située à l’avant de l’œil), les phosphates peuvent causer, dans de très rares cas, des troubles de la vision en raison de l’accumulation de calcium pendant le traitement (nuage).
3. COMMENT UTILISER NETAXEN 1 mg/3 mg par ml, collyre en solution en récipient unidose ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
La dose recommandée est d’une goutte dans l’œil à traiter quatre fois par jour ou conformément à la prescription de votre médecin. La durée de traitement habituelle peut aller de 5 à 14 jours.
Ne modifiez pas la dose du collyre sans l’avis de votre médecin.
Utilisation chez les enfants et adolescents
L’utilisation de NETAXEN chez les enfants ou adolescents (âgés de moins de 18 ans) n’est pas recommandée.
Patients portant des lentilles de contact
Vous pouvez porter vos lentilles de contact pendant le traitement par NETAXEN en récipient unidose car il ne contient pas de conservateur. Cependant, il est fortement recommandé d’éviter de porter des lentilles de contact en cas d’infection ou d’inflammation oculaire. Vous ne devez pas porter de lentilles de contact pendant le traitement par un collyre contenant un corticoïde en raison du risque accru d’infection.
Si vous utilisez NETAXEN avec d’autres médicaments ophtalmiques
Vous devez respecter un intervalle d’au moins 10 minutes entre l’instillation de NETAXEN et l’utilisation d’autres collyres ou de pommades. Les pommades ophtalmiques doivent être appliquées en dernier.
Mode d’emploi
Vérifiez que le récipient unidose est intact.
1. Lavez‑vous les mains et asseyez‑vous ou mettez‑vous en position confortable.
2. Ouvrez le sachet en aluminium contenant les récipients unidose.
3. Détacher un récipient unidose de la bande (figure 1) et replacez les récipients non ouverts dans le sachet.
4. Ouvrez en tournant la partie supérieure sans tirer (figure 2). Ne touchez pas l’embout après avoir ouvert le récipient.
5. Penchez la tête en arrière.
6. Avec le doigt, tirez doucement la paupière inférieure de l’œil à traiter vers le bas.
7. Retournez le récipient unidose et placez l’embout du récipient près de l’œil, mais sans qu’il touche l’œil. Ne touchez pas votre œil ou votre paupière avec l’embout du récipient (figure 3).
8. Pressez le récipient unidose de façon à instiller une seule goutte, puis relâchez la paupière inférieure.
9. Fermez l’œil et appuyez avec le doigt sur le coin interne de l’œil traité pendant deux minutes.
10. Répétez l’instillation dans l’autre œil si votre médecin vous l’a prescrit.
11. Eliminez le récipient unidose après utilisation.

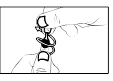

|
|||||
|
|||||
|
|||||
Si le collyre n’est pas utilisé correctement, il peut être contaminé par des bactéries, ce qui peut entraîner des infections oculaires. L’utilisation d’un collyre contaminé peut provoquer une atteinte oculaire grave et la perte de vision en résultant.
Si vous avez utilisé plus de NETAXEN que vous n’auriez dû
Si vous avez instillé plus de gouttes que vous n’auriez dû, il est peu probable que cela provoque des problèmes.
Instillez la dose suivante au moment habituel.
Si vous oubliez d’utiliser NETAXEN
N’utilisez pas de dose double pour compenser la dose que vous avez oublié d’utilisez.
Instillez la dose suivante au moment habituel.
Si vous arrêtez d’utiliser NETAXEN
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
La fréquence de chaque effet mentionné ne peut pas être estimée sur la base des données disponibles.
Affections oculaires
Augmentation de la pression intraoculaire, développement d’une cataracte après un traitement prolongé, vision floue, apparition ou aggravation d’une infection oculaire causée par le virus Herpes simplex (HSV) ou d’une infection fongique, retard de cicatrisation.
Dans de très rares cas (moins de 1/10 000), chez certains patients présentant des lésions sévères de la cornée (couche transparente située à l’avant de l’œil), des troubles de la vision en raison de l’accumulation de calcium pendant le traitement (nuage).
Affections du système immunitaire
Réaction allergique locale : rougeur de la conjonctive, sensation de brûlure, démangeaisons.
Affections endocriniennes
Pilosité excessive (en particulier chez les femmes), faiblesse musculaire et perte de masse musculaire, vergetures (stries violacées sur la peau), augmentation de la pression artérielle, règles irrégulières ou absence de règles, modification des taux de protéines et de calcium dans l’organisme, retard de croissance chez les enfants et les adolescents et prise de poids et gonflement du corps et du visage (« syndrome de Cushing ») (voir rubrique 2 « Avertissements et précautions »).
Dans tous les cas ci‑dessus, il est recommandé d’arrêter le traitement.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER NETAXEN 1 mg/3 mg par ml, collyre en solution en récipient unidose ?
Tenir hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte, le sachet et le récipient après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 30 °C.
Conserver les récipients unidose dans le sachet à l’abri de la lumière et de l’humidité.
Ce médicament ne contient pas de conservateur.
Après ouverture d’un récipient unidose, utiliser immédiatement et éliminer le récipient unidose et toute solution restante après utilisation.
Ne jetez aucun médicament au tout‑à‑l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Chaque récipient unidose contient 0,9 mg de nétilmicine et 0,3 mg de dexaméthasone.
· Les autres composants sont : citrate de sodium, phosphate monosodique monohydraté, phosphate disodique dodécahydraté, eau purifiée.
Qu’est-ce que NETAXEN et contenu de l’emballage extérieur
NETAXEN est une solution limpide incolore ou légèrement jaune.
5 récipients unidose contenant chacune 0,3 mL de NETAXEN collyre en solution, emballés dans un sachet en aluminium.
Chaque boîte contient 15 ou 20 récipients unidose.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
VIA ERCOLE PATTI, 36
95025 ACI S. ANTONIO (CT)
ITALIE
Exploitant de l’autorisation de mise sur le marché
SIFI FRANCE
8 RUE DES GRANDES TERRES
92500 RUEIL MALMAISON
Via Ercole Patti, 36
95025 Aci Sant'antonio (CT)
Italie
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l'ANSM (France) (www.ansm.fr)