Dernière mise à jour le 13/10/2025
GLYDO 20 mg/mL, gel en seringue préremplie
Indications thérapeutiques
Classe pharmacothérapeutique : système nerveux, anesthésiques, anesthésiques locaux, amides, Code ATC: N01BB02.
GLYDO est un gel stérile qui contient comme substance active le chlorhydrate de lidocaïne (sous forme de chlorhydrate de lidocaïne monohydraté). Il sera fait référence à la « lidocaïne » tout au long de cette notice.
La lidocaïne a un effet anesthésique local et est utilisée pour anesthésier les parties du corps sur lesquelles le gel est appliqué. Elle empêche aux nerfs de transmettre les messages de douleur au cerveau et empêche donc de ressentir la douleur.
Grâce à son effet anesthésique local et à ses propriétés lubrifiantes pour les sondes, les endoscopes ou autres instruments médicaux, GLYDO 20 mg/mL gel est conçu pour soulager l’inconfort et faciliter la mise en œuvre de certains types d’examens ou de procédures. GLYDO 20 mg/mL gel est utilisé
· en instillation (insertion) dans l’urètre avant la pose ou le remplacement d’une sonde et lors d’une cystoscopie, lorsqu’un médecin insère un tube dans l’urètre pour visualiser votre vessie.
· pour la proctoscopie/rectoscopie (procédures médicales au cours desquelles un instrument appelé endoscope est utilisé pour examiner la cavité anale ou rectum). Pendant cette procédure, GLYDO 20 mg/mL gel est instillé dans la cavité anale/le rectum et/ou l’instrument utilisé est lubrifié avec GLYDO 20 mg/mL gel avant l’insertion.
Grâce à son effet anesthésique local, GLYDO est également utilisé
· pour aider à soulager la douleur de l’inflammation de la vessie.
GLYDO est indiqué chez les adultes, les adolescents (plus de 12 ans) et les enfants de 2 à 12 ans.
Votre médecin vous expliquera pour quels examens ou affection spécifiques GLYDO est utilisé.
L’administration sera généralement effectuée par un médecin, mais elle peut également être effectuée par vous ou votre soignant, par exemple pour l’auto-cathétérisme (voir rubrique 3. « Comment utiliser GLYDO 20 mg/mL, gel en seringue préremplie? »)
Présentations
> 10 seringues préremplies polypropylène de 11 mL
Code CIP : 34009 302 463 8 2
Déclaration de commercialisation : 22/09/2023
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 15,63 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 16,65 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 14/12/2022 | Inscription (CT) | Dans l’anesthésie locale de contact et la lubrification lors d’interventions de cystoscopie, de cathétérisme, d’exploration instrumentale et d’autres opérations endo-urétrales chez l’homme et la femme, la Commission considère que le service médical rendu par GLYDO 20 mg/mL (lidocaïne), gel en seringue préremplie est important à partir de l’âge de 12 ans. |
| Insuffisant | Avis du 14/12/2022 | Inscription (CT) | Le service médical rendu par GLYDO 20 mg/mL (lidocaïne), gel en seringue préremplie est insuffisant pour une prise en charge par la solidarité nationale au regard des alternatives disponibles : • dans l’anesthésie locale de contact et la lubrification lors d’interventions de cystoscopie, de cathétérisme, d’exploration instrumentale et d’autres opérations endo-urétrales chez l’homme et la femme, chez les enfants de moins de 12 ans, • dans l’anesthésie locale de contact et la lubrification en cas de rectoscopie, • dans le traitement symptomatique de la douleur liée à la cystite. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 14/12/2022 | Inscription (CT) | Compte tenu de : • l’usage médical bien établi de la lidocaïne par voie urétrale dans l’anesthésie locale de contact avant exploration en urologie . • du besoin couvert par une autre spécialité en gel urétral, à base de lidocaïne seule, • l’hétérogénéité des conclusions des études cliniques disponibles en fonction de l’acte urologique, du sexe et de l’âge . la Commission considère que cette spécialité n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux autres spécialités à base de lidocaïne en gel urétral déjà inscrites. |
ANSM - Mis à jour le : 09/10/2024
GLYDO 20 mg/mL, gel en seringue préremplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 mL de gel contient 20,1 mg de chlorhydrate de lidocaïne équivalant à 21,5 mg de chlorhydrate de lidocaïne monohydraté.
Une seringue préremplie de 6 mL contient 120,60 mg de chlorhydrate de lidocaïne
Une seringue préremplie de 11 mL contient 221,10 mg de chlorhydrate de lidocaïne
Pour la liste complète des excipients, voir rubrique 6.1.
Gel clair, presque incolore, stérile.
Le pH du gel est de 6,5.
4.1. Indications thérapeutiques
GLYDO est destiné à l’anesthésie locale de contact et la lubrification :
· lors d’interventions de cystoscopie, de cathétérisme, d’exploration instrumentale et d’autres opérations endo-urétrales chez l’homme et la femme;
· la proctoscopie et la rectoscopie ;
· le traitement symptomatique de la douleur liée à la cystite.
GLYDO est indiqué chez les adultes, les adolescents et les enfants à partir de 2 ans.
4.2. Posologie et mode d'administration
Les recommandations posologiques suivantes doivent être considérées comme un guide.
La dose doit être adaptée individuellement par un médecin expérimenté.
Le dosage varie et dépend de la zone à anesthésier, de la vascularisation des tissus, de la tolérance individuelle et de la technique d’anesthésie. Le dosage le plus faible permettant d’obtenir une anesthésie efficace doit être utilisé pour éviter des taux plasmatiques élevés et des effets indésirables graves.
L’anesthésie est obtenue en 5 à 15 minutes, selon la zone d’application. La durée de l’anesthésie est d’environ 20 à 30 minutes.
Posologie
Adultes
Anesthésie urétrale
Patients masculins
Pour une analgésie adéquate chez l’homme, 20 mL de gel (environ 400 mg de chlorhydrate de lidocaïne) sont généralement nécessaires. Le gel est instillé lentement dans l’urètre jusqu’à ce que le patient ait une sensation de tension (environ 10 mL). Une pince pénienne est ensuite appliquée pendant au moins 5 minutes au niveau du sillon balano-préputial, le reste du gel est ensuite instillé.
Lorsque l’anesthésie est particulièrement importante, par exemple lors d’un sondage ou d’une cystoscopie, 10 à 20 mL (environ 200 à 400 mg de chlorhydrate de lidocaïne) sont instillés. Si une analgésie adéquate n’est pas obtenue, une nouvelle administration de 10 à 20 mL (environ 200 à 400 mg de chlorhydrate de lidocaïne) est possible. La dose maximale d’environ 800 mg de chlorhydrate de lidocaïne ne doit pas être dépassée.
Pour anesthésier uniquement l’urètre masculin antérieur, par exemple pour le cathétérisme (y compris l’auto-cathétérisme), de petits volumes (5 à 10 mL, c’est-à-dire environ 100 à 200 mg de chlorhydrate de lidocaïne) sont généralement suffisants pour la lubrification.
Patientes féminines
Chez les femmes, la quantité de gel instillée est adaptée à l’anatomie individuelle de l’urètre.
Habituellement, 5 à 10 mL de gel (environ 100 à 200 mg de chlorhydrate de lidocaïne) sont instillés par petites portions pour remplir tout l’urètre. Si on le souhaite, il est possible d’appliquer un peu de gel sur l’orifice et l’étaler avec un coton-tige. Afin d’obtenir une anesthésie adéquate, il convient d’attendre au moins 5 minutes avant de procéder aux examens urologiques.
Traitement symptomatique de la douleur liée à la cystite
Pour une analgésie adéquate, 10 à 20 mL de gel (environ 200 à 400 mg de chlorhydrate de lidocaïne) sont généralement nécessaires.
Au début du traitement, le gel est généralement administré une fois par jour pendant une semaine.
Ensuite, le médecin décide de la fréquence et de la durée d’utilisation en fonction des symptômes et de l’état du patient. La dose maximale est : 20 mL (environ 400 mg de chlorhydrate de lidocaïne) une fois par jour.
Proctoscopie et rectoscopie
L’instillation de 10 à 20 mL de gel (environ 200 à 400 mg de chlorhydrate de lidocaïne) est recommandée pour une analgésie adéquate et une petite quantité doit être appliquée pour lubrifier l’endoscope. En cas d’association avec d’autres produits à base de lidocaïne, la dose totale de chlorhydrate de lidocaïne ne doit pas dépasser environ 400 mg.
Le taux d’absorption est particulièrement élevé dans le rectum.
Dose maximale
Adultes
La dose dépend du site d’application. Une dose de 40 mL de gel (environ 800 mg de chlorhydrate de lidocaïne) pour une utilisation dans l’urètre et la vessie est une dose sûre. La dose quotidienne maximale recommandée pour les adultes est d’environ 800 mg de chlorhydrate de lidocaïne.
Population pédiatrique
Enfants âgés de moins de 2 ans
GLYDO est contre-indiqué chez les enfants âgés de moins de 2 ans (voir rubrique 4.3).
Enfants (2 à 12 ans) et adolescents (plus de 12 ans)
Chez les enfants (2 à 12 ans) et les adolescents (plus de 12 ans), l’effet des gels de chlorhydrate de lidocaïne n’est pas bien démontré et son utilisation doit donc être évaluée par le médecin. Des recommandations posologiques spécifiques ne peuvent pas être données pour ces groupes de patients, mais en règle générale, la quantité de gel instillée est adaptée à l’anatomie individuelle de l’urètre.
L’absorption systémique de la lidocaïne peut être augmentée chez les enfants et la prudence est donc de mise.
En général, la dose maximale de 2,9 mg/kg de chlorhydrate de lidocaïne ne doit pas être dépassée chez les enfants âgés de 2 à 12 ans (Tableau 1).
Tableau 1 : Quantité maximale en [mL] de GLYDO calculée en fonction du poids corporel
|
Poids [Poids corporel en kg] |
GLYDO 20 mg/mL gel Dose maximale [mL] |
|
7 à 13 |
1 mL |
|
14 à 20 |
2 mL |
|
21 à 27 |
3 mL |
|
28 à 34 |
4 mL |
|
35 à 41 |
5 mL |
|
42 à 48 |
6 mL |
|
49 à 55 |
7 mL |
|
56 à 62 |
8 mL |
|
63 à 69 |
9 mL |
Populations spécifiques
Insuffisance rénale ou hépatique
En raison du métabolisme de premier passage important dans le foie et de son excrétion par les reins, les doses de lidocaïne doivent être réduites chez les patients présentant une insuffisance rénale ou hépatique afin de prévenir une accumulation potentielle de métabolites (voir rubrique 4.4).
Les patients affaiblis, âgés, atteints de maladies aiguës et les patients présentant un sepsis doivent recevoir des doses réduites en fonction de leur âge, de leur poids et de leur condition physique, car ils peuvent être plus sensibles aux effets systémiques dus à l’augmentation des taux sanguins de lidocaïne après des doses répétées (voir rubrique 4.4).
a dose maximale de 2,9 mg/kg de chlorhydrate de lidocaïne ne doit pas être dépassée dans ces populations particulières.
Mode d’administration
Les seringues graduées préremplies sont disponibles en 6 ou 11 mL de gel.
Chaque graduation de la seringue équivaut à environ 1 mL de gel (soit 20,1 mg de chlorhydrate de lidocaïne).
Pour une utilisation urétrale
Instructions d’utilisation :
L’emballage plaquette contient une seringue stérile. N’ouvrez pas la plaquette avant d’être prêt(e) pour l’administration.
1. Nettoyez et désinfectez l’orifice externe de l’urètre.
2. Lorsque vous êtes prêt(e) pour l’utilisation, ouvrez la plaquette et déposez la seringue sur un champ stérile.
3. Avant de retirer le capuchon, appuyez le capuchon d’étanchéité contre un doigt ou un autre objet solide. Appuyez sur le piston pour éliminer toute résistance éventuelle. Cela permet de s’assurer que la seringue se vide facilement et uniformément.
4. Retirez le capuchon de la seringue. La seringue est maintenant prête à être utilisée.
5. Le gel doit être instillé lentement et uniformément dans l’urètre.
6. Attendez quelques minutes après l’instillation du gel pour que l’anesthésie fasse son effet. L’effet anesthésique complet se produit dans les 5 à 15 minutes qui suivent l’instillation complète.
Pour d’autres traitements ou procédures/examens
(en intravésical, rectal)
Instructions d’utilisation :
1. Lorsque vous êtes prêt(e) pour l’utilisation, ouvrez la plaquette et déposez la seringue sur un champ stérile.
2. Avant de retirer le capuchon, appuyez le capuchon d’étanchéité contre un doigt ou un autre objet solide. Appuyez sur le piston pour éliminer toute résistance éventuelle. Cela permet de s’assurer que la seringue se vide facilement et uniformément.
3. Retirez le capuchon de la seringue. La seringue est maintenant prête à être utilisée.
4. L’effet anesthésique complet se produit dans les 5 à 15 minutes qui suivent l’instillation complète.
Tout gel non utilisé en une seule fois doit être jeté.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Hypersensibilité aux anesthésiques locaux de type amide.
· Enfants de moins de 2 ans.
4.4. Mises en garde spéciales et précautions d'emploi
Une dose excessive, ou des intervalles courts entre les doses, peuvent entraîner des taux plasmatiques élevés et des effets indésirables graves. Il faut informer les patients qu’ils doivent respecter strictement la posologie et les directives d’administration recommandées (la prise en charge des effets indésirables graves peut nécessiter l’utilisation de matériel de réanimation, d’oxygène ou d’autres médicaments de réanimation).
L’absorption par la surface des plaies et les muqueuses est relativement élevée. En raison de la possibilité d’une absorption systémique importante avec un risque accru de symptômes toxiques, tels que des convulsions, GLYDO 20 mg/mL gel doit être utilisé avec prudence chez les patients présentant une septicémie et/ou une muqueuse lésée dans la région d’application proposée.
Si une quantité supérieure à la quantité recommandée est instillée lors d’une anesthésie urétrale et qu’une quantité significative de gel pénètre dans la vessie, ou si l’urètre est enflammé ou ulcéré, cela peut généralement conduire à une absorption accrue de lidocaïne et, par conséquent, à un surdosage avec des effets indésirables nerveux centraux et cardiovasculaires (voir également rubrique 4.9), en particulier chez les enfants et les patients âgés.
Si la dose ou l’administration est susceptible d’entraîner des taux sanguins élevés, certains patients doivent faire l’objet d’une attention particulière pour éviter des effets indésirables potentiellement dangereux :
· Les patients âgés, les patients en mauvaise santé générale et les patients atteints de sepsis (voir rubrique 4.2).
· Les patients atteints d’épilepsie.
· Les patients présentant une bradycardie ou une altération de la fonction cardiovasculaire, car ils peuvent être moins aptes à compenser les modifications fonctionnelles associées à la prolongation de la conduction AV produite par les anesthésiques locaux de type amide.
· Les patients souffrant d’insuffisance cardiaque ou d’un bloc AV.
· Les patients en état de choc.
· Les patients présentant troubles de la fonction rénale et une maladie hépatique (voir rubrique 4.2).
· Les patients atteints d’un dysfonction respiratoire.
· Les patients souffrant de myasthénie grave, car ils sont particulièrement sensibles aux anesthésiques locaux.
Antiarythmiques de classe III
Les patients traités par des médicaments antiarythmiques de classe III (par exemple l’amiodarone) doivent faire l’objet d’une surveillance étroite. Une surveillance ECG doit être envisagée, car les effets cardiaques peuvent être additifs (voir rubrique 4.5).
Méthémoglobinémie
Des cas de méthémoglobinémie ont été rapportés en association avec l’utilisation d’anesthésiques locaux. Les patients présentant un défaut de la glucose-6-phosphate déshydrogénase, une méthémoglobinémie héréditaire ou idiopathique sont plus sensibles aux signes de méthémoglobinémie induits par les substances actives. Chez les patients présentant un déficit en glucose-6-phosphate déshydrogénase, l’antidote bleu de méthylène est inefficace pour réduire la méthémoglobine et est capable d’oxyder l’hémoglobine elle-même ; le traitement au bleu de méthylène ne peut donc pas être administré.
Patients atteints de porphyrie
La lidocaïne est possiblement porphyrinogène et ne doit être utilisée chez les patients atteints de porphyrie aiguë qu’en cas de forte indication ou en cas d’urgence et avec une surveillance étroite. Des précautions appropriées doivent être prises pour tous les patients atteints de porphyrie.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Interactions pharmacodynamiques
Anesthésiques locaux et agents structurellement apparentés aux anesthésiques locaux de type amide
GLYDO ne doit pas être utilisé chez les patients recevant de la lidocaïne ou d’autres anesthésiques locaux ou des agents structurellement apparentés aux anesthésiques locaux de type amide, car les effets toxiques sont additifs.
Antiarythmiques
Les antiarythmiques de classe I (tels que la mexilétine) doivent être utilisés avec prudence, car les effets toxiques sont additifs et potentiellement synergiques.
Aucune étude spécifique d’interaction portant sur la lidocaïne et les médicaments antiarythmiques de classe III (par exemple l’amiodarone) n’a été réalisée, mais la prudence est recommandée (voir rubrique 4.4).
En raison d’effets additifs possibles sur le cœur, la lidocaïne doit être utilisée avec prudence chez les patients recevant d’autres antiarythmiques tels que les bêtabloquants (par exemple le propranolol, le métoprolol) ou les inhibiteurs calciques (par exemple le diltiazem, le vérapamil).
Interactions pharmacocinétiques
Bêtabloquants, cimétidine
Les bêtabloquants (par exemple le propranolol, le métoprolol (voir également ci-dessus)) et la cimétidine (voir également ci-dessous)) réduisent le débit cardiaque et/ou le débit sanguin hépatique et réduisent donc la clairance plasmatique de la lidocaïne, prolongeant ainsi sa demi-vie d’élimination. Il faut donc tenir compte de la possibilité d’accumulation de la lidocaïne.
Inhibiteurs du CYP 3A4 et/ou du CYP 1A2
L’administration concomitante de lidocaïne et d’inhibiteurs du CYP 3A4 et/ou du CYP 1A2 peut entraîner une accélération des concentrations plasmatiques de lidocaïne. Une augmentation des taux plasmatiques a été rapportée, par exemple, pour l’érythromycine, la fluvoxamine, l’amiodarone, la cimétidine, les inhibiteurs de protéase (par exemple le ritonavir).
Pour des raisons de sécurité, lorsque la lidocaïne est utilisée par voie topique, les concentrations plasmatiques sont un élément important (voir rubrique 4.4). Cependant, lorsque GLYDO 20 mg/mL gel est utilisé conformément aux recommandations posologiques, l’exposition systémique est faible et, par conséquent, les interactions métaboliques susmentionnées ne devraient pas avoir de pertinence clinique.
Méthémoglobinémie
La méthémoglobinémie peut être accentuée chez les patients prenant déjà des médicaments inducteurs de méthémoglobine (par exemple sulfamides, nitrofurantoïne, phénytoïne, phénobarbital). La liste n’est pas exhaustive. Voir également la rubrique 4.4.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il existe des données limitées sur l’utilisation de la lidocaïne chez la femme enceinte. La lidocaïne traverse le placenta. Les études effectuées chez l’animal n’ont pas mis en évidence d’effets délétères directs ou indirects sur la reproduction à des niveaux d’expositions pertinents pour l'application topique de la lidocaïne (voir rubrique 5.3). La prescription de GLYDO peut être envisagée pendant la grossesse, si cela est cliniquement nécessaire.
Allaitement
La lidocaïne est excrétée dans le lait maternel, mais lorsque GLYDO est utilisé à des doses thérapeutiques, aucun effet sur chez les nouveau-nés/nourrissons allaités n’est attendu.
Fertilité
Il n’y a pas de données de l’effet de la lidocaïne sur la fertilité chez l’humain. Les études animales n’ont pas montré d’altération de la fertilité des rats mâles ou femelles (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Il est peu probable que des effets indésirables surviennent après l’utilisation de GLYDO 20 mg/mL gel, tant que le médicament est utilisé conformément aux recommandations et que les précautions nécessaires sont prises (voir les rubriques 4.2 et 4.4).
Liste des effets indésirables sous forme de tableau
Les catégories de fréquence sont définies selon la convention suivante :
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100, < 1/10)
Peu fréquent (≥ 1/1 000, < 1/100)
Rare (≥ 1/10 000, < 1/1 000)
Très rare (< 1/10 000)
Fréquence indéterminée (ne peut être estimée à partir des données disponibles)
|
Système des classes d’organes |
Effet indésirable |
Fréquence |
|
Affections du système immunitaire |
Hypersensibilité, réaction anaphylactique, dermite de contact |
Rare |
|
Troubles généraux et anomalies au site d’administration |
irritation au site d’administration |
Très rare |
La lidocaïne peut provoquer des symptômes d’effets indésirables systémiques ou une toxicité aiguë si des taux plasmatiques élevés apparaissent à la suite d’une absorption rapide ou d’un surdosage (voir rubriques 4.9 Surdosage et 5.1 Propriétés pharmacodynamiques).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
Symptômes
Si des symptômes de toxicité systémique apparaissent, ils sont de même nature que ceux qui surviennent après l’administration d’anesthésiques locaux par d’autres voies d’administration.
Un surdosage peut se manifester par une stimulation transitoire du système nerveux central avec les premiers symptômes suivants : bâillements, agitation, vertiges, nausées, vomissements, dysarthrie, ataxie, troubles auditifs et visuels. Une toxicité modérée peut également provoquer des contractions musculaires et des convulsions. Cela peut être suivi d’une perte de conscience, d’une dépression respiratoire et d’un coma. En cas de toxicité très grave, en raison de la contractilité réduite du myocarde et du retard de la conduction de la stimulation, une hypotension et un collapsus cardiovasculaire suivis d’un bloc cardiaque complet et d’un arrêt cardiaque sont susceptibles de survenir.
Traitement de la toxicité aiguë
Si des signes de toxicité aiguë apparaissent pendant l’administration de l’anesthésique local, celle-ci doit être immédiatement arrêtée.
Les symptômes touchant le SNC (convulsions, dépression du SNC) doivent être traités rapidement par une assistance respiratoire appropriée et l’administration d’anticonvulsivants.
En cas d’arrêt circulatoire, une réanimation cardio-pulmonaire immédiate doit être mise en place.
Une oxygénation, une ventilation et une assistance circulatoire optimales ainsi que le traitement de l’acidose ont une importance vitale.
En cas de dépression cardiovasculaire (hypotension, bradycardie), un traitement approprié par des fluides intraveineux, des agents vasopresseurs, chronotropes et/ou inotropes doivent être envisagés.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
GLYDO 20 mg/mL gel est un gel stérile pour l’anesthésie topique des muqueuses.
Mécanisme d’action/Effets pharmacodynamiques
La lidocaïne est un anesthésique local de type amide.
GLYDO 20 mg/mL gel provoque une anesthésie immédiate et profonde des membranes muqueuses. Lors d’une endoscopie et d’un cathétérisme, il augmente également le pouvoir lubrifiant des matériaux à insérer.
GLYDO 20 mg/mL gel est particulièrement indiqué pour l’anesthésie de l’urètre. L’effet anesthésiant se produit généralement rapidement (dans les 5 minutes, selon la zone d’application).
L’effet anesthésique local de la lidocaïne est basé sur l’inhibition de l’influx de Na+ suite au blocage des canaux Na+ voltage-dépendants au niveau des fibres nerveuses. Comme l’effet dépend de la valeur du pH du milieu environnant (présence de la substance active sous forme de base non chargée ou de cation), l’efficacité de la lidocaïne dans la zone enflammée est réduite.
Les anesthésiques locaux peuvent avoir des effets similaires sur les membranes excitables du cerveau et du myocarde. Si de grandes quantités atteignent rapidement la circulation systémique, des symptômes et des signes de toxicité du système nerveux central et cardiovasculaire apparaîtront.
5.2. Propriétés pharmacocinétiques
La lidocaïne peut être absorbée après administration topique sur les membranes muqueuses, son taux d’absorption et la quantité de dose absorbée dépendant de la concentration et de la dose totale administrée, du site spécifique d’application et de la durée d’exposition. En général, le taux d’absorption des agents anesthésiques locaux après application topique sur la surface des plaies et des muqueuses est élevé.
Les concentrations sanguines de chlorhydrate de lidocaïne après instillation du gel dans l’urètre et la vessie intacts à des doses allant jusqu’à environ 800 mg sont assez faibles et inférieures aux niveaux auxquels des effets systémiques ou une toxicité sont susceptibles de se produire.
Les lésions de la muqueuse urétrale et/ou l’élargissement de la surface dû à la dilatation de l’urètre peuvent entraîner une absorption accrue de lidocaïne.
Distribution
Lorsque la lidocaïne est administrée par voie intraveineuse à des sujets sains, le volume de distribution est de 0,6 à 4,5 l/kg. Le volume de distribution peut être modifié chez les patients souffrant d’autres maladies, par exemple une insuffisance cardiaque, une insuffisance hépatique ou une insuffisance rénale.
La liaison de la lidocaïne aux protéines plasmatiques dépend de la concentration du médicament et la fraction liée diminue avec l’augmentation de la concentration. À des concentrations de 1 à 4 microgrammes de base libre par mL, 60 % à 80 % de la lidocaïne est liée aux protéines. La liaison dépend également de la concentration plasmatique de l’alpha-1-glycoprotéine acide (AGP), une protéine de phase aiguë qui lie la lidocaïne libre. Après un traumatisme, une intervention chirurgicale ou des brûlures, selon l’état physiopathologique du patient, la concentration en AGP peut être augmentée, ce qui entraîne une augmentation de la liaison de la lidocaïne aux protéines plasmatiques, tandis que chez les nouveau-nés et les patients souffrant d’insuffisance hépatique, les concentrations en AGP sont faibles, ce qui entraîne une réduction marquée de la liaison de la lidocaïne aux protéines plasmatiques.
La lidocaïne traverse les barrières hémato-encéphalique et placentaire, vraisemblablement par diffusion passive.
Biotransformation
La lidocaïne est soumise à un métabolisme de premier passage prononcé. Au total, environ 90 % de la lidocaïne est métabolisée en 4-hydroxy-2,6-xylidine, en 4-hydroxy-2,6-xylidine glucuronide et, dans une moindre mesure, en métabolites actifs, le monoéthyl glycine xylidide (MEGX) et le glycine xylidide (GX). Les effets pharmacologiques/toxicologiques du MEGX et du GX sont similaires, mais moins puissants, que ceux de la lidocaïne. La lidocaïne et ses métabolites sont principalement excrétés par les reins.
Elimination
La lidocaïne a une demi-vie d’élimination de 1,6 heure et un taux d’extraction hépatique estimé à 0,65. La clairance de la lidocaïne est presque entièrement due au métabolisme hépatique et dépend à la fois du flux sanguin hépatique et de l’activité des enzymes de métabolisation. Environ 90 % de la lidocaïne administrée par voie intraveineuse est excrétée sous forme de divers métabolites et moins de 10 % est excrétée sous forme inchangée dans l’urine. Le principal métabolite dans l’urine est un conjugué de la 4-hydroxy-2,6-diméthylaniline, représentant environ 70 à 80 % de la dose excrétée dans l’urine.
Populations spécifiques
La demi-vie peut être multipliée par deux ou plus chez les patients présentant un trouble de la fonction hépatique. Chez les patients présentant une insuffisance cardiaque sévère, la demi-vie d’élimination peut être prolongée. Les troubles de la fonction rénale n’affectent pas la cinétique de la lidocaïne, mais peuvent augmenter l’accumulation des métabolites.
5.3. Données de sécurité préclinique
Dans les études animales, la toxicité rapportée après l’administration de fortes doses de lidocaïne a provoqué des effets sur le système nerveux central et le système cardiovasculaire.
Génotoxicité et potentiel cancérigène
Les tests de génotoxicité portant sur la lidocaïne n’ont pas mis en évidence de potentiel mutagène. Cependant, la 2,6-xylidine, un métabolite mineur de la lidocaïne, a montré un potentiel génotoxique in vitro et in vivo.
Aucune étude de cancérogénicité portant sur la lidocaïne n’a été réalisée. Il a été démontré que la 2,6-xylidine a un potentiel cancérigène (tumeurs nasales et sous-cutanées ainsi qu’un taux accru de tumeurs hépatiques) dans des études toxicologiques précliniques évaluant l’exposition chronique chez le rat. Des doses élevées de 2,6-xylidine étaient nécessaires pour induire des tumeurs dans les études animales. La pertinence clinique de l’effet inducteur de tumeurs de ce métabolite de la lidocaïne après une utilisation intermittente comme anesthésique local est inconnue.
Toxicité pour la reproduction et le développement
La lidocaïne n’a pas eu d’effet sur le développement embryo-foetal ni d’effet tératogène dans les études de reproduction réalisées chez le rat à des doses allant jusqu’à 500 mg/kg/jour de lidocaïne. Dans les études sur la toxicité pour la reproduction, des effets embryotoxiques ou fœtotoxiques de la lidocaïne ont été détectés à des doses de 25 mg/kg s.c. chez le lapin. Aucune altération de la fertilité des rats mâles ou femelles due à la lidocaïne n’a été observée.
Hydroxyde de sodium (pour l’ajustement du pH)
Eau purifiée.
6.4. Précautions particulières de conservation
Conserver les plaquettes dans l’emballage extérieur à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
GLYDO est disponible sous forme de seringues préremplies stériles contenant 6 ou 11 mL de gel. Les seringues sont composées du cylindre de seringue et d’un piston en polypropylène (PP), ainsi que d’un bouchon de piston et d’un capuchon d’étanchéité en caoutchouc de bromobutyle. L’embout de la seringue ne permet pas de fixer une aiguille.
Chaque seringue préremplie est conditionnée sous une plaquette stérile composé d’un film en polypropylène et d’une feuille de papier pour usage médical non pelliculée.
Chaque graduation de la seringue équivaut à environ 1 mL de gel (soit 20,1 mg de chlorhydrate de lidocaïne).
Présentations :
· 10 seringues préremplies contenant chacune 6 mL de gel
· 10 seringues préremplies contenant chacune 11 mL de gel
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Le produit est à usage unique. La seringue et tout gel non utilisé doivent être éliminés conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
GEREONSMÜHLENGASSE 1-11
50670 COLOGNE
ALLEMAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 463 7 5 : 6 mL de gel en seringue préremplie (PP). Boîte de 10.
· 34009 302 463 8 2 : 11 mL de gel en seringue préremplie (PP). Boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II
ANSM - Mis à jour le : 09/10/2024
GLYDO 20 mg/mL, gel en seringue préremplie
Chlorhydrate de lidocaïne (sous forme de chlorhydrate de lidocaïne monohydraté)
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que GLYDO 20 mg/mL, gel en seringue préremplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser GLYDO 20 mg/mL, gel en seringue préremplie ?
3. Comment utiliser GLYDO 20 mg/mL, gel en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver GLYDO 20 mg/mL, gel en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE GLYDO 20 mg/mL, gel en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : système nerveux, anesthésiques, anesthésiques locaux, amides, Code ATC: N01BB02.
GLYDO est un gel stérile qui contient comme substance active le chlorhydrate de lidocaïne (sous forme de chlorhydrate de lidocaïne monohydraté). Il sera fait référence à la « lidocaïne » tout au long de cette notice.
La lidocaïne a un effet anesthésique local et est utilisée pour anesthésier les parties du corps sur lesquelles le gel est appliqué. Elle empêche aux nerfs de transmettre les messages de douleur au cerveau et empêche donc de ressentir la douleur.
Grâce à son effet anesthésique local et à ses propriétés lubrifiantes pour les sondes, les endoscopes ou autres instruments médicaux, GLYDO 20 mg/mL gel est conçu pour soulager l’inconfort et faciliter la mise en œuvre de certains types d’examens ou de procédures. GLYDO 20 mg/mL gel est utilisé
· en instillation (insertion) dans l’urètre avant la pose ou le remplacement d’une sonde et lors d’une cystoscopie, lorsqu’un médecin insère un tube dans l’urètre pour visualiser votre vessie.
· pour la proctoscopie/rectoscopie (procédures médicales au cours desquelles un instrument appelé endoscope est utilisé pour examiner la cavité anale ou rectum). Pendant cette procédure, GLYDO 20 mg/mL gel est instillé dans la cavité anale/le rectum et/ou l’instrument utilisé est lubrifié avec GLYDO 20 mg/mL gel avant l’insertion.
Grâce à son effet anesthésique local, GLYDO est également utilisé
· pour aider à soulager la douleur de l’inflammation de la vessie.
GLYDO est indiqué chez les adultes, les adolescents (plus de 12 ans) et les enfants de 2 à 12 ans.
Votre médecin vous expliquera pour quels examens ou affection spécifiques GLYDO est utilisé.
L’administration sera généralement effectuée par un médecin, mais elle peut également être effectuée par vous ou votre soignant, par exemple pour l’auto-cathétérisme (voir rubrique 3. « Comment utiliser GLYDO 20 mg/mL, gel en seringue préremplie? »)
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER GLYDO 20 mg/mL, gel en seringue préremplie ?
N’utilisez jamais GLYDO 20 mg/mL, gel en seringue préremplie :
· si vous êtes allergique au chlorhydrate de lidocaïne ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous êtes allergique à certains autres anesthésiques locaux (de type amide).
· chez les enfants âgés de moins de 2 ans.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser GLYDO.
Avant d’utiliser ce médicament, votre médecin doit savoir si vous êtes, ou avez été, concernée(e) par l’un des éléments suivants :
· si vous avez des plaies, des blessures aux muqueuses ou un ulcère/une inflammation dans ou autour du site d’application proposé.
· si votre fonction hépatique ou rénale est altérée, si vous êtes gravement malade, en état de faiblesse ou si vous présentez un sepsis (« empoisonnement du sang »), votre médecin peut réduire la dose de GLYDO.
· si vous présentez un rythme cardiaque lent, un dysfonctionnement du cœur ou des voies respiratoires (problèmes au niveau des voies respiratoires).
· si vous avez une faiblesse au cœur (insuffisance cardiaque) ou des troubles de la conduction cardiaque (bloc auriculo-ventriculaire).
· si vous êtes en état de choc.
· si vous êtes sujet/sujette aux convulsions ou si vous êtes épileptique.
· si vous souffrez de certaines maladies musculaires (myasthénie grave).
· si vous êtes atteint(e) d’une maladie héréditaire rare qui affecte le sang appelée « déficit en glucose-6-phosphate déshydrogénase ».
· si vous présentez un trouble de pigmentation du sang appelé « méthémoglobinémie ».
· si vous souffrez de porphyrie (un trouble de la formation du sang).
· si vous suivez un traitement avec certains médicaments pour traiter les troubles du rythme cardiaque, connus sous le nom d’antiarythmiques de classe III (par exemple l’amiodarone), car les effets sur le cœur peuvent être augmentés. Voir également la rubrique « Autres médicaments et GLYDO».
Veuillez également informer votre médecin si vous utilisez fréquemment et/ou à fortes doses d’autres médicaments contenant de la lidocaïne, car cela peut entraîner des effets secondaires graves.
Si une grande quantité de GLYDO est instillée dans l’urètre et qu’une grande quantité de gel pénètre dans la vessie ou si l’urètre est ulcéré/enflammé, cela peut généralement conduire à une augmentation de l’absorption de la lidocaïne par les muqueuses, en particulier chez les enfants et les patients âgés, entraînant des effets indésirables graves (voir également la rubrique 3 « Si vous avez utilisé plus de GLYDO que vous n’auriez dû »).
Autres médicaments et GLYDO 20 mg/mL, gel en seringue préremplie
Informez votre médecin ou pharmacien si vous prenez/utilisez, avez récemment pris/utilisé ou pourriez prendre/utiliser tout autre médicament. La lidocaïne peut avoir des interactions avec d’autres médicaments.
En particulier, informez votre médecin si vous prenez/utilisez l’un des produits suivants :
· les antiarythmiques - médicaments destinés à traiter les battements cardiaques irréguliers (par exemple, mexilétine, amiodarone).
· les inhibiteurs calciques - médicaments pris pour des problèmes cardiaques ou une pression artérielle élevée (par exemple, diltiazem, vérapamil).
· les bêtabloquants (par exemple, propranolol, métoprolol) - pour le traitement de l’hypertension artérielle ou de l’angor (douleur thoracique).
· ces médicaments peuvent avoir un effet renforcé sur le cœur.
· d’autres médicaments contenant de la lidocaïne ou certains autres anesthésiques locaux (de type amide), car cela peut renforcer leurs effets respectifs de manière imprévisible.
· la cimétidine pour traiter l’hyperacidité, les ulcères de l’estomac et du duodénum. L’utilisation simultanée de ce médicament peut augmenter le risque d’effets indésirables.
· la fluvoxamine pour traiter la dépression.
· l’érythromycine (antibiotique).
· les inhibiteurs de la protéase utilisés pour traiter le VIH (par exemple, le ritonavir).
· les médicaments utilisés pour traiter les infections, appelés sulfonamides et nitrofurantoïne.
· les médicaments utilisés pour traiter l’épilepsie, appelés phénytoïne et phénobarbital.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
Pendant la grossesse et l’allaitement, GLYDO ne doit être utilisé qu’après évaluation soigneuse de la balance bénéfice-risque par votre médecin.
Conduite de véhicules et utilisation de machines
Les effets sur l’aptitude à conduire et à utiliser des machines sont peu probables, mais ne peuvent être totalement exclus en cas de sensibilité individuelle accrue. Si vous vous sentez somnolent(e), étourdi(e) ou si vous avez des troubles de la vision, ne conduisez pas et n’utilisez pas d’outils ou de machines.
3. COMMENT UTILISER GLYDO 20 mg/mL, gel en seringue préremplie ?
Si vous vous soignez vous-même, par exemple en cas d’auto-cathétérisme (insertion d’un petit tube en plastique (sonde) dans votre urètre), utilisez toujours ce médicament exactement comme votre médecin vous l’a dit et suivez les instructions ci-dessous pour l’application du gel. Consultez votre médecin en cas de doute.
GLYDO commence à agir dans les 5 à 15 minutes après l’application. L’effet dure généralement de 20 à 30 minutes.
Posologie
Votre médecin décidera du dosage le plus adapté à votre cas particulier en fonction de votre âge et de votre état de santé, ainsi que du site d’application, de la méthode utilisée et de votre réaction.
La dose recommandée est :
Adultes
Pour instillation (insertion) dans l’urètre
Chez les hommes
Pour un soulagement adéquat de la douleur, 20 mL de gel sont généralement nécessaires.
Lorsque l’anesthésie est particulièrement importante, par exemple pendant un sondage ou une cystoscopie, votre médecin peut instiller une plus grande quantité de gel (jusqu’à 40 mL).
Pour le cathétérisme, de petits volumes (5-10 mL) sont généralement suffisants pour la lubrification.
Chez les femmes
Le médecin adaptera la quantité de gel à insérer en fonction des conditions anatomiques individuelles de l’urètre. Habituellement, 5 à 10 mL de gel sont instillés par petites portions pour remplir tout l’urètre.
Pour le soulagement de la douleur due à l’inflammation de la vessie
10 à 20 mL de gel sont généralement nécessaires pour un soulagement adéquat de la douleur.
Le médecin décidera de la fréquence et de la durée d’utilisation en fonction de votre état et de vos symptômes.
La dose maximale est : 20 mL de gel une fois par jour.
Proctoscopie/rectoscopie
Pour un soulagement adéquat de la douleur, votre médecin instillera généralement 10 à 20 mL de gel dans la cavité anale/le rectum et en appliquera une petite quantité pour lubrifier l’endoscope.
Dose maximale
La dose dépend du site d’application. Chez l’adulte, une dose de 40 mL de gel (environ 800 mg de chlorhydrate de lidocaïne) pour une utilisation dans l’urètre et la vessie est une dose sûre. La dose quotidienne maximale recommandée est d’environ 800 mg de chlorhydrate de lidocaïne.
Population spécifique
Votre médecin peut décider de réduire la dose si vous êtes âgé, si vous êtes gravement malade, si vous êtes dans en état de faiblesse, si vous avez des problèmes de foie ou de rein ou si vous présentez un sepsis (« empoisonnement du sang »). La dose maximale de 2,9 mg/kg de poids corporel de chlorhydrate de lidocaïne ne doit pas être dépassée.
Utilisation chez les enfants et les adolescents
Enfants âgés de moins de 2 ans
GLYDO 20 mg/mL gel ne doit pas être utilisé chez les enfants de moins de 2 ans.
Enfants (2 à 12 ans) et adolescents (plus de 12 ans)
Le médecin déterminera la dose en fonction de l’âge, du poids et de la condition physique de l’enfant.
La dose maximale de 2,9 mg/kg de poids corporel de chlorhydrate de lidocaïne ne doit pas être dépassée chez les enfants (2 à 12 ans).
Mode d’administration
Les seringues graduées préremplies sont disponibles avec 6 ou 11 mL de gel. Votre médecin choisira la taille appropriée en fonction de la quantité dont vous avez besoin.
Chaque graduation de la seringue équivaut à environ 1 mL de gel (soit 20,1 mg de chlorhydrate de lidocaïne).
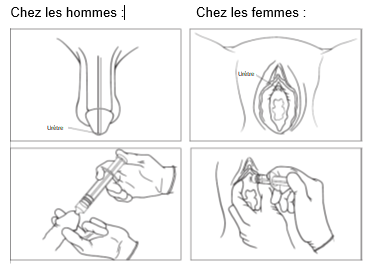
Pour l’(auto)cathétérisme (utilisation par voie urétrale)
Suivez attentivement ces instructions :
1. Lavez vos mains. Nettoyez et désinfectez la zone génitale.
2. Lorsque vous êtes prêt(e) à utiliser le produit, ouvrez la plaquette.
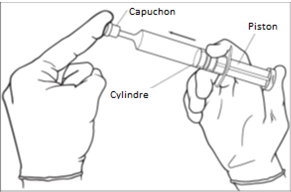
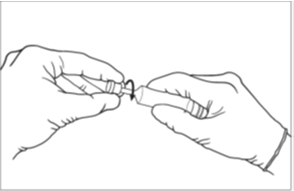
3. Avant de retirer le capuchon de l’extrémité de la seringue, appuyez sur le piston pour éliminer toute résistance éventuelle. Cela permet de s’assurer que la seringue se vide facilement et uniformément. [Image 1]
4. Retirez le capuchon de la seringue. La seringue est maintenant prête à être utilisée. [Image 2]
5. Insérez l’embout dans l’ouverture de l’urètre et appuyez sur le piston lentement et régulièrement pour faire sortir le gel dans l’urètre. [Image 3]
6. Attendez quelques minutes après l’instillation du gel pour que l’anesthésie fasse son effet. L’effet anesthésique complet se produit dans les 5 à 15 minutes qui suivent l’instillation complète.
|
Image 1 : |
Image 2 : |
|
|
|
|
Image 3 : |
|
|
|
|
Pour la cytoscopie
Votre médecin administrera ce médicament dans l’urètre et/ou l’appliquera sur l’endoscope.
Pour la proctoscopie/rectoscopie
Votre médecin administrera ce médicament dans la cavité anale/le rectum et/ou l’appliquera sur l’endoscope.
La seringue est à usage unique. Utiliser immédiatement après l’ouverture de la plaquette.
La seringue et tout gel non utilisé en une seule fois doivent être éliminés.
Durée du traitement
Pour les examens/procédures, GLYDO n’est généralement utilisé que pour une ou deux doses ou pour un traitement de courte durée.
Si GLYDO vous a été prescrit pour une auto-administration, votre médecin décidera de la durée pendant laquelle vous devez continuer à utiliser ce médicament en fonction de votre état.
Si on vous a administré / si vous avez utilisé plus de GLYDO 20 mg/mL, gel en seringue préremplie que vous n’auriez dû
Administration de GLYDO gel par un médecin
Comme ce médicament vous est généralement administré par un médecin qualifié, il est peu probable que l’on vous donne trop de GLYDO. Cependant, si vous pensez avoir reçu une trop grande quantité de médicament ou si vous commencez à ressentir les symptômes de surdosage énumérés ci-dessous, vous devez en informer immédiatement la personne qui vous a administré GLYDO. Votre médecin saura comment gérer ces symptômes et vous donner le traitement nécessaire.
Administration de GLYDO par vous-même ou par un soignant pour l’auto-cathétérisme
Le fait que vous développiez ou non des symptômes de surdosage dépend du taux de ce médicament présent dans votre sang. Plus la quantité de lidocaïne dans le sang est importante, plus les symptômes d’un surdosage peuvent être graves. Normalement, seules de petites quantités de lidocaïne sont absorbées dans le sang à partir de GLYDO. Une trop grande quantité de lidocaïne peut être absorbée si la surface à traiter est endommagée.
Les premiers symptômes d’un surdosage sont par exemple :
· des problèmes d’audition, de vision, d’élocution et/ou de coordination des mouvements, des bâillements, de l’agitation, des vertiges, des nausées et des vomissements.
En cas de surdosage, contactez immédiatement un médecin ou le service des urgences d’un hôpital, même en l’absence de symptômes.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations <à votre médecin, pharmacien ou infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
La lidocaïne est généralement bien tolérée à condition que le médicament soit utilisé comme indiqué dans la rubrique « 3. Comment utiliser GLYDO 20 mg/mL, gel en seringue préremplie ? » et que les précautions nécessaires soient prises (voir rubrique « 2. Quelles sont les informations à connaître avant d’utiliser GLYDO 20 mg/mL, gel en seringue préremplie ? »)
Certains effets indésirables peuvent être graves. Consultez immédiatement un médecin si vous avez une réaction allergique (hypersensibilité) provoquant :
· un gonflement des mains, des pieds, du visage, des lèvres, de la bouche, de la langue ou de la gorge
· des difficultés respiratoires
· un essoufflement dû au rétrécissement des voies respiratoires (bronchospasme)
· des problèmes de peau tels que des démangeaisons ou des éruptions cutanées
· de l’urticaire
· une chute de la pression sanguine et un choc
Ces effets indésirables sont rares (peuvent toucher jusqu’à 1 personne sur 1 000).
Les autres effets indésirables peuvent être :
Très rare (peuvent toucher jusqu’à 1 personne sur 10 000)
· irritation au niveau du site d’administration.
Des symptômes de surdosage peuvent apparaître en raison d’une absorption accrue (du site d’application vers le sang) ou d’un surdosage (voir également la rubrique« 3. Si on vous a administré / si vous avez utilisé plus de GLYDO 20 mg/mL, gel en seringue préremplie que vous n’auriez dû »
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER GLYDO 20 mg/mL, gel en seringue préremplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette/la plaquette/l’emballage après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température. Conserver les plaquettes dans l’emballage extérieur à l’abri de la lumière.
Conservez la seringue préremplie dans sa plaquette non ouverte jusqu’à son utilisation.
GLYDO est destiné à un usage unique. La seringue et tout gel non utilisé en une seule fois doivent être éliminés.
Ne jetez aucun médicament au tout-à-l’égout. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient GLYDO 20 mg/mL, gel en seringue préremplie
· La substance active est la lidocaïne, présente sous forme de chlorhydrate de lidocaïne monohydraté.
1 mL de gel contient 20,1 mg de chlorhydrate de lidocaïne équivalent à 21,5 mg de chlorhydrate de lidocaïne monohydraté.
Seringue préremplie de 6 mL :
Une seringue préremplie de 6 mL de gel contient 120,6 mg de chlorhydrate de lidocaïne.
Seringue préremplie de 11 mL :
Une seringue préremplie de 11 mL de gel contient 221,1 mg de chlorhydrate de lidocaïne.
· Les autres composants sont:
Hypromellose, hydroxyde de sodium (pour l’ajustement du pH), eau purifiée.
Qu’est-ce que GLYDO 20 mg/mL, gel en seringue préremplie et contenu de l’emballage extérieur
Gel clair, presque incolore, stérile.
GLYDO est disponible sous forme de seringue préremplie stérile contenant 6 ou 11 mL de gel. Les seringues sont emballées individuellement sous plaquette transparente stérile.
Chaque graduation de la seringue équivaut à environ 1 mL de gel (soit 20,1 mg de chlorhydrate de lidocaïne).
Présentations :
Boîte de 10 seringues préremplies, chacune contenant 6 mL de gel.
Boîte de 10 seringues préremplies, chacune contenant 11 mL de gel.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
GEREONSMÜHLENGASSE 1-11
50670 COLOGNE
ALLEMAGNE
Exploitant de l’autorisation de mise sur le marché
84 QUAI JOSEPH GILLET
69004 LYON
MOTZENER STR. 41
12277 BERLIN
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).