Dernière mise à jour le 08/01/2026
VOQUILY 1 mg/mL, solution buvable
Indications thérapeutiques
Classe pharmacothérapeutique : Mélatonine, code ATC : N05CH01.
VOQUILY contient la substance active mélatonine, une hormone produite naturellement par le corps humain. Cette hormone aide à réguler le cycle jour-nuit du corps.
VOQUILY peut être utilisé pour :
· L’insomnie d’endormissement chez les enfants et les adolescents (âgés de 6 à 17 ans) présentant un trouble déficit de l'attention avec hyperactivité (TDAH) lorsque les autres mesures de bonne hygiène de sommeil n’ont pas assez bien fonctionné.
Présentations
> 1 flacon en verre brun avec fermeture de sécurité enfant de 150 mL avec adaptateur pour flacon avec seringue pour administration orale graduée polyéthylène basse densité (PEBD)
Code CIP : 34009 302 605 1 7
Déclaration de commercialisation : 23/12/2025
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 31/07/2025
VOQUILY 1 mg/mL, solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque millilitre de solution contient 1 mg de mélatonine.
Excipients à effet notoire :
Sorbitol : 140 mg par dose de 1 mL.
Propylèneglycol : 150 mg par dose de 1 mL.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution transparente, incolore à jaunâtre, avec une odeur de fraise caractéristique.
4.1. Indications thérapeutiques
· L’insomnie d’endormissement chez les enfants et les adolescents âgés de 6 à 17 ans présentant un trouble déficit de l'attention avec hyperactivité (TDAH) lorsque les mesures d’hygiène de sommeil ont été insuffisantes.
4.2. Posologie et mode d'administration
Insomnie d’endormissement chez les enfants et les adolescents âgés de 6 à 17 ans présentant un TDAH :
Des données limitées sont disponibles pour un traitement allant jusqu’à 3 ans maximum. Après au moins 3 mois de traitement, le médecin doit évaluer l’effet du traitement et envisager l’arrêt du traitement s’il ne donne lieu à aucun effet cliniquement pertinent. Les patients doivent être surveillés à intervalles réguliers (au moins tous les 6 mois) afin de vérifier que VOQUILY est toujours le traitement le plus approprié. Pendant le traitement, en particulier si l’effet du traitement est insuffisant, des tentatives d’arrêt du traitement doivent être faites régulièrement, au moins une fois par an.
Si le patient a été sujet à des insomnies en étant sous traitement par médicament contre le TDAH, un ajustement de la dose ou un changement de médicament contre le TDAH doit être envisagé.
Enfants de moins de 6 ans présentant un TDAH
La sécurité et l’efficacité de VOQUILY chez les enfants de 0 à 6 ans n’ont pas été établies.
Populations particulières
Insuffisance rénale
Des données limitées chez les patients présentant une insuffisance rénale sont disponibles. La prudence s’impose lors de l’administration de la mélatonine chez des patients présentant une insuffisance rénale. VOQUILY n’est pas recommandé pour les patients présentant une insuffisance rénale sévère (voir rubrique 5.2).
Insuffisance hépatique
Aucune donnée n’est actuellement disponible quant à l’utilisation de VOQUILY chez les patients présentant une insuffisance hépatique. Les données limitées indiquent que la clairance plasmatique de la mélatonine est significativement réduite chez les patients présentant une cirrhose du foie. VOQUILY n’est pas recommandé chez les patients présentant une insuffisance hépatique sévère (voir rubrique 5.2).
Intolérance au glucose
La prise de mélatonine avec des repas riches en glucides pourrait affecter le contrôle du niveau de glucose dans le sang pendant plusieurs heures (voir rubrique 4.4).
Sujets âgés
Les niveaux d’exposition à la mélatonine après administration par voie orale chez les jeunes adultes et les adultes modérément plus âgés sont comparables. La sensibilité à la mélatonine exogène des personnes significativement plus âgées n’est pas connue. Il est donc recommandé d’agir avec prudence lors du traitement de cette tranche d’âge et une posologie individualisée est recommandée (voir la rubrique 5.2).
Mode d’administration
VOQUILY est administré par voie orale uniquement.
VOQUILY doit être pris avec un verre d’eau.
La nourriture peut favoriser l’augmentation de la concentration plasmatique en mélatonine. Il est recommandé d’administrer VOQUILY à jeun et de ne pas consommer de nourriture 1 h avant et 1 h après la prise de VOQUILY (voir rubrique 5.2).
Une seringue orale graduée de 10 mL avec des graduations de 0,5 mL d’intervalle et un adaptateur à pression pour flacon (PIBA) sont fournis avec le médicament.
1. Ouvrir le flacon et insérer le PIBA lors de la première utilisation.
2. Insérer la seringue dans le PIBA et aspirer le volume requis à partir du flacon retourné.
3. Retirer la seringue remplie du flacon remis en position verticale.
4. Vider le contenu de la seringue dans la bouche.
5. Rincer la seringue et replacer le bouchon sur le flacon (en gardant le PIBA en place).
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
La prise de mélatonine peut provoquer de la somnolence. VOQUILY 1 mg/mL solution orale doit être utilisé avec prudence si les effets de la somnolence sont susceptibles d’être associés à un risque pour la sécurité du patient (voir rubrique 4.7).
Maladies auto-immunes
Des cas occasionnels d’exacerbation de maladie auto-immune ont été décrits chez les patients prenant de la mélatonine. Il n’existe actuellement aucune donnée quant à l’utilisation de la mélatonine chez les patients présentant une maladie auto-immune. VOQUILY n’est pas recommandé chez les patients présentant une maladie auto-immune.
Intolérance au glucose
Des données limitées suggèrent que la mélatonine prise dans un laps de temps trop proche de la consommation de plats riches en glucides pourrait affecter le contrôle du niveau de glucose pendant plusieurs heures. VOQUILY doit être pris au moins 2 heures avant et au moins 2 heures après un repas ; idéalement 3 heures après un repas pour les personnes présentant une forte intolérance au glucose ou un diabète.
Insuffisance rénale/hépatique
Il n’existe que des données limitées sur la sécurité et l’efficacité de la mélatonine chez les patients présentant une insuffisance rénale ou une insuffisance hépatique. L’utilisation de VOQUILY n’est pas recommandée chez les patients présentant une insuffisance rénale ou hépatique sévère.
VOQUILY contient du sorbitol et du propylèneglycol :
La présence de sorbitol dans les médicaments pris par voie orale peut affecter la biodisponibilité d’autres médicaments administrés de façon concomitante par voie orale.
Ce médicament contient 150 mg de propylèneglycol par millilitre.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Interactions pharmacocinétiques
La mélatonine est métabolisée principalement par les enzymes du cytochrome hépatique P450 CYP1A, plus spécifiquement le CYP1A2. Par conséquent, des interactions entre la mélatonine et d’autres substances actives découlant de leur effet sur les enzymes CYP1A sont possibles.
· La prudence s’impose chez les patients traités par la fluvoxamine, car cet agent entraîne une augmentation des niveaux de mélatonine (une ASC 17 fois supérieure et une Cmax 12 fois supérieure) en inhibant son métabolisme par les isoenzymes CYP1A2 et CYP2C19. Cette association est à éviter.
· La prudence s’impose chez les patients traités par le 5- ou le 8-méthoxypsoralène (5- ou 8-MOP), car ces agents entraînent une augmentation des niveaux de mélatonine en inhibant son métabolisme.
· La prudence s’impose chez les patients traités par la cimétadine, car cet agent entraîne une augmentation des concentrations plasmatiques de mélatonine en inhibant son métabolisme par le CYP1A2.
· La prudence s’impose chez les patientes sous œstrogénothérapie (par ex. contraceptifs ou hormonothérapie de substitution), car les œstrogènes accroissent les niveaux de mélatonine en inhibant son métabolisme par le CYP1A2.
· Les inhibiteurs du CYP1A2 (tels que les quinolones) sont susceptibles d’accroître les niveaux de mélatonine systémique.
Inducteurs du CYP1A2
· Les inducteurs du CYP1A2 (tels que la carbamazépine et la rifampicine) sont susceptibles de réduire les concentrations plasmatiques de la mélatonine.
· Le tabagisme peut réduire les niveaux de mélatonine car il provoque une induction du métabolisme de l’isoenzyme CYP1A2.
Interactions pharmacodynamiques
Benzodiazépines et hypnotiques autres que les benzodiazépines
La mélatonine peut amplifier les propriétés sédatives des benzodiazépines (par ex. midazolam, témazépam) et des hypnotiques autres que les benzodiazépines (par ex. zaléplon, zolpidem et zopiclone). Dans une étude sur le traitement du syndrome du décalage horaire, l’association de la mélatonine et du zolpidem s’est traduite par une plus forte incidence de somnolence matinale, de nausées et de confusion, une altération accrue de l’attention, de la mémoire et de la coordination, ainsi qu’une activité réduite pendant la première heure suivant le réveil, par rapport au zolpidem utilisé seul. L’utilisation de la mélatonine en association avec ces types de médicaments n’est pas recommandée.
Nifédipine
La mélatonine peut réduire l’effet hypotenseur de la nifédipine, la prudence s’impose donc dans cette association et un ajustement de la dose de nifédipine peut être requis.
Warfarine
La mélatonine peut augmenter l’activité anticoagulante de la warfarine. L’association de la warfarine ou autre antagoniste de la vitamine K avec la mélatonine peut nécessiter un ajustement de la dose des médicaments anticoagulants et doit être évitée.
Thioridazine/imipramine
La mélatonine peut accroître les sensations de somnolence et l’incapacité à effectuer des tâches lorsqu’elle est administrée en association avec la thioridazine et l’imipramine.
Alcool
L’alcool est un sédatif ayant la capacité d’altérer les fonctions physiques et mentales. Il est possible que les patients ressentent une somnolence accrue lorsque l’alcool est consommé en même temps que la mélatonine.
Bêta-bloquants
Les bêta-bloquants peuvent supprimer la mélatonine endogène, mais l’importance clinique de ce facteur est inconnue lorsqu’une mélatonine exogène est administrée.
AINS
Certains AINS, par ex. l’aspirine et l’ibuprofène peuvent supprimer la sécrétion endogène de mélatonine, mais l’importance clinique de ce facteur est inconnue lorsqu’une mélatonine exogène est administrée.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas ou peu de données sur l’utilisation de la mélatonine chez la femme enceinte. La mélatonine exogène traverse facilement le placenta humain.
Les études effectuées chez l’animal sont insuffisantes pour permettre de conclure sur la toxicité sur la reproduction (voir rubrique 5.3).
VOQUILY n’est pas recommandé pendant la grossesse ou chez les femmes en âge de procréer n’ayant pas recours à la contraception.
Allaitement
La mélatonine endogène est secrétée dans le lait maternel.
Les données pharmacodynamiques/toxicologiques chez les animaux ont montré une excrétion de mélatonine exogène/métabolites dans le lait (voir rubrique 5.3).
Il est impossible d’exclure un risque pour les enfants allaités.
VOQUILY ne doit pas être utilisé pendant l’allaitement.
Fertilité
Des doses élevées de mélatonine ont affecté la fertilité des animaux mâles et femelles. L’impact de ces données sur la fertilité humaine n’est pas connu.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
La mélatonine a une influence modérée sur l’aptitude à conduire des véhicules et à utiliser des machines. La mélatonine peut induire une somnolence et réduire le niveau de vigilance pendant plusieurs heures. Par conséquent, l’utilisation de VOQUILY n’est pas recommandée avant de conduire des véhicules et d’utiliser des machines
Résumé du profil de sécurité
La somnolence, les maux de tête, l’étourdissement/la désorientation et les nausées sont des effets indésirables signalés plus fréquemment lors de la prise de doses sur des périodes allant de plusieurs jours à plusieurs semaines chez les personnes en bonne santé et les patients.
Liste tabulée des effets indésirables
Les effets indésirables suivants à la mélatonine en général ont été signalés dans des essais cliniques ou dans des rapports de cas spontanés. Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre de sévérité décroissante.
|
Classes de systèmes d’organes |
|
Très fréquent (≥ 1/10) |
Fréquent (≥ 1/100 à < 1/10) |
Peu fréquent (≥ 1/1 000 à < 1/100) |
Rare (≥ 1/10 000 à < 1/1 000) |
Fréquence indéterminée : (ne peut pas être estimée sur la base des données disponibles) |
|
Infections et infestations |
|
|
|
|
Herpès zoster |
|
|
Affections hématologiques et du système lymphatique |
|
|
|
|
Leucopénie, thrombocytopénie |
|
|
Affections du système immunitaire |
|
|
|
|
|
Réaction d’hypersensibilité |
|
Troubles du métabolisme et de la nutrition |
|
|
|
|
Hypertriglycéridémie, hypocalcémie, hyponatrémie |
|
|
Affections psychiatriques |
|
|
|
Irritabilité, nervosité, impatience, insomnie, rêves anormaux, cauchemars, anxiété |
Troubles de l’humeur, agressivité, agitation, pleurs, stress, désorientation, réveil tôt le matin, augmentation de la libido, humeur dépressive, dépression |
|
|
Affections du système nerveux |
|
|
Maux de tête, somnolence |
Migraine, léthargie, hyperactivité psychomotrice, étourdissement |
Syncope (évanouissement), trouble de la mémoire, trouble de l’attention, état rêveur, syndrome des jambes sans repos, sommeil de qualité médiocre, paresthésie |
Somnolence, Sédation |
|
Affections de la vue |
|
|
|
|
Baisse de l’acuité visuelle, vision trouble, larmoiement accru |
|
|
Affections de l’oreille et du labyrinthe |
|
|
|
|
Vertige positionnel, vertige |
|
|
Affections cardiaques |
|
|
|
|
Angine de poitrine, palpitations |
|
|
Affections vasculaires |
|
|
|
Hypertension |
Bouffées de chaleur |
|
|
Affections gastro-intestinales |
|
|
|
Douleurs abdominales, douleurs dans la partie supérieure de l’abdomen, dyspepsie, ulcères buccaux, sécheresse buccale, nausées |
Reflux gastro-œsophagien, Troubles gastro-intestinales, pemphigus de la muqueuse buccale, ulcères sur la langue, douleurs gastro-intestinales, vomissements, sons anormaux dans les intestins, flatulences, hypersécrétion salivaire, halitose, gênes abdominales, troubles gastriques, gastrite |
|
|
Affections hépatobiliaires |
|
|
|
Hyper-bilirubinémie |
|
|
|
Affections de la peau et du tissus sous-cutané |
|
|
|
Dermatite, sueurs nocturnes, prurit, éruptions cutanées, prurit généralisé, sècheresse cutanée |
Eczéma, érythème, dermatite des mains, psoriasis, éruption cutanée généralisée, éruptions cutanées pruritiques, affection des ongles |
angio-œdème, œdème de la langue, œdème buccal |
|
Affections musculo-squelettiques et systémiques |
|
|
|
Douleurs aux extrémités |
Arthrite, spasmes musculaires, douleurs cervicales, crampes nocturnes |
|
|
Affections du rein et des voies urinaires |
|
|
|
Glycosurie, protéinurie |
Polyurie, hématurie, nycturie |
|
|
Affections du système reproductif et de la poitrine |
|
|
|
Symptômes de la ménopause |
Priapisme, prostatite |
Galactorrhée |
|
Troubles généraux et anomalies au site d'administration |
|
|
|
Asthénie, douleurs dans la poitrine |
Fatigue, douleurs, soif |
|
|
Investigations |
|
|
|
Anomalies au test de la fonction hépatique, prise de poids |
Augmentation des enzymes hépatiques, ionogramme sanguin anormal, analyses biologiques anormales |
|
Population pédiatrique
Chez la population pédiatrique, une fréquence plus basse des effets indésirables généralement modérés a été signalée. Le nombre d’effets indésirables ne variait pas de manière significative entre les enfants ayant reçu un placebo et les enfants ayant reçu de la mélatonine. Les effets indésirables les plus fréquents étaient les maux de tête, l’hyperactivité, l’étourdissement et les douleurs abdominales. Aucun effet indésirable grave n’a été observé.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
L’ingestion de doses quotidiennes allant jusqu’à 300 mg de mélatonine n’a provoqué aucun effet indésirable cliniquement significatif.
Bouffées de chaleur, crampes abdominales, diarrhée, maux de tête et scotome (scotoma lucidum) ont été signalés après ingestion de doses extrêmement élevées de mélatonine (3 000 à 6 600 mg) pendant plusieurs semaines.
Des mesures générales d’assistance médicale doivent être prises. Un lavage gastrique et l’administration de charbon actif peuvent être envisagés.
La clairance de la substance active est attendue dans les 12 heures suivant l’ingestion.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Mélatonine, code ATC : N05CH01.
La mélatonine est une hormone et un antioxydant. La mélatonine, sécrétée par la glande pinéale, est impliquée dans la synchronisation des rythmes circadiens et dans la régulation du rythme jour-nuit. La sécrétion de mélatonine et son taux plasmatique augmentent rapidement après la tombée de la nuit, avec un pic autour de 2 h 00 à 4 h 00 du matin puis diminuent jusqu’au nadir à l’aube. Le pic de sécrétion de la mélatonine est pratiquement diamétralement opposé au pic d’intensité lumineuse de la journée, lequel est le principal stimulus pour le maintien de la rythmicité circadienne de la sécrétion de mélatonine.
Mécanisme d’action
Il est supposé que le mécanisme d’action pharmacologique de la mélatonine soit basé sur son interaction avec les récepteurs MT1, MT2 et MT3, car ces récepteurs (en particulier MT1 et MT2) sont impliqués dans la régulation du sommeil et des rythmes circadiens en général.
Effets pharmacodynamiques
La mélatonine a un effet hypnotique/sédatif et augmente la propension au sommeil. La mélatonine administrée plus tôt ou plus tard que le pic nocturne de sécrétion de la mélatonine peut, respectivement, anticiper ou retarder la rythmicité circadienne de la sécrétion de mélatonine.
Efficacité et sécurité clinique
Population pédiatrique présentant un TDAH et des troubles du sommeil
Des traitements à base de mélatonine ont été étudiés dans une étude de 4 semaines, randomisée, en double aveugle et contrôlée par placebo chez 105 enfants âgés de 6 à 12 ans, ne prenant pas de stimulant, présentant un TDAH et une insomnie d’endormissement chronique (van der Heijden KB et al. 2007). Les participants ont reçu de la mélatonine (3 mg lorsque le poids corporel était de < 40 kg [n = 44] ; ou 6 mg lorsque le poids corporel était > 40 kg [n = 9]) par comprimés à libération rapide ou ont reçu un placebo.
Les estimations moyennes par actimétrie de l’endormissement ont montré un avancement de 26,9 ± 47,8 minutes avec la mélatonine, et au contraire un retard de 10,5 ± 37,4 minutes avec le placebo (p < 0,0001). 48,8 % des enfants ayant reçu de la mélatonine ont montré un avancement de l’endormissement de > 30 minutes par rapport à 12,8 % avec le placebo (p = 0,001). Il a été observé une augmentation de la durée moyenne de sommeil de 19,8 ± 61,9 minutes avec la mélatonine et une diminution de 13,6 ± 50,6 minutes avec le placebo (p = 0,01). Par rapport au placebo, le groupe mélatonine a montré une diminution de la latence à l'endormissement (p = 0,001) et une augmentation de l’efficacité du sommeil (p = 0,01). Le score moyen sur la partie « difficultés à s’endormir » de l’échelle d’évaluation du sommeil a diminué de 1,2 ± 1,3 points (35,3 % par rapport à la valeur de référence) avec la mélatonine et de 0,1 ± 0,8 points (4,3 % par rapport à la valeur de référence) avec le placebo (p < 0,0001).
Aucun effet significatif sur le comportement, les facteurs cognitifs ni la qualité de vie n’a été observé.
5.2. Propriétés pharmacocinétiques
La mélatonine est une petite molécule amphiphile (poids moléculaire de 232 g/mol) active dans sa forme parentale. La mélatonine est synthétisée dans le corps humain à partir du tryptophane par la sérotonine. De petites quantités sont apportées par l’alimentation. Les données résumées ci-dessous proviennent d’études qui, généralement, ont inclus des hommes et des femmes en bonne santé, principalement de jeunes adultes et des adultes d’âge moyen.
La mélatonine administrée par voie orale est presque totalement absorbée. La biodisponibilité orale est de 10 à 35 %, en raison d’un métabolisme de premier passage de la mélatonine. Le tmax dans le plasma est d’environ 20 minutes. Une dose de 3 mg de mélatonine à libération immédiate élève la Cmax plasmatique de mélatonine à environ 8 700 pg/mL, soit environ 60 fois la Cmax plasmatique nocturne de mélatonine (endogène) chez les jeunes adultes et 170 fois celle des personnes plus âgées, bien que les deux Cmax, endogène et exogène, montrent une variabilité inter-individuelle importante.
Les données sur l’effet de l’apport de nourriture au moment, ou proche du moment, de l’administration de la mélatonine sur sa pharmacocinétique sont limitées, mais suggèrent que l’apport alimentaire concomitant peut augmenter la biodisponibilité de presque 2 fois. La nourriture semble avoir un effet limité sur le tmax pour la mélatonine à libération immédiate. Ceci ne devrait pas affecter l’efficacité ou la sécurité de la mélatonine ; toutefois, il est recommandé de ne pas consommer de nourriture durant l’heure qui précède et l’heure qui suit la prise de mélatonine.
Distribution
Le taux de liaison aux protéines de la mélatonine est d’environ 50 à 60 %. La mélatonine se lie principalement à l’albumine, mais elle se lie également à l’alpha-1-glycoprotéine acide ; la liaison à d’autres protéines plasmatiques est limitée. La mélatonine se distribue rapidement depuis le plasma dans et hors de la plupart des tissus et des organes, et traverse facilement la barrière hémato-encéphalique. La mélatonine traverse aisément le placenta. Sa concentration dans le sang ombilical des bébés nés à terme est en corrélation étroite avec celle de leur mère suite à la prise d’une dose de 3 mg.
Biotransformation
La mélatonine est principalement métabolisée par le foie. Les données expérimentales suggèrent que les enzymes CYP1A1 et CYP1A2 du cytochrome P450 sont les principales responsables du métabolisme de la mélatonine, CYP2C19 ayant une importance mineure. La mélatonine est principalement métabolisée en 6-hydroxymélatonine (représentant environ 80 à 90 % des métabolites de la mélatonine retrouvés dans l’urine). La N-acétylsérotonine semble être le principal métabolite mineur (représentant environ 10 % des métabolites de la mélatonine retrouvés dans l’urine). Le métabolisme de la mélatonine est très rapide, le taux plasmatique de 6-hydroxymélatonine augmentant quelques minutes après l’entrée de la mélatonine exogène dans la circulation systémique. La 6-hydroxymélatonine subit une sulfo-conjugaison (environ 70 %) et une glucurono-conjugaison (environ 30 %) avant l’excrétion.
Élimination
La demi-vie d’élimination plasmatique (t½) est d’environ 45 minutes (plage normale environ 30 à 60 minutes) chez les adultes en bonne santé. La demi-vie, en moyenne, est comparable ou légèrement plus courte chez les enfants par rapport aux adultes. Les métabolites de la mélatonine sont principalement éliminés par l’urine, environ 90 % sous forme de conjugués de sulfate et de glucuronide de 6-hydroxymélatonine. Moins d’environ 1 % de la dose de mélatonine est éliminé sous forme inchangée dans les urines.
Linéarité/non-linéarité
La Cmax plasmatique de la mélatonine et l’ASC augmentent d’une manière linéaire directement proportionnelle pour des doses orales de mélatonine à libération immédiate allant de 1 à 10 mg alors que le tmax et la t½ plasmatiques restent constants.
Sexe
Des données limitées suggèrent que la Cmax peut être plus élevée chez les femmes plus âgées par rapport aux hommes. Une grande variabilité dans la Cmax entre des personnes de même sexe a également été observée. Cependant, aucune différence pharmacodynamique entre les hommes et les femmes n’a été observée malgré des différences dans les taux sanguins. Un ajustement de la dose pour les femmes n’est pas nécessaire.
Populations particulières
Sujets âgés
La concentration plasmatique nocturne en mélatonine endogène est plus faible chez les personnes âgées par rapport aux jeunes adultes. Des données limitées pour le tmax, la Cmax et la demi-vie d’élimination (t½) plasmatiques, ainsi que pour l’ASC suite à l’ingestion de mélatonine à libération immédiate ne montrent pas de différences significatives entre les jeunes adultes et les personnes âgées en général, bien que la plage des valeurs (variabilité inter-individuelle) pour chaque paramètre ait tendance à être plus élevée chez les personnes âgées.
Insuffisance hépatique
Des données limitées indiquent que, durant la journée, la concentration plasmatique de mélatonine endogène dans le sang est sensiblement plus élevée chez les patients souffrant d’une cirrhose du foie, probablement en raison de la clairance réduite (métabolisme) de la mélatonine. La t½ sérique pour la mélatonine exogène chez les patients atteints de cirrhose était le double de celle des patients du groupe contrôle dans une petite étude. Comme le foie est le site principal du métabolisme de la mélatonine, il est prévisible qu’une insuffisance hépatique entraîne des concentrations plasmatiques en mélatonine endogène plus élevées.
Insuffisance rénale
Comme la mélatonine est principalement excrétée sous forme de métabolites dans l’urine, une augmentation des taux plasmatiques de ces métabolites est probable chez les patients atteints d’une insuffisance rénale plus avancée.
5.3. Données de sécurité préclinique
Les données non cliniques issues des études de toxicologie, génotoxicité et potentiel cancérogène en administration répétée et unique n’ont pas révélé de risque particulier pour l’homme.
Les données sur la toxicologie reproductive sont limitées.
Des études sur le développement embryo-fœtal chez les rats et les lapins n’ont pas démontré d’effets dangereux directs ou indirects sur la grossesse, la survie du fœtus, le poids corporel du fœtus ou d’incidences sur des malformations/anomalies fœtales.
Des résultats provenant d’études sur le développement prénatal et postnatal chez les rats indiquent que l’administration de la mélatonine affecte les niveaux hormonaux et la maturation sexuelle chez les petits.
Les données provenant d’études chez les animaux indiquent que la mélatonine se transmet au fœtus via le placenta.
Il n’existe pas d’études de sécurité chez les jeunes animaux.
Sorbitol liquide (non cristallisable) (E420)
Sucralose (E955)
Arôme de fraise (contient du propylèneglycol (E1520))
Acide chlorhydrique (pour l’ajustement du pH) (E507)
Eau purifiée
2 ans.
Utiliser dans les 6 mois suivant la 1ère ouverture.
6.4. Précautions particulières de conservation
À conserver dans l’emballage d’origine à l’abri de la lumière.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Flacons en verre brun contenant 60 mL ou 150 mL de solution buvable, fermé à l’aide d’un bouchon à vis en (PEHD) avec un revêtement (PEBD), scellé et avec une fermeture de sécurité enfant,
Une seringue orale graduée (PEBD) de 10 mL, avec des graduations intermédiaires, tous les 0,5 mL, et un adaptateur à pression pour flacon/seringue (PIBA) en PEBD sont fournis avec le médicament.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Utilisation dans la population pédiatrique
Pas d’exigences particulières.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SCHIPHOL BOULEVARD 359
WTC SCHIPHOL AIRPORT,
D TOWER 11TH FLOOR
1118BJ SCHIPHOL
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 605 0 0 : 60 mL en flacon (verre brun) avec seringue pour administration orale de 10 mL graduée toutes les 0,5 mL.
· 34009 302 605 1 7 : 150 mL en flacon (verre brun) avec seringue pour administration orale de 10 mL graduée toutes les 0,5 mL.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I
ANSM - Mis à jour le : 31/07/2025
VOQUILY 1 mg/mL, solution buvable
Mélatonine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que VOQUILY 1 mg/mL, solution buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser VOQUILY 1 mg/mL, solution buvable?
3. Comment utiliser VOQUILY 1 mg/mL, solution buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver VOQUILY 1 mg/mL, solution buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE VOQUILY ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Mélatonine, code ATC : N05CH01.
VOQUILY contient la substance active mélatonine, une hormone produite naturellement par le corps humain. Cette hormone aide à réguler le cycle jour-nuit du corps.
VOQUILY peut être utilisé pour :
· L’insomnie d’endormissement chez les enfants et les adolescents (âgés de 6 à 17 ans) présentant un trouble déficit de l'attention avec hyperactivité (TDAH) lorsque les autres mesures de bonne hygiène de sommeil n’ont pas assez bien fonctionné.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER VOQUILY 1 mg/mL, solution buvable ?
· Si vous êtes allergique à la mélatonine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre VOQUILY :
· Si vous souffrez d’épilepsie. VOQUILY peut augmenter la fréquence des convulsions chez les patients souffrant d’épilepsie.
· Si vous souffrez d’une maladie auto-immune (lorsque le corps est « attaqué » par son propre système immunitaire).
· Si vous souffrez de diabète ou d’une intolérance au glucose, car ce médicament pourrait augmenter votre taux de glucose dans le sang (voir rubrique 3).
· Si vous souffrez d’une insuffisance rénale ou hépatique.
· Si vous fumez. Fumer pourrait réduire l’effet de VOQUILY, car les composants du tabac peuvent favoriser la dégradation de la mélatonine par le foie.
· Si vous êtes une personne âgée.
· Si vous êtes une femme en âge de procréer. Une méthode de contraception doit être utilisée pendant le traitement par VOQUILY. Ce médicament peut toutefois affecter certaines méthodes de contraception, voir la rubrique « Autres médicaments et VOQUILY » pour plus d’informations.
Enfants de moins de 6 ans
N’administrez pas ce médicament aux enfants de moins de 6 ans car sa sécurité et son efficacité ne sont pas connues.
Autres médicaments et VOQUILY
Informez votre médecin ou pharmacien si vous ou votre enfant prenez, avez récemment pris ou pourriez prendre tout autre médicament. Ils incluent :
· La fluvoxamine (utilisée pour le traitement de la dépression et du trouble obsessionnel compulsif), car elle peut augmenter les effets de la mélatonine.
· Les psoralènes (utilisés pour le traitement des troubles de la peau, par exemple le psoriasis), car ils peuvent augmenter les effets de la mélatonine.
· La cimétidine (utilisée pour le traitement des problèmes gastriques tels que les ulcères), car elle peut augmenter les effets de la mélatonine.
· Les œstrogènes (utilisés dans les contraceptifs ou hormonothérapies de substitution) car ils peuvent augmenter les effets de la mélatonine.
· Les quinolones (utilisées pour le traitement des infections bactériennes), car elles peuvent augmenter les effets de la mélatonine.
· La rifampicine (utilisée pour le traitement des infections bactériennes), car elle peut diminuer les effets de la mélatonine.
· Le tabagisme peut diminuer les effets de la mélatonine.
· La carbamazépine (utilisée pour le traitement de l’épilepsie), car elle peut diminuer les effets de la mélatonine.
· Les bêta-bloquants (utilisés pour le traitement de l’hypertension artérielle), car ils peuvent diminuer les effets de la mélatonine.
· La nifédipine (utilisée pour le traitement de l’hypertension artérielle), car la mélatonine peut diminuer les effets de la nifédipine.
· Les benzodiazépines et hypnotiques autres que les benzodiazépines (médicaments utilisés pour induire le sommeil, p. ex. midazolam, témazépam, et zaléplon, zolpidem, zopiclone), car la mélatonine peut augmenter les effets sédatifs de ces médicaments et certains effets indésirables du zolpidem (somnolence matinale, nausées, confusion).
· La warfarine (anticoagulants), car la mélatonine peut influencer les effets anticoagulants de la warfarine.
· La thioridazine (utilisée pour le traitement des troubles mentaux/troubles de l’humeur), car prise avec la mélatonine, elle peut augmenter la somnolence et la difficulté à accomplir des tâches.
· L’imipramine (utilisée pour le traitement de la dépression), car prise avec la mélatonine, elle peut augmenter la somnolence et la difficulté à accomplir des tâches.
· La caféine (stimulant), car la mélatonine interagit avec la caféine.
VOQUILY avec des aliments, boissons et de l’alcool
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Contraception pour les femmes et les jeunes filles en âge de procréer
Les femmes et les jeunes filles fertiles doivent utiliser une contraception lors de la prise de VOQUILY. Certains contraceptifs pouvant augmenter la concentration de mélatonine dans le corps, le choix de la méthode de contraception doit être abordé avec un médecin (voir « Autres médicaments et VOQUILY »).
Grossesse
VOQUILY n’est pas recommandé si vous, ou votre enfant, êtes enceinte. La mélatonine traverse le placenta et il n’existe pas assez d’informations sur le risque que cela pourrait induire pour l’enfant à naître.
Allaitement
VOQUILY n’est pas recommandé si vous allaitez. La mélatonine passe dans le lait maternel, et un risque pour l’enfant à naître ne peut pas être exclu.
Conduite de véhicules et utilisation de machines
VOQUILY peut entraîner une somnolence et réduire la vigilance pendant plusieurs heures après sa prise. Par conséquent, ce médicament ne doit pas être pris avant de conduire ou d’utiliser des machines.
VOQUILY contient du sorbitol et du propylène glycol
Ce médicament contient 140 mg de sorbitol par millilitre. Le sorbitol est une source de fructose. Si votre médecin vous a dit que vous (ou votre enfant) présente(z) une intolérance à certains sucres, ou si l’on vous a diagnostiqué une intolérance héréditaire au fructose, un rare trouble génétique empêchant la personne de détruire le fructose, parlez-en à votre médecin avant que vous (ou votre enfant) ne preniez (prenne) ce médicament.
Ce médicament contient 150 mg de propylèneglycol par millilitre.
3. COMMENT PRENDRE VOQUILY 1 mg/mL, solution buvable ?
La dose initiale recommandée est de 1 à 2 mL (1 à 2 mg), 30 à 60 minutes avant l’heure du coucher.
La dose sera ajustée au cas par cas à un maximum de 5 mL (5 mg) par jour, quel que soit l’âge du patient. La dose la plus faible possible doit être donnée.
Le traitement doit être suivi régulièrement par un médecin (il est recommandé de le faire au moins tous les 6 mois) pour voir s’il est toujours approprié. Le traitement doit être interrompu au moins une fois par an pour voir s’il est toujours requis.
Diabète
Si vous ou votre enfant avez du diabète ou une intolérance au glucose, il ne faut pas consommer de nourriture 2 heures avant ou 2 heures après la prise de VOQUILY, voir « Avertissements et précautions ».
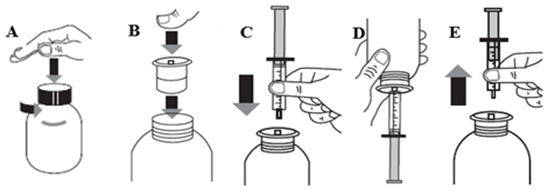
Instructions d’utilisation
VOQUILY doit être avalé avec un verre d’eau.
Il ne faut pas consommer de nourriture 1 heure avant ou 1 heure après la prise du médicament.
Une seringue pour administration orale graduée (pipette) de 10 mL avec des graduations intermédiaires tous les 0,5 mL et un adaptateur à pression pour flacon sont fournis avec le produit.
1. Ouvrir le flacon et lors de la première utilisation, enfoncer l’adaptateur sur le goulot du flacon (1-2).
2. Insérer la seringue dans l’adaptateur (2-3) et retourner le flacon.
3. Aspirer le volume requis du flacon retourné (4).
4. Replacer le flacon en position verticale et retirer la seringue remplie de l’adaptateur (5).
5. Verser doucement le contenu de la seringue dans la bouche en appuyant dessus et avaler le médicament (6).
6. Rincer la seringue et replacer le bouchon sur le flacon pour le fermer (en gardant l’adaptateur en place).
|
|
Si vous avez pris plus de VOQUILY que vous n’auriez dû
Si vous ou votre enfant avez accidentellement pris trop de médicament, ou si par exemple votre enfant a ingéré ce médicament par erreur, contactez un médecin ou un pharmacien immédiatement. Les symptômes les plus fréquents de surdosage sont la somnolence, des maux de tête, de l’étourdissement et des nausées.
Si vous oubliez de prendre VOQUILY
Si vous oubliez de prendre votre dose au moment du coucher et vous réveillez pendant la nuit, vous pouvez prendre la dose oubliée mais pas plus tard que 4 h 00 du matin.
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre VOQUILY
Il n’y a pas d’effets dangereux connus liés à l’interruption ou à l’arrêt du traitement. L’utilisation de VOQUILY n’est pas connue pour causer des effets de sevrage après l’arrêt du traitement.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Si vous ou votre enfant présentez l’un des effets indésirables graves suivants, informez-en immédiatement votre médecin et arrêtez de prendre ce médicament.
Fréquence indéterminée
· Réaction d’hypersensibilité, (réactions de type allergie telles que des démangeaisons ou des difficultés respiratoires)
· Gonflement des couches plus profondes de l’épiderme (angio-œdème)
· Gonflement dans la bouche et de la langue (œdème).
Les autres effets indésirables pouvant survenir sont énumérés ci-dessous :
Effets indésirables fréquents (pouvant toucher jusqu’à 1 personne sur 10)
· Maux de tête
· Somnolence.
Effets indésirables peu fréquents (pouvant toucher jusqu’à 1 personne sur 100)
· Irritabilité, nervosité, agitation, insomnie
· Rêves anormaux, cauchemars, sueurs nocturnes, anxiété, agitation anxieuse, faiblesse physique, manque d’énergie et d’enthousiasme
· Migraine
· Étourdissements
· Hypertension artérielle
· Douleurs abdominales, ulcères buccaux, sécheresse buccale, nausées
· Troubles cutanées (dermatite, prurit, éruption cutanée, sécheresse cutanée)
· Douleurs dans les bras et les jambes
· Symptômes de la ménopause
· Douleurs dans la poitrine
· Excrétion de glucose dans l’urine, protéinurie
· Modification de la composition de votre sang, pouvant entraîner un jaunissement de la peau et des yeux
· Résultats anormaux de l’analyse de la fonction hépatique
· Prise de poids.
Effets indésirables rares (pouvant toucher jusqu’à 1 personne sur 1 000)
· Zona (herpès zoster)
· Diminution du nombre de globules blancs dans le sang
· Diminution du nombre de plaquettes dans le sang
· Taux faibles de calcium ou de sodium dans le sang
· Taux élevés de lipides sanguins
· Troubles de l’humeur, agressivité, agitation, pleurs, symptômes de stress, sentiment de confusion (désorientation), réveil tôt le matin, augmentation du désir sexuel (augmentation de la libido), trouble dépressif, dépression
· Évanouissement, trouble de la mémoire, trouble de l’attention, état rêveur, sensation inconfortable dans les jambes (syndrome des jambes sans repos), mauvaise qualité de sommeil, fatigue
· Troubles visuels, vision trouble, larmoiement accru.
· Sensation d’étourdissement ou de tournoiement (vertige), étourdissement en position debout ou assise
· Battements de cœur plus rapides, douleurs dans la poitrine causées par une angine de poitrine.
· Reflux acides, affections gastro-intestinales, pemphigus de la muqueuse buccale, ulcères sur la langue, douleurs gastro-intestinales, vomissements, sons anormaux dans les intestins, hypersécrétion salivaire, mauvaise haleine, flatulences, gênes abdominales, inflammation de la paroi stomacale
· Sensations anormales au niveau de l’épiderme (paresthésie), affections cutanées (eczéma, érythème, psoriasis), affection des ongles, sensation de chaleur soudaine (bouffées de chaleur)
· Douleurs, arthrite, spasmes musculaires, douleurs cervicales, crampes nocturnes.
· Mictions à grand volume, présence de globules rouges dans l’urine, besoin d’uriner la nuit.
· Érection prolongée (priapisme), gonflement de la prostate (prostatite)
· Soif
· Augmentation des enzymes hépatiques, niveaux d’électrolytes dans le sang anormaux, analyses de laboratoire anormales.
Fréquence indéterminée (la fréquence ne peut être estimée à partir des données disponibles)
· Production spontanée de lait au niveau de la poitrine (également chez les hommes).
Effets indésirables supplémentaires chez les enfants et les adolescents
Une basse fréquence d’effets indésirables généralement légers a été signalée. Les effets indésirables les plus fréquents étaient des maux de tête, de l’hyperactivité, une sensation d’étourdissement et de tournoiement (vertige) et des douleurs abdominales. Aucun effet indésirable grave n’a été observé.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER VOQUILY 1 mg/mL, solution buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
À conserver dans l’emballage d’origine à l’abri de la lumière.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
Utiliser dans les 6 mois suivant la 1ère ouverture.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient VOQUILY 1 mg/mL, solution buvable
· La substance active est :
1 mL de solution contient 1 mg de mélatonine.
· Les autres composants sont :
Propylèneglycol (E1520), sorbitol liquide (non cristallisable) (E420), sucralose (E955), arôme de fraise (contenant du propylèneglycol (E1520)), eau purifiée, acide chlorhydrique (pour l’ajustement du pH) (E507).
Qu’est-ce que VOQUILY 1 mg/mL, solution buvable et contenu de l’emballage extérieur
VOQUILY est une solution transparente, incolore à jaunâtre, avec une odeur de fraise.
Ce médicament est conditionné dans un flacon en verre brun, fermé à l’aide d’un bouchon à vis scellé, avec une fermeture de sécurité enfant.
Une seringue pour administration orale en plastique de 10 mL avec des graduations intermédiaires tous les 0,5 mL et un adaptateur à pression pour flacon/seringue sont également fournis dans chaque boîte en carton.
Présentation : 60 mL ou 150 mL.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
SCHIPHOL BOULEVARD 359
WTC SCHIPHOL AIRPORT,
D TOWER 11TH FLOOR
1118BJ SCHIPHOL
PAYS-BAS
Exploitant de l’autorisation de mise sur le marché
22 Rue Des Aqueducs
94250 Gentilly
THESI POUSI-XATZI
AGIOU LOUKA
PAIANIA ATTIKI
19002, PO BOX 37
GRECE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).