Dernière mise à jour le 02/02/2026
GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule
Indications thérapeutiques
Qu’est-ce que GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation ?
Ce médicament contient une substance active appelée bromure de glycopyrronium, qui appartient à un groupe de médicaments appelés bronchodilatateurs.
Dans quel cas GLYCOPYRRONIUM BIOGARAN AXICA est-il utilisé ?
Ce médicament est utilisé pour faciliter la respiration chez les patients adultes qui souffrent de difficultés respiratoires dues à une maladie pulmonaire appelée broncho-pneumopathie chronique obstructive (BPCO).
En cas de BPCO, le calibre des voies respiratoires (bronches) est resserré par les muscles qui les entourent, ce qui rend la respiration difficile. Ce médicament empêche le resserrement de ces muscles afin de faciliter la circulation de l'air dans vos bronches.
Si vous utilisez ce médicament une fois par jour, il aidera à diminuer les effets de la BPCO sur votre vie quotidienne.
Présentations
> 30 plaquettes thermoformées unitaires pelables polyamide aluminium PVC-Aluminium de 1 gélule + 1 inhalateur
Code CIP : 34009 303 157 1 2
Déclaration de commercialisation : 22/12/2025
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 12,37 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 13,39 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 10/09/2025 | Inscription (CT) | Le service médical rendu par GLYCOPYRRONIUM BIOGARAN AXICA (bromure de glycopyrronium) est important dans le « traitement bronchodilatateur continu pour soulager les symptômes de la broncho-pneumopathie chronique obstructive (BPCO) ». |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 10/09/2025 | Inscription (CT) | Cette spécialité est un hybride qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité de référence SEEBRI BREEZHALER (bromure de glycopyrronium) 44 µg, poudre pour inhalation en gélule. |
ANSM - Mis à jour le : 04/04/2025
GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Bromure de glycopyrronium.................................................................................................... 63 µg
Equivalant à glycopyrronium................................................................................................... 50 µg
Pour 1 gélule.
Chaque dose délivrée au travers de l’embout buccal de l’inhalateur est de 55 microgrammes de bromure de glycopyrronium équivalant à 44 microgrammes de glycopyrronium.
Excipient à effet notoire : chaque gélule contient 23,6 mg de lactose (sous forme de monohydrate).
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre pour inhalation en gélule.
Gélules avec une tête orange transparente et avec un corps transparent sans couleur contenant une poudre blanche à blanc cassé.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
La dose recommandée est l’inhalation du contenu d’une gélule une fois par jour à l’aide de l’inhalateur GLYCOPYRRONIUM BIOGARAN AXICA.
Il est recommandé d’administrer GLYCOPYRRONIUM BIOGARAN AXICA à la même heure chaque jour. En cas d’omission d’une dose, la dose suivante doit être prise le plus tôt possible. Les patients seront avertis qu’ils ne doivent pas prendre plus d’une dose par jour.
Sujets âgés
GLYCOPYRRONIUM BIOGARAN AXICA peut être utilisé à la dose recommandée chez les sujets âgés (75 ans et plus) (voir rubrique 4.8).
Insuffisance rénale
GLYCOPYRRONIUM BIOGARAN AXICA peut être utilisé à la dose recommandée chez les patients atteints d’insuffisance rénale légère à modérée. En cas d’insuffisance rénale sévère ou en phase terminale nécessitant une dialyse, GLYCOPYRRONIUM BIOGARAN AXICA ne doit être utilisé que si le bénéfice attendu pour le patient est supérieur au risque potentiel car l’exposition systémique au glycopyrronium peut augmenter dans cette population (voir rubriques 4.4 et 5.2).
Insuffisance hépatique
Aucune étude n’a été conduite chez les patients atteints d’insuffisance hépatique. Le glycopyrronium étant éliminé essentiellement par voie rénale, il n’est pas attendu d’augmentation importante de l’exposition systémique chez ces patients. Aucun ajustement de dose n’est requis chez les patients présentant une insuffisance hépatique.
Population pédiatrique
Il n’existe pas d’utilisation justifiée de GLYCOPYRRONIUM BIOGARAN AXICA dans la population pédiatrique (en dessous de 18 ans) dans l’indication de la BPCO.
Mode d’administration
Voie inhalée uniquement.
Les gélules doivent être exclusivement administrées à l’aide de l’inhalateur GLYCOPYRRONIUM BIOGARAN AXICA (voir rubrique 6.6).
Les gélules ne doivent être retirées de la plaquette qu’immédiatement avant leur utilisation. Les gélules ne doivent pas être avalées.
Les patients doivent recevoir les instructions adaptées pour une utilisation correcte du dispositif et l'administration du médicament. En cas de non amélioration des symptômes respiratoires par le traitement, il convient de vérifier que le patient n’avale pas la gélule au lieu de l’utiliser en inhalation à l’aide du dispositif d’inhalation.
Pour les instructions concernant l’utilisation du médicament avant administration, voir la rubrique 6.6.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Ce médicament n’est pas destiné à être utilisé pour le traitement des symptômes aigus
GLYCOPYRRONIUM BIOGARAN AXICA est un traitement continu au long cours qui doit être administré régulièrement une fois par jour et non en traitement de secours pour soulager les symptômes d'un épisode de bronchospasme aigu.
Hypersensibilité
Des réactions d’hypersensibilité immédiate ont été rapportées après administration de glycopyrronium. En cas d’apparition de signes évocateurs d’une réaction allergique, notamment angioedème (difficultés à respirer ou à déglutir, gonflement de la langue, des lèvres et du visage), urticaire ou réaction cutanée, le traitement doit être immédiatement arrêté et un traitement alternatif doit être envisagé.
Bronchospasme paradoxal
Il n’a pas été observé de bronchospasme paradoxal dans les études cliniques conduites avec le glycopyrronium. Cependant, des bronchospasmes paradoxaux pouvant engager le pronostic vital, ont été observés avec d’autres traitements administrés par voie inhalée. En cas de survenue d'un bronchospasme paradoxal, le traitement doit être arrêté immédiatement et un autre traitement doit être instauré.
Effet anticholinergique
GLYCOPYRRONIUM BIOGARAN AXICA doit être utilisé avec prudence chez les patients présentant un glaucome à angle fermé ou une rétention urinaire.
Il convient d’informer les patients des signes et symptômes évocateurs d’un glaucome aigu par fermeture de l’angle et de les avertir qu’ils doivent arrêter d’utiliser GLYCOPYRRONIUM BIOGARAN AXICA et contacter immédiatement leur médecin en cas d’apparition de l’un de ces signes ou symptômes.
Insuffisance rénale sévère
Une augmentation moyenne modérée de l’exposition systémique totale (ASCt) allant jusqu’à un facteur de 1,4 a été observée chez des sujets présentant une insuffisance rénale légère ou modérée et jusqu’à un facteur de 2,2 chez des sujets présentant une insuffisance rénale sévère ou terminale. En cas d’insuffisance rénale sévère (débit de filtration glomérulaire estimé inférieur à 30 mL/min/1,73 m2) ou en phase terminale sous dialyse, GLYCOPYRRONIUM BIOGARAN AXICA ne doit être utilisé que si le bénéfice attendu pour le patient est supérieur au risque potentiel (voir rubrique 5.2). La survenue d’effets indésirables doit être surveillée étroitement chez ces patients.
Patients ayant des antécédents de maladies cardiovasculaires
Les patients ayant un angor instable, une insuffisance ventriculaire gauche, un antécédent d’infarctus du myocarde, une arythmie (autre qu’une fibrillation auriculaire chronique stable), un antécédent de syndrome du QT long ou un allongement de l’intervalle QTc (méthode de Fridericia) (QTc >450 ms pour les hommes ou >470 ms pour les femmes) ont été exclus des études cliniques. Par conséquent, l’expérience clinique est limitée chez ces patients et GLYCOPYRRONIUM BIOGARAN AXICA devra être utilisé avec prudence.
Excipients
Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Bien qu’aucune étude spécifique d’interaction médicamenteuse n’ait été réalisée, il n'a pas été rapporté d'interaction médicamenteuse cliniquement pertinente lors de l'administration concomitante de glycopyrronium avec d’autres médicaments couramment utilisés dans le traitement de la BPCO, incluant les bronchodilatateurs sympathomimétiques, les méthylxanthines, et les corticoïdes oraux ou inhalés.
Dans une étude clinique conduite chez des volontaires sains, l’administration concomitante de cimétidine, inhibiteur du transport des cations organiques considéré comme contribuant à l’élimination rénale du glycopyrronium, a augmenté de 22% l’exposition totale (ASC) au glycopyrronium et diminué de 23% la clairance rénale. Au vu de ces résultats, il n’est pas attendu d'interaction cliniquement significative en cas d’administration concomitante du glycopyrronium avec la cimétidine ou avec d’autres inhibiteurs du transport des cations organiques.
L’administration concomitante de glycopyrronium et d’indacatérol (un agoniste bêta-2-adrénergique) par voie inhalée n’a pas entrainé d’interaction pharmacocinétique entre les 2 médicaments.
Les études d’interaction n’ont été réaliséesque sur des adultes.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données sur l’utilisation de GLYCOPYRRONIUM BIOGARAN AXICA chez la femme enceinte. Les études effectuées chez l’animal n’ont pas mis en évidence d'effets délétères directs ou indirects sur la reproduction (voir rubrique 5.3). Le glycopyrronium ne doit être utilisé pendant la grossesse que si le bénéfice attendu justifie le risque potentiel pour le fœtus.
On ne sait pas si le bromure de glycopyrronium est excrété dans le lait maternel. Néanmoins, le bromure de glycopyrronium (et ses métabolites) sont excrétés dans le lait de la rate allaitante (voir rubrique 5.3). L’utilisation du glycopyrronium pendant l’allaitement ne doit être envisagée que si le bénéfice attendu pour la patiente est supérieur aux risques encourus pour le nourrisson (voir rubrique 5.3).
Fertilité
Les études de reproduction et les autres données chez l’animal n’indiquent pas d’effet indésirable sur la fertilité chez les mâles ou les femelles (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Synthèse du profil de sécurité
L’effet indésirable anticholinergique le plus fréquent est une sécheresse buccale (2,4%). La majorité des cas de sécheresse buccale rapportés ont été considérés comme possiblement liés au médicament et bénins, aucun cas sévère n’a été rapporté.
Les autres effets anticholinergiques rapportés peu fréquemment sont la rétention urinaire. Des effets gastro-intestinaux incluant gastro-entérite et dyspepsie ont également été observés. Les effets indésirables en rapport avec la tolérance locale ont été : irritation de la gorge, rhinopharyngite, rhinite et sinusite.
Résumé tabulé des effets indésirables
Les effets indésirables rapportés pendant les six premiers mois des deux études pivots de phase III conduites individuellement sur une durée de 6 et 12 mois sont présentés par classe de système d’organes MedDRA (Tableau 1). Dans chaque classe de système d’organe, les effets indésirables sont présentés suivant un ordre décroissant de fréquence. Dans chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité. De plus, pour chaque effet indésirable, la fréquence de survenue correspondante est présentée selon la convention suivante : très fréquent (≥1/10) ; fréquent (≥1/100, <1/10) ; peu fréquent (≥1/1 000, <1/100) ; rare (≥1/10 000, <1/1 000) ; très rare (<1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 1 Effets indésirables
|
Effets indésirables |
Catégorie de fréquence de survenue |
|
Infections et infestations Nasopharyngite1) Rhinite Cystite |
Fréquent Peu fréquent Peu fréquent |
|
Affections du système immunitaire Hypersensibilité Angioedème2) |
Peu fréquent Peu fréquent |
|
Troubles du métabolisme et de la nutrition Hyperglycémie |
Peu fréquent |
|
Affections psychiatriques Insomnie |
Fréquent |
|
Affections du système nerveux Céphalée3) Hypoesthésie |
Fréquent Peu fréquent |
|
Affections cardiaques |
|
|
Fibrillation auriculaire |
Peu fréquent |
|
Palpitations |
Peu fréquent |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Congestion au niveau des sinus |
Peu fréquent |
|
Toux productive |
Peu fréquent |
|
Irritation de la gorge |
Peu fréquent |
|
Epistaxis |
Peu fréquent |
|
Dysphonie2) |
Peu fréquent |
|
Bronchospasme paradoxal2) |
Fréquence inconnue |
|
Affections gastro-intestinales |
|
|
Sécheresse buccale |
Fréquent |
|
Gastro-entérite Nausées2) Vomissements1)2) |
Fréquent Peu fréquent Peu fréquent |
|
Dyspepsie |
Peu fréquent |
|
Caries dentaires |
Peu fréquent |
|
Affections de la peau et du tissu sous-cutané |
|
|
Eruption cutanée |
Peu fréquent |
|
Prurit2) |
Peu fréquent |
|
Affections musculo-squelettiques et systémiques |
|
|
Douleurs musculo-squelettiques1)2) |
Fréquent |
|
Douleurs des extrémités |
Peu fréquent |
|
Douleur thoracique musculo-squelettique |
Peu fréquent |
|
Affections du rein et des voies urinaires |
|
|
Infection urinaire3) |
Fréquent |
|
Dysurie |
Peu fréquent |
|
Rétention urinaire |
Peu fréquent |
|
Troubles généraux et anomalies au site d’administration |
|
|
Sensation de fatigue |
Peu fréquent |
|
Asthénie |
Peu fréquent |
1) Plus fréquent avec le glycopyrronium qu’avec le placebo uniquement dans la base de données de 12 mois
2) Des cas ont été observés depuis la commercialisation de glycopyrronium. Ces cas sont issus de notifications spontanées sans information sur la population totale exposée ce qui rend impossible l'estimation précise de la fréquence de survenue de cet effet indésirable. Par conséquent, la fréquence de survenue présentée a été calculée à partir des données issues des essais cliniques.
3) Observé plus fréquemment avec le glycopyrronium qu’avec le placebo chez le sujet âgé >75 ans uniquement.
Description spécifique des effets indésirables :
Dans la base regroupant les données à 6 mois, la fréquence de la sécheresse buccale a été respectivement de 2,2% avec glycopyrronium versus 1,1% avec le placebo, celle de l’insomnie de 1,0% versus 0,8% et celle de la gastro-entérite de 1,4% versus 0,9%.
La sécheresse buccale a été rapportée essentiellement pendant les 4 premières semaines de traitement, avec une durée médiane de 4 semaines chez la majorité des patients. Dans 40% des cas toutefois, les symptômes ont persisté pendant la période complète de 6 mois. Aucun nouveau cas de sécheresse buccale n’a été rapporté pendant les mois 7 à 12.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Des doses élevées de glycopyrronium pourraient entrainer des signes et symptômes anticholinergiques pour lesquels un traitement symptomatique serait indiqué.
Une intoxication aiguë par ingestion accidentelle de gélules de GLYCOPYRRONIUM BIOGARAN AXICA est peu probable compte tenu de la faible biodisponibilité orale (environ 5%).
Après administration intraveineuse de 150 microgrammes de bromure de glycopyrronium (équivalant à 120 microgrammes de glycopyrronium) chez des volontaires sains, la concentration plasmatique maximale et l’exposition systémique totale ont été environ 50 fois et 6 fois supérieures à la concentration maximale et à l’exposition totale qui ont été atteintes à l’état d’équilibre avec la dose de glycopyrronium recommandée (44 microgrammes une fois par jour) et ont été bien tolérées.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le glycopyrronium est un antagoniste des récepteurs muscariniques (anticholinergique) de longue durée d’action administré par voie inhalée une fois par jour en traitement bronchodilatateur continu dans la bronchopneumopathie chronique obstructive (BPCO). La bronchoconstriction des voies respiratoires est en majorité liée au système nerveux parasympathique dont l’effet cholinergique est le principal composant de l’obstruction réversible des voies aériennes dans la BPCO. Le glycopyrronium agit en inhibant l’effet bronchoconstricteur de l’acétylcholine dans les cellules des muscles lisses des voies aériennes, ce qui entraîne leur relaxation.
Le bromure de glycopyrronium est un antagoniste des récepteurs muscariniques de haute affinité. Des études de liaison par radioligand ont mis en évidence une sélectivité 4 fois plus élevée pour les récepteurs M3 humains que pour les récepteurs M2. Son délai d’action est rapide, selon les valeurs des constantes d’association et de dissociation aux récepteurs et le délai d’action après une inhalation observé dans les études cliniques.
La longue durée d’action peut être attribuée en partie à la persistance des taux de substance active dans le poumon, comme en témoigne la demi-vie d’élimination terminale du glycopyrronium qui apparait prolongée après une inhalation avec l’inhalateur de Glycopyrronium, par rapport à une administration par voie intraveineuse (voir rubrique 5.2).
Effets pharmacodynamiques
Deux études de phase III ont été conduites: une étude de 6 mois contrôlée contre placebo et une étude de 12 mois contrôlée contre placebo et contre comparateur actif (tiotropium 18 microgrammes une fois par jour en ouvert), incluant toutes les deux des patients présentant une bronchopneumopathie chronique obstructive (BPCO) modérée à sévère.
Effets sur la fonction respiratoire :
Dans plusieurs études cliniques, le Glycopyrronium 44 microgrammes une fois par jour a induit une amélioration constamment et statistiquement significative de la fonction respiratoire (volume expiratoire maximum par seconde [VEMS], capacité vitale forcée [CVF] et capacité inspiratoire [CI]). Dans les études de phase III, les effets bronchodilatateurs ont été observés dans les 5 minutes suivant la première dose et se sont maintenus pendant la période de 24 heures entre deux doses. Il n’a pas été observé d’atténuation de l’effet bronchodilatateur au cours du temps dans les études de 6 et 12 mois. L’amplitude de l’effet était dépendante de la réversibilité initiale de l’obstruction bronchique (mesurée par l’administration d’un bronchodilatateur antagoniste des récepteurs muscariniques de courte durée d’action). L’effet bronchodilatateur observé était plus faible chez les patients qui avaient à l’état initial une réversibilité <5% que chez ceux qui avaient une réversibilité ≥5%. Après 12 semaines le VEMS (critère principal), était augmenté de 72 mL chez les patients qui avaient le degré de réversibilité le plus faible à l’état initial (<5%) et de 113 mL chez ceux qui avaient un degré de réversibilité plus élevé à l’état initial (≥5%) dans le groupe de sujets traités par Glycopyrronium en comparaison au placebo (p<0,05 dans les 2 cas).
Dans l’étude de 6 mois, le VEMS était augmenté après la première dose de Glycopyrronium, avec une amélioration moyenne de 93 mL dans les 5 minutes suivant l’administration et de 144 mL dans les 15 minutes par rapport au placebo (p<0,001 dans les 2 cas). Dans l’étude de 12 mois, les améliorations moyennes ont été de 87 mL à 5 minutes et de 143 mL à 15 minutes (p<0,001 dans les 2 cas). Dans l’étude de 12 mois, l’amélioration moyenne du VEMS était statistiquement significative par rapport au tiotropium dans les 4 heures suivant l’administration le jour 1 et à la semaine 26, et les valeurs du VEMS étaient numériquement plus élevées que dans le groupe traité par le tiotropium dans les 4 heures suivant l’administration aux semaines 12 et 52.
Les valeurs du VEMS mesuré à la fin de l’intervalle entre deux administrations (24 heures après l’administration) ont été comparables après la première dose et après un an de traitement. A la semaine 12 (critère principal), l’augmentation du VEMS moyen était de 108 mL dans l’étude de 6 mois et de 97 mL dans l’étude de 12 mois par rapport au placebo (p<0,001 dans les 2 cas). Dans l’étude de 12 mois, l’amélioration observée avec le tiotropium par rapport au placebo a été de 83 mL (p<0,001).
Effets sur les symptômes
Glycopyrronium administré à raison de 44 microgrammes une fois par jour a diminué de façon statistiquement significative la dyspnée, évaluée par le questionnaire Transitional Dyspnoea Index (TDI). Dans une analyse regroupant les 2 études pivots de 6 et 12 mois, le pourcentage de patients ayant présenté une amélioration d’au moins 1 point du score TDI à la semaine 26 a été de façon statistiquement significative supérieur chez les patients recevant Glycopyrronium par rapport au placebo (58,4% et 46,4% respectivement, p<0,001). Ces résultats ont été comparables à ceux observés chez les patients recevant le tiotropium, dont 53,4% ont répondu par une amélioration ≥1 point (p=0,009 par rapport au placebo).
Glycopyrronium une fois par jour a également eu un effet statistiquement significatif sur la qualité de vie liée à la santé, mesurée par le questionnaire St George’s Respiratory Questionnaire (SGRQ). Une analyse regroupant les données des 2 études pivots de 6 mois et 12 mois a montré que le pourcentage de patients ayant présenté une amélioration de 4 points ou plus du score SGRQ à la semaine 26 était de façon statistiquement significative supérieur dans le groupe de patients traités par Glycopyrronium par rapport au groupe placebo (respectivement 57,8% et 47,6%, p<0,001). Chez les patients ayant reçu le tiotropium, 61,0% ont présenté une amélioration de 4 points ou plus du score SGRQ (p=0,004 en comparaison au placebo).
Réduction des exacerbations de la BPCO
Les données relatives à la survenue des exacerbations de la BPCO ont été recueillies au cours des études pivotales de 6 et 12 mois. Dans les 2 études, le pourcentage de patients présentant une exacerbation modérée à sévère (définie comme nécessitant un traitement par des corticoïdes oraux et/ou des antibiotiques ou une hospitalisation) a été réduit. Dans l’étude à 6 mois, le pourcentage de patients présentant une exacerbation modérée à sévère a été de 17,5% pour le groupe Glycopyrronium et 24,2% pour le groupe placebo et, dans l’étude à 12 mois ce pourcentage était de 32,8% pour le groupe Glycopyrronium et 40,2% pour le groupe placebo (Hazard ratio : 0,66; p=0,001). Dans une analyse regroupant les données des 6 premiers mois des études de 6 et 12 mois, en comparaison au placebo, le délai moyen de survenue de la première exacerbation modérée ou sévère était de façon statistiquement significative plus long dans le groupe de patients traités par Glycopyrronium, et l’incidence des exacerbations modérées ou sévères était diminuée (0,53 exacerbations par an comparativement à 0,77 exacerbations par an, p<0,001). Cette analyse a également montré un nombre de patients présentant une exacerbation nécessitant une hospitalisation plus faible dans le groupe de patients traités par Glycopyrronium que dans le groupe de patients recevant le placebo (1,7% contre 4,2%, p=0,003).
Autres effets
Glycopyrronium administré une fois par jour a réduit de façon statistiquement significative le recours à un traitement de secours (salbutamol) par rapport au placebo, de 0,46 bouffée par jour (p=0,005) sur 26 semaines et de 0,37 bouffée par jour (p=0,039) sur 52 semaines dans les études de 6 et 12 mois respectivement.
Dans une étude de 3 semaines dans laquelle la tolérance à l’effort a été testée à l’aide d’un cyclo- ergomètre à intensité sous-maximale (80%) (test de tolérance à l’effort sous-maximal), l’administration de Glycopyrronium le matin a réduit l’hyperinflation dynamique et amélioré la durée pendant laquelle l’effort pouvait être maintenu, et ce dès la première dose. Le premier jour de traitement, la capacité inspiratoire pendant l’effort a été améliorée de 230 mL et la durée d’endurance à l’effort a été améliorée de 43 secondes (augmentation de 10%) par rapport au placebo. Après trois semaines de traitement, l’amélioration moyenne de la capacité inspiratoire induite par Glycopyrronium a été similaire à celle observée le premier jour (200 mL), mais la durée d’endurance à l’effort a augmenté de 89 secondes (augmentation de 21%) par rapport au placebo. Glycopyrronium a diminué la dyspnée et l’inconfort dans les jambes pendant l’effort, mesurés à l’aide des échelles de Borg. Glycopyrronium a également diminué la dyspnée au repos, mesurée à l’aide du « Transitional Dyspnoea Index ».
Effets pharmacodynamiques secondaires
Aucune modification des valeurs moyennes de la fréquence cardiaque ou de l’intervalle QTc n’a été observée après l’administration de Glycopyrronium à des doses allant jusqu’à 176 microgrammes chez des patients présentant une BPCO. Dans une étude spécifique de l’intervalle QT menée chez 73 volontaires sains, une dose inhalée unique de 352 microgrammes de glycopyrronium (8 fois la dose thérapeutique) n’a pas entraîné d’allongement de l’intervalle QTc et a diminué légèrement la fréquence cardiaque (effet maximal : -5,9 bpm ; effet moyen sur 24 heures : -2,8 bpm) par rapport au placebo).
L’effet sur la fréquence cardiaque et l’intervalle QTc de 150 microgrammes de bromure de glycopyrronium (équivalant à 120 microgrammes de glycopyrronium) administré par voie intraveineuse a été étudié chez des volontaires sains jeunes. Les expositions maximales (Cmax) ont été environ 50 fois plus élevées qu’après l’inhalation de 44 microgrammes de glycopyrronium à l’état d’équilibre et n’ont pas entraîné de tachycardie ni d’allongement de l’intervalle QTc. Une légère réduction de la fréquence cardiaque (différence moyenne sur 24 heures de -2 bpm par rapport au placebo), qui est un effet connu des expositions faibles aux anticholinergiques, a été observée chez les volontaires sains jeunes.
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec Glycopyrronium dans tous les sous-groupes de la population pédiatrique dans l’indication de la BPCO (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques
Après inhalation à l’aide de l’inhalateur de Glycopyrronium, le glycopyrronium est absorbé rapidement et la concentration plasmatique maximale est atteinte 5 minutes après l’administration.
La biodisponibilité absolue estimée du glycopyrronium administré à l’aide de l’inhalateur de Glycopyrronium est d’environ 45% de la dose délivrée. Après une inhalation, environ 90% de l’exposition systémique sont dus à l’absorption pulmonaire et 10% à l’absorption gastro-intestinale.
Chez les patients présentant une BPCO, l’état d’équilibre pharmacocinétique du glycopyrronium est atteint une semaine après le début du traitement. En cas d’administration de 44 microgrammes de glycopyrronium une fois par jour, les concentrations plasmatiques maximale et résiduelle moyennes à l’état d’équilibre sont respectivement de 166 picogrammes/mL et 8 picogrammes/mL. L’exposition au glycopyrronium à l’état d’équilibre (ASC mesurée entre deux doses) est environ 1,4 à 1,7 fois plus élevée qu’après la première dose.
Distribution
Après administration intraveineuse, le volume de distribution à l’état d’équilibre du glycopyrronium est de 83 litres et le volume de distribution dans la phase terminale est de 376 litres. Après une inhalation, le volume apparent de distribution dans la phase terminale est presque 20 fois plus important, témoignant d’une élimination beaucoup plus lente après l’inhalation. La liaison du glycopyrronium aux protéines plasmatiques humaines in vitro est de 38% à 41% aux concentrations de 1 à 10 nanogrammes/mL.
Biotransformation
Les études de métabolisme in vitro ont montré des voies métaboliques du bromure de glycopyrronium comparables chez l’animal et l’homme. Une hydroxylation entraînant la formation de différents métabolites mono et bis-hydroxylés et une hydrolyse directe entraînant la formation d’un dérivé acide carboxylique (M9) ont été observées. In vivo, le métabolite M9 est formé à partir de la fraction ingérée de la dose de bromure de glycopyrronium administrée. Des glycuroconjugués et/ou des sulfoconjugués du glycopyrronium, représentant environ 3% de la dose, ont été détectés dans les urines chez l’homme après des inhalations répétées.
De nombreuses isoenzymes du cytochrome P450 (CYP) contribuent au métabolisme oxydatif du glycopyrronium. Il est peu probable que l’inhibition ou l’induction du métabolisme du glycopyrronium entraîne une modification significative de l’exposition systémique à la substance active.
Les études d’inhibition in vitro ont montré que le bromure de glycopyrronium n’a pas de capacité significative à inhiber les CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 ou CYP3A4/5, les transporteurs d’efflux MDR1, MRP2 ou MXR et les transporteurs d’influx OCT1 ou OCT2. Les études d’induction enzymatique in vitro n’ont pas montré d’induction cliniquement significative par le bromure de glycopyrronium des isoenzymes du cytochrome P450 ou de l’UGT1A1 et des transporteurs MDR1 et MRP2.
Élimination
Après administration intraveineuse de bromure de glycopyrronium marqué au [3H] chez l’homme, l’élimination urinaire moyenne de la radioactivité en 48 heures a représenté 85% de la dose. Une fraction représentant 5% de la dose a en outre été détectée dans la bile.
L’élimination rénale de la molécule mère représente environ 60 à 70% de la clairance totale du glycopyrronium disponible au niveau systémique, tandis que les voies d’élimination non rénale représentent environ 30 à 40%. La clairance biliaire contribue à la clairance non rénale, mais la majorité de l’élimination non rénale semble être due au métabolisme.
Après une inhalation, la clairance rénale moyenne du glycopyrronium est de l’ordre de 17,4 à 24,4 litres/heure. La sécrétion tubulaire active contribue à l’élimination rénale du glycopyrronium. Jusqu’à 23% de la dose délivrée ont été retrouvés sous forme de molécule mère dans les urines.
Les concentrations plasmatiques de glycopyrronium diminuent de façon multiphasique. La demi-vie d’élimination terminale moyenne est beaucoup plus longue après une administration par voie inhalée (33 à 57 heures) qu’après une administration intraveineuse (6,2 heures) ou orale (2,8 heures). Le profil d’élimination semble indiquer une absorption pulmonaire soutenue et/ou un transfert du glycopyrronium dans la circulation systémique à partir de 24 heures suivant l’inhalation.
Linéarité/non-linéarité
Chez des patients présentant une BPCO, l’exposition systémique et l’élimination urinaire totale de glycopyrronium sont à peu près linéaire à l’état d’équilibre pharmacocinétique sur l’intervalle de doses de 44 à 176 microgrammes.
Relations pharmacocinétique/pharmacodynamique
Populations particulières
Une analyse pharmacocinétique de population à partir des données obtenues chez des patients atteints de BPCO a montré que le poids et l’âge étaient des facteurs intercurrents sur la variabilité interindividuelle de l’exposition systémique. Glycopyrronium 44 microgrammes une fois par jour peut être utilisé en toute sécurité dans tous les groupes d’âges et de poids.
Le sexe, le tabagisme et le VEMS initial n’ont pas eu d’effet apparent sur l’exposition systémique.
Il n’a pas été observé de différences majeures dans l’exposition systémique totale (ASC) entre des sujets japonais et caucasiens après l’administration de bromure de glycopyrronium par voie inhalée. Il n’existe pas de données pharmacocinétiques suffisantes concernant les autres groupes ethniques ou races.
Insuffisance hépatique
Il n’a pas été mené d’études cliniques chez des patients présentant une insuffisance hépatique. Le glycopyrronium est éliminé essentiellement de la circulation systémique par excrétion rénale. Une diminution du métabolisme hépatique du glycopyrronium ne devrait pas entraîner une augmentation cliniquement significative de l’exposition systémique.
Insuffisance rénale
L’insuffisance rénale a un effet sur l’exposition systémique au bromure de glycopyrronium. Une augmentation moyenne modérée de l’exposition systémique totale (ASCτ) allant jusqu’à un facteur de 1,4 a été observée chez des sujets présentant une insuffisance rénale légère ou modérée et jusqu’à un facteur de 2,2chez des sujets présentant une insuffisance rénale sévère ou une insuffisance rénale terminale. Glycopyrronium peut être utilisé à la dose recommandée chez les patients atteints de BPCO présentant une insuffisance rénale légère ou modérée (débit de filtration glomérulaire estimé, DFGe, ≥30 mL/min/1,73 m2). En cas d’insuffisance rénale sévère (débit de filtration glomérulaire <30 mL/min/1,73 m2) ou terminale sous dialyse, Glycopyrronium ne doit être utilisé que si le bénéfice attendu pour le patient est supérieur au risque potentiel (voir rubrique 4.4).
5.3. Données de sécurité préclinique
Les effets imputables aux propriétés antagonistes des récepteurs muscariniques du bromure de glycopyrronium ont été des augmentations légères à modérées de la fréquence cardiaque chez le chien, une opacification du cristallin chez le rat et des modifications réversibles associées à la diminution des sécrétions glandulaires chez le rat et le chien. Une irritation légère ou des modifications adaptatives de l’appareil respiratoire ont été observées chez le rat. Tous ces effets sont survenus à des expositions largement supérieures à celles attendues chez l’homme.
Après administration par voie inhalée, le glycopyrronium n’a pas été tératogène chez le rat ou le lapin. La fertilité et les développements prénatal et postnatal n’ont pas été affectés chez le rat. Il n’y a pas eu de transfert placentaire significatif du bromure de glycopyrronium ni de ses métabolites chez la souris, la lapine et la chienne gestantes. Le bromure de glycopyrronium (et ses métabolites) ont été excrétés dans le lait de rates allaitantes, la concentration dans le lait ayant été jusqu’à 10 fois supérieure à la concentration sanguine chez la mère.
Les études de génotoxicité n’ont pas révélé de potentiel mutagène ou clastogène du bromure de glycopyrronium. Les études de cancérogenèse par voie orale chez des souris transgéniques et par voie inhalée chez des rats n’ont pas mis en évidence de potentiel cancérogène à des expositions systémiques (ASC) correspondant chez la souris à environ 53 fois et chez le rat à environ 75 fois la dose maximale recommandée chez l’homme de 44 microgrammes une fois par jour.
Lactose monohydraté (peut contenir des protéines de lait)
Stéarate de magnésium
Gélule :
Hypromellose
Chlorure de potassium
Carraghénanes
Jaune orange S
Eau purifiée
Plaquettes : 18 mois
L'inhalateur de chaque boite ou l'inhalateur réutilisé doit être jeté après 90 utilisations, à compter de la première utilisation de l'inhalateur.
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 25°C.
Les gélules doivent toujours être conservées dans la plaquette d'origine à l’abri de l’humidité. Les gélules ne doivent être retirées de la plaquette qu’immédiatement avant leur utilisation.
6.5. Nature et contenu de l'emballage extérieur
GLYCOPYRRONIUM BIOGARAN AXICA est un inhalateur monodose. Le corps et le bouchon de l’inhalateur sont en acrylonitrile-butadiène-styrène, les boutons pressoir sont en méthacrylate de méthyle-acrylonitrile- butadiène-styrène. Les aiguilles et ressorts sont en acier inoxydable.
Plaquettes prédécoupées unitaires pelables (PA/Aluminium/PVC – Aluminium) :
Boîte contenant 10 x 1, 30 x 1, 60 x 1 ou 90 x1 gélules sous plaquettes prédécoupées unitaires pelables et un inhalateur.
Boîte contenant 10 x 1, 30 x 1, 60 x 1 ou 90 x1 gélules sous plaquettes prédécoupées unitaires pelables.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Utiliser l’inhalateur délivré avec chaque nouveau conditionnement.
L'inhalateur de chaque boite ou l'inhalateur réutilisé doit être jeté après 90 utilisations, à compter de la première utilisation de l'inhalateur.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Instructions pour l’utilisation et la manipulation
Lire l’ensemble des instructions de manipulation avant d’utiliser GLYCOPYRRONIUM BIOGARAN AXICA.
![]()
|
|
|
|
|
|||||||||
|
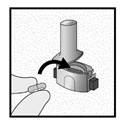
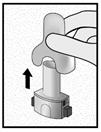
Insérer |
Percer et relâcher |
Inhaler profondément |
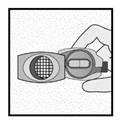
Vérifier que la gélule est vide |
|||||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|||||||||
|
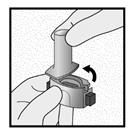
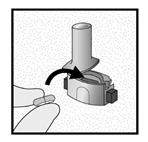
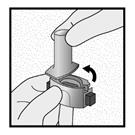
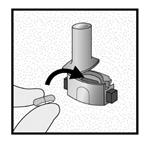
Etape 1a: Retirer le capuchon
Etape 1b: Ouvrir l’inhalateur
|
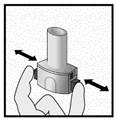
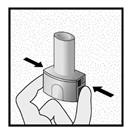
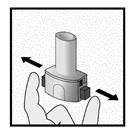
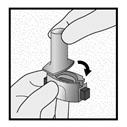
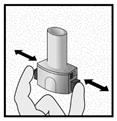
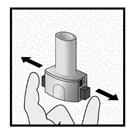
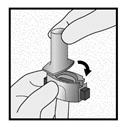
Etape 2a: Percer la gélule une seule fois
Tenir l’inhalateur en position verticale.
Percer la gélule en appuyant fermement sur les deux boutons latéraux en même temps Un bruit doit être entendu lorsque la gélule est percée. Percer la gélule une seule fois.
Etape 2b: Relâcher les boutons latéraux
|
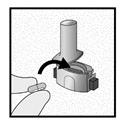
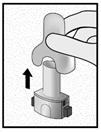
Etape 3a: Expirer à fond Ne pas souffler dans l’embout buccal.
Etape 3b: Inhaler le médicament profondément Tenir l’inhalateur comme le montre l’illustration. Placer l’embout buccal dans la bouche et serrer fermement les lèvres sur l’embout. Ne pas appuyer sur les boutons latéraux.
|
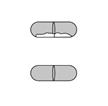
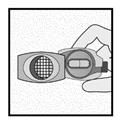
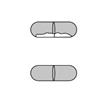
Vérifier que la gélule est vide Ouvrir l’inhalateur pour voir s’il reste de la poudre dans la gélule.
S’il reste de la poudre dans la gélule : Fermer l’inhalateur. Répéter les étapes 3a à 3c.
Poudre restante
Vide
|
|
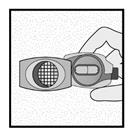
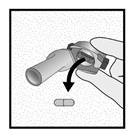
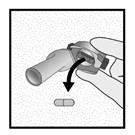
Etape 1c: Extraire une gélule de la plaquette Détacher une alvéole de la plaquette. Retirer la pellicule de l’alvéole et sortir la gélule. Ne pas pousser la gélule à travers la feuille. Ne pas avaler la gélule. |
|
Inspirez rapidement et aussi profondément que possible. Pendant l’inhalation, vous entendrez un bourdonnement. Vous sentirez un goût lors de l’inhalation.
Etape 3c: Retenir sa respiration Retenir sa respiration pendant au moins 5 secondes. |
Retirer la gélule vide Jeter la gélule vide avec vos ordures ménagères. Fermer l’inhalateur et replacer le capuchon.
|
|||||||||
|
Etape 1d: Insérer la gélule dans l’emplacement prévu à cet effet. Ne jamais placer une gélule directement dans l’embout buccal.
Etape 1e: Fermer l’inhalateur |
|
Information importante · Les gélules de Glycopyrronium doivent toujours être conservées dans la plaquette et n’être sorties qu’immédiatement avant utilisation. · Ne pas pousser la gélule à travers la feuille d’aluminium. · Ne pas avaler la gélule. · Ne pas utiliser les gélules Glycopyrronium avec un autre inhalateur. · Ne pas utiliser l’inhalateur de Glycopyrronium avec un autre médicament sous forme de gélules. · Ne jamais placer la gélule dans la bouche ou dans l’embout buccal de l’inhalateur. · Ne pas appuyer sur les boutons latéraux plus d’une fois. · Ne pas souffler dans l’embout buccal. · Ne pas appuyer sur les boutons latéraux lors de l’inhalation à travers l’embout buccal. · Ne pas manipuler les gélules avec les mains mouillées. · Ne jamais laver votre inhalateur avec de l’eau. |
|
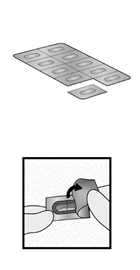
Votre boîte de GLYCOPYRRONIUM BIOGARAN AXICA contient : un inhalateur de Glycopyrronium une ou plusieurs plaquettes, contenant des gélules de Glycopyrronium à utiliser dans l’inhalateur.
Inhalateur Base de l’inhalateur Plaquette |
Questions fréquentes
Pourquoi l’inhalateur n’a-t-il pas fait de bruit au moment où j’ai inhalé la poudre contenue dans la gélule ? La gélule est peut-être coincée dans son logement. Dans ce cas, décoincez la gélule avec précaution en tapotant la base de l’inhalateur. Inhalez à nouveau le médicament en répétant les étapes 3a à 3c
Que dois-je faire s’il reste de la poudre dans la gélule? Vous n’avez pas pris assez de médicament. Fermez l’inhalateur et répétez les étapes 3a à 3c.
|
Nettoyage de l’inhalateur Nettoyer l’intérieur et l’extérieur de l’embout buccal avec un tissu propre, sec et non pelucheux pour éliminer les résidus de poudre. Conserver l’inhalateur au sec. Ne jamais laver votre inhalateur avec de l’eau. |
|
Elimination de l’inhalateur après utilisation Chaque inhalateur d’une boite ou réutilisé doit être jeté après 90 utilisations, à compter de la première utilisation de l'inhalateur. Demandez à votre pharmacien ce qu’il faut faire des médicaments et des inhalateurs dont vous n’avez plus besoin. |
||
|
Je tousse après avoir inhalé – cela est-il important ? Cela peut arriver. Dès lors que la gélule est vide, cela signifie que vous avez inhalé une quantité suffisante du médicament. |
|
|
|
J’ai senti des morceaux minuscules de la gélule sur ma langue – cela est- il important ? Cela peut arriver. Cela ne présente pas de risque. La possibilité de rupture de la gélule en minuscules morceaux est augmentée si la gélule est percée plus d’une fois. |
|
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
15, BOULEVARD CHARLES DE GAULLE
92700 COLOMBES
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 303 157 1 2 : poudre pour inhalation en gélules sous plaquettes thermoformées unitaires (PA/Aluminium/PVC – Aluminium). Boîte de 30 x 1 gélule + 1 inhalateur.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 04/04/2025
GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule
Glycopyrronium
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule ?
3. Comment utiliser GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule ET DANS QUELS CAS EST-IL UTILISE ?
Qu’est-ce que GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation ?
Ce médicament contient une substance active appelée bromure de glycopyrronium, qui appartient à un groupe de médicaments appelés bronchodilatateurs.
Dans quel cas GLYCOPYRRONIUM BIOGARAN AXICA est-il utilisé ?
Ce médicament est utilisé pour faciliter la respiration chez les patients adultes qui souffrent de difficultés respiratoires dues à une maladie pulmonaire appelée broncho-pneumopathie chronique obstructive (BPCO).
En cas de BPCO, le calibre des voies respiratoires (bronches) est resserré par les muscles qui les entourent, ce qui rend la respiration difficile. Ce médicament empêche le resserrement de ces muscles afin de faciliter la circulation de l'air dans vos bronches.
Si vous utilisez ce médicament une fois par jour, il aidera à diminuer les effets de la BPCO sur votre vie quotidienne.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule ?
N’utilisez jamais GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule :
· si vous êtes allergique au bromure de glycopyrronium ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser GLYCOPYRRONIUM BIOGARAN AXICA si l’un des cas ci-dessous vous concerne :
· si vous avez des problèmes de reins.
· si vous avez une affection oculaire appelée glaucome à angle fermé.
· si vous avez des difficultés pour uriner.
Pendant le traitement par GLYCOPYRRONIUM BIOGARAN AXICA, arrêtez d’utiliser ce médicament et prévenez immédiatement votre médecin dans les cas suivants :
· si vous présentez une sensation d’oppression dans la poitrine, une toux, une respiration sifflante ou un essoufflement immédiatement après avoir utilisé GLYCOPYRRONIUM BIOGARAN AXICA (signes de bronchospasme).
· si vous présentez des difficultés à respirer ou à avaler, un gonflement de la langue, des lèvres ou du visage, une réaction cutanée, des démangeaisons ou une urticaire (signes de réaction allergique).
· en cas de douleur ou de gêne oculaire, de vision floue passagère, si vous voyez des halos ou des images colorés et qu’ils sont associés à une rougeur oculaire. Ils peuvent être les signes d’une crise aiguë de glaucome par fermeture de l’angle (glaucome à angle fermé).
GLYCOPYRRONIUM BIOGARAN AXICA est utilisé en traitement d’entretien de la BPCO. N’utilisez pas ce médicament pour traiter une crise subite d’essoufflement ou de sifflement respiratoire.
Enfants et adolescents
Ce médicament ne doit pas être utilisé chez les enfants et adolescents de moins de 18 ans
Autres médicaments et GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. Cela inclut les médicaments comparables à GLYCOPYRRONIUM BIOGARAN AXICA utilisés pour votre broncho-pneumopathie tels que l’ipratropium, l’oxitropium ou le tiotropium (appelés anticholinergiques).
Aucun effet indésirable spécifique n’a été signalé lorsque le glycopyrronium a été utilisé avec d’autres médicaments utilisés pour traiter la BPCO tels que les traitements inhalés utilisés pour soulager les symptômes respiratoires aigus (par exemple : salbutamol), les médicaments à base de méthylxanthines (par exemple : théophylline) et/ou les corticoïdes par voie orale ou inhalée (par exemple : prednisolone).
GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule avec des aliments, des boissons et de l’alcool
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Il n’existe pas de données concernant l’utilisation de ce médicament chez la femme enceinte, et on ne sait pas si la substance active de ce médicament passe dans le lait maternel.
Conduite de véhicules et utilisation de machines
Il est peu probable que ce médicament ait un effet sur votre aptitude à conduire et à utiliser des machines.
GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule contient du lactose
Ce médicament contient du lactose. Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
3. COMMENT UTILISER GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule ?
Quelle dose de GLYCOPYRRONIUM BIOGARAN AXICA devez-vous utiliser ?
La dose habituelle est l’inhalation du contenu d’une gélule chaque jour.
Vous ne devez inhaler ce médicament qu’une fois par jour parce que l’effet du médicament dure 24 heures.
Ne dépassez pas la dose indiquée par votre médecin.
Patients âgés
Si vous êtes âgé(e) de 75 ans ou plus, vous pouvez utiliser ce médicament à la même dose que les autres adultes.
Quand devez-vous inhaler GLYCOPYRRONIUM BIOGARAN AXICA ?
Vous devez utiliser ce médicament à la même heure chaque jour. Cela vous aidera également à vous rappeler quand vous devez prendre votre médicament.
Ce médicament peut être inhalé à tout moment, avant ou après un repas.
Comment utiliser GLYCOPYRRONIUM BIOGARAN AXICA ?
· Cette boîte contient un inhalateur et des gélules (présentées en plaquettes) qui contiennent le médicament sous forme de poudre pour inhalation. Vous ne devez utiliser les gélules qu’avec l’inhalateur fourni dans cette boîte. Les gélules ne doivent être sorties de la plaquette qu’au moment de leur utilisation.
· Ne poussez pas la gélule à travers la feuille d’aluminium.
· Lorsque vous entamez une nouvelle boîte, utilisez le nouvel inhalateur contenu dans la boîte, ou, si vous réutilisez l’inhalateur, vous devrez jeter celui-ci après 90 utilisations, à compter de la première utilisation de l'inhalateur.
· N’avalez pas les gélules.
· Veuillez lire les instructions situées à la fin de cette notice pour plus d’informations sur la façon d’utiliser l’inhalateur.
Si vous avez utilisé plus de GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule que vous n’auriez dû
Si vous avez inhalé une quantité excessive de ce médicament ou si une autre personne a utilisé accidentellement vos gélules, contactez immédiatement votre médecin ou rendez-vous au service d’urgences le plus proche. Montrez la boîte de GLYCOPYRRONIUM BIOGARAN AXICA. Des soins médicaux pourraient être nécessaires.
Si vous oubliez d’utiliser GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule
Si vous avez oublié d’inhaler une dose, prenez-la dès que possible. Mais n’inhalez pas deux doses le même jour. Prenez ensuite la dose suivante au moment habituel
Si vous arrêtez d’utiliser GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule
Sans objet.
Durée du traitement par GLYCOPYRRONIUM BIOGARAN AXICA
· Vous devez continuer à utiliser ce médicament aussi longtemps que votre médecin vous le prescrit.
· La BPCO est une maladie chronique et vous devez utiliser ce médicament tous les jours et pas seulement lorsque vous avez des difficultés respiratoires ou d’autres symptômes de la BPCO.
Si vous avez des questions sur la durée de votre traitement par ce médicament, parlez-en à votre médecin ou à votre pharmacien.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Certains effets indésirables peuvent être graves mais sont peu fréquents (peuvent affecter jusqu’à 1 patient sur 100)
· Battements de cœur irréguliers
· Taux élevé de sucre dans le sang (hyperglycémie : les symptômes typiques se manifestent par une soif ou une faim excessive et une envie d’uriner fréquente)
· Eruption cutanée, démangeaisons, urticaire, difficultés à respirer ou à avaler, vertiges (signes possibles évocateurs d’une réaction allergique)
· Gonflement de la langue, des lèvres, du visage ou de la gorge principalement (signes possibles d’un angioedème)
Si vous avez l’un de ces effets indésirables, parlez-en à votre médecin immédiatement.
Certains effets indésirables peuvent être graves, mais la fréquence de ces effets indésirables n’est pas connue (la fréquence de survenue ne peut pas être estimée à partir des données disponibles)
· Difficultés à respirer accompagnées de sifflements ou de toux (signes de bronchospasme paradoxal)
Certains effets indésirables sont fréquents (peuvent affecter jusqu’à 1 patient sur 10)
· Bouche sèche
· Difficultés pour dormir
· Nez qui coule ou nez bouché, éternuements, mal de gorge
· Diarrhées ou douleurs à l’estomac
· Douleurs musculo-squelettiques
Certains effets indésirables sont peu fréquents (peuvent affecter jusqu’à 1 patient sur 100)
· Difficulté pour uriner et douleur en urinant
· Mictions (action d’uriner) fréquentes et douloureuses
· Palpitations
· Eruption cutanée
· Engourdissement
· Toux grasse
· Caries dentaires
· Sensation de pression ou douleur dans les joues et le front
· Saignements de nez
· Douleurs dans les bras ou les jambes
· Douleurs dans les muscles, les os ou les articulations du thorax
· Inconfort au niveau de l’estomac après les repas
· Irritation de la gorge
· Sensation de fatigue
· Sensation de faiblesse
· Démangeaisons
· Modification de la voix (enrouement)
· Nausées
· Vomissements
Certains patients âgés de plus de 75 ans ont présenté des maux de tête (de façon fréquente) et des infections urinaires (de façon fréquente).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage. La date de péremption fait référence au dernier jour de ce mois.
À conserver à une température ne dépassant pas 25°C.
Les gélules doivent toujours être conservées dans la plaquette d'origine à l’abri de l’humidité. Les gélules ne doivent être retirées de la plaquette qu’immédiatement avant leur utilisation.
L'inhalateur de chaque boite ou l'inhalateur réutilisé doit être jeté après 90 utilisations, à compter de la première utilisation de l'inhalateur.
N’utilisez pas ce médicament si vous remarquez que l’emballage est endommagé ou a été ouvert.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient GLYCOPYRRONIUM BIOGARAN AXICA 44 microgrammes, poudre pour inhalation en gélule
· La substance active est :
Bromure de glycopyrronium.............................................................................................. 63 µg
Equivalant à glycopyrronium............................................................................................. 50 µg
Pour 1 gélule.
Chaque dose délivrée au travers de l’embout buccal de l’inhalateur est de 44 microgrammes de glycopyrronium.
· Les autres excipients sont : lactose monohydraté, stéarate de magnésium.
Chaque boite contient des gélules, et peut contenir ou non un inhalateur.
Présentations :
Boîte contenant 10 x 1, 30 x 1, 60 x 1 ou 90 x1 gélules sous plaquettes prédécoupées unitaires pelables et un inhalateur.
Boîte contenant 10 x 1, 30 x 1, 60 x 1 ou 90 x1 gélules sous plaquettes prédécoupées unitaires pelables.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
15, BOULEVARD CHARLES DE GAULLE
92700 COLOMBES
Exploitant de l’autorisation de mise sur le marché
15, BOULEVARD CHARLES DE GAULLE
92700 COLOMBES
AVDA. MIRALCAMPO N°7
POLIGONO INDUSTRIAL MIRALCAMPO
19200 AZUQUECA DE HENARES (GUADALAJARA)
ESPAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Instructions d’utilisation de l’inhalateur
Lire l’ensemble des instructions de manipulation avant d’utiliser l’inhalateur.
![]()
|
|
|
|
|
|||||||||
|
Insérer |
Percer et relâcher |
Inhaler profondément |
Vérifier que la gélule est vide |
|||||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|||||||||
|
Etape 1a: Retirer le capuchon
Etape 1b: Ouvrir l’inhalateur
|
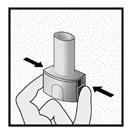
Etape 2a: Percer la gélule une seule fois Tenir l’inhalateur en position verticale. Percer la gélule en appuyant fermement sur les deux boutons latéraux en même temps Un bruit doit être entendu lorsque la gélule est percée. Percer la gélule une seule fois.
Etape 2b: Relâcher les boutons latéraux
|
Etape 3a: Expirer à fond
Ne pas souffler dans l’embout buccal.
Etape 3b: Inhaler le médicament profondément Tenir l’inhalateur comme le montre l’illustration. Placer l’embout buccal dans la bouche et serrer fermement les lèvres sur l’embout. Ne pas appuyer sur les boutons latéraux. |
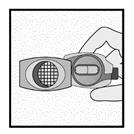
Vérifier que la gélule est vide
Ouvrir l’inhalateur pour voir s’il reste de la poudre dans la gélule.
S’il reste de la poudre dans la gélule : Fermer l’inhalateur. Répéter les étapes 3a à 3c.
Poudre restante
Vide
|
|
Etape 1c: Extraire une gélule de la plaquette Détacher une alvéole de la plaquette. Retirer la pellicule de l’alvéole et sortir la gélule. Ne pas pousser la gélule à travers la feuille. Ne pas avaler la gélule. |
|
Inspirez rapidement et aussi profondément que possible. Pendant l’inhalation, vous entendrez un bourdonnement. Vous sentirez un goût lors de l’inhalation.
Etape 3c: Retenir sa respiration Retenir sa respiration pendant au moins 5 secondes. |
Retirer la gélule vide Jeter la gélule vide avec vos ordures ménagères. Fermer l’inhalateur et replacer le capuchon.
|
|||||||||
|
Etape 1d: Insérer la gélule dans l’emplacement prévu à cet effet. Ne jamais placer une gélule directement dans l’embout buccal.
Etape 1e: Fermer l’inhalateur |
|
Information importante · Les gélules de Glycopyrronium doivent toujours être conservées dans la plaquette et n’être sorties qu’immédiatement avant utilisation. · Ne pas pousser la gélule à travers la feuille d’aluminium. · Ne pas avaler la gélule. · Ne pas utiliser les gélules Glycopyrronium avec un autre inhalateur. · Ne pas utiliser l’inhalateur de Glycopyrronium avec un autre médicament sous forme de gélules. · Ne jamais placer la gélule dans la bouche ou dans l’embout buccal de l’inhalateur. · Ne pas appuyer sur les boutons latéraux plus d’une fois. · Ne pas souffler dans l’embout buccal. · Ne pas appuyer sur les boutons latéraux lors de l’inhalation à travers l’embout buccal. · Ne pas manipuler les gélules avec les mains mouillées. · Ne jamais laver votre inhalateur avec de l’eau. |
|
Votre boîte de GLYCOPYRRONIUM BIOGARAN AXICA contient : · un inhalateur de Glycopyrronium · une ou plusieurs plaquettes, contenant des gélules de Glycopyrronium à utiliser dans l’inhalateur.
Inhalateur Base de l’inhalateur Plaquette |
Questions fréquentes
Pourquoi l’inhalateur n’a-t-il pas fait de bruit au moment où j’ai inhalé la poudre contenue dans la gélule ? La gélule est peut-être coincée dans son logement. Dans ce cas, décoincez la gélule avec précaution en tapotant la base de l’inhalateur. Inhalez à nouveau le médicament en répétant les étapes 3a à 3c
Que dois-je faire s’il reste de la poudre dans la gélule? Vous n’avez pas pris assez de médicament. Fermez l’inhalateur et répétez les étapes 3a à 3c.
|
Nettoyage de l’inhalateur Nettoyer l’intérieur et l’extérieur de l’embout buccal avec un tissu propre, sec et non pelucheux pour éliminer les résidus de poudre. Conserver l’inhalateur au sec. Ne jamais laver votre inhalateur avec de l’eau. |
|
Elimination de l’inhalateur après utilisation Chaque inhalateur d’une boite ou réutilisé doit être jeté après 90 utilisations, à compter de la première utilisation de l'inhalateur. Demandez à votre pharmacien ce qu’il faut faire des médicaments et des inhalateurs dont vous n’avez plus besoin. |
||
|
Je tousse après avoir inhalé – cela est-il important ? Cela peut arriver. Dès lors que la gélule est vide, cela signifie que vous avez inhalé une quantité suffisante du médicament. |
|
|
|
J’ai senti des morceaux minuscules de la gélule sur ma langue – cela est- il important ? Cela peut arriver. Cela ne présente pas de risque. La possibilité de rupture de la gélule en minuscules morceaux est augmentée si la gélule est percée plus d’une fois. |
|