Dernière mise à jour le 08/01/2026
VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose
Indications thérapeutiques
Classe pharmacothérapeutique : Antidotes, code ATC : V03AB15.
VENTIZOLVE contient de la naxolone, une substance active antidote aux opioïdes. Il est indiqué dans le traitement d’urgence des surdosages caractérisés ou suspectés aux opioïdes (tels que morphine, héroïne, méthadone, fentanyl, oxycodone, ou buprénorphine).
VENTIZOLVE est un spray nasal utilisé dans le traitement d’urgence des surdosages caractérisés ou suspectés aux opioïdes chez l’adulte. Les signes d’un tel surdosage incluent :
· Des problèmes pour respirer
· Une somnolence sévère inhabituelle.
· Ne répondant pas à un bruit fort ou au toucher
Si vous êtes à risque de présenter un surdosage aux opioïdes, ayez toujours VENTIZOLVE sur vous.
VENTIZOLVE fonctionne pendant une courte période, pour contrer les effets des opioïdes dans l’attente d’une prise en charge par les services de secours et une structure médicalisée. Ce n’est pas un substitut aux soins de secours d’urgence.
Prévenez toujours vos amis et votre famille que vous avez VENTIZOLVE sur vous.
Présentations
> 2 flacons pulvérisateurs unidoses en verre de 0,1 mL
Code CIP : 34009 301 616 8 5
Déclaration de commercialisation : 16/10/2023
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 27/03/2024 | Inscription (CT) | Le service médical rendu par VENTIZOLVE 1,26 mg (naloxone base), solution pour pulvérisation nasale, est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 27/03/2024 | Inscription (CT) | Compte tenu : • des données de pharmacocinétique du chlorhydrate de naloxone 1,4 mg/0,1 mL administrée par voie intranasale, • du profil d’efficacité et de tolérance connu de la naloxone sous sa forme injectable, et de la marge thérapeutique du produit, • du besoin médical partiellement couvert par les antidotes prêts à l’emploi disponibles en ville, • des données de la littérature sur l’impact positif sur la mortalité par surdose d’opioïdes d’anciens programmes d’éducation et de formation associés à la mise à disposition de naloxone à emporter, • de l’absence de données comparatives avec les kits de naloxone prêts à l’emploi actuellement disponibles, • de l’absence de données cliniques chez l’enfant et l’adolescent, la Commission considère que VENTIZOLVE 1,26 mg (naloxone), solution pour pulvérisation nasale n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la prise en charge des surdoses d’opioïdes, connues ou suspectées, se manifestant par une dépression respiratoire et/ou du système nerveux central, dans un contexte médical ou non-médical. |
ANSM - Mis à jour le : 15/04/2024
VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Naloxone .......................................................................................................................... 1,26 mg
Sous forme de chlorhydrate de naloxone dihydraté
Pour un récipient unidose (pulvérisateur)
Excipient à effet notoire : chlorure de benzalkonium (20 microgrammes par dose)
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour pulvérisation nasale.
Solution limpide, incolore.
4.1. Indications thérapeutiques
VENTIZOLVE est indiqué chez l’adulte.
L’utilisation de VENTIZOLVE ne se substitue pas aux soins dispensés par les services de secours d’urgence.
4.2. Posologie et mode d'administration
Adultes
La dose recommandée est de 1,26 mg administrée dans une narine (une pulvérisation nasale).
Si la respiration est stabilisée, le patient doit être placé en position latérale de sécurité et surveillé jusqu'à l’arrivée de professionnels de la santé.
VENTIZOLVE est administré chez les sujets dépendants aux opioïdes, particulièrement chez les sujets à risque de développer des symptômes sévères de sevrage aux opioïdes. Dans certains cas, des doses supplémentaires peuvent être nécessaires. La dose maximale appropriée de VENTIZOLVE est spécifique à la situation. Si l’état du patient ne s’améliore pas, une seconde dose doit être administrée 2 à 3 minutes après la première dose. Si l’état du patient s’améliore après la première administration, mais que la fréquence respiratoire ou l’état du patient se dégrade à nouveau, la deuxième dose doit être administrée immédiatement. Les doses suivantes (si disponibles) doivent être administrées alternativement dans chaque narine et le patient doit être surveillé en attendant l'arrivée des services d'urgence.
Population pédiatrique
La sécurité et l'efficacité de VENTIZOLVE chez les enfants et les adolescents n'ont pas été établies.
Aucune donnée n’est disponible.
Personnes âgées
Aucune adaptation de la posologie n'est requise.
Mode d’administration
Administration par voie nasale.
VENTIZOLVE doit être administré dès que possible pour éviter les dommages sur le système nerveux central ainsi que le décès.
Les instructions détaillées sur l'utilisation de VENTIZOLVE sont fournies dans la notice.
Le pulvérisateur ne contient qu’une seule dose. Ne pas amorcer ou tester le pulvérisateur avant l'administration. Ne pas réutiliser le pulvérisateur après l’administration.
Hypersensibilité à la substance active ou à l’un des excipients du médicament (voir rubrique 6.1).
4.4. Mises en garde spéciales et précautions d'emploi
Information du patient / des utilisateurs pour une utilisation adéquate de VENTIZOLVE
VENTIZOLVE est utilisé pour le traitement d’urgence d’un surdosage aux opioïdes, connu ou suspecté, essentiellement dans un cadre non médical. Par conséquent, le professionnel de santé doit prendre les mesures appropriées pour s’assurer que le patient et/ou toute autre personne qui pourrait être en mesure d’administrer VENTIZOLVE comprend parfaitement ses indications et ses modalités d’utilisation.
Les professionnels de santé doivent décrire aux patients et aux personnes susceptibles d’administrer VENTIZOLVE, les symptômes qui permettent de diagnostiquer une dépression du système nerveux central (SNC) et/ou une dépression respiratoire ainsi que l’indication et les instructions d’utilisation de VENTIZOLVE. Cela doit être réalisé conformément aux recommandations éducationnelles de VENTIZOLVE.
VENTIZOLVE contient une dose unique de naloxone. Les patients et les personnes susceptibles d’administrer VENTIZOLVE doivent donc connaître les instructions appropriées sur la façon d’utiliser le dispositif, et qu’il ne doit pas être amorcé ou testé avant l’administration, ni réutilisé après l’administration de la dose (voir rubrique 4.2).
Surveillance du patient
Administrer des doses supplémentaires si nécessaire, si le patient ne réagit pas de façon adéquate à la première dose, ou s’il réagit dans un premier temps puis que sa fréquence respiratoire ou son état se dégrade à nouveau (voir rubrique 4.2).
L’importance de contacter les services de secours d’urgence
Le patient doit être surveillé jusqu'à l’arrivée des services d'urgence. La durée d'action de la plupart des opioïdes peut dépasser celle de VENTIZOLVE, entraînant un retour vers la dépression respiratoire et/ou la dépression du système nerveux central après l’amélioration initiale des symptômes. Par conséquent, il est nécessaire de prévenir immédiatement et systématiquement une assistance médicale d'urgence et de garder le patient sous surveillance continue.
Efficacité de la naloxone
La naloxone n'est pas efficace dans le traitement de la dépression du système nerveux central ou la dépression respiratoire causée par des médicaments autres que les opioïdes. L'inversion de la dépression respiratoire causée par des agonistes partiels ou des agonistes / antagonistes mixtes, tels que la buprénorphine et la pentazocine, peut être incomplète et nécessiter des doses plus élevées de naloxone ou des administrations répétées. L'absorption intranasale et l'efficacité de la naloxone peuvent être altérées chez les patients présentant une muqueuse nasale endommagée et des malformations septales. Si une réponse incomplète se produit, la respiration doit être assistée mécaniquement.
Syndrome de sevrage aux opioïdes
L'inversion brutale des effets des opioïdes chez une personne physiquement dépendante peut déclencher un syndrome de sevrage aigu. La sévérité et la durée du syndrome de sevrage est corrélée à la dose de naloxone et au degré et type de dépendance aux opioïdes (voir la rubrique 4.8). Les patients qui sont traités par des opioïdes pour soulager une douleur chronique peuvent voir leur douleur augmenter et peuvent subir des symptômes de sevrage aux opioïdes après une administration de VENTIZOLVE.
VENTIZOLVE contient du chlorure de benzalkonium en tant que conservateur. Le chlorure de benzalkonium peut causer une irritation ou un gonflement dans le nez, surtout s'il est utilisé pendant une longue période.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L'administration de naloxone peut atténuer les effets analgésiques des opioïdes utilisés principalement pour soulager la douleur, en raison de ses propriétés antagonistes (voir rubrique 4.4).
Chez les patients traités par buprénorphine à des fins analgésiques, l'effet analgésique complet de la buprénorphine peut être rétabli par l'administration de naloxone. Cet effet est considéré comme le résultat de la courbe dose-réponse de la buprénorphine qui mène à une diminution de l’analgésie lors de l’utilisation de fortes doses de buprenorphine. L'inversion de la dépression respiratoire causée par la buprénorphine est cependant limitée.
Les données concernant l'interaction de la naloxone avec l'alcool ne sont pas concluantes. Selon la cause de l'intoxication, l'effet de l'administration de naloxone peut être retardé chez les patients atteints d’intoxications multiples par des opioïdes et des sédatifs ou de l'alcool.
Une hypertension sévère a été rapportée lors de l'utilisation de naloxone dans des cas de coma provoqué par un surdosage en clonidine.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'y a pas de données disponibles sur l'utilisation de naloxone chez la femme enceinte. Des études chez l'animal ont montré une toxicité sur la reproduction uniquement à des doses toxiques pour la mère. Le risque potentiel pour les humains n'est pas connu. Ainsi, VENTIZOLVE ne devrait pas être utilisé pendant la grossesse sauf si l'état clinique de la mère nécessite un traitement par naloxone.
L’utilisation de VENTIZOLVE chez la femme enceinte nécessite une surveillance appropriée du fœtus pour déceler les signes de détresse.
Il n’est pas établi si la naloxone est excrétée dans le lait maternel ou si elle a une influence sur le nouveau-né allaité. Cependant, étant donné la très faible biodisponibilité par voie orale de la naloxone, son potentiel à affecter un nourrisson allaité est négligeable. Des précautions doivent être prises lors de l’utilisation de naloxone chez une femme qui allaite, mais il n’est pas nécessaire d’interrompre l’allaitement. Les nouveau-nés allaités par une mère traitée par VENTIZOLVE doivent être surveillés pour contrôler d’éventuels signes de sédation ou d'irritabilité.
Fertilité
Aucune donnée clinique n’est disponible concernant les effets de la naloxone sur la fertilité. Toutefois, les données disponibles chez le rat ne montrent pas d’effets sur la fertilité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
L'effet indésirable le plus fréquemment observé suite à l'administration de naloxone est la nausée (très fréquent). L'inversion brutale des effets des opioïdes chez les personnes physiquement dépendantes peut déclencher un syndrome de sevrage aigu.
Liste des effets indésirables
Les effets indésirables suivants ont été rapportés avec VENTIZOLVE et/ou d'autres médicaments contenant de la naloxone au cours des études cliniques et après commercialisation. Les effets indésirables sont listés ci-dessous par classe de système d'organes et par fréquence.
Les fréquences des effets indésirables qui sont au moins possiblement directement liés à la naloxone sont définies selon la convention suivante : Très fréquent (≥1/10), fréquent (≥1/100 à <1/10), peu fréquent (≥1/1 000 à <1/100), rare (≥1/10 000 à <1/1 000), et très rare (<1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classes de système d’organes |
Effet indésirable |
|
Affections du système immunitaire |
|
|
Très rare : |
Hypersensibilité, choc anaphylactique |
|
Affections du système nerveux |
|
|
Fréquent : Peu fréquent : |
Vertiges, maux de tête Tremblements |
|
Affections cardiaques |
|
|
Fréquent : Peu fréquent : Très rare : |
Tachycardie Arythmie, bradycardie Fibrillation cardiaque, arrêt cardiaque |
|
Affections vasculaires |
|
|
Fréquent : |
Hypotension, hypertension |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Peu fréquent : |
Hyperventilation |
|
Très rare : |
Œdème pulmonaire |
|
Affections gastro-intestinales |
|
|
Très fréquent : Fréquent : Peu fréquent : |
Nausées Vomissements Diarrhées, sécheresse buccale |
|
Affections cutanées et sous cutanées |
|
|
Peu fréquent : |
Hyperhydrose |
|
Très rare : |
Érythème polymorphe |
|
Troubles généraux et anomalies au site d’administration |
|
|
Peu fréquent : |
Syndrome de sevrage aux opioïdes (chez les patients dépendants) |
Description de certains effets indésirables
Syndrome de sevrage
Les signes et les symptômes du syndrome de sevrage peuvent être : agitation, irritabilité, hyperesthésie, nausées, vomissements, douleurs gastro-intestinales, spasmes musculaires, dysphorie, insomnie, anxiété, hyperhydrose, pilo-érection, tachycardie, augmentation de la tension artérielle, bâillements, pyrexie. Des changements comportementaux, y compris un comportement violent, une nervosité et une excitation peuvent également être observés.
Troubles vasculaires
En utilisation intraveineuse/intramusculaire de naloxone : hypotension, hypertension, arythmie cardiaque (y compris la tachycardie ventriculaire et la fibrillation) et œdème pulmonaire ont été signalés dans l’usage post-opératoire de naloxone. Des effets indésirables cardiovasculaires sont apparus plus fréquemment en post-opératoire chez des patients ayant des maladies cardiovasculaires préexistantes ou lors d'une utilisation concomitante avec des médicaments produisant des effets indésirables cardiovasculaires similaires.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Un surdosage n'est pas attendu compte tenu de l'indication et du large indice thérapeutique. Des doses uniques de 10 mg de naloxone administrées par voie intraveineuse ont été tolérées sans effets indésirables ou modifications des valeurs biologiques.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Antidotes, code ATC : V03AB15.
Mécanisme d’action
La naloxone est un dérivé morphinique semi-synthétique (N-allyl-noroxymorphone) et un antagoniste spécifique aux opioïdes qui s’oppose à leurs effets en se fixant sur leurs récepteurs. L’effet est dû à l’antagonisme des récepteurs aux opioïdes mu, kappa, et delta. L'antagonisme du récepteur mu rétablit la respiration.
Effets pharmacodynamiques
La naloxone inverse les effets des opioïdes, y compris la dépression respiratoire, la sédation et l'hypotension. Elle a une très forte affinité pour les récepteurs aux opioïdes et, par conséquent, déplace à la fois les agonistes opioïdes et les antagonistes partiels (par ex. pentazocine et nalorphine). La naloxone n'inverse pas la dépression du SNC causée par des hypnotiques ou d'autres médicaments non-opioïdes et n'a pas d'effets agonistes ou morphiniques comme les autres antagonistes des opioïdes.
En cas de dépendance aux opiacés, l'administration de naloxone augmentera les symptômes de dépendance physique. Les effets pharmacologiques de la naloxone sont généralement observés dans les 2 minutes suivant son administration. La durée de l'effet antagoniste dépend de la dose, mais est généralement de 1 à 4 heures. La nécessité d'une administration répétée dépend de la quantité, du type et de la voie d'administration de l'opioïde à antagoniser.
5.2. Propriétés pharmacocinétiques
Dans une étude pharmacocinétique chez 22 sujets adultes en bonne santé, la biodisponibilité relative d'une pulvérisation nasale dans une narine (dose totale de 1,4 mg de chlorhydrate de naloxone, équivalent à 1,26 mg de naloxone base, administré en tant que 0,1 mL de chlorhydrate de naloxone à 14 mg/mL) et deux pulvérisations nasales administrées dans la même narine (dose totale de 2,8 mg de chlorhydrate de naloxone, équivalent à deux fois 1,26 mg de naloxone base, administré en tant que 2 x 0,1 mL de chlorhydrate de naloxone à 14 mg/mL) a été comparée à une dose unique de 0,8 mg de chlorhydrate de naloxone en injection intramusculaire (IM) et de 0,4 mg de chlorhydrate de naloxone en injection intraveineuse (IV). La biodisponibilité absolue par pulvérisation nasale était en moyenne de 0,49 ± 0,24. Les résultats sont présentés dans le tableau 1 ci-dessous.
Tableau 1. Paramètres pharmacocinétiques moyens de la naloxone après administration de Ventizolve de chlorhydrate de naloxone par voie intramusculaire et intraveineuse sur sujets sains.
|
Paramètre |
1.4 mg/dose intranasale – une dose |
1.4 mg/dose intranasale – deux doses |
0.8 mg injection intramusculaire |
0.4 mg injection intraveineuse |
|
tmax (min) |
20,16 |
20,7 |
13,62 |
3,48* |
|
Cmax (ng/mL) |
2,356 |
4,181 |
3,734 |
7,437* |
|
AUC0-last (h*ng/mL) |
2,622 |
5,232 |
3,091 |
1,839 |
|
AUC0-inf (h*ng/mL) |
2,842 |
5,469 |
3,431 |
2,087 |
|
t1/2 (h) |
1,216 |
1,162 |
1,414 |
1,239 |
|
Biodisponibilité relative normalisée (%) IN vs IM |
0,52 |
|
|
|
* Temps et concentration au premier point d'échantillonnage = 2 minutes
Les concentrations plasmatiques moyennes de naloxone à 2 et 5 minutes après l’administration de 1,4 mg de Ventizolve en intranasal étaient respectivement de 0,5475 ng/mL (23% de Cmax) et de 0,9519 ng/mL (40% de Cmax). Le début de l’action après administration intranasale peut raisonnablement être attendu chez chaque individu avant que le tmax ne soit atteint. Les concentrations plasmatiques moyennes correspondantes de naloxone à 2 et 5 minutes après l’administration IM de 0,8 mg de naloxone, étaient respectivement de 1,4979 ng/mL (40% de Cmax) et de 3,1551 ng/mL (85% de Cmax).
Distribution
La naloxone est un composé hautement lipophile et, après administration parentérale, elle est distribuée rapidement et largement dans les liquides corporels et les tissus, y compris le cerveau. La naloxone passe facilement à travers la barrière fœto-placentaire. Son excrétion dans le lait maternel n’est pas connue.
La naloxone se lie relativement faiblement aux protéines plasmatiques (32-45%). L’albumine contenue dans le plasma est le contenu auquel la naloxone se lie majoritairement, mais elle se lie également de façon significative à d’autres constituants du plasma.
Biotransformation
La naloxone est métabolisée dans le foie, principalement par glucuroconjugaison, le naloxone-3-glucoronide étant le principal métabolite.
Élimination
Chez l’adulte, la demi-vie d'élimination est d'environ 1 à 1,5 heures après l'administration parentérale. Dans une étude de pharmacocinétique, il n'y avait pas de différence significative dans l'élimination après l'administration de VENTIZOLVE ou de formulations intramusculaires de 0,8 mg de formulations intraveineuses de 0,4 mg.
5.3. Données de sécurité préclinique
Génotoxicité et carcinogénicité
La naloxone s’est révélée faiblement positive dans le test d'Ames et dans le test in vitro d'aberration chromosomique sur lymphocytes humains et négative dans les essais de mutagenèse HGPRT des cellules V79 de hamster chinois et dans l'étude in vivo des aberrations chromosomiques de la moelle osseuse chez le rat.
Dans l'ensemble, les preuves apportées indiquent que la naloxone présente un risque minime, voire nul, de génotoxicité et de cancérogénicité chez l’humain.
Toxicité sur la reproduction et le développement
La naloxone n'a eu aucun effet sur la fertilité et la reproduction chez le rat, ni sur le développement embryonnaire précoce du rat et de la souris. La naloxone n'est pas tératogène chez l’animal.
3 ans.
6.4. Précautions particulières de conservation
Conserver les récipients unidoses dans leur boîte en plastique, à l’abri de la lumière.
Conserver les plaquettes dans l’emballage extérieur, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
La solution est conditionnée dans un flacon en verre de type I avec un bouchon en caoutchouc chlorobutyle. Le dispositif de pulvérisation est composé d'un actionneur en polypropylène, d'une goupille de pulvérisation et d'une canule en acier inoxydable.
Présentations :
Une boîte comprenant 1 emballage plastique contenant 2 récipients unidoses de 0,1 mL de solution pour pulvérisation nasale.
Une boîte comprenant 10 emballages plastiques contenant chacun 2 récipients unidoses de 0,1 mL de solution pour pulvérisation nasale.
Une boîte comprenant 6 plaquettes contenant chacune 1 récipient unidose de 0,1 mL de solution pour pulvérisation nasale.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
KARIHAUGVEIEN 22
NO-1086 OSLO
NORVEGE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 616 8 5 : Solution en flacon pulvérisateur unidose de 0,1 mL (verre), boîte de 2.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 15/04/2024
VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose
Naloxone
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien ou votre infirmier/ère.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre médecin, pharmacien ou infirmier/ère pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose ?
3. Comment utiliser VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose, ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Antidotes, code ATC : V03AB15.
VENTIZOLVE contient de la naxolone, une substance active antidote aux opioïdes. Il est indiqué dans le traitement d’urgence des surdosages caractérisés ou suspectés aux opioïdes (tels que morphine, héroïne, méthadone, fentanyl, oxycodone, ou buprénorphine).
VENTIZOLVE est un spray nasal utilisé dans le traitement d’urgence des surdosages caractérisés ou suspectés aux opioïdes chez l’adulte. Les signes d’un tel surdosage incluent :
· Des problèmes pour respirer
· Une somnolence sévère inhabituelle.
· Ne répondant pas à un bruit fort ou au toucher
Si vous êtes à risque de présenter un surdosage aux opioïdes, ayez toujours VENTIZOLVE sur vous.
VENTIZOLVE fonctionne pendant une courte période, pour contrer les effets des opioïdes dans l’attente d’une prise en charge par les services de secours et une structure médicalisée. Ce n’est pas un substitut aux soins de secours d’urgence.
Prévenez toujours vos amis et votre famille que vous avez VENTIZOLVE sur vous.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose ?
N’utilisez jamais VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose
· si vous êtes allergique à la naloxone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Ce médicament est utilisé pour le traitement d’urgence d’un surdosage aux opioïdes et doit vous être administré par une autre personne.
VENTIZOLVE doit vous être administré immédiatement et ne remplace pas les équipes médicales d’urgences.
Contacter les secours immédiatement, même si le patient se réveille. Appelez le 15 ou le 112.
· Le pulvérisateur nasal VENTIZOLVE contient une seule dose de naloxone. Il est important de ne pas amorcer ni tester le pulvérisateur avant son utilisation, au risque qu’il se vide et que le patient ne reçoive pas la dose nécessaire. Utilisez un second pulvérisateur nasal VENTIZOLVE si des doses supplémentaires sont nécessaires. Des doses supplémentaires peuvent être administrées 2 à 3 minutes après la dose initiale (voir rubrique 3).
· Symptômes du syndrome de sevrage : Il est possible que VENTIZOLVE occasionne une réversion rapide de l’effet des opioïdes qui peut causer un syndrome aigu de sevrage chez une personne physiquement dépendante aux opioïdes. Les symptômes du syndrome aigu de sevrage peuvent être : accélération du rythme cardiaque, hypertension artérielle, courbatures et crampes abdominales, diarrhées, nausées, vomissements, sueurs, fièvre, chair de poule, frissons ou tremblements, troubles du comportement incluant comportement violent, nervosité, anxiété, excitation, agitation ou irritabilité, troubles de l’humeur, sensibilité accrue de la peau, difficulté à dormir. Si vous prenez des opioïdes pour soulager une douleur chronique, vous pouvez voir votre douleur augmenter quand vous êtes traité par VENTIZOLVE.
· La durée d’action de certains opioïdes peut dépasser celle de VENTIZOLVE. Même si une réponse initiale est observée, il est important que le patient soit mis sous surveillance, car les signes et les symptômes de surdosage aux opioïdes peuvent réapparaitre. Dans ce cas, des doses supplémentaires de VENTIZOLVE peuvent être administrées (voir rubrique 3).
· Si vous utilisez de la buprénorphine, sachez que VENTIZOLVE peut ne pas complètement contrer la détresse respiratoire causée par le surdosage. Une dose supplémentaire peut être nécessaire.
Informez votre médecin si votre muqueuse nasale est endommagée car ceci pourrait affecter le fonctionnement de VENTIZOLVE.
Enfants et adolescents
Ne pas utiliser VENTIZOLVE chez les enfants et les adolescents.
Autres médicaments et VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Si vous prenez ou avez pris des doses élevées d'opioïdes ou des opioïdes à action prolongée, parlez-en à votre médecin.
VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose avec de l’alcool
Le délai d’action de ce médicament peut être retardé chez les patients souffrant d’une intoxication causée par les opioïdes et l'alcool.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou votre pharmacien avant de prendre ce médicament.
Une surveillance étroite du fœtus ou de l’enfant est nécessaire si VENTIZOLVE est utilisé au cours de la grossesse ou de l’allaitement.
Conduite de véhicules et utilisation de machines
Les effets causés par les opioïdes pouvant réapparaître, vous ne devez pas conduire d’automobiles ou de machines et ne pas entreprendre d’activités demandant une attention particulière ou une aptitude physique spécifique pendant au moins 24 heures après traitement par VENTIZOLVE.
VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose contient du chlorure de benzalkonium
Ce médicament contient 0,02 mg de chlorure de benzalkonium dans chaque pulvérisateur nasal, ce qui équivaut à 0,2 mg/mL. Le chlorure de benzalkonium peut causer une irritation ou un gonflement dans le nez, surtout s'il est utilisé pendant une longue période.
3. COMMENT UTILISER VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose ?
Adultes :
Une pulvérisation (1,26 mg de naloxone) administrée par voie nasale (dans le nez).
Les premiers secours doivent être administrés jusqu'à l’arrivée des services de secours d’urgence. Placez la personne en position latérale de sécurité. Une dose supplémentaire peut être administrée 2 à 3 minutes après l’administration de la première dose si aucun effet clinique significatif n'est atteint ou si l'état du patient ne s’améliore pas.
Si deux doses de 1,26 mg de naloxone n'entraînent pas une amélioration significative des symptômes, il faut considérer que les symptômes peuvent être causés entièrement ou partiellement par d'autres facteurs ou substances que les opioïdes.
Mode d’emploi :
1. Surveillez les symptômes et les réactions.
· Vérifiez si la personne réagit, pour voir si elle est consciente : vous pouvez crier son nom, secouer ses épaules, parler fort dans ses oreilles, frotter son sternum, pincer son oreille ou la base de l’ongle.
· Vérifiez les voies respiratoires et la respiration. Libérez la bouche et le nez de tout obstacle qui pourrait empêcher la respiration. Vérifiez la respiration pendant 10 secondes - est ce que la poitrine se soulève ? Entendez-vous des bruits respiratoires ? Pouvez-vous sentir un souffle en approchant votre joue ?
· Vérifiez les signes d’un surdosage, comme : un manque de réponse suite au toucher ou au bruit, une respiration lente ou irrégulière ou pas de respiration, un ronflement, un halètement ou un déglutissement, des lèvres ou des ongles bleus ou violacés.
· Si un surdosage est suspecté, VENTIZOLVE doit être administré.
2. Appelez immédiatement les services de secours en faisant le 15 ou le 112.

3. Allongez la personne sur le dos. Assurez-vous que ses voies respiratoires sont dégagées. Il est recommandé d'inspecter et de dégager les voies nasales avant d'administrer la pulvérisation nasale.
4. Ouvrez l'emballage intérieur en retirant d'abord l'élastique, puis en appuyant au centre des faces plates de la boîte en plastique pour l'ouvrir.
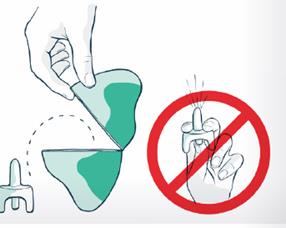
Ne testez pas et n’amorcez pas le pulvérisateur avant utilisation. Un pulvérisateur de VENTIZOLVE ne contient qu’une seule dose de naloxone.
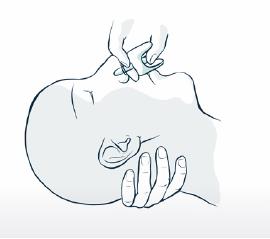
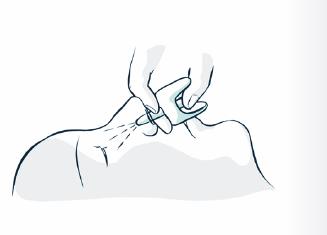
5. Soutenez la nuque pour permettre à la tête de s'incliner vers l'arrière. Placez le pulvérisateur dans une narine. Appuyez fermement sur le piston jusqu'à ce qu'il clique pour administrer la dose, puis retirez le pulvérisateur de la narine.
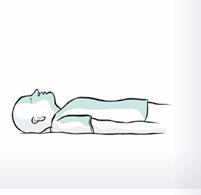
6. Placez la personne en position latérale de sécurité. Restez auprès d’elle jusqu’à l’arrivée des services de secours. Surveillez toute amélioration de la fréquence respiratoire, de l’état d’éveil ou de la réaction au bruit ou au toucher.
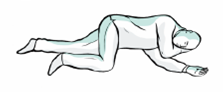
7. S'il n'y a pas d'amélioration après 2 à 3 minutes, une deuxième dose doit être administrée dans l’autre narine.
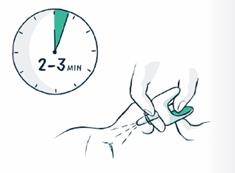
Afin de visualiser la vidéo explicative, veuillez-vous reporter au QR code et à l’URL présents en fin de notice.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Il peut être difficile d’attester qu’un effet indésirable est dû à l’utilisation de VENTIZOLVE puisque ce médicament est toujours administré secondairement à la prise d’opioïdes.
Les effets indésirables suivants ont été rapportés après l’administration de VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose :
Très fréquemment (pouvant affecter plus de 1 personne sur 10) :
· Sensation d’être malade
Fréquemment (pouvant affecter jusqu’à 1 personne sur 10) :
· Vertiges, maux de têtes
· Augmentation du rythme cardiaque
· Augmentation ou diminution de la pression artérielle (possibles maux de tête ou sensation de malaise)
· Vomissements
Peu fréquemment (pouvant affecter jusqu’à 1 personne sur 100) :
· Sueurs, tremblements
· Irrégularités ou diminution du rythme cardiaque
· Diarrhée, sécheresse buccale
· Accélération de la respiration
· Symptômes de sevrage : agitation, irritabilité, augmentation de la sensibilité cutanée, sensation d’être malade, vomissements, crampes abdominales, crampes musculaires, sautes d’humeur, difficultés d’endormissement, anxiété, frissons, sueurs, augmentation du rythme cardiaque, hypertension artérielle, bâillements, fièvre
Très rarement (pouvant affecter jusqu’à 1 personne sur 10 000) :
· Réactions allergiques : gonflement du visage, de la bouche, des lèvres ou de la gorge, choc allergique
· Troubles du rythme cardiaque potentiellement mortels, crise cardiaque
· Accumulation de liquide dans les poumons
· Troubles cutanés : démangeaisons, éruptions cutanées, rougeurs, enflures, desquamations sévères de la peau
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon, l’emballage plastique/plaquette et la boîte après la mention EXP. La date de péremption fait référence au dernier jour de ce mois. Conserver les plaquettes dans l’emballage extérieur, à l’abri de la lumière.
Ne pas congeler. Conserver les récipients unidoses dans leur emballage plastique, à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose
· La substance active est la naloxone.
Chaque pulvérisation nasale délivre 1,26 mg de naloxone (sous forme de chlorhydrate de naloxone dihydraté)
· Les autres composants sont :
La povidone, le glyécérol, l’édétate disodique, le chlorure de benzalkonium, l’acide citrique monohydraté, le citrate de sodium, l’hydroxyde de sodium (pour l’ajustement du pH), l’acide chlorydrique (pour l’ajustement du pH), l’eau pour préparations injectables.
VENTIZOLVE est une solution limpide et incolore emballée dans un flacon en verre avec un bouchon en caoutchouc inclus dans un dispositif de pulvérisation composé de polypropylène et d’acier inoxydable. Aucun dispositif supplémentaire n’est nécessaire à son utilisation.
Présentations :
Une boîte comprenant 1 emballage plastique contenant 2 récipients unidoses de 0,1 mL de solution pour pulvérisation nasale.
Une boîte comprenant 10 emballages plastiques contenant chacun 2 récipients unidoses de 0,1 mL de solution pour pulvérisation nasale.
Une boîte comprenant 6 plaquettes contenant chacune 1 récipient unidose de 0,1 mL de solution pour pulvérisation nasale.
Titulaire de l’autorisation de mise sur le marché
KARIHAUGVEIEN 22
NO-1086 OSLO
NORVEGE
Exploitant de l’autorisation de mise sur le marché
LABORATOIRE CEVIDRA
45 BOULEVARD MARCEL PAGNOL
06130 GRASSE
KARIHAUGVEIEN 22
NO-1086 OSLO
NORVEGE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations en vigueur les plus récentes [notice, guide rapide d’utilisation et vidéo] sur ce médicament sont disponibles en scannant le QR code présent sur cette notice et sur l’emballage extérieur avec un téléphone/appareil. Les mêmes informations sont disponibles à l’adresse URL suivante : www.ventizolve.com et sur le site Internet de l’ANSM.

Les informations suivantes sont destinées aux témoins uniquement :
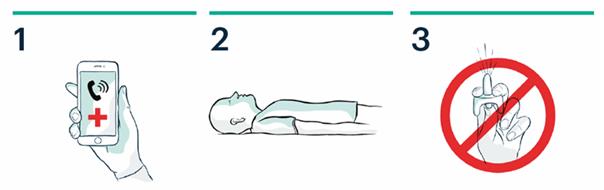
1. Appelez le 15 ou le 112
2. Allongez le patient sur le dos. Dégagez les voies respiratoires.
3. Ne pas amorcer ou tester le pulvérisateur nasal.
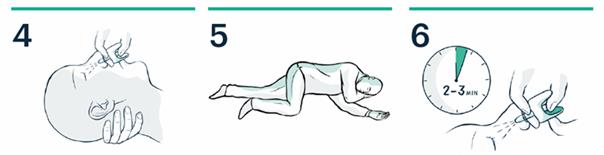
4. Soutenez la nuque. Placez le pulvérisateur dans une narine. Appuyez fermement sur le piston jusqu'à ce qu'il clique.
5. Placez le patient en position latérale de sécurité. Restez avec lui jusqu’à l’arrivée des services de secours.
6. Après 2 à 3 minutes, s'il n'y a pas d'amélioration, une deuxième dose doit être administrée dans l’autre narine.
[1] Indiquer le libellé détaillé qui figure dans l’application form avec le code de la modification selon les lignes directrices https://ec.europa.eu/health//sites/health/files/files/eudralex/vol-2/c_2013_2008/c_2013_2008_pdf/c_2013_2804_fr.pdf