Dernière mise à jour le 08/01/2026
RHINEA, solution buvable en récipient unidose
Indications thérapeutiques
Classe pharmacothérapeutique : Médicament homéopathique.
Médicament indiqué chez l'enfant de 1 mois à 12 ans.
Présentations
> 30 récipient(s) (6 x 5) unidose(s) de 1 mL polyéthylène basse densité (PEBD) en sachet aluminium
Code CIP : 34009 302 387 7 6
Déclaration de commercialisation : 26/08/2024
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 28/06/2022
RHINEA, solution buvable en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Dulcamara 8 DH................................................................................................................ 333,3 mg
Atropa belladonna 8 DH..................................................................................................... 333,3 mg
Sambucus nigra 4 DH........................................................................................................ 333,3 mg
Pour un récipient unidose de 1 mL.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution buvable en récipient unidose.
4.1. Indications thérapeutiques
RHINEA, solution buvable en récipient unidose est indiqué chez l'enfant de 1 mois à 12 ans.
4.2. Posologie et mode d'administration
Enfant de 1 mois à 12 ans.
La posologie habituelle est de 1 unidose 4 à 6 fois par jour pour un traitement de 5 jours.
Espacer les prises dès amélioration.
Population pédiatrique
RHINEA, solution buvable en récipient unidose est contre-indiqué chez les nourrissons âgés de moins de 1 mois.
Mode d’administration
Voie orale.
Ouvrir le sachet.
Détacher un récipient unidose de la barrette. Fermer soigneusement le sachet contenant les autres récipients unidoses en repliant le côté ouvert.
Ouvrir le récipient unidose en tournant l’embout. Verser le contenu du récipient unidose dans la cavité buccale de l’enfant tout en maintenant l’enfant en position assise.
Durée de traitement
La durée de traitement ne doit pas dépasser 5 jours, sans avis médical.
Si les symptômes persistent ou s’aggravent au-delà de 5 jours, ou en cas de fièvre supérieure à 38,5°C, un médecin doit être consulté.
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
· Enfants âgés de moins de 1 mois.
4.4. Mises en garde spéciales et précautions d'emploi
Un médecin doit être consulté :
· si les symptômes persistent ou s’aggravent au-delà de 5 jours ;
· en cas de fièvre supérieure à 38,5°C ;
· en cas d’expectorations purulentes.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Sans objet.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Sans objet.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Médicament homéopathique
En l’absence de données scientifiques, l’indication de ce médicament repose sur l’usage homéopathique traditionnel de ses composants.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Avant ouverture du sachet : 3 ans.
Après ouverture du sachet : 1 an.
Après ouverture du récipient unidose :
· Le produit doit être utilisé immédiatement.
· Jeter le récipient unidose après utilisation.
· Ne pas le conserver pour une utilisation ultérieure.
6.4. Précautions particulières de conservation
Avant ouverture du sachet : pas de précautions particulières de conservation.
Après ouverture du sachet : conserver les récipients unidoses non utilisés dans le sachet.
6.5. Nature et contenu de l'emballage extérieur
Barrette de 5 récipients unidoses type Bottle-pack (PEBD) de 1 mL conditionnée en sachet (Aluminium).
Boîte de 15, 20 ou 30 récipients unidoses.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
AVENUE DU GENERAL DE GAULLE
14200 HEROUVILLE SAINT-CLAIR
[Tel, fax, e-Mail : à compléter ultérieurement par le titulaire]
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 387 4 5 : étui de 15 récipients unidoses de 1 mL.
· 34009 302 387 6 9 : étui de 20 récipients unidoses de 1 mL.
· 34009 302 387 7 6 : étui de 30 récipients unidoses de 1 mL.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
Date de première autorisation : 14 janvier 2022
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 28/06/2022
RHINEA, solution buvable en récipient unidose
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 5 jours.
1. Qu'est-ce que RHINEA, solution buvable en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser RHINEA, solution buvable en récipient unidose ?
3. Comment utiliser RHINEA, solution buvable en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver RHINEA, solution buvable en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE RHINEA, solution buvable en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Médicament homéopathique.
Médicament indiqué chez l'enfant de 1 mois à 12 ans.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER RHINEA, solution buvable en récipient unidose ?
N’utilisez jamais RHINEA, solution buvable en récipient unidose
· si vous êtes allergique aux substances actives ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· chez l’enfant de moins de 1 mois.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser RHINEA, solution buvable en récipient unidose.
NE PAS INSTILLER DANS L’OEIL, NI DANS L’OREILLE, NI DANS LE NEZ.
NE PAS INJECTER.
Si les symptômes persistent ou s’aggravent au-delà de 5 jours, ou en cas de fièvre supérieure à 38,5°C ou d’expectorations purulentes, consultez un médecin
Enfants
Cette présentation est réservée à l'enfant de 1 mois à 12 ans.
Autres médicaments et RHINEA, solution buvable en récipient unidose
Informez votre médecin ou pharmacien utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
RHINEA, solution buvable en récipient unidose avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Sans objet.
Conduite de véhicules et utilisation de machines
Sans objet.
3. COMMENT UTILISER RHINEA, solution buvable en récipient unidose ?
Posologie
La dose recommandée est de 1 unidose 4 à 6 fois par jour pour un traitement de 5 jours.
Espacer les prises dès amélioration.
Mode d’administration
Voie orale.
· Se laver les mains avant d’utiliser les unidoses.
· Ne pas conserver un récipient unidose après ouverture. Le récipient unidose doit être jeté après chaque usage.
· Chez l’enfant, le mettre en position assise avant administration.
Afin d’administrer une solution toujours stérile, utiliser un nouveau récipient unidose lors de chaque utilisation.
1. Ouvrir le sachet aluminium.
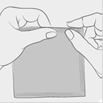
2. Détacher un récipient unidose de la barrette.
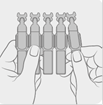
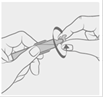
3. Ouvrir le récipient unidose en tournant l’embout.
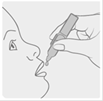
4. Verser le contenu du récipient unidose en pressant légèrement dessus, dans la bouche.
5. Fermer soigneusement le sachet contenant les autres récipients unidoses en repliant le côté ouvert.

Durée de traitement
Ne pas dépasser 5 jours de traitement sans avis médical.
Si les symptômes s’aggravent en cours de traitement, consultez votre médecin.
Si vous avez utilisé plus de RHINEA, solution buvable en récipient unidose que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser RHINEA, solution buvable en récipient unidose
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser RHINEA, solution buvable en récipient unidose
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER RHINEA, solution buvable en récipient unidose ?
Avant ouverture du sachet : pas de précautions particulières de conservation.
Après ouverture du sachet : les unidoses doivent être utilisées dans les 12 mois.
Après ouverture du récipient unidose :
· Le produit doit être utilisé immédiatement.
· Jeter le récipient unidose après utilisation.
· Ne pas le conserver pour une utilisation ultérieure.
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage. La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas ce médicament si vous remarquez que l’unidose est endommagée ou déjà ouverte, au vu du risque de rapide contamination bactérienne.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient RHINEA, solution buvable en récipient unidose
· Les substances actives sont :
Dulcamara 8 DH......................................................................................................... 333,3 mg
Atropa belladonna 8 DH............................................................................................... 333,3 mg
Sambucus nigra 4 DH ................................................................................................. 333,3 mg
Pour un récipient unidose de 1 mL.
· L’autre composant est : eau purifiée.
Qu’est-ce que RHINEA, solution buvable en récipient unidose et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution buvable en récipient unidose de 1 mL.
Boîte de 15, 20 ou 30 récipients unidoses.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
AVENUE DU GENERAL DE GAULLE
14200 HEROUVILLE SAINT-CLAIR
FRANCE
Exploitant de l’autorisation de mise sur le marché
LABORATOIRES GILBERT
928 AVENUE DU GENERAL DE GAULLE
14200 HEROUVILLE SAINT-CLAIR
FRANCE
AVENUE DE CAMBRIDGE
14200 HEROUVILLE SAINT-CLAIR
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).