Dernière mise à jour le 03/09/2025
ZAMELINE 1 mg/mL, collyre en solution
Indications thérapeutiques
Classe pharmacothérapeutique : Autres anti-infectieux - code ATC : S01AX08
ZAMELINE contient un antiseptique oculaire contre les bactéries et est utilisé comme un antiseptique local pour traiter certaines infections de l'œil et de son pourtour telles que :
· inflammation de la membrane externe de l'œil (conjonctivite),
· inflammation de certaines parties de l'œil : la conjonctive et la cornée (kératoconjonctivite),
· inflammation localisée aux bords des paupières, souvent à la base des cils (blépharite),
· inflammation chronique des sacs lacrymaux (dacryocystite).
Ce médicament est également utilisé pour désinfecter les sacs conjonctivaux (l'espace entre les paupières et l'œil) avant une opération.
ZAMELINE est un collyre en solution sans conservateur.
Présentations
> 10 (2 x 5) récipient(s) multidose(s) polyéthylène basse densité (PEBD) suremballée(s)/surpochée(s) de 0,6 ml
Code CIP : 34009 302 572 1 0
Déclaration de commercialisation : 07/07/2025
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 04/07/2024
ZAMELINE 1 mg/mL, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Di-iséthionate d’hexamidine...................................................................................................... 1 mg
Equivalent à hexamidine ..................................................................................................... 0,58 mg
Pour 1 mL de solution.
Une goutte contient environ 0,020 mg d’hexamidine.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide, incolore.
pH : 5,7 - 7,0
Osmolalité : 260-310 mosmol/kg
4.1. Indications thérapeutiques
· pour le traitement des :
o Conjonctivites bactériennes purulentes dues à des germes sensibles (voir rubriques 4.4 et 5.1),
o Kérato-conjonctivites infectieuses dues à des germes sensibles (voir rubriques 4.4 et 5.1),
o Blépharites infectieuses dues à germes sensibles (voir rubriques 4.4 et 5.1),
o Infections chroniques des voies lacrymales causées par des germes sensibles (voir rubriques 4.4 et 5.1),
· comme antiseptique préopératoire des sacs conjonctivaux.
4.2. Posologie et mode d'administration
Le traitement recommandé est d’une goutte dans le sac conjonctival de l’œil ou des yeux affecté(s) 4 à 6 fois par jour.
La durée totale du traitement ne doit pas dépasser 8 jours (voir rubrique 4.4).
Population pédiatrique
La sécurité et l’efficacité du diisétionate d’hexamidine ophtalmique n’a pas été établie chez les enfants (voir rubrique 5.1).
Aucune donnée n’est disponible.
Mode d’administration
Voie ophtalmique. Ce médicament doit être appliqué dans le sac conjonctival.
En cas d’utilisation concomitante de plusieurs collyres, les instillations de chacun des collyres doivent être espacées d'au moins 15 minutes.
Ce médicament est une solution stérile qui ne contient pas de conservateur. Les patients doivent aussi être informés que les solutions ophtalmiques, incorrectement manipulées, peuvent être contaminées par des bactéries communes, connues pour entraîner des infections oculaires. L’usage de solutions contaminées peut provoquer des lésions importantes graves de l’œil et une perte de vision.
Il doit être demandé aux patients :
· d’éviter de mettre en contact l’extrémité du récipient multidose avec l'œil, les cils, les autres surfaces ou les doigts.
· de refermer le récipient multidose immédiatement après utilisation.
· Pour un récipient multidose de 0,6 mL : de jeter le récipient multidose au bout de 24 heures.
· Pour un récipient multidose de 10 mL : de jeter le récipient multidose au bout de 30 jours.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Eviter les traitements de longue durée ou fréquemment répétés en raison du risque d’apparition de souches résistantes. La durée totale du traitement ne doit pas dépasser 8 jours.
ZAMELINE n’est pas indiqué en cas d’infection oculaire causée par des bactéries Gram-négatives (par exemple Neisseria gonorrhoeae ou Pseudomonas aeruginosa) ou Chlamydia trachomatis.
En cas d’infection oculaire, le port de lentilles de contact est contre-indiqué pendant toute la durée du traitement.
Population pédiatrique
ZAMELINE ne doit pas être considéré comme un traitement prophylactique de la conjonctivite chez le nouveau-né.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
A ce jour, aucune interaction n'a été signalée.
A ce jour, aucune incompatibilité n'est connue avec le principe actif de ZAMELINE.
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucun effet pendant la grossesse n’est attendu, dans la mesure où l’exposition systémique à l’hexamidine est négligeable.
ZAMELINE peut être utilisé pendant la grossesse.
Aucun effet sur le nouveau-né/nourrisson allaité n'est attendu dans la mesure où l'exposition systémique de la femme qui allaite à l'hexamidine est négligeable.
ZAMELINE peut être utilisé pendant l'allaitement.
Fertilité
Il n'y a pas de données sur les effets potentiels de l'hexamidine sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
ZAMELINE n’affecte pas l’acuité visuelle, mais peut induire une vision trouble temporaire ou d’autres perturbations visuelles qui pourraient potentiellement affecter l’aptitude à conduire des véhicules ou à utiliser des machines. Si une vision trouble apparaît, le patient doit attendre jusqu’à ce que sa vision soit revenue à la normale avant de conduire des véhicules ou d’utiliser des machines.
Résumé du profil de sécurité :
L'hexamidine peut provoquer des réactions d'hypersensibilité.
Liste des effets indésirables :
Les événements indésirables sont classés selon les catégories de fréquence suivantes : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections du système immunitaire
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· Hypersensibilité.
Description de certains effets indésirables :
Des réactions d'hypersensibilité ont été rapportées avec l'hexamidine, y compris des réactions allergiques cutanées (telles que des dermatites).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Il est peu probable qu'un surdosage topique se produise après administration oculaire.
En cas de surdosage avec ZAMELINE (utilisation répétée excessive), les symptômes peuvent inclure une irritation oculaire. Un lavage oculaire avec du sérum physiologique est recommandé.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Autres anti-infectieux, code ATC : S01AX08
L'hexamidine, substance active de ZAMELINE est un antiseptique appartenant à la famille des diamidines. C'est un agent antimicrobien cationique présentant des propriétés tensioactives.
In vitro, l'activité de l'hexamidine s'exerce sur les bactéries Gram-positives (sans inhibition par le pus, le sérum et les débris organiques), ainsi que sur les deux formes (trophozoïtes et kystes) des amibes de type Acanthamoeba.
In vitro, la substance n'est pas active contre les bactéries Gram-négatives et Chlamydia trachomatis.
ZAMELINE est un collyre sans conservateur, en solution conditionné dans un récipient multidose.
Population pédiatrique
Un large spectre d’organismes pathogènes est associé à la conjonctivite bactérienne chez les adultes et les enfants. Les données de la littérature existantes montrent que, comme chez les adultes, les agents pathogènes les plus fréquemment associés à la conjonctivite bactérienne chez les enfants sont des bactéries Gram-positives (i.e, Staphylococci et Streptococci spp).
5.2. Propriétés pharmacocinétiques
Les paramètres pharmacocinétiques de l'hexamidine après application ophtalmique ne sont pas connus à ce jour.
Cependant, aucun effet systémique n'a été rapporté suite à l'application oculaire d'hexamidine
5.3. Données de sécurité préclinique
Les effets dans les études non cliniques (non conventionnelles) n'ont été observés qu'à des expositions considérées comme suffisamment supérieures à l'exposition humaine maximale, ce qui indique une faible pertinence pour l'utilisation clinique.
Acide borique, borax, chlorure de sodium, eau pour préparations injectables.
3 ans dans l'emballage extérieur.
Pour un récipient multidose de 0,6 mL :
Après la première ouverture du sachet : utiliser les récipients multidoses dans les 30 jours.
Après la première ouverture du récipient multidose : Utiliser le récipient multidose refermé dans les 24 heures après la première ouverture du récipient multidose.
Pour un récipient multidose de 10 mL :
Après la première ouverture du récipient multidose : Utiliser le récipient multidose dans les 30 jours après la première ouverture du récipient multidose.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25 °C.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Pour un récipient multidose de 0,6 mL :
5 récipients multidoses (PEBD) contenant 0,6 mL de collyre en solution conditionnés dans un sachet. (copolymères/aluminium/polyéthylène/papier ou PE/aluminium/polyéthylène/PET).
Un récipient multidose de 0,6 mL contient au moins 12 gouttes sans conservateur.
Pour un récipient multidose de 10 mL :
Un récipient multidose contenant 10 mL de collyre en solution conditionné dans un flacon (PE) muni d’un compte-gouttes et d’un bouchon avec une bague de sécurité intégrée.
Un récipient multidose de 10 mL contient environ 250 gouttes sans conservateur.
Une boîte contient 5 ou 10 (2x5) récipients multidoses de 0,6 mL ou un récipient multidose de 10 mL.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LABORATOIRES THEA
12, rue Louis Blériot
63017 Clermont-Ferrand Cedex 2
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· CIP : 34009 302 572 0 3 : 0,6 mL en récipient multidose (PEBD). Boîte de 5.
· CIP : 34009 302 572 1 0 : 0,6 mL en récipient multidose (PEBD). Boîte de 10.
· CIP : 34009 302 956 3 2 : 10 mL en récipient multidose (PE).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 04/07/2024
ZAMELINE 1 mg/mL, collyre en solution
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
1. Qu'est-ce que ZAMELINE 1 mg/mL, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ZAMELINE 1 mg/mL, collyre en solution ?
3. Comment utiliser ZAMELINE 1 mg/mL, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ZAMELINE 1 mg/mL, collyre en solution ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ZAMELINE 1 mg/mL, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Autres anti-infectieux - code ATC : S01AX08
ZAMELINE contient un antiseptique oculaire contre les bactéries et est utilisé comme un antiseptique local pour traiter certaines infections de l'œil et de son pourtour telles que :
· inflammation de la membrane externe de l'œil (conjonctivite),
· inflammation de certaines parties de l'œil : la conjonctive et la cornée (kératoconjonctivite),
· inflammation localisée aux bords des paupières, souvent à la base des cils (blépharite),
· inflammation chronique des sacs lacrymaux (dacryocystite).
Ce médicament est également utilisé pour désinfecter les sacs conjonctivaux (l'espace entre les paupières et l'œil) avant une opération.
ZAMELINE est un collyre en solution sans conservateur.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ZAMELINE 1 mg/mL, collyre en solution ?
N’utilisez jamais ZAMELINE 1 mg/mL, collyre en solution
· si vous êtes allergique à l’hexamidine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou votre pharmacien avant d’utiliser ce médicament.
Arrêtez le traitement et contactez votre médecin si :
· votre état ne s'améliore pas après 8 jours,
· de nouveaux symptômes apparaissent (rougeur, douleur oculaire ou vision trouble).
Si vous avez une infection oculaire, vous ne devez pas porter de lentilles de contact pendant la durée du traitement.
Enfants
Sans objet.
Autres médicaments et ZAMELINE 1 mg/mL, collyre en solution
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
ZAMELINE 1 mg/mL, collyre en solution avec des aliments et boissons
Sans objet.
ZAMELINE peut être utilisé pendant la grossesse ou l’allaitement.
Conduite de véhicules et utilisation de machines
ZAMELINE n'affecte pas l'acuité visuelle mais peut induire une vision trouble temporaire ou d'autres perturbations de la vue qui pourraient potentiellement affecter l’aptitude à conduire des véhicules ou à utiliser des machines. En cas de vision trouble, ne conduisez pas et n'utilisez pas de machines jusqu’à ce que votre vision soit revenue à la normale.
ZAMELINE 1 mg/mL, collyre en solution contient {nommer le/les excipient (s)}
Sans objet.
3. COMMENT UTILISER ZAMELINE 1 mg/mL, collyre en solution ?
La dose recommandée est d’une goutte dans le sac conjonctival (l'espace entre les paupières inférieures et l'œil) de l'œil (des yeux) à traiter 4 à 6 fois par jour.
Eviter les traitements de longue durée ou fréquemment répétés, car les bactéries peuvent devenir résistantes au produit. Pour cette raison, il est conseillé de ne pas dépasser 8 jours de traitement.
Utilisation chez les enfants
La sécurité et l’efficacité du collyre n’a pas été établie chez les enfants. Aucune donnée n’est disponible.
Mode et voie d’administration
Ce médicament doit être administré dans l’œil. Si vous utilisez ce médicament avec d’autres médicaments à usage oculaire, attendre au moins 15 minutes entre les instillations.
Ce médicament est un collyre en solution sans conservateur. Ne laissez pas l’embout du récipient multidose toucher l’œil ou les zones autour de l’œil. L’embout pourrait être contaminé et déclencher un risque d’infection oculaire. Pour éviter une éventuelle contamination du récipient multidose, tenez l’embout du récipient multidose éloigné de toutes surfaces.
Pour un récipient multidose de 0,6 mL]
Veuillez suivre les instructions suivantes lors de l’utilisation de ZAMELINE :
1.Se laver soigneusement les mains et asseyez-vous ou tenez-vous debout confortablement.
2. Ouvrir le sachet contenant 5 récipients multidoses. Notez la date de première ouverture sur le sachet.
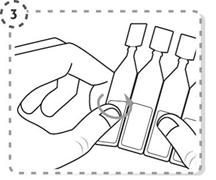
3. Détachez un récipient multidose de la barrette.
|
|
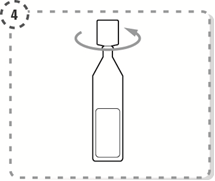
4. Ouvrez le haut du récipient multidose en le tournant comme indiqué. Ne touchez pas l'embout avec vos doigts après avoir ouvert le récipient.
|
|
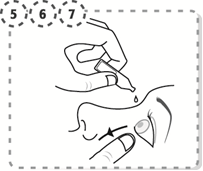
5. Utilisez votre doigt pour tirer doucement vers le bas la paupière inférieure de votre œil affecté.
6. Approcher l'extrémité du récipient multidose près de votre œil, de vos cils, d'autres surfaces sans les toucher et ne touchez pas l’embout du compte-gouttes avec vos doigts.
7. Pressez doucement le récipient multidose pour qu'une seule goutte pénètre dans votre œil, puis relâchez la paupière inférieure
|
|
8. Répétez l'opération dans l'autre œil si celui-ci est affecté.
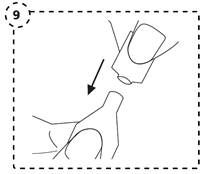
9. Après utilisation, fermez immédiatement le récipient multidose : repoussez fermement le bouchon sur le récipient multidose si tout le contenu n'a pas été utilisé. Chaque récipient multidose refermé peut être réutilisé pendant 24 heures au maximum.
|
|
10. Jetez le récipient multidose au bout de 24 heures ou lorsqu'il est vide.
[Pour un récipient multidose de 10 mL]
Veuillez suivre les instructions suivantes lors de l’utilisation de ZAMELINE :
1. Lavez-vous les mains et asseyez-vous ou installez-vous confortablement.
2. Dévissez le bouchon pour ouvrir le flacon multidose. Ne touchez pas l’embout avec vos doigts après ouverture.
3. Inclinez votre tête vers l’arrière et avec votre doigt tirez légèrement la paupière inférieure de l’œil à traiter vers le bas.
4. Placer l’embout du récipient multidose à proximité de votre oeil, mais le compte-goutte ne doit pas toucher votre œil, vos cils, d'autres surfaces ou vos doigts.
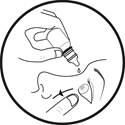 5. Pressez légèrement le récipient multidose afin de faire tomber une goutte dans votre œil, puis relâchez la paupière inférieure.
5. Pressez légèrement le récipient multidose afin de faire tomber une goutte dans votre œil, puis relâchez la paupière inférieure.
6. Répétez cette procédure dans l’autre œil s’il est atteint.
7. Après utilisation, fermez le récipient multidose en revissant le bouchon
8. Jetez le récipient multidose après 30 jours d’utilisation.
Si vous avez utilisé plus de ZAMELINE 1 mg/mL, collyre en solution que vous n’auriez dû
Rincer l'œil avec du sérum physiologique si vous avez appliqué trop de produit sur votre œil.
Si vous oubliez d’utiliser ZAMELINE 1 mg/mL, collyre en solution
N’utilisez pas de dose double pour compenser la dose que vous avez oublié d’utiliser.
Si vous arrêtez d’utiliser ZAMELINE 1 mg/mL, collyre en solution
Utilisez ce médicament exactement comme décrit dans cette notice. Vous devez informer votre médecin si vous ne vous sentez pas mieux ou si vous vous sentez moins bien.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets secondaires suivants peuvent apparaitre :
Fréquence indéterminée : la fréquence ne peut être estimée à partir des données disponibles
· Réaction allergique locale (rougeur de l'œil, gonflement et rougeur des paupières, démangeaisons).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ZAMELINE 1 mg/mL, collyre en solution ?
Tenir ce médicament hors de la vue et de la portée des enfants.
[Pour un récipient multidose de 0,6 mL] N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte, le sachet et le récipient multidose. La date de péremption fait référence au dernier jour de ce mois.
[Pour un récipient multidose de 10 mL] N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et le récipient multidose. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25 ºC.
[Pour un récipient multidose de 0,6 mL]
Avant la première ouverture du sachet : utiliser les récipients multidoses non ouverts dans les 30 jours. Notez la date de première ouverture sur le sachet.
Après la première ouverture du récipient multidose : utiliser le récipient multidose refermé dans les 24 heures après la première ouverture du récipient multidose.
Pour un récipient multidose de 10 mL] Après la première ouverture du récipient multidose : Utiliser le récipient multidose dans les 30 jours après la première ouverture du récipient multidose.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ZAMELINE 1 mg/mL, collyre en solution
· La substance active est :
Di-iséthionate d’hexamidine................................................................................................ 1 mg
Pour 1 mL de solution.
· Les autres composants sont :
Acide borique, borax, chlorure de sodium, eau pour préparations injectables.
Qu’est-ce que ZAMELINE 1 mg/mL, collyre en solution et contenu de l’emballage extérieur
[Pour un récipient multidose de 0,6 mL] Ce médicament se présente sous la forme d'un collyre en solution. La solution est limpide et incolore, présentée dans des récipients multidoses conditionnés en sachet de 5 unités, chaque récipient multidose contenant 0,6 mL de produit.
Un récipient multidose de 0,6 mL contient au moins 12 gouttes sans conservateur.
[Pour un récipient multidose de 10 mL] Ce médicament se présente sous la forme d'un collyre en solution. La solution est limpide et incolore, présentée dans un récipient multidose de 10 mL.
Un récipient multidose de 10 mL contient environ 250 gouttes sans conservateur
Une boîte contient 5 ou 10 (2x5) récipients multidoses de 0,6 mL ou un récipient multidose de 10 mL.
Toutes les présentations peuvent ne pas être commercialisées
Titulaire de l’autorisation de mise sur le marché
LABORATOIRES THEA
12 RUE LOUIS BLERIOT
63017 CLERMONT-FERRAND CEDEX
FRANCE
Exploitant de l’autorisation de mise sur le marché
37 rue georges besse
63100 CLERMONT-FERRAND
[Pour un récipient multidose de 0,6 mL]
LABORATOIRES UNITHER
1 RUE DE L’ARQUERIE
50200 COUTANCES
OU
LABORATOIRES THEA
12 RUE LOUIS BLERIOT
63017 CLERMONT-FERRAND CEDEX 2
[Pour un récipient multidose de 10 mL]
Laboratoires THEA
12 rue Louis Blériot
63017 Clermont-Ferrand Cedex 2
France
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseils d’éducation sanitaire en cas d’infection oculaire
Vous devez consulter un médecin si vous ne vous sentez pas mieux ou si vous vous sentez plus mal.
Comme votre infection oculaire est contagieuse, vous devez prendre les mesures simples suivantes pour éviter qu'elle ne se propage à l'autre œil ou à une personne de votre entourage :
· Lavez-vous régulièrement les mains avec de l'eau chaude savonneuse.
· Ne vous frottez pas les yeux
· Laver les oreillers et les gants de toilette à l'eau chaude et au détergent.
· Ne partagez pas les serviettes et les oreillers