Dernière mise à jour le 08/01/2026
CEZIBOE 0,25 mg, solution injectable en seringue pré-remplie
Indications thérapeutiques
Classe pharmacothérapeutique : Antagonistes de la GnRH, code ATC : H01CC02.
Qu’est ce CEZIBOE
CEZIBOE contient un médicament appelé « cétrorélix ». Ce médicament empêche la libération d’un ovule par vos ovaires (ovulation) pendant votre cycle menstruel. CEZIBOE fait partie d’une classe de médicaments appelée « antagonistes de la GnRH ».
Dans quels cas CEZIBOE est-il utilisé
CEZIBOEest l’un des médicaments utilisés dans le cadre de « l’assistance médicale à la procréation » afin de vous aider à devenir enceinte. Il empêche la libération prématurée des ovules, car si les ovules sont libérés trop tôt (ovulation prématurée), il est alors possible que votre médecin ne puisse pas les prélever.
Comment CEZIBOE agit-il ?
CEZIBOE bloque une hormone naturelle présente dans votre corps appelée LH-RH (« hormone de libération de l’hormone lutéinisante »).
· La LH-RH contrôle une autre hormone, appelée LH (« hormone lutéinisante »).
· La LH stimule l’ovulation au cours de votre cycle menstruel.
Cela signifie que CEZIBOE interrompt la série de processus conduisant à la libération d’un ovule par vos ovaires. Lorsque vos ovules sont prêts à être prélevés, un autre médicament vous sera prescrit pour déclencher leur libération (induction de l’ovulation).
Présentations
> 1 seringue(s) préremplie(s) en verre de 1 ml
Code CIP : 34009 302 195 0 8
Déclaration de commercialisation : 23/02/2024
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 30,82 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 31,84 €
- Taux de remboursement :100 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 20/07/2022 | Inscription (CT) | Le service médical rendu par CEZIBOE 0,25 mg (cétrorélix) est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 20/07/2022 | Inscription (CT) | CEZIBOE (cétrorélix) est un hybride qui n’apporte pas d’amélioration du service médical ren-du (ASMR V) par rapport au médicament de référence. |
Autres informations
- Titulaire de l'autorisation : SUN PHARMACEUTICAL INDUSTRIES EUROPE BV
- Conditions de prescription et de délivrance :
- liste I
- médicament nécessitant une surveillance particulière pendant le traitement
- prescription réservée aux spécialistes et services ENDOCRINOLOGIE
- prescription réservée aux spécialistes et services GYNECOLOGIE
- prescription réservée aux spécialistes et services MALADIES METABOLIQUES
- prescription réservée aux spécialistes et services OBSTETRIQUE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 566 939 8
ANSM - Mis à jour le : 02/11/2023
CEZIBOE 0,25 mg solution injectable en seringue pré-remplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque flacon de 1 ml solution contient 0,25 mg de cétrorélix (sous forme d’acétate).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en seringue pré-remplie
Solution claire et incolore, exempte de particules visibles avec un pH de 4,0 à 6,0.
4.1. Indications thérapeutiques
Dans les études cliniques, cétrorélix a été associé à la gonadotrophine de femme ménopausée (HMG). Cependant, l’expérience plus réduite acquise avec l’hormone folliculo-stimulante (FSH) recombinante suggère une efficacité équivalente
4.2. Posologie et mode d'administration
Cétrorélix ne sera prescrit que par un spécialiste de l’indication concernée.
La première injection de cétrorélix doit être réalisée sous la surveillance d’un médecin et dans des conditions où d’éventuelles réactions allergiques/pseudo-allergiques (y compris des réactions anaphylactiques mettant en jeu le pronostic vital) peuvent être prises en charge immédiatement. La patiente pourra pratiquer elle-même les injections suivantes, à condition qu’elle soit informée des signes et symptômes pouvant révéler une hypersensibilité, des conséquences d’une telle réaction et de la nécessité d’une intervention médicale immédiate.
Le contenu d’un flacon (0,25 mg de cétrorélix) sera administré une fois par jour, à intervalles de 24 heures, soit le matin, soit le soir. Après la première administration, il est recommandé que la patiente reste sous surveillance médicale pendant 30 minutes pour s’assurer qu’il n’y a pas de réaction allergique/pseudo-allergique à l’injection.
Population âgée
Il n’existe pas d’utilisation justifiée de cétrorélix dans la population âgée
Population pédiatrique
Il n’existe pas d’utilisation justifiée de cétrorélix dans la population pédiatrique.
Mode d’administration
Cétrorélix est administré par injection sous-cutanée dans la paroi abdominale inférieure.
Les réactions au site d’injection peuvent être réduites en choisissant des sites d’injection différents pour espacer les injections consécutives sur un même site et en injectant le médicament lentement pour faciliter l’absorption progressive du médicament.
Administration le matin
Le traitement par cétrorélix doit commencer le 5ème ou le 6ème jour de la stimulation ovarienne par les gonadotrophines urinaires ou recombinantes (environ 96 à 120 heures après le début de la stimulation ovarienne), et doit se poursuivre pendant toute la période de traitement par les gonadotrophines, y compris le jour de l’induction de l’ovulation.
Le jour d’initiation du traitement par cétrorélix est déterminé en fonction de la réponse ovarienne, c’est-à-dire du nombre et de la taille des follicules en croissance et/ou du taux d’estradiol circulant. Le début du traitement par cétrorélix peut être retardé en l’absence de croissance folliculaire, bien que l’expérience clinique soit basée sur un début de traitement par cétrorélix au 5ème ou au 6ème jour de la stimulation.
Administration le soir
Le traitement par cétrorélix doit commencer le 5ème jour de la stimulation ovarienne par les gonadotrophines urinaires ou recombinantes (environ 96 à 108 heures après le début de la stimulation ovarienne), et doit se poursuivre pendant toute la période de traitement par les gonadotrophines jusqu’au soir précédant le jour de l’induction de l’ovulation.
Le jour d’initiation du traitement par cétrorélix est déterminé en fonction de la réponse ovarienne, c’est-à-dire du nombre et de la taille des follicules en croissance et/ou du taux d’estradiol circulant. Le début du traitement par cétrorélix peut être retardé en l’absence de croissance folliculaire, bien que l’expérience clinique soit basée sur un début de traitement par cétrorélix au 5ème ou au 6ème jour de la stimulation.
Le cétrorélix ne doit pas être utilisé dans les situations indiquées ci-dessous :
· hypersensibilité à la substance active ou à tout autre analogue structural de la gonadotropin- releasing hormone (GnRH), aux hormones peptidiques exogènes ou à l’un des excipients mentionnés à la rubrique 6.1
· pendant la grossesse et l’allaitement
· patientes présentant une insuffisance rénale sévère.
4.4. Mises en garde spéciales et précautions d'emploi
Des cas de réactions allergiques/pseudo-allergiques, y compris des réactions anaphylactiques mettant en jeu le pronostic vital, ont été signalés lors de l’administration de la première dose (voir rubrique 4.8).
Des précautions particulières seront prises chez les femmes présentant des signes et symptômes d’allergie active ou ayant un terrain allergique connu. Le traitement par cétrorélix n’est pas recommandé chez les femmes ayant des épisodes allergiques graves.
Syndrome d’hyperstimulation ovarienne (SHO)
Un syndrome d’hyperstimulation ovarienne peut survenir pendant ou à la suite d’une stimulation ovarienne. Cette éventualité doit être considérée comme un risque intrinsèque du processus de stimulation par les gonadotrophines.
Un SHO doit être traité de manière symptomatique, par exemple : repos, injection intraveineuse d’électrolytes/colloïdes, héparine.
Un traitement de soutien de la phase lutéale sera instauré en fonction des pratiques habituelles du centre.
Protocole de stimulation ovarienne répété
À l’heure actuelle, l’expérience acquise sur le cétrorélix au cours de protocole de stimulation ovarienne répété est limitée. Par conséquent, l’utilisation du cétrorélix sur plusieurs cycles ne doit intervenir qu’après une évaluation attentive du rapport bénéfice/risque.
Anomalies congénitales
La prévalence des anomalies congénitales après le recours aux techniques de reproduction assistée, avec ou sans antagonistes de la GnRH, peut être légèrement plus élevée qu’après une conception spontanée, bien que l’on ne sache pas clairement si cela est lié à des facteurs inhérents à l’infertilité du couple ou aux procédures de reproduction assistée. D’après des données limitées issues d’études de suivi clinique menées chez 316 nouveau-nés dont la mère avait reçu le cétrorélix pour traiter l’infertilité, le cétrorélix n’augmente pas le risque d’anomalies congénitales chez la descendance.
Insuffisance hépatique
Le cétrorélix n’a pas été étudié chez des patientes présentant une insuffisance hépatique. La prudence s’impose donc dans ce cas.
Insuffisance rénale
Le cétrorélix n’a pas été étudié chez des patientes présentant une insuffisance rénale. La prudence s’impose donc dans ce cas.
Le cétrorélix est contre-indiqué chez les patientes présentant une insuffisance rénale sévère (voir rubrique 4.3).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction médicamenteuse n’a été formellement réalisée avec le cétrorélix. Les études in vitro ont montré qu’il est peu probable d’observer des interactions avec les médicaments métabolisés par le cytochrome P-450 ou subissant une conjugaison ou une glucuroconjugaison. Cependant, l’éventualité d’interactions avec les gonadotrophines ou les médicaments histamino-libérateurs chez les individus sensibles ne peut être totalement exclue.
4.6. Fertilité, grossesse et allaitement
Grossesse
Cétrorélix n’est pas destiné à être utilisé pendant la grossesse et l’allaitement (voir rubrique 4.3).
Fertilité
Les études réalisées chez l’animal ont montré que le cétrorélix exerce une influence dose-dépendante sur la fertilité, les performances de reproduction et la grossesse. Aucun effet tératogène n’a été observé lorsque le médicament est administré pendant la phase sensible de la gestation.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment rapportés sont des réactions localisées au site d’injection telles qu’érythème, réaction œdémateuse et démangeaisons, et sont généralement légères et transitoires. Dans les études cliniques, leur fréquence était de 9,4 % après injections multiples de cétrorélix 0,25 mg.
Le SHO d’intensité légère à modérée (OMS– grade I ou II) a été fréquemment rapporté et doit être considéré comme un risque intrinsèque du processus de stimulation. En revanche, les cas de SHO sévère restent peu fréquents.
Des cas peu fréquents de réactions d’hypersensibilité, y compris de réactions pseudo- allergiques/anaphylactiques, ont été rapportés.
Liste des effets indésirables
Les effets indésirables rapportés ci-dessous sont classés en fonction de leur fréquence comme suit : très fréquent (≥1/10), fréquent (≥1/100, <1/10), peu fréquent (≥1/1 000, <1/100), rare (≥1/10 000, <1/1 000), très rare (<1/10 000).
|
MedDRA des classes de systèmes d’organes |
Fréquent |
Peu fréquent |
|
Affections du système immunitaire |
|
Réactions allergiques généralisées/pseudo-allergiques, y compris réactions anaphylactiques mettant en jeu le pronostic vital |
|
Affections du système nerveux |
|
Maux de tête |
|
Affections gastro-intestinales |
|
Nausées |
|
Affections des organes de reproduction et du sein |
Un SHO d’intensité légère à modérée (OMS – grade I ou II), risque intrinsèque du processus de stimulation, peut survenir (voir rubrique 4.4). |
SHO sévère (OMS – grade III). |
|
Troubles généraux et anomalies au site d’administration |
Réactions au site d’injection (telles que érythème, réaction œdémateuse et démangeaisons). |
|
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Un surdosage peut avoir pour conséquence une augmentation de la durée d’action, mais il est peu probable qu’il soit accompagné d’effets toxiques aigus.
Dans le cadre d’études de toxicité aiguë réalisées chez le rongeur, des symptômes de toxicité non spécifiques ont été observés suite à l’administration intrapéritonéale de doses de cétrorélix plus de 200 fois supérieures à la dose pharmacologique efficace par voie sous-cutanée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Antagonistes de la GnRH, code ATC : H01CC02.
Mécanisme d’action
Le cétrorélix est un antagoniste du facteur de libération de l’hormone lutéinisante (LH-RH). La LH- RH se lie aux récepteurs membranaires des cellules hypophysaires. Le cétrorélix entre en compétition avec la LH-RH endogène au niveau de ses récepteurs. Grâce à ce mode d’action, le cétrorélix contrôle la sécrétion des gonadotrophines (LH et FSH).
Le cétrorélix inhibe de façon dose-dépendante la sécrétion de la LH et de la FSH par l’hypophyse. La suppression se produit pratiquement immédiatement et se maintient pendant la poursuite du traitement, sans effet stimulant initial.
Efficacité et sécurité clinique
Chez la femme, le cétrorélix retarde le pic de LH et par conséquent l’ovulation. Chez les femmes subissant un traitement de stimulation ovarienne, la durée d’action du cétrorélix est dose-dépendante. A la dose de 0,25 mg par injection, des injections répétées toutes les 24 heures maintiennent l’effet du cétrorélix.
Chez l’animal comme chez l’homme, les effets hormonaux antagonistes du cétrorélix sont complètement réversibles à l’arrêt du traitement.
5.2. Propriétés pharmacocinétiques
Après administration sous-cutanée, la biodisponibilité absolue du cétrorélix est d’environ 85 %.
Distribution
Le volume de distribution (Vd) est de 1,1 l × kg-1.
Élimination
La clairance plasmatique totale et la clairance rénale sont respectivement de 1,2 ml x min-1 x kg-1 et de 0,1 ml x min-1 x kg-1.
Les demi-vies terminales moyennes après l’administration intraveineuse et sous-cutanée sont respectivement d’environ 12 heures et 30 heures, démontrant l’impact du processus de résorption au site d’injection.
Linéarité
L’administration sous-cutanée de doses uniques (de 0,25 mg à 3 mg de cétrorélix) ainsi que des administrations journalières pendant 14 jours font apparaître une cinétique linéaire.
5.3. Données de sécurité préclinique
Les études de toxicité aiguë, subaiguë et chronique réalisées chez le rat et le chien par voie sous- cutanée n’ont mis en évidence aucun organe cible. Aucun signe d’irritation locale ou d’intolérance en relation avec le médicament n’a été observé chez le chien suite à l’injection intraveineuse, intra- artérielle et paraveineuse de doses de cétrorélix nettement supérieures à celles qui sont prévues en clinique.
Le cétrorélix n’a montré aucun potentiel mutagène ou clastogène lors des essais de mutation génique ou chromosomique.
Acide lactique (-S)
Eau pour préparations injectables.
2 ans
6.4. Précautions particulières de conservation
À conserver au réfrigérateur (entre 2°C et 8°C).
Avant ouverture, le médicament peut être conservé dans l’emballage d’origine à température ambiante (ne dépassant pas 25°C) pendant un maximum de trois mois.
6.5. Nature et contenu de l'emballage extérieur
La présentation en seringue préremplie comporte :
1 cylindre en verre transparent de type I (1 ml) avec aiguille 27 gauge de ½ pouce prémontée, fermé par un bouchon-piston en élastomère (bromobutyle). La seringue comporte une tige de piston blanc et un système de sécurité automatique.
1 seringue préremplie assemblée avec dispositif de sécurité est conditionnée dans 1 emballage blister. 1 emballage blister avec 1 tampon imbibé d’alcool sera conditionné dans une boîte en carton.
Conditionnement multiple contenant 7 seringues préremplies assemblées avec dispositifs de sécurité sont conditionnées dans 7 emballages blisters. 7 emballages blisters avec 7 tampons imbibés d’alcool sont conditionnés séparément dans 7 boîtes en carton et placés ensemble dans le conditionnement multiple.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Ce produit doit être ramené à température ambiante avant injection. Il doit être sorti du réfrigérateur 30 minutes environ avant utilisation.
L’injection sous-cutanée est administrée de la même manière qu’avec une seringue classique. Pour les seringues munies d'un système de sécurité, l'aiguille doit être orientée loin de l'utilisateur et de toute autre personne présente. Le système de sécurité est activé en appuyant fermement sur la tige du piston. Le manchon protecteur couvrira automatiquement l'aiguille et produira un clic audible qui confirmera l'activation du dispositif. La seringue doit être éliminée immédiatement, en la jetant dans le collecteur d’aiguilles le plus proche (l'aiguille dedans). Le couvercle du récipient doit être fermé hermétiquement et le contenant placé hors de la portée des enfants.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation locale en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Sun Pharmaceutical Industries Europe B.V.
Polarisavenue 87
2132 JH Hoofddorp
Pays-Bas
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 195 0 8 : 1 mL en seringue pré-remplie (verre). Boîte de 1.
· 34009 302 195 1 5 : 1 mL en seringue pré-remplie (verre). Boîte de 7.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament nécessitant une surveillance particulière pendant le traitement
Médicament soumis à une prescription réservée aux spécialistes en gynécologie et/ou en gynécologie-obstétrique et/ou en endocrinologie et métabolisme.
ANSM - Mis à jour le : 02/11/2023
CEZIBOE 0,25 mg solution injectable en seringue pré-remplie
cétrorélix (sous forme d’acétate)
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que CEZIBOE 0,25 mg solution injectable en seringue pré-remplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser CEZIBOE 0,25 mg solution injectable en seringue pré-remplie ?
3. Comment utiliser CEZIBOE 0,25 mg solution injectable en seringue pré-remplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CEZIBOE 0,25 mg solution injectable en seringue pré-remplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CEZIBOE 0,25 mg solution injectable en seringue pré-remplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Antagonistes de la GnRH, code ATC : H01CC02.
Qu’est ce CEZIBOE
CEZIBOE contient un médicament appelé « cétrorélix ». Ce médicament empêche la libération d’un ovule par vos ovaires (ovulation) pendant votre cycle menstruel. CEZIBOE fait partie d’une classe de médicaments appelée « antagonistes de la GnRH ».
Dans quels cas CEZIBOE est-il utilisé
CEZIBOEest l’un des médicaments utilisés dans le cadre de « l’assistance médicale à la procréation » afin de vous aider à devenir enceinte. Il empêche la libération prématurée des ovules, car si les ovules sont libérés trop tôt (ovulation prématurée), il est alors possible que votre médecin ne puisse pas les prélever.
Comment CEZIBOE agit-il ?
CEZIBOE bloque une hormone naturelle présente dans votre corps appelée LH-RH (« hormone de libération de l’hormone lutéinisante »).
· La LH-RH contrôle une autre hormone, appelée LH (« hormone lutéinisante »).
· La LH stimule l’ovulation au cours de votre cycle menstruel.
Cela signifie que CEZIBOE interrompt la série de processus conduisant à la libération d’un ovule par vos ovaires. Lorsque vos ovules sont prêts à être prélevés, un autre médicament vous sera prescrit pour déclencher leur libération (induction de l’ovulation).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER CEZIBOE 0,25 mg solution injectable en seringue pré-remplie ?
N’utilisez jamais CEZIBOE
· si vous êtes allergique au cétrorélix ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous êtes allergique aux médicaments similaires à CEZIBOE (toute autre hormone peptidique)
· si vous êtes enceinte ou si vous allaitez
· si vous souffrez de troubles graves des reins
N’utilisez pas CEZIBOE si l’un des cas ci-dessus vous concerne. En cas de doute, parlez-en à votre médecin avant d’utiliser ce médicament.
Avertissements et précautions
Allergies
Avant d’utiliser CEZIBOE, signalez à votre médecin toute allergie active ou tout terrain allergique connu.
Syndrome d’hyperstimulation ovarienne (SHO)
CEZIBOE est utilisé en association avec d’autres médicaments qui stimulent vos ovaires afin que ceux- ci produisent un plus grand nombre d’ovules prêts à être libérés. Lorsque vous prenez ce médicament, ou par la suite, il est possible que vous développiez un SHO. Cela se produit lorsque vos follicules se développent de manière excessive et se transforment en gros kystes.
Pour connaître les signes éventuels à surveiller et ce qu’il faut faire si cela vous arrive, voir rubrique 4 « Quels sont les effets indésirables éventuels ».
Utilisation de CEZIBOE pendant plus d’un cycle
L’expérience acquise lors de l’utilisation de CEZIBOE pendant plus d’un cycle est limitée. S’il est nécessaire que vous utilisiez du CEZIBOE pendant plus d’un cycle, votre médecin examinera de façon approfondie les avantages et les risques qui s’appliquent à votre cas.
Troubles hépatiques
Avant d’utiliser CEZIBOE, signalez à votre médecin toute maladie du foie. CEZIBOE n’a pas été étudié chez les patientes atteintes d’une maladie du foie.
Troubles rénaux
Avant d’utiliser CEZIBOE, signalez à votre médecin toute maladie des reins. CEZIBOE n’a pas été étudié chez les patientes atteintes d’une maladie des reins.
Enfants et adolescents
L’utilisation de CEZIBOE n’est pas indiquée chez les enfants et les adolescentes.
Autres médicaments et CEZIBOE
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
CEZIBOE avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
N’utilisez pas CEZIBOE si vous êtes enceinte, si vous pensez être enceinte, ou si vous allaitez.
Conduite de véhicules et utilisation de machines
Il est peu probable que CEZIBOE agisse sur votre aptitude à conduire des véhicules et à utiliser des machines.
3. COMMENT UTILISER CEZIBOE 0,25 mg solution injectable en seringue pré-remplie?
Ce médicament s’administre uniquement par injection sous la peau (sous-cutanée) de votre ventre. Afin de réduire l’irritation cutanée, changez chaque jour de point d’injection sur votre ventre.
· Votre médecin doit surveiller votre première injection. Votre médecin ou votre infirmier/ère vous montrera comment préparer et injecter le médicament.
· Vous pourrez ensuite réaliser vous-même les injections, dans la mesure où votre médecin vous a alertée des signes révélateurs d’une allergie et des conséquences potentiellement graves ou fatales nécessitant un traitement immédiat (voir rubrique 4 « Quels sont les effets indésirables éventuels »).
· Veuillez lire et suivre attentivement les instructions figurant à la fin de cette notice intitulées « Comment injecter CEZIBOE».
· Vous commencerez par prendre un autre médicament le 1er jour de votre cycle de traitement.
· Vous prendrez ensuite CEZIBOE quelques jours plus tard. (Voir la rubrique suivante « Quelle quantité utiliser ».)
Quelle quantité utiliser
Injectez le contenu d’une seringue (0,25 mg de CEZIBOE) une fois par jour, tous les jours. Il est préférable de s’administrer le médicament chaque jour à la même heure, en espaçant chaque dose de 24 heures.
Vous pouvez choisir de vous faire l’injection chaque matin ou bien chaque soir.
· Si vous faites l’injection chaque matin : commencez vos injections le 5e ou le 6e jour du cycle de traitement. En fonction de votre réponse ovarienne, votre médecin pourra décider que le traitement doit être débuté un autre jour. Votre médecin vous indiquera la date et l’heure précises. Vous continuerez à vous injecter ce médicament jusqu’au matin (inclus) du jour où vos ovules seront prélevés (induction de l’ovulation).
OU
· Si vous faites l’injection chaque soir : commencez vos injections le 5e jour du cycle de traitement. En fonction de votre réponse ovarienne, votre médecin pourra décider que le traitement doit être débuté un autre jour. Votre médecin vous indiquera la date et l’heure précises. Vous continuerez à vous injecter ce médicament jusqu’au soir (inclus) précédant le jour où vos ovules seront prélevés (induction de l’ovulation).
Si vous avez utilisé plus de CEZIBOE que vous n’auriez dû
Si vous injectez accidentellement plus de médicament que vous n’auriez dû, aucun effet négatif n’est attendu. L’effet du médicament durera plus longtemps. Aucune mesure spécifique n’est habituellement nécessaire.
Si vous oubliez d’utiliser CEZIBOE
· Si vous oubliez une dose, injectez-la dès que vous y pensez et signalez-le à votre médecin.
· Ne vous injectez pas de dose double pour compenser la dose que vous avez oublié d’injecter.
Si vous arrêtez d’utiliser CEZIBOE
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Réactions allergiques
· Rougeurs, chaleur cutanée, démangeaisons (souvent à l’aine ou au niveau des aisselles), plaques rouges saillantes avec démangeaisons (urticaire), écoulement nasal, pouls rapide ou irrégulier, gonflement de la langue et de la gorge, éternuements, respiration sifflante ou importantes difficultés à respirer, ou vertiges. De tels symptômes peuvent indiquer que vous présentez une réaction allergique au médicament pouvant être grave ou fatale. Ces réactions sont peu fréquentes (peuvent concerner jusqu’à 1 femme sur 100).
Si vous ressentez l’un des effets indésirables mentionnés ci-dessus, cessez d’utiliser CEZIBOE et contactez votre médecin immédiatement.
Syndrome d’hyperstimulation ovarienne (SHO)
Ce syndrome peut survenir en raison de la prise d’autres médicaments que vous utilisez pour stimuler vos ovaires.
· Une douleur dans le bas-ventre avec des nausées ou des vomissements peuvent être les signes d’un SHO. Cela peut indiquer une réaction excessive des ovaires au traitement et l'apparition de gros kystes ovariens. Il s’agit d’un effet indésirable fréquent (peut concerner jusqu’à 1 femme sur 10).
· Le SHO peut devenir sévère avec une nette augmentation du volume des ovaires, une diminution de la production d’urine, une prise de poids, des difficultés respiratoires ou la présence de liquide dans l’estomac ou la poitrine. Cet effet indésirable est peu fréquent (peut concerner jusqu’à 1 femme sur 100).
Si vous ressentez l’un des effets indésirables mentionnés ci-dessus, contactez votre médecin immédiatement.
Autres effets indésirables
Fréquent (peut toucher jusqu’à 1 femme sur 10) :
· une irritation cutanée légère et transitoire au point d’injection, telle que rougeur, démangeaisons ou gonflement, peut survenir.
Peu fréquent (peut toucher jusqu’à 1 femme sur 100) :
· mal au cœur (nausées)
· maux de tête.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin,votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CEZIBOE 0,25 mg solution injectable en seringue pré-remplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la seringue pré remplie après EXP. La date de péremption fait référence au dernier jour de ce mois.
À conserver au réfrigérateur (entre 2°C et 8°C).
Avant ouverture, le produit peut être conservé dans l’emballage d’origine à température ambiante (ne dépassant pas 25°C) pendant un maximum de trois mois.
N’utilisez pas la solution dans la seringue si elle n’est pas incolore et limpide ou s’il y a des particules à l’intérieur.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est : le cétrorélix (sous forme d’acétate). Chaque seringue pré-remplie (1 mL) contient 0,25 mg de cétrorélix (sous forme d’acétate).
· Les autres composants sont : mannitol (E421), acide lactique (-S) et l’eau pour préparations injectables.
Qu’est-ce que CEZIBOE et contenu de l’emballage extérieur
CEZIBOE se présente sous forme d’une solution claire et incolore dans une 1 cylindre en verre transparent de type I (1 ml) avec aiguille 27 gauge de ½ pouce prémontée, fermé par un bouchon-piston en élastomère (bromobutyle). La seringue pré-remplie comporte une tige de piston blanc et un système de sécurité automatique.
Il est disponible en une boîte contenant 1 seringue pré-remplie et en conditionnement multiple comprenant 7 boîtes, chacune contenant 1 seringue pré-remplie
.
Une boîte contient également pour chaque seringue :
· une seringue préremplie assemblée avec un dispositif de sécurité contenant la solution
· un tampon imbibé d’alcool pour désinfecter.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
Sun Pharmaceutical Industries Europe B.V.
Polarisavenue 87
2132 JH Hoofddorp
Pays-Bas
Exploitant de l’autorisation de mise sur le marché
SUN PHARMA France
31 rue des Poissonniers
92200 NEUILLY SUR SEINE
Sun Pharmaceutical Industries Europe B.V.
Polarisavenue 87
2132 JH Hoofddorp
Pays-Bas
OU
TERAPIA SA
STR. FABRICII NR. 124
400 632 CLUJ NAPOCA
ROUMANIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
[dans le cas des MRP et DCP]
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
COMMENT INJECTER CEZIBOE SUN
La seringue pré-remplie de CEZIBOE SUN contient :
1. Protège-aiguille rigide
2. Piston
3. Prise en main
4. Dispositif de sécurité
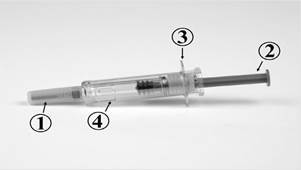
Seringue avant utilisation :
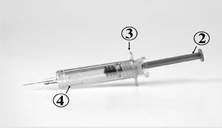
Seringue après utilisation :
Cette rubrique vous explique comment injecter votre médicament.
· Veuillez lire attentivement l'intégralité de cette notice avant d’utiliser le médicament.
· Ce médicament vous a été personnellement prescrit. Ne laissez jamais quelqu’un d’autre l’utiliser.
· N’utilisez chaque aiguille et seringue qu’une seule fois.
Avant toute utilisation
1. Ce produit doit être à température ambiante avant injection. Le sortir du réfrigérateur 30 minutes environ avant utilisation.
2. Lavez-vous les mains.
Il est important que vos mains et les objets que vous utilisez soient aussi propres que possible.
3. Préparez tout ce dont vous avez besoin sur une surface propre :
· une seringue préremplie
· un tampon imbibé d’alcool.
Préparation du site d’injection et injection de votre médicament
1. Nettoyez le site d’injection.
· Asseyez-vous ou couchez-vous dans une position confortable. Choisissez un site d’injection sur la paroi abdominale inférieure, de préférence autour du nombril (Figure A). Afin de réduire l’irritation cutanée, changez quotidiennement le site d’injection sur la paroi abdominale. Désinfectez la peau au point d’injection avec un tampon imbibé d’alcool.
· Retirez le protège-aiguille en le tirant dans l’axe de la seringue (Figure B). Jetez le protège-aiguille. Pour prévenir tout risque d’infection, ne touchez pas l’aiguille et évitez tout contact entre l’aiguille et une quelconque surface avant l’injection. La présence d’une petite bulle d’air dans la seringue est normale. Afin d’éviter toute perte de médicament, n’essayez pas de chasser les bulles d’air de la seringue avant d’administrer l’injection.
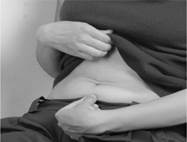

Figure A Figure B
2. Pincez doucement la peau qui a été désinfectée pour faire un pli. Tenez le pli entre le pouce et l’index d’une main pendant toute la durée de l’injection (Figure C).

Figure C
3. Tenez la seringue d’une main, comme si vous teniez un crayon.
Pincez doucement la peau autour de la zone du site d’injection et maintenez-la fermement dans cette position avec l’autre main.
Enfoncez l’aiguille lentement et entièrement dans la peau à un angle de 45 à 90°, puis relâchez la peau.
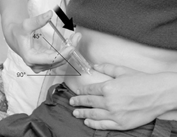
Figure D
4. Retirez doucement le piston de la seringue. Si du sang apparaît, suivez l’étape 5 ci-dessous.
S’il n’y a pas de sang, appuyez lentement sur le piston pour injecter le médicament.
Injectez la totalité du médicament contenu dans la seringue en appuyant doucement sur le piston jusqu’à la butée (Figure E). Avertissement : N’appuyez pas fermement, au risque d’activer le dispositif de sécurité de l’aiguille, voir étape 6.
Lorsque la seringue est vide, retirez l’aiguille lentement en conservant le même angle que celui utilisé lorsque vous l'avez enfoncée et en gardant votre doigt sur le piston. Utilisez un tampon imbibé d’alcool pour exercer une légère pression à l’endroit où vous venez d’injecter le médicament.
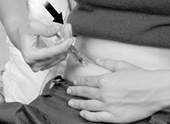
Figure E
5. Si du sang apparaît
Retirez l’aiguille lentement en conservant le même angle que celui utilisé lorsque vous l'avez enfoncée. Utilisez un tampon imbibé d’alcool pour exercer une légère pression à l’endroit où vous venez de percer la peau. Videz le médicament dans un évier et suivez l’étape 6 ci-dessous. Lavez-vous les mains et recommencez avec une nouvelle seringue préremplie (Figure F).

Figure F
6. Orientez l’aiguille loin de vous et d’autres personnes et activez le dispositif de sécurité en appuyant fermement sur le piston. Le manchon protecteur couvrira automatiquement l'aiguille et produira un « clic » audible qui confirmera l'activation du dispositif. (Figure G)
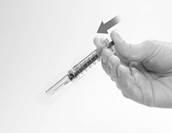
Figure G
Suivez les instructions données par votre infirmier/ère ou votre médecin à propos de l’élimination appropriée de seringues et d’aiguilles usagées. Une législation nationale peut réglementer l’élimination appropriée de seringues, d’aiguilles et de collecteurs de déchets de soins.
REMARQUE :
· Le système de sécurité ne peut être activé qu’une fois que la seringue a été vidée.
· L’activation du système de sécurité ne doit intervenir qu’après que l’aiguille a été retirée de la peau du patient.
· Ne remettez pas le protège-aiguille en place après injection.
· Le système de sécurité ne doit pas être stérilisé.
· L’activation du système de sécurité peut provoquer de faibles éclaboussures de solution. Pour une sécurité optimale, activez le système en l’orientant vers le bas, loin de vous et d’autres personnes.