Dernière mise à jour le 01/12/2025
CUTAQUIG 165 mg/mL, solution injectable
Indications thérapeutiques
Qu'est-ce que CUTAQUIG 165 mg/mL, solution injectable ?
CUTAQUIG appartient à une classe de médicaments appelée "immunoglobulines humaines normales". Les immunoglobulines sont également appelées "anticorps", ce sont des protéines présentes dans le sang des personnes en bonne santé. Les anticorps font partie du système immunitaire (les défenses naturelles du corps), ils aident le corps à combattre les infections.
Comment CUTAQUIG 165 mg/mL, solution injectable agit-il ?
CUTAQUIG contient des immunoglobulines qui ont été préparées à partir du sang de personnes en bonne santé. Le médicament agit exactement de la même manière que les immunoglobulines naturellement présentes dans votre sang.
Dans quel cas CUTAQUIG 165 mg/mL, solution injectable est-il utilisé ?
CUTAQUIG est utilisé chez les patients qui n'ont pas assez d'anticorps pour combattre les infections et qui, de ce fait, ont tendance à être régulièrement malades. L'administration régulière de doses suffisantes de CUTAQUIG permet de ramener à une valeur normale des taux d'immunoglobulines anormalement bas (thérapie de substitution).
CUTAQUIG est prescrit aux adultes et aux enfants (âgés de 0 à 18 ans) dans les cas suivants :
· Traitement des patients nés avec une capacité réduite ou une incapacité à produire des immunoglobulines (Déficit immunitaire primitif).
· Patients présentant un déficit acquis en anticorps (Déficit immunitaire secondaire) dû à une maladie et/ou un traitement spécifique et qui présentent des infections sévères ou récurrentes.
Présentations
> 1 flacon(s) en verre de 6 ml
Code CIP : 34009 301 732 2 0
Déclaration de commercialisation : 04/01/2022
Cette présentation est agréée aux collectivités
Inscription sur la liste de rétrocession au titre de son AMM, selon les conditions précisées au Journal Officiel. Prix de cession publié au Journal Officiel.
> 1 flacon(s) en verre de 12 ml
Code CIP : 34009 301 732 4 4
Déclaration de commercialisation : 31/12/2021
Cette présentation est agréée aux collectivités
Inscription sur la liste de rétrocession au titre de son AMM, selon les conditions précisées au Journal Officiel. Prix de cession publié au Journal Officiel.
> 1 flacon(s) en verre de 24 ml
Code CIP : 34009 301 732 6 8
Déclaration de commercialisation : 31/12/2021
Cette présentation est agréée aux collectivités
Inscription sur la liste de rétrocession au titre de son AMM, selon les conditions précisées au Journal Officiel. Prix de cession publié au Journal Officiel.
> 1 flacon(s) en verre de 48 ml
Code CIP : 34009 301 732 7 5
Déclaration de commercialisation : 31/12/2021
Cette présentation est agréée aux collectivités
Inscription sur la liste de rétrocession au titre de son AMM, selon les conditions précisées au Journal Officiel. Prix de cession publié au Journal Officiel.
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 17/02/2021 | Inscription (CT) | Le service médical rendu par CUTAQUIG 165 mg/mL (immunoglobuline humaine normale) est important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 17/02/2021 | Inscription (CT) | La Commission considère que CUTAQUIG 165 mg/mL (immunoglobuline humaine normale) par voie sous-cutanée n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux autres immunoglobulines humaines normales administrées par voie sous-cutanée ou intraveineuse. |
Autres informations
- Titulaire de l'autorisation : OCTAPHARMA France
- Conditions de prescription et de délivrance :
- liste I
- prescription hospitalière
- prescription par un médecin exerçant dans un établissement de transfusion sanguine
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 470 069 1
ANSM - Mis à jour le : 27/08/2025
CUTAQUIG 165 mg/mL, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Immunoglobuline humaine normale (IgSC)
Immunoglobuline humaine normale........................................................................................ 165 mg
(Pureté de l’IgG au moins égale à 95 %)
Pour 1 mL de solution
Chaque flacon de 6 mL contient : 1 g d’immunoglobuline humaine normale.
Chaque flacon de 10 mL contient : 1,65 g d’immunoglobuline humaine normale.
Chaque flacon de 12 mL contient : 2 g d’immunoglobuline humaine normale.
Chaque flacon de 20 mL contient : 3,3 g d’immunoglobuline humaine normale.
Chaque flacon de 24 mL contient : 4 g d’immunoglobuline humaine normale.
Chaque flacon de 48 mL contient : 8 g d’immunoglobuline humaine normale.
Distribution des sous-classes d'IgG (valeurs approximatives) :
IgG1 .......... 71 %
IgG2 .......... 25 %
IgG3 .......... 3 %
IgG4..............2 %
La teneur maximale en IgA est de 300 microgrammes/mL.
Produit à partir de plasma de donneurs humains.
Excipient(s) à effet notoire :
Ce médicament contient 33,1 mg de sodium par flacon de 48 mL et 13,8 mg par flacon de 20 Ml, voir rubrique 4.4.
Pour la liste complète des excipients, voir rubrique 6.1.
La préparation liquide est transparente et incolore.
Pendant la conservation, le liquide peut devenir légèrement opalescent et jaune pâle.
L'osmolalité de la préparation liquide est comprise entre 310 et 380 mosmol/kg.
Le pH de la solution varie entre 5 et 5,5.
4.1. Indications thérapeutiques
Traitement de substitution chez les adultes, enfants et adolescents (0-18 ans) atteints de :
· Déficits immunitaires primitifs (DIP) avec une production d'anticorps défaillante (voir rubrique 4.4).
· Déficits immunitaires secondaires (DIS)) chez les patients souffrant d'infections sévères ou récurrentes, dont le traitement antimicrobien est inefficace et qui présentent une insuffisance prouvée en anticorps spécifiques (PSAF, proven specific antibody failure)* ou un taux d'IgG sérique < 4 g/L.
*PSAF = incapacité à atteindre une augmentation d’au moins deux fois le titre d’anticorps IgG avec les vaccins à polysaccharides pneumococciques et antigènes polypeptidiques
4.2. Posologie et mode d'administration
Posologie
La posologie et le schéma posologique dépendent de l'indication.
Traitement de substitution
Le médicament doit être administré par voie sous-cutanée.
Pour une thérapie de substitution, il est possible que la dose soit individualisée pour chaque patient en fonction de la réponse pharmacocinétique et clinique.
CUTAQUIG peut être administré à intervalles réguliers, depuis tous les jours jusqu'à une semaine sur deux.
Les schémas posologiques suivants sont fournis à titre indicatif.
Traitement de substitution des déficits immunitaires primitifs (tels que définis dans la rubrique 4.1)
La posologie doit permettre d'atteindre un taux minimal d'IgG (mesuré avant la prochaine perfusion) d'au moins 5 à 6 g/L et doit avoir pour objectif de se situer dans l'intervalle de référence de l'IgG sérique pour l'âge. Une dose de charge d'au minimum 0,2 à 0,5 g/kg (1,2 à 3,0 mL/kg) de poids corporel peut être nécessaire. La dose pourra être répartie sur plusieurs jours, avec une dose journalière maximale de 0,1 à 0,15 g/kg.
Lorsque le taux d'IgG est stabilisé, des doses d'entretien seront administrées à intervalles répétés pour parvenir à une dose mensuelle cumulée de l'ordre de 0,4-0,8 g/kg (2,4 à 4,8 mL/kg). Il peut être nécessaire d'administrer chaque dose unique sur des sites anatomiques différents.
Les taux résiduels doivent être mesurés et évalués conjointement à l'incidence d'infection. Pour réduire le taux d'infection, il peut être nécessaire d'augmenter la dose et de viser un taux minimal plus élevé.
Traitement de substitution des déficits immunitaires secondaires (tels que définis dans la rubrique 4.1)
La dose recommandée sera administrée à intervalles répétés (environ une fois par semaine) pour parvenir à une dose mensuelle cumulée de l'ordre de 0,2-0,4 g/kg (1,2 à 2,4 mL/kg). Il peut être nécessaire d'administrer chaque dose unique sur des sites anatomiques différents.
Les taux résiduels d'IgG doivent être mesurés et évalués conjointement à l'incidence des infections. La dose doit être ajustée si nécessaire pour obtenir une protection optimale contre les infections. Il peut être nécessaire d'augmenter la dose chez les patients présentant une infection persistante ; une diminution de la dose peut être envisagée lorsque le patient reste indemne d'infection.
Population pédiatrique
La posologie chez les enfants et adolescents (0 à 18 ans) n’est pas différente de celle des adultes puisque la posologie pour chaque indication est calculée en fonction du poids corporel et ajustée pour le résultat clinique dans les indications de traitement de substitution.
Population âgée
Etant donné que la dose est calculée en fonction du poids corporel et ajustée pour le résultat clinique dans les affections mentionnées ci-dessus, la dose chez les patients âgés n'est pas considérée comme étant différente de celle administrée aux patients âgés de 18 à 65 ans. Dans les études cliniques, CUTAQUIG a été évalué chez 17 patients âgés de plus de 65 ans. Aucune exigence relative à la dose n’a été nécessaire pour atteindre les taux sériques d’IgG souhaités.
Mode d’administration
Voie sous-cutanée uniquement.
La perfusion par voie sous-cutanée pour le traitement à domicile doit être instaurée et supervisée par un médecin spécialisé dans le traitement des patients à domicile. Le patient et/ou l'aidant doit être formé à l’utilisation d’un dispositif de perfusion, aux techniques de perfusion, aux techniques de manipulations aseptiques, à la tenue d’un journal de traitement, à l’identification et aux mesures à prendre en cas de survenue d'effets indésirables graves.
CUTAQUIG peut être injecté dans des sites tels que la paroi abdominale, la cuisse, la partie supérieure du bras et la face latérale de la hanche.
Vitesse de perfusion
La vitesse de perfusion et le volume de perfusion doivent être adaptés en fonction de la tolérance du patient.
Il est recommandé d’utiliser une vitesse initiale d’administration de 15 mL/h/site chez les patients qui n’ont jamais reçu d’IgSC. Chez les patients qui sont déjà traités par IgSC et passent sous CUTAQUIG, il est recommandé d’utiliser la même vitesse d’administration lors des perfusions initiales que celle utilisée précédemment. Pour les perfusions suivantes, si les premières sont bien tolérées (voir rubrique 4.4), la vitesse de perfusion peut être graduellement augmentée d’environ 10 mL/h/site toutes les 2 à 4 semaines chez les adultes (≥ 40 kg) et d’un maximum de 10 mL/h/site toutes les 4 semaines chez les patients pédiatriques (< 40 kg) (voir rubrique 5.1).
Par la suite, si les perfusions initiales sont bien tolérées par le patient à la dose complète par site et à la vitesse maximale, une augmentation de la vitesse de perfusion peut être envisagée pour les perfusions suivantes jusqu’à atteindre un maximum de 67,5 mL/h/site chez les adultes et 25 mL/h/site chez les patients pédiatriques (voir rubrique 5.1).
Plusieurs dispositifs de perfusion peuvent être utilisés simultanément.
Volume de perfusion par site
La quantité de produit perfusée est différente selon le site. Chez les enfants et adolescents, le site de perfusion peut être changé tous les 5 à 15 mL. Chez les adultes, les doses de plus de 30 mL peuvent être fractionnées selon les préférences du patient. Il n’y a pas de limite au nombre de sites de perfusion. Les sites de perfusion doivent être espacés d'au moins 5 cm.
CUTAQUIG ne doit pas être administré par voie intravasculaire.
De même, il ne doit pas être administré par voie intramusculaire en cas de thrombocytopénie sévère et d'autres troubles de l'hémostase.
4.4. Mises en garde spéciales et précautions d'emploi
Ce médicament contient au maximum 90 mg de maltose par mL en tant qu'excipient. L'interférence du maltose dans les dosages de glucose sanguin peut entraîner une glycémie anormalement élevée et par conséquent, en cas d'administration inappropriée d'insuline, entraîner une hypoglycémie grave et le décès. De même, les cas de véritable hypoglycémie peuvent rester non traités si l'état hypoglycémique est masqué par des glycémies faussement élevées (voir rubrique 4.5). Concernant l'insuffisance rénale aiguë, voir ci-dessous.
CUTAQUIG est destiné à être administré par voie sous-cutanée uniquement. L'administration accidentelle de CUTAQUIG dans un vaisseau sanguin peut provoquer un choc.
La vitesse de perfusion recommandée dans la rubrique 4.2 doit être scrupuleusement respectée. Les patients doivent être attentivement suivis et observés pendant la durée de la perfusion afin de s’assurer qu’aucun symptôme n’apparaisse.
Certains effets indésirables peuvent survenir plus fréquemment chez les patients qui reçoivent une immunoglobuline humaine normale pour la première fois ou, dans de rares cas, lorsque les patients changent d'immunoglobuline humaine normale ou lorsque la perfusion précédente a été administrée il y a longtemps.
Les complications potentielles peuvent souvent être évitées en :
· commençant par injecter lentement le produit (voir rubrique 4.2)
· surveillant attentivement les patients pour s’assurer qu’aucun symptôme n’apparaisse pendant la durée de la perfusion. En particulier, les patients naïfs de toute immunoglobuline humaine normale, les patients qui ont changé d'immunoglobuline ou qui n’ont pas reçu de perfusion pendant une longue période, doivent être surveillés pendant la première perfusion et pendant la première heure suivant la première perfusion, afin de détecter d'éventuels effets indésirables.
Tous les autres patients doivent rester en observation pendant au moins 20 minutes après l’administration.
En cas d'effet indésirable, il conviendra soit de réduire la vitesse d'administration ou d’arrêter la perfusion. Si une réaction de type allergique ou anaphylactique est suspectée, la perfusion sera immédiatement arrêtée. Le traitement nécessaire dépend de la nature et de la sévérité de la réaction indésirable.
En cas de choc, le traitement médical standard adapté doit être instauré.
Hypersensibilité
Les vraies réactions allergiques sont rares. Elles peuvent apparaître notamment chez les patients qui présentent des anticorps anti-IgA. Ces patients doivent être traités avec une précaution particulière. Les patients porteurs d’anticorps anti-IgA, pour lesquels le traitement avec des IgG par voie sous-cutanée reste la seule option, ne doivent être traités par CUTAQUIG que sous supervision médicale étroite.
Dans de rares cas, les immunoglobulines humaines normales peuvent entraîner une chute de la pression artérielle associée à une réaction anaphylactique, même chez des patients ayant bien toléré un traitement antérieur par une immunoglobuline humaine normale.
Thromboembolie
Des événements thromboemboliques artériels et veineux, y compris l'infarctus du myocarde, l'accident vasculaire cérébral, la thrombose veineuse profonde et l'embolie pulmonaire, ont été associés à l’utilisation d’immunoglobulines. Les patients doivent être suffisamment hydratés avant de recevoir des immunoglobulines. La prudence est de mise chez les patients qui présentent des facteurs de risque préexistants d'événements thrombotiques (tels que un âge avancé, une hypertension, un diabète sucré et des antécédents de maladies vasculaires ou d'épisodes thrombotiques, les patients atteints de troubles thrombophiliques héréditaires ou acquis, les patients ayant connu des immobilisations prolongées, les patients présentant une hypovolémie sévère, les patients atteints d'une maladie qui augmente la viscosité sanguine).
Les patients doivent être informés des premiers symptômes des événements thromboemboliques, tels qu’un essoufflement, une douleur et le gonflement d’un membre, des déficits neurologiques focaux et des douleurs dans la poitrine et il doit leur être conseillé de consulter leur médecin traitant dès l’apparition de symptômes.
Syndrome de méningite aseptique (SMA)
Des cas de syndrome de méningite aseptique sont survenus en association avec un traitement par immunoglobulines sous cutanées. Les symptômes débutent habituellement quelques heures à 2 jours après le traitement. L’arrêt du traitement par immunoglobulines peut entraîner une résolution du SMA en quelques jours sans séquelles.
Les patients doivent être informés des premiers symptômes qui incluent des maux de tête sévères, une raideur de la nuque, une somnolence, de la fièvre, une photophobie, des nausées et des vomissements.
Altération du fonctionnement des reins/Insuffisance rénale
Des cas d'effets indésirables rénaux sévères ont été rapportés chez des patients recevant des immunoglobulines, en particulier celles contenant du saccharose (CUTAQUIG ne contient pas de saccharose). Il s'agissait d'une insuffisance rénale aiguë, d'une nécrose tubulaire aiguë, d'une néphropathie tubulaire proximale et d'une néphrose osmotique. Les facteurs qui augmentent le risque de complications rénales incluent notamment une insuffisance rénale préexistante, un diabète sucré, une hypovolémie, la prise concomitante de médicaments néphrotoxiques, un âge supérieur à 65 ans, une septicémie, une hyperviscosité et une paraprotéinémie.
Hémolyse
Les patients traités par immunoglobulines doivent être surveillés afin de déceler tous signes et symptômes d'hémolyse.
Teneur en sodium
Ce médicament contient 33,1 mg de sodium par flacon de 48 mL et 13,8 mg par flacon de 20 mL, ce qui équivaut respectivement à 1,7 % et 0,7 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
Interférence avec les tests sérologiques
Après injection d’immunoglobuline, l’augmentation transitoire de la concentration de divers anticorps transférés passivement dans le sang des patients peut entraîner des résultats faussement positifs lors des dosages sérologiques.
La transmission passive d’anticorps anti-érythrocytaires, par exemple A, B, D, peut interférer avec certains tests sérologiques pour des anticorps érythrocytaires (par exemple, test de Coombs ou antiglobuline directe).
Agents transmissibles
Les mesures habituelles de prévention des infections dues à l’utilisation de médicaments préparés à partir de sang ou de plasma humain comprennent la sélection des donneurs, la recherche des marqueurs spécifiques d’infection sur chaque don et sur les mélanges de plasma et l’inclusion dans le procédé de fabrication d'étapes efficaces pour l’inactivation/élimination des virus. Malgré ces mesures, le risque de transmission d’agents infectieux ne peut pas être totalement exclu lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés. Ceci s'applique également à tous les virus inconnus ou émergents ou aux autres types d'agents infectieux.
Les mesures prises sont considérées comme efficaces contre les virus enveloppés tels que le virus de l’immunodéficience humaine (VIH), le virus de l’hépatite B (VHB) et le virus de l’hépatite C (VHC).
Les mesures prises peuvent être d’une efficacité limitée contre les virus non enveloppés tels que le virus de l'hépatite A (VHA) et le parvovirus B19.
Des données cliniques rassurantes révèlent l’absence de transmission du virus de l'hépatite A ou du parvovirus B19 par les immunoglobulines, et il est également supposé que la concentration en anticorps contribue de façon importante à la sécurité virale.
Population pédiatrique
Les avertissements et précautions décrits s'appliquent aux adultes et aux enfants.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les interactions décrites s'appliquent tant aux adultes qu'aux enfants.
Associations à prendre en compte
Vaccins contenant des virus vivants atténués
L'administration d'immunoglobulines peut altérer pendant une période d'au minimum 6 semaines à 3 mois au maximum l'efficacité des vaccins contenant des virus vivants atténués, comme les vaccins contre la rougeole, la rubéole, les oreillons et la varicelle. Après administration de ce médicament, un intervalle de 3 mois doit s’écouler avant une vaccination avec des vaccins contenant des virus vivants atténués. Dans le cas de la rougeole, cette diminution d’efficacité peut persister jusqu’à 1 an.
Il est donc nécessaire de contrôler le taux d'anticorps chez les patients qui reçoivent un vaccin contre la rougeole.
Mesure de la glycémie
CUTAQUIG contient du maltose, ce qui peut fausser les résultats de la glycémie mesurée avec certains dispositifs de mesure de la glycémie. Compte tenu de cette possibilité de résultats faussement élevés de la glycémie, seuls des systèmes prévus spécifiquement pour mesurer la glycémie doivent être utilisés pour tester ou contrôler les taux de glucose dans le sang chez les patients diabétiques.
4.6. Fertilité, grossesse et allaitement
Grossesse
La sécurité de ce médicament au cours de la grossesse n’a pas été établie par des études cliniques contrôlées et ne doit dès lors être administré qu'avec précaution chez la femme enceinte et qui allaite. Il a été démontré que les produits à base d’immunoglobulines traversent le placenta, de manière croissante au cours du troisième trimestre. Selon l’expérience clinique obtenue avec les immunoglobulines aucun effet nocif n'est attendu sur le déroulement de la grossesse ou sur le fœtus et le nouveau-né.
Les immunoglobulines sont excrétées dans le lait maternel et peuvent contribuer à protéger le nouveau-né contre les agents pathogènes qui utilisent les muqueuses comme porte d’entrée.
Fertilité
Selon l’expérience clinique obtenue avec les immunoglobulines aucun effet nocif n'est attendu sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Des effets indésirables tels que frissons, maux de tête, étourdissements, fièvre, vomissements, réactions allergiques, nausées, arthralgies, pression artérielle basse et douleur lombaire modérée peuvent survenir occasionnellement.
Rarement, les immunoglobulines humaines normales peuvent provoquer une chute brutale de la pression artérielle et, dans des cas isolés, un choc anaphylactique, même si le patient n’avait présenté aucun signe d’hypersensibilité lors de l’administration précédente.
Des réactions locales aux sites de perfusion (gonflement, endolorissement, rougeur, induration, sensation de chaleur locale, démangeaisons, ecchymose et éruption cutanée) peuvent survenir fréquemment. La fréquence de ces réactions diminue normalement au fur et à mesure que le traitement se poursuit.
Pour des informations de sécurité concernant les agents transmissibles, voir rubrique 4.4.
Tableau des effets indésirables
Les données de sécurité clinique sur CUTAQUIG chez des sujets atteints de DIP, sont basées sur les résultats de l'étude pivot de Phase III ouverte, à un bras, prospective, multicentrique (n = 75 ; 4 462 perfusions), sur ceux de l’’étude d’extension de Phase III prospective, ouverte, à bras unique, multicentrique (n = 27 ; 2 777 perfusions) ainsi que ceux de l’étude de Phase III ,ouverte, à trois bras, multicentrique (n = 64 ; 1 338 perfusions).
Le tableau présenté ci-dessous est organisé selon la classification par systèmes d'organes MedDRA (CSO et « terme préféré »).
Les fréquences par patient ont été évaluées selon la convention suivante : Très fréquent (≥1/10) ; fréquent (≥1/100 à <1/10) ; peu fréquent (≥1/1000 à <1/100) ; rare (≥1/10000 à <1/1000) ; très rare (<1/10000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Fréquence des effets indésirables (FEI) par patient et par perfusion dans l'étude clinique portant sur CUTAQUIG :
|
Classe de systèmes d’organes MedDRA (CSO) |
Effet indésirable |
Fréquence/perfusion |
Fréquence/patient |
|
Affections du système nerveux |
Maux de tête Etourdissement |
Peu fréquent Rare |
Fréquent Peu fréquent |
|
Affections gastro-intestinales |
Nausée Distension abdominale |
Peu fréquent Rare |
Fréquent Fréquent |
|
Douleurs abdominales |
Rare |
Fréquent |
|
|
Vomissements Haut-le cœur |
Rare Rare |
Fréquent Peu fréquent |
|
|
Affections hépatobiliaires |
Hypertransaminasémie |
Rare |
Peu fréquent |
|
Affections de la peau et du tissu sous-cutané |
Eruption cutanée Réaction cutanée |
Rare Rare |
Peu fréquent Peu fréquent |
|
Affections musculo-squelettiques et systémiques |
Myalgie Arthralgie |
Rare Rare |
Fréquent Peu fréquent |
|
Troubles généraux et anomalies au site d'administration |
Réaction au site d'injection |
Très fréquent |
Très fréquent |
|
Pyrexie Frissons Fatigue Gêne thoracique Syndrome pseudo-grippal Malaise Douleur |
Rare Rare Peu fréquent Rare Rare
Rare Rare |
Fréquent Fréquent Fréquent Peu fréquent Peu fréquent
Peu fréquent Peu fréquent |
|
|
Investigations |
Présence d’hémoglobine libre Test de Coombs positif |
Rare
Rare |
Fréquent
Peu fréquent |
|
|
|
|
|
|
Diminution de l'haptoglobine Augmentation de l’hémoglobine Augmentation de la créatine sanguine |
Rare
Rare
Rare |
Peu fréquent
Peu fréquent
Peu fréquent |
Les effets indésirables suivants ont été signalés durant l’utilisation post-commercialisation de CUTAQUIG.
Ces effets indésirables rapportés de façon spontanée étant issus d'une population de taille indéterminée, il n'est pas toujours possible d'estimer avec précision leur fréquence ou d'établir un lien de causalité avec l'exposition au médicament.
Les effets indésirables déjà rapportés au cours des études cliniques avec CUTAQUIG ne sont pas inclus dans cette liste :
|
Classe de systèmes d’organes MedDRA (CSO) : |
Effet indésirable |
|
Affections du système immunitaire |
Hypersensibilité (erythème, urticaire, par exemple |
|
Thromboembolie, (thrombose veineuse profonde, accident vasculaire cérébral, par exemple), hypertension |
|
|
Affections de la peau et du tissu sous-cutané |
Prurit |
|
Affections musculosquelettiques et du tissu conjonctif Troubles généraux et anomalies au site d'administration : |
Dorsalgie |
D’autres effets indésirables ont été signalés après le début de la commercialisation de produits à base d’immunoglobulines : œdème du visage, tremblements, pâleur, bronchospasme, dyspnée, toux, diarrhée, rougeur du visage, sensation de chaleur, sensation de froid, asthénie, douleur au site d’injection, serrement dans la gorge, méningite aseptique.
Population pédiatrique
On s'attend à ce que la fréquence, le type et la gravité des effets indésirables soient les mêmes chez les enfants et chez les adultes.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Les conséquences d'un surdosage ne sont pas connues.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
L'immunoglobuline humaine normale contient principalement des immunoglobulines G (IgG) présentant un large spectre d’anticorps contre les agents infectieux.
L'immunoglobuline humaine normale contient des anticorps IgG présents dans la population normale. Ce produit est généralement préparé à partir de plasma mélangé provenant d'au moins 1000 dons. La distribution des sous-classes d’immunoglobuline G est étroitement proportionnelle à celle présente dans le plasma humain d'origine. Des doses adaptées de ce médicament peuvent ramener à une valeur normale des taux anormalement bas d’IgG.
Efficacité et sécurité clinique
Lors d'une étude clinique, un total de 75 patients (37 adultes, 12 jeunes enfants [≥ 2 et < 6 ans], 14 enfants plus âgés [≥ 6 et < 12 ans] et 12 adolescents [≥ 12 et < 17 ans]), atteints d'un syndrome de déficit immunitaire primitif a été traité par CUTAQUIG pendant une durée allant jusqu'à 64 semaines. La dose moyenne administrée chaque semaine était de 0,187g/kg chez les patients adultes, de 0,150 g/kg chez les jeunes enfants, de 0,164 g/kg chez les enfants plus âgés et de 0,170 g/kg chez les adolescents. Au total, 4462perfusions hebdomadaires de CUTAQUIG ont été administrées.
Aucune infection bactérienne grave n'a été rapportée pendant la période de wash-in/wash-out ni pendant la période d'efficacité chez les sujets recevant CUTAQUIG dans le cadre de l'étude clinique.
CUTAQUIG a été évalué chez 38 patients pédiatriques (26 enfants âgés entre 2 et < 12 ans et 12 adolescents âgés entre 12 et < 16 ans) présentant un déficit immunitaire primitif. Aucune adaptation de dose pédiatrique n’a été nécessaire pour atteindre les taux sériques d’IgG souhaités.
L’étude d’extension était une étude de suivi de la sécurité. Cette étude de Phase III, prospective, en ouvert, à 1 bras, multicentrique, a été menée chez 27 patients (17 adultes, 2 jeunes enfants [≥ 2 et < 6 ans], 4 enfants plus âgés [≥ 6 et < 12 ans], 4 adolescents [≥ 12 et < 17 ans]) présentant un déficit immunitaire primitif. Parmi ces derniers, 21 patients avaient été traités initialement dans le cadre de l’étude pivot et 6 patients ont été nouvellement recrutés. Les patients ayant participé à l’étude pivot ont été suivis sur une durée allant jusqu’à 4,5 ans et pendant 12 mois pour les nouveaux participants. Les patients ont reçu CUTAQUIG une fois par semaine (25 patients) ou une semaine sur deux (2 patients). La dose moyenne de CUTAQUIG perfusée par patient a été de 0,127 g/kg chez les jeunes enfants, 0,210 g/kg chez les enfants plus âgés, 0,160 g/kg chez les adolescents et 0,166 g/kg chez les adultes. Les patients ont reçu un total de 2 777 perfusions (2 740 une fois par semaine et 37 toutes les deux semaines). Une infection bactérienne sévère de type bactériémie/septicémie a été rapportée.
Afin de surveiller la sécurité, la tolérance et l’efficacité de CUTAQUIG, une étude de Phase III prospective, en ouvert, à trois bras, multicentrique a été menée chez 64 patients âgés de 5 à 74 ans, atteints de DIP (59 adultes, 1 jeune enfant [≥ 2 et < 6 ans], 2 enfants plus âgés [≥ 6 et < 12 ans], 2 adolescents [≥ 12 et < 17 ans]).
À l’issue de la période de stabilisation de 4 semaines, les patients ont débuté une période de traitement avec un suivi de 24 semaines et ont été répartis dans les 3 cohortes suivantes :
· Cohorte 1 : évaluation de l’augmentation du volume par site jusqu’à un maximum de 100 mL/site.
· Cohorte 2 : évaluation de l’augmentation de la vitesse de perfusion par site jusqu’à un maximum de 100 mL/h/site ou jusqu’à la vitesse maximale permise par la pompe.
· Cohorte 3 : évaluation de l’administration de CUTAQUIG une semaine sur deux, à une dose équivalant à deux fois la dose hebdomadaire définie selon le poids du patient (mg/kg).
Le critère principal d’évaluation était composé de la comparaison des concentrations résiduelles totales en IgG entre les perfusions hebdomadaires et les perfusions une semaine sur deux, de l’évaluation de la sécurité et de la tolérance des perfusions lors de l’augmentation des volumes et des vitesses de perfusion sur chaque site de perfusion et également lors de l’administration une semaine sur deux.
Globalement, les patients ont reçu un total de 1 338 perfusions (386 dans la Cohorte 1, 396 dans la Cohorte 2, 556 dans la Cohorte 3).
Dans la Cohorte 1 (n = 15 adultes), le volume maximal moyen atteint par site a été de 69,4 mL/site, avec un volume maximal de 108 mL/site. Un tiers des patients (5/15 ; 33,3 %) a atteint au moins 90 % du volume maximal autorisé de 100 mL/site, un tiers a atteint entre 50 % et < 90 % du volume maximal autorisé et un tiers a atteint moins de 50 % du volume maximal autorisé. La vitesse de perfusion maximale médiane atteinte par patient a été de 56,9 mL/h, avec un intervalle allant de 34,0 mL/h à 94,7 mL/h.
Dans la Cohorte 2 (n = 15 ; 13 adultes, 1 enfant plus âgé [≥ 6 et < 12 ans], 1 adolescent [≥ 12 et < 17 ans]), la vitesse maximale moyenne de perfusion atteinte par site a été de 42,1 mL/h/site, avec une vitesse maximale de perfusion de 67,5 mL/h/site. Chez 73,3 % des patients, une vitesse de perfusion maximale par site < 50 % du maximum autorisé de 100 mL/h/site a été atteinte. Les 26,7 % sujets restants ont atteint entre 50 % et 75 % du maximum autorisé. La vitesse maximale médiane de perfusion atteinte par patient a été de 135,0 mL/h, avec un intervalle allant de 51,4 mL/h à 192,0 mL/h.
Dans la Cohorte 3 (n = 34 ; 31 adultes, 1 jeune enfant [≥ 2 et < 6 ans], 1 enfant plus âgé [≥ 6 et < 12 ans], 1 adolescent [≥ 12 et < 17 ans]), une diminution des concentrations résiduelles totales moyennes (ET) en IgG a été observée avec le schéma d’administration une semaine sur deux (9,927 [2,0146] g/L) par comparaison avec l’administration hebdomadaire (10,364 [1,9632] g/L) (p = 0,0017 ; limite inférieure de l’intervalle de confiance unilatéral à 97,5 % = -0,799). La vitesse maximale médiane de perfusion atteinte par patient a été de 93,5 mL/h, avec un intervalle allant de 24,3 mL/h à 145,9 mL/h.
La dose moyenne de CUTAQUIG effectivement administrée selon le poids a été de 0,143 g/kg dans la Cohorte 1, 0,157 g/kg dans la Cohorte 2 et 0,256 g/kg dans la Cohorte 3, respectivement.
Aucune infection bactérienne sévère n’a été rapportée au cours de l’étude et le taux global d’infections bactériennes sévères a été de 0,00 par personne-année (limite supérieure de l’IC à 98 % [méthode alternative] = 0,135 [0,614 dans la Cohorte 1, 0,602 dans la Cohorte 2 et 0,244 dans la Cohorte 3]).
Population pédiatrique
Aucune différence n'a été observée dans les propriétés pharmacodynamiques entre les adultes et les patients pédiatriques.
5.2. Propriétés pharmacocinétiques
Lors d'un essai clinique de phase III, une sous-étude pharmacocinétique (PK) a été menée chez 37 patients atteints de syndromes d'immunodéficience primaire (DIP). Des échantillons de sang pour l'étude PK ont été prélevés avant le passage à CUTAQUIG (profil IgIV : PKIV), après la 11e perfusion de CUTAQUIG (premier profil SC : PKSC1) et après la 28e perfusion de CUTAQUIG (deuxième profil SC : PKSC2). L'objectif de la sous-étude PK était de comparer les ASC après administration IV et SC, en utilisant un facteur de correction de dose (FCD) de 1,5. A partir d'un modèle PK de population, les paramètres PK ont été estimés et des simulations ont été effectuées.
Après l'administration par voie sous-cutanée de CUTAQUIG, le taux sérique maximal est atteint après environ 2 jours.
Du fait de l'absorption progressive, l'administration de IgSC conduit à des profils plus plats et à des fluctuations plus faibles à l'état d'équilibre par rapport au traitement par IgIV : la Cmax moyenne était plus faible après IgSC (13,2 ± 3,4 g/L et 13,5 ± 3,7 g/L pour PKSC1 et PKSC2, respectivement) par rapport à la concentration à la fin de la perfusion par IgIV (18,0 ± 4,5 g/L). En conséquence, les taux sériques moyens d'IgG et les taux résiduels de sous-classe d'IgG étaient plus élevés après le traitement SC (11,5 et 11,7 g/L pour PKSC1 et PKSC2, respectivement, la marge globale étant de 6,5 à 18,9 g/L-, par rapport à ceux à la fin du traitement par IgIV (10,1 g/L ; plage : 6,5 g/L à 14,3 g/L).
La biodisponibilité SC a été calculée à 75 %, ce qui correspond à un facteur de correction de dose de 1,3 afin d’obtenir une exposition égale (ASC) après traitement par IgSC corrélé au poids par rapport au traitement par IgIV.
Une modélisation basée sur la PK et une simulation à partir des données recueillies dans l'étude clinique sur l'administration hebdomadaire de CUTAQUIG ont été réalisées. Elles indiquent qu'une dose ajustée en fonction du poids, sans facteur de correction de dose pour la biodisponibilité SC plus basse, serait suffisante pour maintenir le taux d’IgG dans l'intervalle thérapeutique, pour un intervalle entre les injections allant jusqu'à 1 semaine, ou plus fréquemment (par ex. des doses quotidiennes).
Des intervalles de dose plus longs (en particulier à des niveaux de base d'IgG faibles) augmentent le risque de tomber en-dessous du taux résiduel d'IgG de 5 g/L.
Exemple : 'En considérant un taux basal d'IgG de 4,0 g/L et un facteur de conversion de dose de 1,0 pour passer du traitement par IgIV au traitement par IgSC, le pourcentage de patients passant sous le seuil de 5 g/L d'IgG atteindrait 4 % avec une dose toutes les 2 semaines par rapport à 1,4 % avec un intervalle de dose ≤1 semaine.
Élimination
Les IgG et les complexes IgG sont fractionnés dans les cellules du système réticulo-endothélial.
La demi-vie médiane des IgG après l'administration de CUTAQUIG chez les sujets atteints de DIP a été estimée à environ 16 jours [9,2-36,3], telle que calculée dans le modèle PK de population, en supposant une production endogène nulle d'IgG.
Population pédiatrique
Aucune différence cliniquement pertinente n'a été observée concernant les paramètres pharmacocinétiques, entre les patients adultes et pédiatriques de l'étude DIP.
La modélisation basée sur la pharmacocinétique et la simulation réalisée sur les données recueillies dans l'étude clinique sur l'administration hebdomadaire de CUTAQUIG indiquent qu'une dose ajustée en fonction du poids serait suffisante pour maintenir des taux d’IgG dans l'intervalle thérapeutique quel que soit l'âge.
5.3. Données de sécurité préclinique
Maltose, polysorbate 80, eau pour préparations injectables.
3 ans
Après ouverture du flacon, la solution doit être utilisée immédiatement.
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (2°C – 8°C).
Ne pas congeler.
Conserver le flacon dans l’emballage d’origine, à l’abri de la lumière.
Pendant sa durée de conservation, le produit peut être conservé à température ambiante (à conserver à une température ne dépassant pas 25°C) pendant une période unique ne dépassant pas 9 mois, sans être replacé au réfrigérateur pendant cette période. Il doit être éliminé s’il n’est pas utilisé après cette période.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
6, 10, 12, 20, 24 ou 48 mL de solution dans un flacon (verre de type I) muni d'un capuchon en caoutchouc bromobutyl - conditionnement de 1,10 ou 20.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Le médicament doit être amené à température ambiante ou à température corporelle avant utilisation.
Avant l'administration, les produits doivent être inspectés visuellement pour s'assurer de l'absence de particules et de coloration anormale.
Les solutions troubles ou présentant des dépôts ne doivent pas être utilisées.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
62 BIS AVENUE ANDRE MORIZET
92100 BOULOGNE BILLANCOURT
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 732 2 0 : Flacon (verre) de 6 mL ; boîte de 1
· 34009 301 732 3 7 : Flacon (verre) de 10 mL ; boîte de 1
· 34009 301 732 4 4 : Flacon (verre) de 12 mL ; boîte de 1
· 34009 301 732 5 1 : Flacon (verre) de 20 mL ; boîte de 1
· 34009 301 732 6 8 : Flacon (verre) de 24 mL ; boîte de 1
· 34009 301 732 7 5 : Flacon (verre) de 48 mL ; boîte de 1
· 34009 301 732 8 2 : Flacon (verre) de 6 mL ; boîte de 10
· 34009 301 732 9 9 : Flacon (verre) de 10 mL ; boîte de 10
· 34009 301 733 0 5 : Flacon (verre) de 12 mL ; boîte de 10
· 34009 301 733 1 2 : Flacon (verre) de 20 mL ; boîte de 10
· 34009 301 733 2 9 : Flacon (verre) de 24 mL ; boîte de 10
· 34009 301 733 3 6 : Flacon (verre) de 48 mL ; boîte de 10
· 34009 550 728 3 6 : Flacon (verre) de 6 mL ; boîte de 20
· 34009 550 728 4 3 : Flacon (verre) de 10 mL ; boîte de 20
· 34009 550 728 5 0 : Flacon (verre) de 12 mL ; boîte de 20
· 34009 550 728 6 7 : Flacon (verre) de 20 mL ; boîte de 20
· 34009 550 728 8 1 : Flacon (verre) de 24 mL ; boîte de 20
· 34009 550 728 9 8 : Flacon (verre) de 48 mL ; boîte de 20
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament soumis à prescription hospitalière.
La prescription par un médecin exerçant dans un établissement de transfusion sanguine autorisé à dispenser des médicaments aux malades qui y sont traités est également autorisée.
ANSM - Mis à jour le : 27/08/2025
CUTAQUIG 165 mg/mL, solution injectable
Immunoglobuline humaine normale (IG SC)
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu’est-ce que CUTAQUIG 165 mg/mL, solution injectable et dans quel cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser CUTAQUIG 165 mg/mL, solution injectable ?
3. Comment utiliser CUTAQUIG 165 mg/mL, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CUTAQUIG 165 mg/mL, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CUTAQUIG 165 mg/mL, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Qu'est-ce que CUTAQUIG 165 mg/mL, solution injectable ?
CUTAQUIG appartient à une classe de médicaments appelée "immunoglobulines humaines normales". Les immunoglobulines sont également appelées "anticorps", ce sont des protéines présentes dans le sang des personnes en bonne santé. Les anticorps font partie du système immunitaire (les défenses naturelles du corps), ils aident le corps à combattre les infections.
Comment CUTAQUIG 165 mg/mL, solution injectable agit-il ?
CUTAQUIG contient des immunoglobulines qui ont été préparées à partir du sang de personnes en bonne santé. Le médicament agit exactement de la même manière que les immunoglobulines naturellement présentes dans votre sang.
Dans quel cas CUTAQUIG 165 mg/mL, solution injectable est-il utilisé ?
CUTAQUIG est utilisé chez les patients qui n'ont pas assez d'anticorps pour combattre les infections et qui, de ce fait, ont tendance à être régulièrement malades. L'administration régulière de doses suffisantes de CUTAQUIG permet de ramener à une valeur normale des taux d'immunoglobulines anormalement bas (thérapie de substitution).
CUTAQUIG est prescrit aux adultes et aux enfants (âgés de 0 à 18 ans) dans les cas suivants :
· Traitement des patients nés avec une capacité réduite ou une incapacité à produire des immunoglobulines (Déficit immunitaire primitif).
· Patients présentant un déficit acquis en anticorps (Déficit immunitaire secondaire) dû à une maladie et/ou un traitement spécifique et qui présentent des infections sévères ou récurrentes.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER CUTAQUIG 165 mg/mL, solution injectable ?
N'utilisez jamais CUTAQUIG 165 mg/mL, solution injectable :
· si vous êtes allergique à l'immunoglobuline humaine normale ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
N'injectez JAMAIS CUTAQUIG dans un vaisseau sanguin.
Avertissements et précautions
Adressez-vous à votre médecin avant d'utiliser CUTAQUIG.
Vous pourriez être allergique (hypersensible) aux immunoglobulines sans le savoir.
Les vraies réactions allergiques, comme une chute soudaine de la pression artérielle ou un choc anaphylactique (une chute importante de la pression artérielle accompagnée d'autres symptômes tels qu'un gonflement de la gorge, des difficultés à respirer et une éruption cutanée), sont rares, mais elles peuvent se produire occasionnellement même si vous avez déjà reçu des immunoglobulines humaines et que vous les aviez bien tolérées. Cela peut se produire si vous n'avez pas suffisamment d'immunoglobulines de type A (IgA) dans le sang (déficit en IgA) et si vous avez des anticorps anti-IgA.
Informez votre médecin ou votre professionnel de la santé avant le traitement si vous souffrez d'un déficit en immunoglobulines de type A (IgA). CUTAQUIG contient des quantités résiduelles d'IgA qui pourraient provoquer une réaction allergique.
Dans ces rares cas, des réactions allergiques, comme une chute soudaine de la pression artérielle ou un choc, peuvent survenir (voir également rubrique 4).
Les signes et symptômes de ces réactions allergiques rares sont les suivants :
· Sensation de tête légère, étourdissements ou syncope
· Eruption cutanée et démangeaisons, gonflement dans la bouche ou la gorge, difficultés à respirer, respiration sifflante
· Fréquence cardiaque anormale, douleurs dans la poitrine, coloration bleue des lèvres ou des doigts et des orteils
· Vision floue
Si ces signes apparaissent pendant la perfusion de CUTAQUIG, avertissez-en immédiatement votre médecin. Il décidera s'il est nécessaire de ralentir la vitesse de perfusion ou de l'arrêter totalement.
Avertissez votre médecin si vous avez des antécédents de maladie cardiaque ou de maladie vasculaire, de caillots sanguins, si votre sang est épais ou si vous êtes resté immobile pendant de longues périodes. Ces situations peuvent augmenter le risque que vous ayez un caillot de sang après avoir utilisé CUTAQUIG. Informez également votre médecin des médicaments que vous utilisez, car certains d'entre eux, notamment ceux qui contiennent des œstrogènes (p. ex., la pilule), peuvent augmenter le risque de caillot sanguin. Appelez immédiatement votre médecin si vous présentez des signes et symptômes tels qu'un essoufflement, des douleurs dans la poitrine, des douleurs et un gonflement dans un membre, une faiblesse ou un engourdissement d'un côté du corps après avoir reçu CUTAQUIG.
Appelez votre médecin si vous présentez les signes et symptômes suivants : des maux de tête sévères, une raideur de la nuque, une somnolence, de la fièvre, une photophobie, des nausées et des vomissements après avoir reçu CUTAQUIG. Il pourrait s’agir de signes de méningite aseptique. Votre médecin décidera si des examens supplémentaires sont nécessaires et si vous devez continuer à utiliser CUTAQUIG.
CUTAQUIG contient des anticorps de groupes sanguins susceptibles de provoquer la destruction des globules rouges et donc une anémie (faible nombre de globules rouges).
Votre professionnel de la santé pourra éviter les complications éventuelles en s'assurant :
· Que vous n'êtes pas sensible à l'immunoglobuline humaine normale
Ce médicament doit commercer par être perfusé lentement. La vitesse de perfusion recommandée, mentionnée dans la rubrique 3, doit être scrupuleusement respectée.
· Que les patients soient attentivement surveillés pour s’assurer qu’aucun symptôme n’apparaisse pendant la durée de la perfusion, en particulier si :
o vous recevez de l'immunoglobuline humaine normale pour la première fois
o vous preniez auparavant un autre médicament que CUTAQUIG
o votre dernière perfusion remonte à longtemps (plus de huit semaines)
· Dans ces cas, une surveillance est alors recommandée pendant la première perfusion et pendant une heure après la fin de celle-ci. Si ces situations ne vous concernent pas, il est recommandé d'être sous surveillance pendant au moins 20 minutes après l'administration.
Enfants et adolescents
Les avertissements et précautions décrits s'appliquent tant aux adultes qu'aux enfants.
Autres médicaments et CUTAQUIG 165 mg/mL, solution injectable
· Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
· Vous ne devez pas mélanger CUTAQUIG avec d'autres médicaments.
· Avant une vaccination, vous devez informer votre médecin vaccinateur que vous êtes sous traitement par CUTAQUIG. CUTAQUIG (comme toutes les solutions d'immunoglobulines humaines normales) peut influencer les effets de certains vaccins contenant des virus vivants, comme les vaccins contre la rougeole, la rubéole, les oreilles ou la varicelle. Il est donc possible que, après avoir reçu CUTAQUIG, vous deviez attendre jusqu'à 3 mois avant de pouvoir recevoir un vaccin contenant un virus vivant atténué. Dans le cas d'un vaccin contre la rougeole, cette diminution d’efficacité peut persister jusqu’à un an.
· Mesure du taux de glucose sanguin
· Certains systèmes de mesure du taux de glucose sanguin (appelés lecteurs de glycémie) interprètent par erreur le maltose contenu dans CUTAQUIG, solution pour perfusion comme du glucose. Il peut en résulter une lecture d’un taux de glucose faussement élevé pendant la durée de la perfusion et jusqu’à environ 15 heures après sa fin, et par conséquent, une administration inappropriée d’insuline entraînant une hypoglycémie dangereuse (c.à.d. une baisse du taux de sucre dans le sang).
· De même, des cas de véritables hypoglycémies peuvent ne pas être traités si l’état d’hypoglycémie est masqué par une lecture faussement élevée du taux de glucose.
· Par conséquent, lorsque CUTAQUIG ou d’autres produits contenant du maltose sont administrés, la mesure du taux de glucose sanguin doit être effectuée en utilisant une méthode spécifique du glucose. Des systèmes basés sur la méthode de glucose-déshydrogénase pyrroloquinoléine quinone (GDH PQQ) ou glucose-dye-oxydoréductase ne doivent pas être utilisés.
· Examinez attentivement la notice d’utilisation de la méthode de mesure du taux de glucose sanguin, y compris des bandelettes réactives, pour déterminer si le système est compatible avec l’utilisation de produits injectables contenant du maltose. En cas de doute, veuillez consulter votre médecin qui déterminera si votre méthode de mesure du taux de glucose peut être utilisée avec des produits injectables contenant du maltose.
CUTAQUIG 165 mg/mL, solution injectable avec des aliments, boissons et de l'alcool
Aucun effet n'a été observé
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament. Ce produit ne doit être utilisé pendant la grossesse ou l'allaitement qu'après consultation de votre médecin ou pharmacien.
Aucune étude clinique n'a été menée avec CUTAQUIG chez les femmes enceintes. Toutefois, des médicaments contenant des immunoglobulines sont utilisés chez les femmes enceintes et allaitantes depuis des années et aucun effet nocifs n'a été observé sur le déroulement de la grossesse ou sur le bébé.
Si vous allaitez et que vous recevez CUTAQUIG, les immunoglobulines contenues dans ce médicament passeront dans votre lait maternel. Votre bébé pourrait donc être protégé contre certaines infections.
Selon l’expérience obtenue avec les immunoglobulines aucun effet nocif n'est attendu sur la fertilité.
Conduite de véhicules et utilisation de machines
L'aptitude à conduire et à utiliser des machines peut être altérée par certains effets indésirables associés à CUTAQUIG. Les patients qui présentent des effets indésirables pendant le traitement doivent attendre que ces effets se soient dissipés avant de conduire ou d’utiliser des machines.
CUTAQUIG 165 mg/mL, solution injectable contient du sodium
Ce médicament contient 33,1 mg de sodium (composant principal du sel de cuisine/table) par flacon de 48 mL et 13,8 mg par flacon de 20 mL. Cela équivaut respectivement à 1,7 % et 0,7 % de l'apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
Informations concernant la composition de CUTAQUIG
CUTAQUIG est fabriqué à partir de plasma de sang humain (la partie liquide du sang). Lorsque les médicaments sont préparés à partir de sang ou de plasma humain, des mesures de prévention de la transmission d’infections sont mises en place.
Ceci inclut :
· une sélection rigoureuse des donneurs de sang et de plasma de façon à exclure les donneurs risquant d’être porteurs d’infections,
· le contrôle de chaque don et des mélanges de plasma afin de détecter la présence de virus/d’infection,
· l'inclusion d'étapes, dans le processus de traitement du sang et du plasma, capables d'inactiver ou d’éliminer les virus.
Malgré ces mesures, le risque de transmission d’agents infectieux ne peut pas être totalement exclu lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés. Ceci s'applique également à tous les virus inconnus ou émergents ou aux autres types d'infections.
Les mesures prises sont considérées comme efficaces contre les virus enveloppés tels que le virus de l’immunodéficience humaine (VIH - le virus qui provoque le SIDA), le virus de l’hépatite B (VHB) et le virus de l’hépatite C (VHC).
Les mesures prises peuvent être d’une efficacité limitée contre les virus non enveloppés tels que le virus de l'hépatite A et le parvovirus B19.
Les immunoglobulines humaines normales ne sont pas associées aux infections par le virus de l'hépatite A et le parvovirus B19, probablement grâce aux anticorps protecteurs présents dans le produit.
Il est vivement recommandé que, chaque fois que vous recevez une dose de CUTAQUIG, le nom et le numéro du lot du produit soient consignés afin de pouvoir garder une trace des lots utilisés (voir également Annexe I : Guide d'administration).
3. COMMENT UTILISER CUTAQUIG 165 mg/mL, solution injectable ?
Ce produit doit être perfusé sous la peau (administration par voie sous-cutanée ou SC).
Le traitement sera instauré par un médecin ou un(e) infirmier/ère expérimenté dans le traitement des patients dont le système immunitaire est faible.
Lorsque le médecin ou l'infirmier/ère aura trouvé la dose et la vitesse de perfusion qui vous convient, et lorsque vous aurez reçu les premières perfusions sous surveillance, vous pourrez choisir de vous administrer le traitement vous-même chez vous ou choisir que votre aidant (formé) vous l'administre à domicile. Votre médecin ou infirmier/ère expérimenté dans la formation des patients au traitement à domicile s'assurera que vous et votre aidant receviez une formation et des informations précises sur:
· la technique de perfusion aseptique (sans transmettre de microbes),
· l'utilisation du dispositif de perfusion (si nécessaire),
· la tenue d'un journal de traitement,
· les mesures à prendre en cas d’apparition d'effets indésirables graves (voir aussi rubrique 4).
Lorsque vous serez capable d’assurer vous-même votre traitement, et si aucun effet indésirable n’est apparu pendant le traitement, le médecin pourra vous autoriser à poursuivre le traitement à domicile.
Posologie
Votre dosage et votre vitesse de perfusion seront déterminés par votre médecin qui adaptera la posologie en fonction de votre poids, des traitements précédents éventuels et de votre réponse aux traitements. Respectez toujours la posologie indiquée par votre médecin.
Traitement de substitution des déficits immunitaires primitifs :
Votre médecin déterminera si vous avez besoin d'une dose de charge (pour les adultes et les enfants) d'au minimum 1,2 à 3,0 g/kg de poids corporel répartie sur plusieurs jours. Après cela, vous recevrez CUTAQUIG régulièrement et passerez d'une administration quotidienne à une administration pouvant aller de tous les jours jusqu’à une semaine sur deux. La dose cumulée par mois sera d'environ 2,4 à 4,8 mL/kg de poids corporel. Votre professionnel de la santé pourra adapter la dose en fonction de votre réponse au traitement.
Traitement de substitution des déficits immunitaires secondaires :
La dose recommandée de CUTAQUIG sera administrée à intervalles répétés (environ une fois par semaine) pour parvenir à une dose mensuelle cumulée de l'ordre de 1,2-2,4 mL/kg. Il peut être nécessaire d'administrer chaque dose unique sur des sites anatomiques différents. Votre professionnel de la santé pourra adapter la dose en fonction de votre réponse au traitement.
Ne modifiez pas la dose ou l'intervalle entre les administrations sans en avoir parlé à votre médecin. Si vous pensez que vous devriez recevoir CUTAQUIG plus fréquemment ou moins fréquemment, parlez-en à votre médecin. Si vous pensez avoir oublié une dose, contactez votre médecin le plus rapidement possible.
Mode et voie d'administration
Choix du (des) site(s) de perfusion :
CUTAQUIG peut être perfusé par voie sous-cutanée dans l'abdomen, la cuisse, partie supérieure du bras et/ou de la jambe/hanche. Plusieurs sites de perfusion sous-cutanée peuvent être utilisés en même temps. Le nombre de sites de perfusion est illimité, mais ils doivent être espacés d'au moins 5 cm. Changez de site de perfusion pour chaque administration, comme recommandé par votre médecin ou infirmier/ère.
La quantité perfusée par site varie, mais il est recommandé de fractionner les grands volumes (> 30 mL) et de les perfuser à différents sites. Chez les enfants et adolescents, le site de perfusion peut être changé tous les 5 à 15 mL.
Vitesse de perfusion :
La vitesse de perfusion initiale recommandée est de 15 mL/h/site si vous n’avez jamais reçu d’IgSC. Si vous recevez déjà un traitement par IgSC et que vous passez sous CUTAQUIG, il est recommandé d’utiliser la même vitesse d’administration lors des perfusions initiales que celle utilisée précédemment. Pour les perfusions suivantes, si les premières sont bien tolérées, la vitesse de perfusion peut être graduellement augmentée d’environ 10 mL/h/site toutes les 2 à 4 semaines chez les adultes (≥ 40 kg) et d’un maximum de 10 mL/h/site toutes les 4 semaines chez les patients pédiatriques (< 40 kg).
Par la suite, si vous tolérez bien les perfusions initiales à la dose complète par site et à la vitesse maximale, une augmentation de la vitesse de perfusion peut être envisagée pour les perfusions suivantes jusqu’à atteindre un maximum de 67,5 mL/h/site chez les adultes (≥ 40 kg) et 25 mL/h/site chez les patients pédiatriques (< 40 kg). Des instructions d'utilisation détaillées sont fournies ci-dessous.
CUTAQUIG est destiné à être administré par voie sous-cutanée (sous la peau) uniquement. N'injectez pas CUTAQUIG dans un vaisseau sanguin.
N'utilisez CUTAQUIG à domicile que si vous avez reçu les instructions et une formation adéquates par votre professionnel de la santé.
Suivez les conseils d'administration indiqués à la fin de cette notice (Annexe I) étape par étape et utilisez une technique aseptique/stérile lorsque vous administrez CUTAQUIG.
Si on vous a demandé de le faire, utilisez des gants pour préparer la perfusion.
Utilisation chez les enfants et les adolescents
Les mêmes indications, dose et fréquence de perfusion que les adultes s'appliquent aux enfants et aux adolescents (âgés de 0 à 18 ans).
Si vous avez utilisé plus de CUTAQUIG 165 mg/mL, solution injectable que vous n’auriez dû
Si vous pensez avoir perfusé une trop grande quantité de CUTAQUIG, contactez votre professionnel de la santé le plus rapidement possible.
Si vous oubliez d’utiliser CUTAQUIG 165 mg/mL, solution injectable
Si vous oubliez une dose, contactez votre médecin le plus rapidement possible. Ne perfusez pas de dose double de CUTAQUIG pour compenser la dose que vous avez oublié de prendre.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Certains des effets secondaires, tels que les maux de tête, les frissons ou les douleurs corporelles, peuvent être atténués en ralentissant la vitesse de perfusion.
Aucun effet indésirable grave lié n'a été observé chez les patients traités par CUTAQUIG au cours des études cliniques évaluant sa sécurité.
Vous pourriez être allergique (hypersensible) aux immunoglobulines et des réactions allergiques, comme une chute soudaine de la pression artérielle et, dans de rares cas un choc, pourraient survenir. Les médecins connaissent ces effets indésirables possibles et ils vous surveilleront pendant et après les premières perfusions.
Avertissez immédiatement votre médecin si vous présentez les effets suivants :
· Sensation de tête légère, étourdissements ou syncope,
· Eruption cutanée et démangeaisons, gonflement dans la bouche ou la gorge, difficultés à respirer, respiration sifflante,
· Fréquence cardiaque anormale, douleurs dans la poitrine, coloration bleue des lèvres ou des doigts et des orteils,
· Vision floue.
Lorsque vous utilisez CUTAQUIG à domicile, vous pouvez réaliser la perfusion en présence de votre aidant. Il vous aidera à déceler l'apparition éventuelle d'une réaction allergique. En cas de symptômes d'une réaction allergique, arrêtez la perfusion et demandez éventuellement de l'aide.
Reportez-vous également à la rubrique 2 de cette notice concernant le risque de réactions allergiques.
Les effets indésirables suivants sont très fréquents (ils peuvent concerner plus de 1 perfusion sur 10) :
· Réactions au site de perfusion, telles que rougeur, gonflement, démangeaisons et inconfort.
· Maux de tête
· Nausées
· Fatigue
Les effets indésirables suivants sont rares (ils peuvent concerner plus de 1 perfusion sur 10000) :
· Etourdissements
· Douleurs abdominales
· Distension abdominale
· Vomissements
· Haut-le coeur
· Douleurs musculaires
· Douleurs articulaires
· Fièvre
· Frissons
· Sensation de gêne dans la poitrine
· Syndrome pseudo-grippal
· Douleur
· Sensation de malaise général
· Test sanguin positif aux anticorps
· Résultats irréguliers aux tests sanguins montrant une destruction des globules rouges
· Augmentation du taux d’hémoglobine
· Augmentation du taux de créatinine sanguine
· Éruption cutanée
· Réactions cutanées
· Taux élevés de certaines enzymes du foie appelées transaminases
· Hypersensibilité (érythème, urticaire, par exemple)
· Élévation de la tension artérielle
· Problèmes dus à la formation de caillots sanguins dans les vaisseaux sanguins (thrombose veineuse profonde, AVC, par exemple)
· Caillots dans les vaisseaux sanguins (voir également la rubrique 2, « Avertissements et précautions »)
· Démangeaisons
· Mal de dos
Effets indésirables observés avec des médicaments similaires
Les effets indésirables supplémentaires suivants ont été observés lors de la perfusion sous cutanée d'immunoglobulines humaines normales. Il est possible qu'un patient traité par CUTAQUIG soit affecté.
· Frissons
· Pâleur
· Diarrhée
· Douleur au site d’injection
· Rougissement rapide du cou/visage
· Sensation de chaleur
· Sensation de froid
· Faiblesse
· Serrement de la gorge
· Difficultés à respirer
· Symptômes semblables à l'asthme
· Toux
· Gonflement du visage
· Syndrome appelé méningite aseptique (voir également rubrique 2 « Avertissements et précautions »)
Avertissez immédiatement votre médecin si vous présentez les effets suivants. Ils peuvent être le signe d'un problème grave.
· Mal de tête sévère accompagné de nausées, de vomissements, d'une raideur de la nuque, de fièvre et d'une sensibilité à la lumière. Il pourrait s'agir des signes d'un gonflement temporaire et réversible, non infectieux, des membranes entourant le cerveau et la moelle épinière (méningite).
· Douleur, gonflement, chaleur, rougeur ou grosseur au niveau des jambes ou des bras, essoufflement inexpliqué, douleurs ou gêne dans la poitrine qui s'intensifient lorsque l'on inspire profondément, pouls rapide inexpliqué, engourdissement ou faiblesse dans un côté du corps, confusion soudaine ou difficultés à parler. Il pourrait s'agir des signes de la présence d'un caillot sanguin.
Ces effets indésirables peuvent survenir même si vous avez déjà reçu des immunoglobulines humaines et que vous les aviez bien tolérées.
Référez-vous également à la rubrique 2 pour d'autres informations sur les circonstances susceptibles d'accroître le risque d'effets indésirables.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CUTAQUIG 165 mg/mL, solution injectable ?
Tenir hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver au réfrigérateur (2°C – 8°C). Ne pas congeler. Conserver le flacon dans l’emballage d’origine, à l’abri de la lumière.
Pendant sa durée de conservation, le produit peut être conservé à température ambiante (à conserver à une température ne dépassant pas 25°C) pendant une période unique ne dépassant pas 9 mois, sans être replacé au réfrigérateur pendant cette période. Il doit être éliminé s’il n’est pas utilisé après cette période.
Après la première ouverture, le produit doit être utilisé immédiatement.
N'utilisez pas CUTAQUIG si la solution est trouble ou contient des particules.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient CUTAQUIG 165 mg/mL, solution injectable
· La substance active est : Immunoglobuline humaine normale (IgSC)
Immunoglobuline humaine normale.................................................................................. 165 mg
(Pureté de l’IgG au moins égale à 95 %)
Pour 1 mL de solution
Distribution des sous-classes d'IgG (valeurs approximatives) :
IgG1 ............... 71 %
IgG2 ............... 25 %
IgG3 ............... 3 %
IgG4................. 2 %
· Les autres composants sont : maltose, polysorbate 80 et eau pour préparations injectables.
La teneur maximale en IgA est de 300 microgrammes/mL.
CUTAQUIG contient ≤ 30 mmol/L de sodium.
Qu’est-ce que CUTAQUIG 165 mg/mL, solution injectable et contenu de l’emballage extérieur
CUTAQUIG est une solution injectable.
La solution est transparente et incolore.
Pendant la conservation, le liquide peut devenir légèrement opalescent et jaune pâle.
CUTAQUIG est disponible dans les conditionnements suivants :
6, 10, 12, 20, 24 ou 48 mL de solution dans un flacon (verre de type I) muni d'un capuchon en caoutchouc bromobutyl - conditionnement de 1,10 ou 20.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
62 BIS AVENUE ANDRE MORIZET
92100 BOULOGNE BILLANCOURT
Exploitant de l’autorisation de mise sur le marché
OCTAPHARMA FRANCE
62 BIS AVENUE ANDRE MORIZET
92100 BOULOGNE BILLANCOURT
OCTAPHARMA PHARMAZEUTIKA PRODUKTIONSGES.M.B.H.
OBERLAAER STRASSE 235
1100 VIENNE
AUTRICHE
OU
OCTAPHARMA AB
LARS FORSSELLS GATA 23
11275 STOCKHOLM
SUEDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Guide d’administration
1. Préparez le nombre de flacons de CUTAQUIG nécessaire
· Si les flacons sont conservés au réfrigérateur, laissez-les atteindre la température ambiante pendant au moins 90 minutes avant de procéder à la perfusion.
· Ne réchauffez pas les flacons et ne les placez pas aux micro-ondes.
· N'agitez pas les flacons pour éviter la formation de mousse.
2. Préparation de la perfusion
· Choisissez et préparez une zone de travail propre en utilisant des lingettes antiseptiques ou une solution désinfectante (Figure 1).
· Rassemblez le matériel de perfusion :
o Pompe à perfusion (facultatif) et seringue(s) compatible(s)
o Aiguille (pour prélever le produit du flacon)
o Set de perfusion
o Tubulure de perfusion et raccord en Y (si nécessaire)
o Alcool et lingettes alcoolisées/antiseptiques
o Compresse ou pansement et adhésif transparent
o Conteneur à objets pointus
Journal de traitement et stylo
· Lavez-vous soigneusement les mains et laissez-les sécher (Figure 2). Utilisez un gel désinfectant comme on vous l'a montré pendant la formation.
· Si nécessaire, programmez la pompe conformément aux instructions du manuel de l'utilisateur et comme vous l'a montré votre professionnel de la santé.
3. Vérification et ouverture des flacons
· Inspectez attentivement chaque flacon et vérifiez :
o que la dose indiquée sur l'étiquette est correcte et correspond à la prescription,
o l’aspect de la solution (elle doit être transparente et incolore à jaune pâle ou marron clair),
o que le capuchon protecteur est bien présent et qu'il n'est pas cassé,
o la date de péremption et le numéro de lot.
o N'utilisez pas la solution si elle est trouble ou contient des particules.
· Retirez le capuchon protecteur.
· Désinfectez le bouchon en caoutchouc à l'aide d’une lingette antiseptique et laissez-le sécher (Figure 3).
4. Préparation et remplissage de la seringue
· Ouvrez l’emballage de la seringue et de l’aiguille stériles.
· Fixez l’aiguille à la seringue en la vissant.
· Reculez le piston de la seringue pour la remplir d'une quantité d’air approximativement égal à la quantité de solution à prélever du flacon.
· Insérez l’aiguille dans le flacon et renversez-le, le bouchon vers le bas. Injectez l’air dans le flacon - assurez-vous que la pointe de l’aiguille n'est pas immergée dans la solution pour éviter la formation de mousse.
· Ensuite, assurez-vous ensuite que l’aiguille reste toujours dans la solution et aspirez lentement CUTAQUIG (Figure 4).
· Retirez l'aiguille du flacon.
· Il peut être nécessaire de répéter cette procédure si vous devez utiliser plus d’un flacon pour obtenir la dose calculée.
· Lorsque vous avez terminé, retirez l’aiguille et placez-la dans le conteneur pour objets tranchants.
· Passez immédiatement à l’étape suivante, car la solution d’immunoglobulines doit être utilisée rapidement.
5. Préparation de la pompe à perfusion et de la tubulure (facultatif)
· Suivez les instructions du fabricant pour la préparation de la pompe à perfusion.
· Pour amorcer la tubulure d’administration, attachez la seringue à la tubulure de perfusion et appuyez délicatement sur le piston pour remplir la tubulure de CUTAQUIG et éliminer toute la quantité d'air. (Figure 5).
6. Choix des sites de perfusion et insertion des aiguilles de perfusion
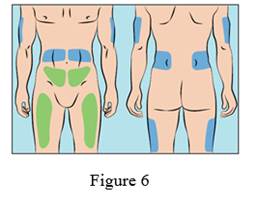
· CUTAQUIG peut être perfusé dans les zones suivantes : abdomen, cuisse, partie haute du bras et/ou de la jambe/hanche (Figure 6).
· Les sites de perfusion doivent être espacés d'au moins 5 cm.
· Utilisez des sites de perfusion différents de ceux que vous avez utilisés lors de l'administration précédente.
· Évitez d’insérer l’aiguille dans des cicatrices, des tatouages, des vergetures ou des zones de peau blessée/enflammée/rouge.
· Nettoyez la peau du (des) site(s) de perfusion choisi(s) avec une lingette antiseptique et laissez la peau sécher.
· Pincez la peau entre le pouce et l’index autour du site d’injection (Figure 7) et retirez délicatement la coiffe de l'aiguille et insérez l'aiguille dans la peau (Figure 8). L’angle de l’aiguille dépendra du type de set de perfusion utilisé.
7. Vérification de la perfusion
· La solution ne doit pas être injectée dans un vaisseau sanguin.
· Fixez l’aiguille en place en la recouvrant d’une compresse stérile et d’un adhésif ou d’un pansement transparent (Figure 9).
8. Démarrage de la perfusion
· Commencez la perfusion. Si vous utilisez une pompe à perfusion, suivez les instructions du fabricant.
9. Consignation de la perfusion
· Sur chaque flacon de CUTAQUIG se trouve une étiquette détachable qui indique des informations sur le numéro de lot. Collez cette étiquette dans votre journal de traitement du patient ou dans votre journal de perfusions. Inscrivez les informations concernant la dose, la date, l'heure, le site de perfusion ainsi que toute infection, tout effet indésirable ou autre commentaire en lien avec cette perfusion.
10. Lorsque la perfusion est terminée
· Retirez l’aiguille et placez-la immédiatement dans le conteneur pour objets tranchants.
· Si nécessaire, appuyez une petite compresse à l'endroit où l'aiguille a été insérée et placez un pansement.
· Jetez immédiatement tout le matériel à usage unique et tout reste de produit non utilisé. Videz le(s) flacon(s) comme recommandé par votre professionnel de la santé et conformément aux exigences locales.
Rangez et conservez dans un lieu sûr tout le matériel réutilisable (p. ex. la pompe) jusqu'à la prochaine perfusion.