Dernière mise à jour le 08/01/2026
SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable
Indications thérapeutiques
SCOPOLAMINE BUTYLBROMURE KALCEKS contient la substance active butylbromure de scopolamine. Elle appartient à un groupe de médicaments appelés « antispasmodiques ». Ces médicaments soulagent les spasmes (contractions semblables à des crampes) des organes internes et atténuent les douleurs spasmodiques qui y sont liées.
Ce médicament est utilisé pour soulager les spasmes des muscles lisses du tractus gastro-intestinal et du tractus urogénital (estomac, intestins, voies biliaires, pancréas et voies urinaires).
SCOPOLAMINE BUTYLBROMURE KALCEKS peut également être utilisé dans des procédures médicales de diagnostic.
Présentations
> 10 ampoules en verre de 1 mL
Code CIP : 34009 550 837 4 0
Déclaration de commercialisation : 11/05/2023
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 26/06/2024
SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Butylbromure de scopolamine............................... ...................... 20 mg
Pour 1 mL de solution en ampoule.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide, incolore ou presque incolore, exempte de particules visibles.
Le pH est compris entre 3,7 à 5,5.
4.1. Indications thérapeutiques
Le butylbromure de scopolamine est utilisé en tant que spasmolytique pendant les examens radiologiques.
4.2. Posologie et mode d'administration
Adultes et enfants de plus de 12 ans
La dose est de 20 à 40 mg (1 à 2 ampoules) par voie intraveineuse lente, intramusculaire ou sous‑cutanée.
La dose quotidienne maximale est de 100 mg (5 ampoules).
Population pédiatrique
Dans les cas graves, chez les nourrissons et les enfants, la dose de 0,3 à 0,6 mg/kg de poids corporel peut être administrée par voie intraveineuse lente, intramusculaire ou sous-cutanée plusieurs fois par jour. La dose quotidienne maximale de 1,5 mg/kg de poids corporel ne doit pas être dépassée.
Mode d’administration
Voie intraveineuse, intramusculaire ou sous-cutanée.
Le butylbromure de scopolamine ne doit pas être administré par injection intramusculaire chez les patients traités avec des anticoagulants en raison du risque d'hématome intramusculaire.
SCOPOLAMINE BUTYLBROMURE KALCEKS peut être utilisé après dilution.
Le butylbromure de scopolamine ne doit pas être utilisé de manière quotidienne en continue ou sur des périodes prolongées sans rechercher la cause de la douleur abdominale.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Glaucome à angle fermé.
· Hypertrophie prostatique avec rétention urinaire.
· Sténose mécanique du tractus gastro-intestinal.
· Mégacôlon.
· Tachycardie.
· Myasthénie grave.
4.4. Mises en garde spéciales et précautions d'emploi
L'administration d'agents anticholinergiques tels que le butylbromure de scopolamine peut conduire à une augmentation de la pression intraoculaire chez des patients présentant un glaucome à angle fermé non diagnostiqué et donc non traité. Par conséquent, les patients doivent consulter rapidement un ophtalmologue s’ils présentent un œil rouge et douloureux, avec une perte de vision après injection de butylbromure de scopolamine.
Après administration parentérale de butylbromure de scopolamine, des cas d'anaphylaxie incluant des épisodes de choc ont été observés. Les patients recevant du butylbromure de scopolamine doivent être gardés en observation.
La prudence est recommandée chez les patients susceptibles de présenter un reflux gastro-œsophagien, car le butylbromure de scopolamine peut relâcher le sphincter œsophagien inférieur.
Ce médicament doit être utilisé avec prudence chez les patients présentant une insuffisance hépatique ou rénale, chez les patients souffrant d'hyperthyroïdie et chez les patients atteints de bronchite chronique en raison de l'augmentation de la viscosité des sécrétions bronchiques.
La prudence est de mise chez les patients atteints de maladies cardiovasculaires recevant un traitement parentéral par le butylbromure de scopolamine. Une surveillance de ces patients est recommandée.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu'il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Un traitement concomitant avec des antagonistes de la dopamine, tel que le métoclopramide peut entraîner une diminution des effets des deux médicaments sur le tractus gastro-intestinal.
Les effets tachycardisants des agents bêta-adrénergiques peuvent être renforcés par le butylbromure de scopolamine.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les données sur l'utilisation du butylbromure de scopolamine chez la femme enceinte sont limitées. Les études animales sont insuffisantes en ce qui concerne la toxicité sur la reproduction (voir rubrique 5.3). Par précaution, le butylbromure de scopolamine n’est pas recommandé pendant la grossesse.
Chez la femme enceinte, le médicament ne peut être utilisé qu'après une évaluation soigneuse du rapport bénéfice/risque.
Il n'existe pas de données suffisantes sur l'excrétion du butylbromure de scopolamine et de ses métabolites dans le lait maternel. L'utilisation du butylbromure de scopolamine pendant l'allaitement n'est pas recommandée.
Fertilité
Aucune étude sur les effets sur la fertilité humaine n'a été réalisée(voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Un grand nombre des effets indésirables listés peut être attribué aux propriétés anticholinergiques du butylbromure de scopolamine. Les effets indésirables anticholinergiques du butylbromure de scopolamine sont habituellement légers et transitoires.
Les effets indésirables sont présentés selon le système de classes d'organes MedDRA en utilisant la convention de fréquence suivante :
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100, < 1/10)
Peu fréquent (≥ 1/1 000, < 1/100)
Rare (≥ 1/10 000, < 1/1 000)
Très rare (< 1/10 000)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
|
Affections du système immunitaire |
Fréquence indéterminée |
Choc anaphylactique* y compris les cas d'évolution fatale, réactions anaphylactiques*, dyspnée*, réactions cutanées* (par exemple urticaire*, rash*, érythème*, prurit*), autres réactions d'hypersensibilité* |
|
Confusion mentale chez les personnes âgées, excitabilité, irritabilité |
||
|
Affections oculaires |
Fréquent |
Troubles de l’accommodation |
|
|
Fréquence indéterminée |
Mydriase*, augmentation de la pression intraoculaire*, diminution des sécrétions lacrymales |
|
|
Fréquence indéterminée |
|
|
Affections cardiaques |
Fréquent |
Tachycardie |
|
Affections vasculaires |
Fréquent |
Etourdissements |
|
|
Fréquence indéterminée |
Diminution de la pression artérielle*, bouffées vasomotrices* |
|
Fréquence indéterminée |
||
|
Affections gastro-intestinales |
Fréquent |
Sécheresse buccale |
|
|
Fréquence indéterminée |
Constipation |
|
Affections de la peau et du tissu sous-cutané |
Fréquence indéterminée |
Dyshidrose* |
|
Affections du rein et des voies urinaires |
Fréquence indéterminée |
Rétention urinaire* |
* Cet effet indésirable a été observé post-commercialisation. Avec une certitude de 95 %, la catégorie de fréquence n'est pas supérieure à « peu fréquent », mais pourrait être inférieure. Une estimation précise de la fréquence n'est pas possible car l'effet indésirable n'a pas été observé dans la base de données d'essais cliniques portant sur 185 patients.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
Symptômes
En cas de surdosage, des symptômes anticholinergiques peuvent apparaître.
Traitement
Les symptômes du surdosage en butylbromure de scopolamine répondent aux parasympathomimétiques. Pour les patients atteints de glaucome, un médecin ophtalmologiste doit être consulté rapidement. Les complications cardiovasculaires doivent être traitées selon les méthodes thérapeutiques habituelles. En cas de paralysie respiratoire, intubation et respiration artificielle doivent être pratiquées
Un cathétérisme peut être nécessaire en cas de rétention urinaire.
De plus, des mesures de soutien appropriées doivent être utilisées si nécessaire.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ALCALOIDES HEMISYNTHETIQUES DE LA BELLADONE : AMMONIUMS QUATERNAIRES, code ATC : A03BB01.
Le butylbromure de scopolamine exerce un effet spasmolytique sur les muscles lisses du tractus gastro-intestinal, des voies biliaires et des voies urogénitales. Le butylbromure de scopolamine est un ammonium quaternaire, il ne traverse pas la barrière hémato-encéphalique vers le système nerveux central (SNC). Par conséquent, aucun effet secondaire anticholinergique n'est observé au niveau du SNC. L'effet anticholinergique périphérique du butylbromure de scopolamine est dû en partie au blocage des ganglions parasympathiques de la paroi intestinale ainsi qu’à un effet anti‑muscarinique.
5.2. Propriétés pharmacocinétiques
Après administration intraveineuse, le butylbromure de scopolamine est rapidement distribué (t½α = 4 min, t½β = 29 min) dans les tissus. Le volume de distribution (Vss) est de 128 L (environ 1,7 L/kg). En raison de sa forte affinité pour les récepteurs muscariniques et les récepteurs nicotiniques, le butylbromure de scopolamine est principalement distribué dans les cellules musculaires de la région abdominale et pelvienne ainsi que dans les ganglions intramuraux des organes abdominaux. La liaison aux protéines plasmatiques est d'environ 4,4 %. Les études animales montrent que le butylbromure de scopolamine ne passe pas la barrière hémato-encéphalique, mais aucune donnée clinique n'est disponible.
Biotransformation et élimination
La principale voie métabolique est le clivage hydrolytique de la liaison ester. La demi-vie d’élimination terminale est d'environ 5 heures. La clairance totale est de 1,2 L/min. Après injection intraveineuse, 42 à 61 % de la dose est excrétée dans les urines et 28,3 à 37 % dans les fèces. Environ 50 % de la dose est excrétée dans les urines sous forme inchangée. Les métabolites excrétés par voie rénale se lient faiblement aux récepteurs muscariniques et ne sont donc pas considérés comme contribuant à l'effet du butylbromure de scopolamine.
5.3. Données de sécurité préclinique
Avant l'ouverture de l'ampoule :
5 ans
Après l’ouverture de l’ampoule :
Le médicament doit être utilisé immédiatement.
Durée de conservation après dilution :
La stabilité physico‑chimique en cours d’utilisation a été démontrée pendant 24 heures à 25°C et entre 2 et 8°C.
D'un point de vue microbiologique, sauf si la méthode d'ouverture/dilution exclut le risque de contamination microbienne, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, la durée et les conditions de conservation en cours d’utilisation relèvent de la seule responsabilité de l’utilisateur.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
Pour les conditions de conservation du médicament après dilution ou première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
1 mL de solution en ampoule en verre transparent de type I.
Les ampoules sont entourées d'une pellicule en PVC et placées dans une boîte en carton.
Boîtes de 5 ou 10 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
À usage unique. Après ouverture de l'ampoule, toute solution non utilisée doit être éliminée.
Le médicament doit être inspecté visuellement avant l'utilisation. Seules les solutions limpides exemptes de particules doivent être utilisées.
SCOPOLAMINE BUTYLBROMURE KALCEKS peut être dilué avec du dextrose ou avec une solution injectable de chlorure de sodium à 0,9 %.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
KRUSTPILS IELA 71E
RĪGA, LV-1057
LETTONIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 360 5 5 : 1 mL en ampoule (verre). Boîte de 5.
· 34009 550 837 4 0 : 1 mL en ampoule (verre). Boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 26/06/2024
SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable
Butylbromure de scopolamine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, ou votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable ?
3. Comment utiliser SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
SCOPOLAMINE BUTYLBROMURE KALCEKS contient la substance active butylbromure de scopolamine. Elle appartient à un groupe de médicaments appelés « antispasmodiques ». Ces médicaments soulagent les spasmes (contractions semblables à des crampes) des organes internes et atténuent les douleurs spasmodiques qui y sont liées.
Ce médicament est utilisé pour soulager les spasmes des muscles lisses du tractus gastro-intestinal et du tractus urogénital (estomac, intestins, voies biliaires, pancréas et voies urinaires).
SCOPOLAMINE BUTYLBROMURE KALCEKS peut également être utilisé dans des procédures médicales de diagnostic.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT d’utiliser SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable ?
N’utilisez jamais SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable :
· si vous êtes allergique au butylbromure de scopolamine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6
· si vous souffrez de glaucome (maladie de l’œil)
· si vous avez une augmentation du volume de la prostate et si vous avez des douleurs ou des difficultés pour uriner
· si vous avez des problèmes d'obstruction intestinale
· si vous avez un intestin anormalement dilaté (mégacôlon)
· si vous avez une augmentation du rythme cardiaque
· si vous souffrez d'une maladie appelée « myasthénie grave » (caractérisée par une faiblesse musculaire extrême).
Vous ne devez pas recevoir d'injection de butylbromure de scopolamine dans le muscle si vous prenez des médicaments pour prévenir la formation de caillots sanguins (anticoagulants), car un hématome (ecchymose) peut se former.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien, ou votre infirmier/ère avant d’utiliser SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable :
· si vous avez des douleurs abdominales inexpliquées qui persistent ou s'aggravent ou qui surviennent avec de la fièvre, une sensation de malaise, des changements dans vos selles, une sensibilité abdominale, une pression artérielle basse, une sensation de faiblesse ou du sang dans les selles.
· si vos intestins ne fonctionnent plus correctement (atonie intestinale)
· si vous avez une inflammation de l'œsophage associée à un reflux (quand l'acide gastrique remonte et pénètre dans l'œsophage)
· si vous avez une inflammation sévère du côlon qui récidive souvent (colite ulcéreuse)
· si vous souffrez d’insuffisance hépatique ou rénale
· si vous avez une thyroïde hyperactive (votre glande thyroïde produit trop d'hormones thyroïdiennes)
· si vous souffrez de bronchite chronique (inflammation des bronches).
Vous devez consulter un médecin immédiatement si vous présentez un œil rouge et douloureux avec perte de la vision après l'injection de butylbromure de scopolamine. Cela peut être le signe d'une pression élevée à l'intérieur de l'œil due à un glaucome à angle fermé jusqu’à présent non diagnostiqué et donc non traité.
Des réactions allergiques ont été observées après l'injection de butylbromure de scopolamine (voir rubrique 4). Par conséquent, vous serez surveillé après l'injection de butylbromure de scopolamine et traité de manière appropriée si de telles réactions se produiraient.
Autres médicaments et SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable
Informez votre médecin ou votre pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament, y compris les médicaments obtenus sans ordonnance et les médicaments à base de plantes.
En particulier, informez votre médecin ou votre pharmacien si vous prenez l’un des médicaments suivants :
· médicaments contre la dépression appelés « antidépresseurs tricycliques » ou « antidépresseurs tétracycliques »
· médicaments pour traiter les allergies (antihistaminiques)
· médicaments pour traiter les maladies mentales
· médicaments pour traiter l'insuffisance cardiaque ou l'asthme (bêtamimétiques)
· médicaments pour traiter les troubles du rythme cardiaque (quinidine ou disopyramide)
· amantadine (utilisé pour traiter la maladie de Parkinson)
· médicaments pour traiter les troubles respiratoires (tels que tiotropium, ipratropium, médicaments similaires à l'atropine)
· métoclopramide (utilisé pour traiter les nausées, les vomissements ou les troubles gastro‑intestinaux).
Si vous n'êtes pas certain que l'une des situations ci-dessus s'applique à vous, parlez-en à votre médecin ou à votre pharmacien avant de recevoir ce médicament.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament..
Grossesse :
Il existe des données limitées sur l'utilisation du produit chez les femmes enceintes et allaitantes. Par conséquent, pour des raisons de sécurité, il n'est pas recommandé d'utiliser ce médicament pendant la grossesse. Pendant la grossesse, le médicament ne peut être utilisé que sur avis d'un médecin qui évaluera le rapport bénéfice/risque.
Allaitement :
Pendant l'allaitement, le médicament ne peut être utilisé que sur avis d'un médecin qui évaluera le rapport bénéfice/risque.
Conduite de véhicules et utilisation de machines
Certaines personnes peuvent avoir des problèmes de vue ou des étourdissements après avoir été traitées par ce médicament. Si vous êtes concerné, attendez que votre vue revienne à la normale ou que vous ne ressentiez plus d’étourdissements avant de conduire ou d'utiliser des machines.
SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable ?
Ce médicament ne doit pas être utilisé de manière quotidienne en continue ou sur des périodes prolongées sans rechercher la cause des douleurs abdominales.
Adultes en enfants de plus de 12 ans
La dose est de 20 à 40 mg (1 à 2 ampoules) plusieurs fois par jour. La dose quotidienne maximale est de 100 mg (5 ampoules).
Utilisation chez les enfants
Dans les cas graves, chez les nourrissons et les enfants, la dose de 0,3 à 0,6 mg/kg de poids corporel peut être utilisée plusieurs fois par jour. La dose quotidienne maximale de 1,5 mg/kg de poids corporel ne doit pas être dépassée.
Si vous avez utilisé plus de SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable que vous n’auriez dû
Si vous pensez que vous avez reçu trop de médicament, parlez-en immédiatement à votre médecin ou à votre infirmière. Les symptômes suivants peuvent apparaître : sécheresse de la bouche, rougeur de la peau, difficulté à uriner, accélération du rythme cardiaque et troubles de la vue.
Si vous oubliez d’utiliser SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable
Vous ne recevrez pas de double dose pour compenser une dose oubliée. Vous ne recevrez la dose suivante que si votre état de santé l'exige.
Si vous arrêtez d’utiliser SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable
Votre médecin ne vous fera une injection que dans les cas aigus. S'il est nécessaire de poursuivre le traitement, votre médecin vous fera passer aux comprimés de butylbromure de scopolamine.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Un grand nombre des effets indésirables listés peut être attribué aux propriétés anticholinergiques du butylbromure de scopolamine. Les effets indésirables anticholinergiques du butylbromure de scopolamine sont généralement légers et transitoires.
Les effets indésirables sont présentés en utilisant la convention de fréquence suivante :
· Très fréquent (pouvant affecter plus de 1 personne sur 10)
· Fréquent (pouvant affecter jusqu’à 1 personne sur 10)
· Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100)
· Rare (pouvant affecter jusqu’à 1 personne sur 1 000)
· Très rare (pouvant affecter jusqu’à 1 personne sur 10 000)
· Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Troubles du système immunitaire
· Fréquence indéterminée : choc anaphylactique (réaction allergique soudaine et grave se manifestant par un essoufflement, une défaillance de la circulation sanguine et un gonflement, y compris des cas d'évolution fatale, réactions anaphylactiques, essoufflement, réactions cutanées (par exemple urticaire, éruption, rougeur de la peau, démangeaisons), autres réactions d'hypersensibilité.
Troubles psychiatriques
· Fréquence indéterminée : confusion mentale chez les personnes âgées, excitabilité, irritabilité.
Troubles oculaires
· Fréquent : troubles de l'accommodation (mise au point).
· Fréquence indéterminée : dilatation des pupilles, augmentation de la pression à l'intérieur de l'œil, réduction des sécrétions lacrymales.
Troubles cardiaques
· Fréquent : augmentation de la fréquence cardiaque.
· Fréquence indéterminée : palpitations.
Troubles vasculaires
· Fréquent : étourdissements.
· Fréquence indéterminée : diminution de la pression artérielle, bouffées vasomotrices.
Troubles respiratoires
· Fréquence indéterminée : épaississement des sécrétions bronchiques.
Troubles gastro-intestinaux
· Fréquent : sécheresse de la bouche.
· Fréquence indéterminée : constipation.
Troubles de la peau et du tissu sous-cutané
· Fréquence indéterminée : trouble de l'excrétion de la sueur.
Troubles rénaux et urinaires
· Fréquence indéterminée : difficulté à uriner.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
5. COMMENT CONSERVER SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Ce médicament ne nécessite pas de précautions particulières de conservation.
N’utilisez pas ce médicament après la date de péremption indiquée sur le carton et l’ampoule après EXP. La date de péremption fait référence au dernier jour de ce mois.
Durée de conservation après ouverture de l'ampoule : Le médicament doit être utilisé immédiatement.
Durée de conservation après dilution : La stabilité physico chimique en cours d’utilisation a été démontrée pendant 24 heures à 25°C et entre 2 et 8°C.
D'un point de vue microbiologique, sauf si la méthode d'ouverture/dilution exclut le risque de contamination microbienne, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, la durée et les conditions de conservation en cours d’utilisation relèvent de la seule responsabilité de l’utilisateur.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SCOPOLAMINE BUTYLBROMURE KALCEKS 20 mg/mL, solution injectable
· La substance active est :
Butylbromure de scopolamine........................................................................................... 20 mg
Pour 1 mL de solution en ampoule.
· Les autres composants sont :
Chlorure de sodium, acide chlorhydrique concentré (pour l'ajustement du pH), hydroxyde de sodium (pour l'ajustement du pH), eau pour préparations injectables.
Solution injectable.
Solution limpide, incolore ou presque incolore, exempte de particules visibles.
1 mL de solution en ampoules en verre transparent de type I.
Les ampoules sont entourées d'une pellicule en PVC et placées dans une boîte en carton.
Boîtes de 5 ou 10 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
KRUSTPILS IELA 71E
RĪGA, LV-1057
LETTONIE
Exploitant de l’autorisation de mise sur le marché
84 QUAI JOSEPH GILLET
69004 LYON
KRUSTPILS IELA 71E
RĪGA, LV-1057
LETTONIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
_________________________________________________________________________________
Les informations suivantes sont destinées exclusivement aux professionnels de santé.
Mode d’administration
Voie intraveineuse, intramusculaire ou sous-cutanée.
Instructions d’utilisation et autres manipulations
À usage unique. Après ouverture de l’ampoule, toute solution non utilisée doit être éliminée.
Le médicament doit être inspecté visuellement avant utilisation. Seules les solutions limpides exemptes de particules doivent être utilisées.
Peut être dilué avec du dextrose ou avec une solution injectable de chlorure de sodium à 0,9 %.
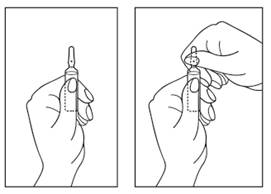
Instruction d'ouverture de l'ampoule
1) Tournez l'ampoule avec la pointe colorée vers le haut. S’il y a de la solution dans la partie supérieure de l'ampoule, tapotez doucement avec votre doigt pour faire passer toute la solution dans la partie inférieure de l'ampoule.
2) Utilisez vos deux mains pour ouvrir l’ampoule. Tout en maintenant la partie inférieure de l’ampoule avec une main, utilisez l’autre main pour casser la partie supérieure de l’ampoule dans la direction opposée au point coloré (voir figure ci-dessous).
|
|
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.