Dernière mise à jour le 02/02/2026
LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
Indications thérapeutiques
LECIGIMON est utilisé pour le traitement de la maladie de Parkinson. Il est utilisé lorsque la maladie est au stade avancé et lorsque les médicaments pris par voie orale (pris par la bouche) n’ont plus un effet suffisant.
LECIGIMON est un gel administré de façon continue au moyen d’une pompe et d’une sonde directement dans votre intestin grêle.
LECIGIMON contient trois substances actives :
· lévodopa
· carbidopa (sous forme de carbidopa monohydratée)
· entacapone
Comment agit LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
Chez une personne atteinte de la maladie de Parkinson, les taux de dopamine dans le cerveau sont faibles. La lévodopa est convertie en dopamine dans le cerveau, atténuant ainsi les symptômes de la maladie de Parkinson. La carbidopa et l’entacapone améliorent les effets antiparkinsoniens de la lévodopa.
Présentations
> 7 cartouche(s) polypropylène de 47 ml
Code CIP : 34009 302 356 1 4
Déclaration de commercialisation : 09/10/2024
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 14/12/2022 | Inscription (CT) | Le service médical rendu par LECIGIMON (levodopa/carbidopa/entacapone) est important dans l’indication de l’AMM. |
| Insuffisant | Avis du 30/03/2022 | Inscription (CT) | Le service médical rendu par LECIGIMON (lévodopa/carbidopa/entacapone) est insuffisant pour justifier d’une prise en charge par la solidarité nationale dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 14/12/2022 | Inscription (CT) | Compte tenu : • des données évaluées lors de la première inscription issues d’une étude de pharmacocinétique versus DUODOPA (lévodopa/carbidopa) réalisée à court terme (deux jours) sur un faible ef-fectif de patients (n=11), n’ayant pas permis de démontrer l’intérêt clinique de l’ajout de l’entacapone à la bithérapie levodopa/carbidopa administrée par une pompe implantable, • des nouvelles données d’efficacité de faible niveau de preuve issues de la littérature, • de l’absence de données robustes sur la qualité de vie des patients, et prenant en compte : • le profil de tolérance connu des trois molécules (lévodopa/carbidopa/entacapone) • les modalités d’administration permettant une administration entérale de l’entacapone là où celle-ci est uniquement disponible en administration orale, • le besoin médical partiellement couvert avec uniquement une seule spécialité disponible en administration intestinale continue (DUODOPA (lévodopa/carbidopa)), la Commission considère que LECIGIMON (lévodopa/carbidopa/entacapone) n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la stratégie de prise en charge de la maladie de Parkinson à un stade avancé avec fluctuations motrices et hyperkinésie ou dyski-nésie sévère, lorsque les associations disponibles d’antiparkinsoniens par voie orale n’ont pas donné de résultats satisfaisants. |
ANSM - Mis à jour le : 05/04/2024
LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Lévodopa.............................................................................................................................. 20 mg
Carbidopa monohydratée......................................................................................................... 5 mg
Equivalent à carbidopa anhydre............................................................................................. 4,6 mg
Entacapone........................................................................................................................... 20 mg
Pour 1 mL de gel intestinal
47 mL de gel (1 cartouche) contiennent 940 mg de lévodopa, 235 mg de carbidopa monohydratée et 940 mg d’entacapone.
Excipient à effet notoire :
1 mL de gel contient 3,5 mg de sodium (1 cartouche contient 166 mg de sodium).
Pour la liste complète des excipients, voir rubrique 6.1.
Gel visqueux opaque jaune ou rouge-jaunâtre.
pH : 4,5– 5,5
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Pour administration intestinale (voir rubrique 6.6). La posologie sera adaptée individuellement afin d’obtenir une réponse clinique optimale, ce qui consiste à maximiser le temps « ON » utile pendant la journée en minimisant le nombre et la durée des périodes « OFF » (bradykinésie) et en minimisant le temps « ON » avec dyskinésies invalidantes.
La dose totale quotidienne de LECIGIMON se compose de trois doses ajustées individuellement : la dose matinale en bolus, la dose d’entretien continue et les doses supplémentaires en bolus. Le traitement est habituellement limité à la période d’éveil du patient. Si cela est justifié sur le plan médical, LECIGIMON peut être administré jusqu’à 24 heures par jour. La dose journalière maximale recommandée est de 100 mL (soit 2000 mg de lévodopa, 500 mg de carbidopa monohydratée et 2000 mg d’entacapone ; voir également rubrique 4.4).
Durant l’administration de la dose d’entretien, le profil des concentrations plasmatiques de lévodopa en fonction du temps a un aspect quelque peu différent, avec une augmentation graduelle de la concentration plasmatique de lévodopa tout au long de la journée, par rapport à ce qui a été précédemment observé avec du gel intestinal contenant de la lévodopa/carbidopa. Un exemple de profil des concentrations plasmatiques en fonction du temps lors de l’utilisation de LECIGIMON est fourni à la rubrique 5.2. Si nécessaire et au cas par cas, la pompe peut être préprogrammée afin de délivrer jusqu’à trois doses d’entretien dans la journée par période de 24 heures. En cas de dyskinésies en fin de journée, une réduction de 10– 20 % de la dose en milieu de journée pourrait être pertinente. Toutes les doses d’entretien doivent être augmentées progressivement jusqu’à obtenir l’effet clinique souhaité.
La fonction de doses d’entretien multiples peut également être utile, par exemple, chez les patients présentant des dyskinésies ou une raideur persistantes et nécessitant, de façon récurrente, des doses supplémentaires en fin de journée, ou chez les patients recevant le traitement sur 24 heures et nécessitant une réduction de la dose d’entretien durant la nuit.
Dose matinale
La dose matinale est administrée avec la pompe de manière à atteindre rapidement (dans un délai de 30 minutes) le niveau de dose thérapeutique. La dose est ajustée par paliers de 0,1 mL (2 mg). La dose matinale totale est généralement comprise entre 5 et 10 mL, ce qui correspond à 100– 200 mg de lévodopa. La dose matinale totale ne doit pas dépasser 15 mL (300 mg de lévodopa).
Dose d’entretien continue
La dose d’entretien continue est administrée avec la pompe de manière à maintenir le niveau de dose thérapeutique. La dose d’entretien peut être ajustée par paliers de 2 mg/heure (0,1 mL par heure). La dose d’entretien est généralement de 0,7– 5,0 mL/heure (15– 100 mg de lévodopa/heure). La dose journalière maximale recommandée est de 100 mL (2000 mg de lévodopa).
Doses supplémentaires en bolus
Les doses supplémentaires sont administrées selon les besoins si le patient devient hypokinétique. La dose supplémentaire est généralement inférieure à 3 mL mais elle doit être ajustée individuellement. Si le besoin de doses supplémentaires quotidiennes est supérieur à 5 par jour, l’augmentation de la dose d’entretien devra être envisagée.
Titration chez les patients passant d’une association de lévodopa/carbidopa à LECIGIMON
LECIGIMON contient de l’entacapone qui augmente les effets de la lévodopa. Par conséquent, il pourra s’avérer nécessaire de réduire la dose journalière totale de LECIGIMON de 20– 35 % en moyenne par rapport à la dose de lévodopa et carbidopa reçue précédemment par le patient en l’absence d’inhibiteur de la catéchol-O-méthyltransférase (COMT). Dans la mesure où l’effet de l’entacapone sur la lévodopa est dépendant de la dose, une réduction plus importante de la dose est attendue chez les patients recevant des doses élevées.
La détermination de la dose initiale est basée sur la dose journalière de lévodopa du patient. La dose matinale doit être équivalente à la dose matinale antérieure de lévodopa, afin d’atteindre une concentration plasmatique thérapeutique le plus rapidement possible, plus le volume nécessaire pour remplir la sonde. La dose d’entretien continue doit être basée sur la dose journalière de lévodopa du patient (en excluant la dose matinale) et initialement réduite à 65 % de la dose journalière antérieure de lévodopa. Les doses sont ensuite augmentées graduellement, en fonction des symptômes cliniques, jusqu’à obtention de l’effet souhaité.
Exemple de détermination de la dose initiale avant titration :
Dose journalière totale antérieure de lévodopa : 1360 mg
Dose matinale antérieure de lévodopa : 100 mg
Dose journalière antérieure de lévodopa (en excluant la dose matinale) : 1260 mg/jour
Dose matinale : 100 mg
Correspondant à un volume de : 100 mg / 20 mg/mL = 5 mL
Dose matinale totale : 5 mL + 3 mL (volume de remplissage de la sonde) = 8 mL
Dose d’entretien continue : 1260 mg/jour
Dose d’entretien continue réduite à 65 % : 1260 mg/jour x 0,65 = 819 mg/jour
Consommation par heure (calculée sur la base de 16 heures d’administration par jour) : 819 mg/16 heures = 51 mg/heure
Correspondant à un débit horaire de : 51 mg/heure/20 mg/mL = 2,5-2,6 mL/heure
Titration chez les patients passant d’une association de lévodopa/bensérazide à LECIGIMON
L’entacapone augmente légèrement plus (de 5 à 10 %) la biodisponibilité de la lévodopa à partir des préparations standard de lévodopa/bensérazide qu’avec des préparations standard de lévodopa/carbidopa. La transition d’une association de lévodopa/bensérazide à LECIGIMON n’a pas été étudiée.
Titration chez les patients passant d’une association de lévodopa/carbidopa/entacapone à LECIGIMON
La détermination de la dose initiale est basée sur la dose journalière de lévodopa du patient. La dose matinale initiale doit être équivalente à la dose matinale antérieure de lévodopa, plus le volume nécessaire pour remplir la sonde. La dose d’entretien continue est convertie selon un ratio de un pour un et est basée sur la dose journalière de lévodopa du patient (en excluant la dose matinale). Les doses sont ensuite augmentées graduellement, en fonction des symptômes cliniques, jusqu’à obtention de l’effet souhaité.
La transition chez les patients passant d’une association de lévodopa/inhibiteur de la DDC/tolcapone à LECIGIMON n’a pas été étudiée.
Transition chez les patients passant d’un traitement concomitant par lévodopa/carbipoda et agonistes dopaminergiques à LECIGIMON
Lors de la transition d’un traitement par agonistes dopaminergiques à LECIGIMON en monothérapie, le risque de symptômes de sevrage des agonistes dopaminergiques doit être pris en compte et un arrêt brutal des agonistes dopaminergiques doit être évité.
Surveillance du traitement
Après la titration initiale, la dose matinale et la dose d’entretien sont finement ajustées sur une période de quelques semaines.
LECIGIMON est initialement administré en monothérapie. Si nécessaire, d’autres médicaments antiparkinsoniens peuvent être pris de façon concomitante (pour le traitement concomitant de la maladie de Parkinson, voir également rubriques 4.3 et 4.5). En cas d’arrêt ou de modification du traitement par d’autres médicaments antiparkinsoniens, il peut être nécessaire d’ajuster les doses de LECIGIMON.
Une diminution brutale de l’efficacité du traitement marquée par des fluctuations motrices récurrentes doit conduire à soupçonner un déplacement de la partie distale de la sonde du duodénum/jéjunum dans l’estomac. Un contrôle radiologique doit alors être pratiqué afin de déterminer la localisation de la sonde. En cas de positionnement incorrect, l’extrémité de la sonde sera repositionnée dans le duodénum/la partie haute du jéjunum.
Traitement dans le contexte d’une démence
En cas de suspicion ou de diagnostic de démence avec abaissement du seuil de confusion, la pompe doit être manipulée uniquement par un professionnel de santé ou un soignant.
Abus du médicament
En cas de suspicion d’abus du médicament, la pompe utilisée avec LECIGIMON (Crono LECIG) est équipée d’une fonction de verrouillage. Cette fonction empêche le patient de modifier les paramètres de la pompe.
Populations particulières
Population pédiatrique
Il n’y a pas d’utilisation justifiée de LECIGIMON dans la population pédiatrique dans l’indication de la maladie de Parkinson à un stade avancé avec fluctuations motrices sévères et hyperkinésie/dyskinésie.
Sujets âgés
L’expérience d’utilisation de l’association lévodopa/carbidopa/entacapone chez le sujet âgé est importante. Les doses pour tous les patients, y compris les patients âgés, sont ajustées individuellement par titration.
Insuffisance hépatique
La dose de LECIGIMON est ajustée individuellement par titration afin d’obtenir l’effet optimal (qui correspond à des expositions plasmatiques à la lévodopa, la carbidopa et l’entacapone optimisées individuellement). Par conséquent, les effets potentiels de l’insuffisance hépatique sur l’exposition à la lévodopa, la carbidopa et l’entacapone sont pris en compte par la titration de la dose. Aucune étude sur la pharmacocinétique de la carbidopa et de la lévodopa n’a été conduite chez des patients insuffisants hépatiques. L’élimination de l’entacapone est réduite chez les patients présentant une insuffisance hépatique légère à modérée. Il est par conséquent recommandé de réaliser la titration de la dose avec prudence chez les patients présentant une insuffisance hépatique légère à modérée. Il peut être nécessaire de réduire la dose (voir rubrique 5.2). LECIGIMON ne doit pas être utilisé chez les patients atteints d’insuffisance hépatique sévère (voir rubrique 4.3).
Insuffisance rénale
La dose de LECIGIMON est ajustée individuellement par titration afin d’obtenir l’effet optimal (qui correspond à des expositions plasmatiques à la lévodopa, la carbidopa et l’entacapone optimisées individuellement). Par conséquent, les effets potentiels de l’insuffisance rénale sur l’exposition à la lévodopa, la carbidopa et l’entacapone sont pris en compte par la titration de la dose. L’insuffisance rénale ne modifie pas la pharmacocinétique de l’entacapone. Aucune étude particulière de la pharmacocinétique de la lévodopa et de la carbidopa n’a été réalisée chez des patients atteints d’insuffisance rénale. La prudence est donc de mise lors de la titration de la dose chez les patients présentant une insuffisance rénale sévère, y compris chez les patients dialysés (voir rubrique 5.2).
Interruption du traitement
Le traitement par LECIGIMON peut être interrompu à tout moment en retirant la sonde et en laissant la plaie cicatriser.
Les patients doivent faire l’objet d’une surveillance attentive si une réduction brutale de la dose ou un arrêt du traitement par LECIGIMON est nécessaire, en particulier si le patient reçoit des antipsychotiques (voir rubrique 4.4).
En cas d’arrêt du traitement, le patient doit recevoir un autre traitement.
Mode d’administration
LECIGIMON est un gel pour administration intestinale continue (dans le duodénum ou la partie haute du jéjunum). LECIGIMON doit être administré exclusivement au moyen de la pompe Crono LECIG (CE 0476). Un manuel contenant des instructions pour l’utilisation de la pompe portable est fourni avec la pompe.
Une sonde naso-duodénale/naso-jéjunale temporaire doit être envisagée pour déterminer si le patient répond favorablement à cette méthode de traitement avant qu’une sonde à demeure de gastrostomie endoscopique percutanée avec sonde jéjunale (sonde GEP-J) ne soit mise en place. Si le médecin estime que cette évaluation n’est pas nécessaire, la phase de test naso-jéjunale peut être omise et le traitement instauré directement avec la mise en place de la sonde GEP-J.
Pour une administration à long terme, ce gel doit être administré directement dans le duodénum ou dans la partie haute du jéjunum à l’aide d’une pompe portable, par une sonde à demeure mise en place lors d’une gastrostomie endoscopique percutanée comprenant la mise en place d’une sonde transabdominale externe et d’une sonde intestinale interne. Une gastro-jéjunostomie radiologique peut être envisagée de manière alternative si la gastrostomie endoscopique percutanée ne peut pas être réalisée pour une raison quelconque. La mise en place de la sonde et l’ajustement de la dose doivent se faire en partenariat avec un service de neurologie.
Remplacement de la cartouche
Lorsqu’une nouvelle cartouche va être utilisée, elle doit être connectée à la pompe portable et le système doit être relié à la sonde pour administrer le produit, conformément aux instructions fournies.
Les cartouches de médicament sont à usage unique et ne doivent pas être utilisées plus de 24 heures.
Une fois la cartouche installée, la pompe d’administration peut être portée près du corps pendant une durée allant jusqu’à 16 heures. Pour le traitement durant la nuit, la pompe ne doit pas être portée près du corps mais peut être posée, par exemple, sur la table de nuit.
Après ouverture, une cartouche peut être utilisée jusqu’au jour suivant, c’est-à-dire pendant 24 heures au maximum après sa première ouverture. La cartouche doit être détachée de la pompe au bout de 24 heures d’utilisation ou lorsqu’elle est vide, selon ce qui survient en premier.
Le gel peut prendre une couleur légèrement jaune/rougeâtre à la fin de sa durée de conservation. Cela n’a pas d’influence sur la concentration du médicament ou l’effet du traitement.
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
· Glaucome à angle fermé.
· Insuffisance cardiaque sévère.
· Arythmie cardiaque sévère.
· Accident vasculaire cérébral aigu.
· Insuffisance hépatique sévère.
· Les inhibiteurs non sélectifs de la MAO et les inhibiteurs sélectifs de la MAO-A sont contre-indiqués avec LECIGIMON. Ces inhibiteurs doivent être arrêtés au moins deux semaines avant l’instauration du traitement par LECIGIMON. LECIGIMON peut être administré en même temps que la dose recommandée par le fabricant d’un inhibiteur sélectif de la MAO-B (par exemple, le chlorhydrate de sélégiline) (voir rubrique 4.5).
· LECIGIMON est contre-indiqué en cas de contre-indications aux adrénergiques, par exemple : phéochromocytome, hyperthyroïdie et syndrome de Cushing.
· Antécédents de syndrome malin des neuroleptiques (SMN) et/ou de rhabdomyolyse non traumatique.
· Lésions cutanées suspectes non diagnostiquées ou antécédents de mélanome car la lévodopa pourrait activer un mélanome malin.
4.4. Mises en garde spéciales et précautions d'emploi
LECIGIMON doit être administré avec prudence aux patients atteints de cardiopathie ischémique, de troubles cardio-vasculaires ou pulmonaires sévères, d’asthme, d’affections rénales, hépatiques ou endocriniennes ou ayant des antécédents d’ulcère gastro-duodénal ou de convulsions.
Chez les patients avec des antécédents d’infarctus du myocarde présentant des troubles séquellaires du rythme auriculaire, nodal ou ventriculaire, la fonction cardiaque doit être étroitement surveillée pendant la période des premiers ajustements posologiques.
Tous les patients traités par LECIGIMON doivent être étroitement surveillés à la recherche de modifications de leur état mental, d’une dépression avec idées suicidaires et d’autres comportements asociaux. Les patients ayant des antécédents de psychoses ou un épisode psychotique actuel doivent être traités avec précaution.
L’administration concomitante d’antipsychotiques bloquant les récepteurs de la dopamine, en particulier les antagonistes D2, demande de la prudence et le patient doit être étroitement surveillé à la recherche d’une disparition de l’effet antiparkinsonien ou d’une aggravation des symptômes parkinsoniens (voir rubrique 4.5).
Les patients atteints de glaucome chronique à angle ouvert peuvent être traités par LECIGIMON avec prudence, si la pression intra-oculaire est bien contrôlée et une surveillance régulière à la recherche de variations de la pression intra-oculaire doit être réalisée.
LECIGIMON peut provoquer une hypotension orthostatique. LECIGIMON doit donc être administré avec prudence aux patients prenant d’autres médicaments susceptibles d’entraîner une hypotension orthostatique (voir rubrique 4.5).
Les substances actives de LECIGIMON ont été associées à une somnolence et à des épisodes d’endormissement brutal chez des patients atteints de la maladie de Parkinson et la prudence s’impose donc en cas de conduite de véhicules ou d’utilisation de machines (voir rubriques 4.7 et 4.8).
Un syndrome ressemblant au syndrome malin des neuroleptiques (SMN), avec raideur musculaire, hyperthermie, troubles mentaux (par exemple, agitation, confusion, coma) et élévation de la créatine phosphokinase sérique, a été rapporté en association avec l’arrêt brutal des agents antiparkinsoniens. Une rhabdomyolyse secondaire à un SMN ou une dyskinésie sévère ont été observées rarement chez des patients souffrant de la maladie de Parkinson. Depuis l’introduction de l’entacapone sur le marché, des cas isolés de SMN ont été rapportés, tout particulièrement après une diminution soudaine de la posologie ou un arrêt brutal de l’entacapone et d’autres médicaments dopaminergiques. Par conséquent, les patients doivent être étroitement suivis lorsque la posologie de LECIGIMON est brutalement réduite ou interrompue, en particulier si le patient est aussi traité par des antipsychotiques/neuroleptiques.
Les patients doivent être surveillés de façon régulière à la recherche de l’apparition de troubles du contrôle des pulsions. Les patients et le personnel soignant doivent être informés sur le fait que des troubles du contrôle des pulsions incluant le jeu pathologique, une augmentation de la libido, une hypersexualité, des dépenses ou des achats compulsifs, une consommation excessive de nourriture et une alimentation compulsive peuvent survenir chez les patients traités par des agonistes dopaminergiques et/ou d’autres traitements dopaminergiques contenant de la lévodopa, tels que LECIGIMON. Une révision du traitement est recommandée si de tels symptômes apparaissent.
Des études épidémiologiques ont montré que les patients atteints de la maladie de Parkinson présentent un risque plus élevé de développer un mélanome que la population générale. On ne sait pas si l’augmentation observée du risque est due à la maladie de Parkinson ou à d’autres facteurs, tels que les médicaments utilisés pour traiter cette maladie. Les patients et les médecins devront donc surveiller régulièrement la survenue éventuelle de mélanomes pendant l’utilisation de LECIGIMON. Idéalement, des examens cutanés périodiques devront être réalisés par des personnes dûment qualifiées (dermatologues, par exemple).
Si une anesthésie générale doit être pratiquée, LECIGIMON peut être poursuivi aussi longtemps que le patient est autorisé à prendre des liquides et des médicaments par voie orale. Si le traitement doit être interrompu temporairement, LECIGIMON peut être repris à la même dose qu’auparavant dès que la prise orale de liquides est autorisée.
Il peut être nécessaire de réduire la dose de LECIGIMON afin d’éviter des dyskinésies induites par la lévodopa.
Une évaluation périodique des fonctions hépatique, hématopoïétique, cardiovasculaire et rénale est recommandée au cours d’un traitement prolongé par LECIGIMON.
LECIGIMON contient de l’hydrazine, un produit de dégradation de la carbidopa qui peut être génotoxique et éventuellement carcinogène. La dose journalière moyenne recommandée de LECIGIMON est de 46 mL (soit 1,6 mg d’hydrazine/jour) et la dose journalière maximale recommandée de LECIGIMON est de 100 mL (soit 3,5 mg d’hydrazine/jour au maximum). Les conséquences cliniques de cette exposition à l’hydrazine ne sont pas connues.
En cas d’antécédent de chirurgie dans la partie supérieure de l’abdomen, des difficultés peuvent être rencontrées pour effectuer une gastrostomie ou une jéjunostomie.
Les complications rapportées pour la lévodopa/carbidopa dans les études cliniques et observées après la mise sur le marché incluent : abcès, bézoard, iléus, érosion/ulcère du site d’implantation, hémorragie intestinale, ischémie intestinale, obstruction intestinale, perforation intestinale, invagination intestinale, pancréatite, péritonite, pneumonie (incluant pneumonie d’inhalation), pneumopéritoine, infection de la plaie postopératoire et septicémie. Les bézoards sont des concrétions d’aliments indigestes (tels que des fibres non digestibles émanant de légumes ou de fruits) retenus dans le tractus digestif. Un bézoard situé près de l’extrémité du jéjunum peut être à l’origine d’une obstruction intestinale ou de la formation d’une invagination intestinale. La plupart des bézoards sont retrouvés dans l’estomac mais les bézoards peuvent être rencontrés n’importe où dans le tractus digestif. Une douleur abdominale peut être un symptôme des complications mentionnées ci-dessus. Certains de ces événements peuvent avoir des conséquences graves, comme la nécessité d’une intervention chirurgicale et/ou le décès. Les patients doivent informer leur médecin s’ils présentent un des symptômes associés aux événements ci-dessus.
Une diminution de la capacité à manipuler le système (pompe, tubes) peut entraîner des complications. Chez ces patients, un prestataire de soins (par exemple, un[e] infirmier[-ère], un[e] aide-soignant[e] ou un[e] parent[e] proche) doit assister le patient.
Une aggravation brutale ou graduelle de la bradykinésie peut indiquer une obstruction du dispositif pour une raison quelconque, et nécessiter une investigation.
Les substances actives contenues dans LECIGIMON ont été associées à une perte de poids ; les soignants doivent donc y être attentifs. Un suivi du poids est recommandé afin d’éviter une perte de poids excessive. Cela s’applique en particulier aux patients présentant une diarrhée. Pour les patients souffrant de diarrhée, un suivi du poids est recommandé pour éviter une potentielle perte de poids excessive. Une diarrhée prolongée ou persistante survenant lors de la prise d’entacapone peut être un signe de colite. En cas de diarrhée prolongée ou persistante, le médicament doit être arrêté et une autre thérapie médicale appropriée ainsi que des investigations doivent être envisagés.
Si nécessaire, le remplacement de LECIGIMON, soit par de la lévodopa et un inhibiteur de la DDC sans entacapone, soit par un autre traitement dopaminergique, doit s’effectuer lentement. Une augmentation de la dose de lévodopa pourra être requise.
Chez les patients présentant une anorexie progressive, une asthénie et une perte de poids sur une durée relativement courte, un examen médical général, incluant une évaluation de la fonction hépatique, doit être envisagé.
La lévodopa/carbidopa peut donner des faux positifs à la recherche de corps cétoniques par bandelette urinaire et cette réaction n’est pas modifiée par l’ébullition de l’échantillon d’urine. L’utilisation de méthodes basées sur la glucose oxydase peut donner des faux négatifs pour la glycosurie.
Le syndrome de dysrégulation dopaminergique (SDD) est un trouble addictif résultant en une utilisation abusive du produit, observé chez certains patients traités par carbidopa/lévodopa. Avant l’instauration du traitement, les patients et les soignants doivent être avertis du risque potentiel de développer un SDD (voir également rubrique 4.8).
En cas de suspicion d’abus du médicament, la pompe utilisée avec LECIGIMON (Crono LECIG) est équipée d’une fonction de verrouillage.
Une polyneuropathie a été rapportée chez des patients traités par le gel intestinal de lévodopa/carbidopa. Avant et régulièrement après avoir débuté le traitement par LECIGIMON, les patients doivent être évalués à la recherche d’antécédents ou de signes d’une polyneuropathie et de facteurs de risque connus.
Ce médicament contient 3,5 mg de sodium par mL. Chaque cartouche contient 166 mg de sodium, ce qui équivaut à 8,3 % de l'apport journalier maximal de 2 g de sodium recommandé par l'OMS.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L’administration concomitante de LECIGIMON avec les médicaments suivants doit être effectuée avec précaution :
Antihypertenseurs
Une hypotension orthostatique symptomatique peut se produire en cas d’addition de lévodopa et d’un inhibiteur de la décarboxylase au traitement de patients prenant déjà des antihypertenseurs. Un ajustement de la posologie de l’agent antihypertenseur peut être nécessaire.
Antidépresseurs
Les inhibiteurs non sélectifs de la MAO et les inhibiteurs sélectifs de la MAO-A sont contre-indiqués avec LECIGIMON. Ces inhibiteurs doivent être arrêtés au moins deux semaines avant l’instauration du traitement par LECIGIMON (voir rubrique 4.3).
Quelques rares cas d’effets indésirables, y compris une hypertension et des dyskinésies, ont été rapportés suite à l’utilisation concomitante d’antidépresseurs tricycliques et de préparations à base de carbidopa/lévodopa.
Un nombre significatif de patients atteints de la maladie de Parkinson ont été traités par une association de lévodopa, carbidopa, entacapone et des antidépresseurs tricycliques et aucune interaction pharmacodynamique n’a été observée. La prudence s’impose cependant en cas d’utilisation concomitante d’antidépresseurs et de LECIGIMON.
Anticholinergiques
Les anticholinergiques peuvent agir de manière synergique avec la lévodopa pour diminuer les tremblements. Cependant, leur utilisation simultanée peut exacerber les mouvements involontaires anormaux. Les anticholinergiques peuvent diminuer les effets de la lévodopa en retardant son absorption. Un ajustement de la dose de LECIGIMON peut être nécessaire.
Autres médicaments antiparkinsoniens
LECIGIMON peut être administré en même temps que la dose recommandée d’un inhibiteur sélectif de la MAO-B (par exemple, le chlorhydrate de sélégiline). L’utilisation concomitante de sélégiline et de lévodopa/carbidopa a été associée à une hypotension orthostatique grave. Par conséquent, une diminution de la dose de LECIGIMON peut être nécessaire lorsqu’un inhibiteur sélectif de la MAO-B est ajouté.
L’amantadine et les agonistes dopaminergiques tels que le piribédil exercent un effet synergique avec la lévodopa, et peuvent augmenter les événements indésirables liés à la lévodopa. Un ajustement de la dose de LECIGIMON peut être nécessaire.
Autres médicaments
Les antagonistes des récepteurs de la dopamine (certains neuroleptiques, notamment phénothiazines, butyrophénones et rispéridone ainsi que des antiémétiques, notamment le métoclopramide), les benzodiazépines, l’isoniazide, la phénytoïne et la papavérine peuvent réduire les effets thérapeutiques de la lévodopa. Les patients recevant ces médicaments de manière simultanée avec LECIGIMON doivent être surveillés étroitement afin de déceler une éventuelle diminution de la réponse thérapeutique.
Les sympathomimétiques peuvent augmenter les événements indésirables cardiovasculaires liés à la lévodopa.
La lévodopa se chélate avec le fer dans le tractus gastro-intestinal, conduisant à une réduction de l’absorption de la Iévodopa. LECIGIMON et les préparations martiales par voie orale doivent donc être pris à 2– 3 heures d’intervalle au moins. Par exemple, la préparation martiale peut être prise avant l’heure du coucher si le patient n’utilise pas la pompe durant la nuit.
Compte tenu de l’affinité in vitro de l’entacapone pour l’isoforme 2C9 du cytochrome P450 (voir rubrique 5.2), LECIGIMON peut éventuellement interférer avec les principes actifs dont le métabolisme dépend de cette isoenzyme, comme la S-warfarine par exemple. Cependant, dans une étude des interactions réalisée chez des volontaires sains, l’entacapone n’a pas modifié les taux plasmatiques de la S-warfarine, tandis que l’aire sous la courbe (ASC) de la R-warfarine a augmenté en moyenne de 18 % (intervalle de confiance à 90 % : 11– 26 %]. Les valeurs de l’INR ont augmenté en moyenne de 13 % (intervalle de confiance à 90 % : 6– 19 %]. Un contrôle de l’INR est donc recommandé en cas d’introduction de LECIGIMON chez des patients recevant de la warfarine.
Les effets de l’administration d’antiacides et de LECIGIMON sur la biodisponibilité de la lévodopa n’ont pas été étudiés.
Interactions avec des aliments
Dans la mesure où la lévodopa est compétitive de certains acides aminés, l’absorption de la lévodopa peut être perturbée chez les patients recevant un régime alimentaire hyperprotéiné.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données ou il existe des données limitées sur l’utilisation de l’association lévodopa/carbidopa/entacapone chez la femme enceinte. Des études effectuées chez l’animal ont mis en évidence une toxicité des différents composants sur la reproduction (voir rubrique 5.3). Le risque potentiel en clinique n’est pas connu. LECIGIMON n’est pas recommandé pendant la grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception sauf si les bénéfices pour la mère dépassent les risques éventuels pour le fœtus.
La lévodopa et peut-être les métabolites de la lévodopa sont excrétés dans le lait maternel. Des données montrent que la lactation est supprimée au cours d’un traitement par la lévodopa.
On ne sait pas si la carbidopa et l’entacapone ou leurs métabolites sont excrétés dans le lait maternel. Les études chez l’animal ont montré que la carbidopa et l’entacapone sont excrétés dans le lait maternel, mais on ignore s’il en est de même dans l’espèce humaine.
Il n’y a pas de données suffisantes sur les effets de l’association lévodopa/carbidopa/entacapone ou de leurs métabolites chez les nouveau-nés/nourrissons. L’allaitement doit donc être évité au cours du traitement par LECIGIMON.
Fertilité
Aucun effet secondaire sur la fertilité n’a été observé lors des études précliniques avec la carbidopa, la lévodopa ou l’entacapone non combinés. Des études de fertilité menées sur les animaux n’ont pas été conduites avec l’association de lévodopa, carbidopa et entacapone.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les patients traités par LECIGIMON et présentant une somnolence et/ou des accès de sommeil d’apparition soudaine doivent être informés qu’ils ne doivent pas conduire de véhicules ni exercer une activité où une altération de leur vigilance pourrait les exposer, eux ou d’autres personnes, à un risque de blessure grave ou de décès (par exemple, la manœuvre de machines) jusqu’à la disparition de ces épisodes récurrents et de la somnolence (voir également rubriques 4.4 et 4.8).
Résumé du profil de tolérance
Le profil de tolérance attendu pour LECIGIMON est basé sur les données disponibles issues des essais cliniques et de l’expérience depuis la commercialisation de la lévodopa/carbidopa en gel intestinal et de l’association de lévodopa/carbidopa/entacapone par voie orale.
Les effets indésirables liés au médicament qui surviennent fréquemment avec la lévodopa/carbidopa en gel intestinal et qui sont donc susceptibles de survenir avec LECIGIMON incluent les nausées et les dyskinésies. Les effets indésirables liés au dispositif et à l’intervention chirurgicale qui surviennent fréquemment avec la lévodopa/carbidopa en gel intestinal et qui sont donc susceptibles de survenir avec LECIGIMON incluent : douleur abdominale, complications liées à l’insertion du dispositif, formation excessive de tissu de granulation, érythème du site d’incision, infection de la plaie postopératoire, écoulement postopératoire, douleur opératoire et réaction au site d’incision. La plupart de ces effets indésirables ont été rapportés au début des études, à la suite de la réalisation de la gastrostomie endoscopique percutanée et se sont produits au cours des 28 premiers jours.
Les effets indésirables les plus fréquemment rapportés avec la lévodopa/carbidopa/entacapone par voie orale sont les suivants : dyskinésies (chez environ 19 % des patients), symptômes digestifs, notamment nausées et diarrhées (chez respectivement près de 15 % et 12 % des patients), affections musculo-squelettiques et systémiques (chez environ 12 % des patients) et, enfin, coloration brun-rougeâtre des urines non cliniquement significative (chromaturie ; chez environ 10 % des patients). Des effets indésirables graves, tels qu’hémorragie digestive (peu fréquent) et angio-œdème (rare) sont survenus lors des essais cliniques avec la lévodopa/carbidopa/entacapone par voie orale ou l’entacapone associé à la lévodopa et un inhibiteur de la DDC.
Des hépatites graves, essentiellement de type cholestatique, une rhabdomyolyse et un syndrome malin des neuroleptiques peuvent apparaître sous lévodopa/carbidopa/entacapone par voie orale, bien qu’aucun cas n’ait été identifié parmi les données des essais cliniques.
Une étude pharmacocinétique de LECIGIMON a été réalisée chez 11 patients atteints de la maladie de Parkinson à un stade avancé. Les effets indésirables considérés associés à LECIGIMON étaient des céphalées, des nausées et des sensations vertigineuses. Aucun effet indésirable grave n’a été rapporté au cours de cette étude sur 2 jours. Aucun effet indésirable n’a été considéré associé à la pompe lors de l’administration de LECIGIMON.
Liste des effets indésirables sous forme de tableau
Les effets indésirables liés au médicament, à l’intervention chirurgicale et au dispositif, observés dans le cadre des essais cliniques et depuis la commercialisation de la lévodopa/carbidopa en gel intestinal et de la lévodopa/carbidopa/entacapone par voie orale sont résumés dans le tableau 1 ci-dessous par classe de systèmes d’organes et par fréquence.
Pour la lévodopa/carbidopa/entacapone par voie orale, les effets indésirables listés dans le tableau 1 ont été compilés à partir des essais cliniques en double aveugle et des données recueillies depuis la commercialisation de l’entacapone pour le traitement combiné avec la lévodopa et un inhibiteur de la DDC.
Tableau 1. Effets indésirables d’après les essais cliniques et l’expérience depuis la commercialisation de la lévodopa/carbidopa en gel intestinal et/ou de la lévodopa/carbidopa/entacapone par voie orale.
|
Classe de systèmes d’organes selon MedDRA
|
Très fréquent (≥ 1/10) |
Fréquent (≥ 1/100, < 1/10) |
Peu fréquent (≥ 1/1 000, < 1/100) |
Rare (≥ 1/10 000, < 1/1000) |
Fréquence non connue (ne peut être estimée sur la base des données disponibles) |
|
Effets indésirables liés au médicament |
|||||
|
Infections et infestations |
Infection des voies urinaires |
|
|
|
|
|
Affections hématologiques et du système lymphatique |
|
Anémie |
Leucopénie, Thrombopénie |
|
Agranulocytose |
|
Affections du système immunitaire |
|
|
|
|
Réaction anaphylactique |
|
Troubles du métabolisme et de la nutrition |
Perte de poids |
Augmentation des taux d’acides aminés (augmentation de l’acide méthylmalonique), Augmentation de l’homocystéinémie, Diminution de l’appétit, Prise de poids, Déficit en vitamine B6, Déficit en vitamine B12 |
|
|
|
|
Affections psychiatriques |
Anxiété, Dépression, Insomnie |
Cauchemars, Agitation, Etat confusionnel, Hallucinations, Trouble du contrôle des pulsions, Troubles psychotiques, Attaques de sommeil, Troubles du sommeil |
Suicide, Désorientation, Euphorie, Peur, Augmentation de la libido (voir rubrique 4.4) Tentative de suicide/comportement suicidaire |
Pensées étranges |
Syndrome de dysrégulation dopaminergiquea |
|
Affections du système nerveux |
Dyskinésie, Maladie de Parkinson/Exacerbation du syndrome parkinsonien (par exemple, bradykinésie) |
Vertiges, Dystonie, Céphalées, Hypoesthésie, Phénomène « on-off », Paresthésies, Polyneuropathie, Somnolence, Syncope, Tremblement, Hyperkinésie |
Ataxie, Convulsions |
|
Syndrome malin des neuroleptiques, Troubles de la mémoire, Démence |
|
Affections oculaires |
|
Vision floue |
Glaucome à angle fermé, Blépharospasme, Diplopie, Neuropathie ischémique optique |
|
|
|
Affections cardiaques |
|
Fréquence cardiaque irrégulière, Cardiopathie ischémique autre qu’infarctus du myocarde (angor, par exemple) |
Palpitations, Infarctus du myocarde |
|
|
|
Affections vasculaires |
Hypotension orthostatique |
Hypertension, Hypotension |
Phlébite |
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
Dyspnée, Douleur oropharyngée, Pneumonie d’inhalation |
Dysphonie |
Respiration anormale |
|
|
Affections gastro-intestinales |
Nausées, Constipation, Diarrhée |
Distension abdominale, Douleur abdominale, Gêne abdominale, Sécheresse buccale, Dysgueusie, Dyspepsie, Dysphagie, Flatulences, Vomissements |
Colite, Hémorrhagie digestive, Hypersalivation |
Bruxisme, Glossodynie, Hoquet, Coloration anormale de la salive |
|
|
Affections hépatobiliaires |
|
|
Anomalies des tests fonctionnels hépatiques |
|
Hépatite à type essentiellement cholestatique |
|
Affections de la peau et du tissu sous-cutané |
|
Dermatite de contact, Hyperhidrose, Prurit, Rash cutané |
Alopécie, Erythème, Urticaire, Coloration anormale de la peau, des cheveux et poils, des ongles et de la sueur |
Mélanome malin (voir rubrique 4.3) Angio-œdème |
|
|
Affections musculo-squelettiques et systémiques |
Douleurs musculaires et dans les tissus, et douleurs musculo-squelettiques |
Arthralgie, Spasmes musculaires, Douleur cervicale |
|
|
Rhabdomyolyse |
|
Affections du rein et des voies urinaires |
Chromaturie |
Incontinence urinaire, Rétention urinaire |
|
|
|
|
Affections des organes de reproduction et du sein |
|
|
|
Priapisme |
|
|
Troubles généraux et anomalies au site d’administration |
|
Asthénie, Douleur thoracique, Fatigue, Troubles de la marche, Douleurs, Œdème périphérique |
Malaise |
|
|
|
Lésions, intoxications et complications liées aux procédures |
Chutes |
|
|
|
|
|
Effets indésirables liés au dispositif et à l’intervention chirurgicale |
|||||
|
Infections et infestations |
Infection de la plaie postopératoire |
Cellulite au site d’incision, Infection postopératoire |
Abcès postopératoire |
|
Septicémie |
|
Affections gastro-intestinales |
Douleur abdominale |
Gêne abdominale, Douleur abdominale haute, Péritonite, Pneumopéritoine |
Bézoard, Colite ischémique, Ischémie gastro-intestinale, Obstruction gastro-intestinale, Pancréatite, Hémorragie de l’intestin grêle, Ulcère de l’intestin grêle, Perforation du côlon, Invagination intestinale |
|
Perforation gastrique, Perforation gastro-intestinale, Ischémie de l’intestin grêle, Perforation de l’intestin grêle |
|
Affections de la peau et du tissu sous-cutané |
Formation excessive de tissu de granulation |
|
|
|
|
|
Troubles généraux et anomalies au site d’administration |
Complications liées à l’insertion du dispositifb |
Déplacement du dispositif, Occlusion du dispositif |
|
|
|
|
Lésions, intoxications et complications liées aux procédures |
Erythème au site d’incision, Ecoulement postopératoire, Douleur lors d’une intervention, Réaction au site opératoire |
Complication au niveau de la zone de stomie gastro-intestinale, Douleur au site d’incision, Iléus postopératoire, Complication postopératoire, Gêne postopératoire, Hémorragie postopératoire |
|
|
|
a Le syndrome de dysrégulation dopaminergique (SDD) est un trouble addictif observé chez certains patients traités par carbidopa/lévodopa. Les patients atteints d’un tel syndrome montrent une utilisation compulsive de médicament dopaminergique au-delà des doses nécessaires pour contrôler les symptômes moteurs, ce qui peut entraîner, dans certains cas, des dyskinésies sévères (voir rubrique 4.4).
b La complication liée à l’insertion du dispositif a été un effet indésirable fréquemment rapporté à la fois avec la sonde naso-jéjunale et avec la sonde GEP-J. Cet effet indésirable a été rapporté en même temps qu’au moins l’un des effets indésirables suivants avec la sonde naso-jéjunale : douleur oropharyngée, distension abdominale, douleur abdominale, gêne abdominale, douleur, irritation de la gorge, lésion gastro-intestinale, hémorragie œsophagienne, anxiété, dysphagie et vomissements. Pour la sonde GEP-J, cet effet indésirable a été rapporté en même temps qu’au moins l’un des effets indésirables suivants : douleur abdominale, gêne abdominale, distension abdominale, flatulences ou pneumopéritoine. Les autres effets indésirables qui ont été rapportés en même temps que la complication liée à l’insertion du dispositif incluent : gêne abdominale, ulcère duodénal, hémorragie, duodénite érosive, gastrite érosive, hémorragie gastro-intestinale, péritonite, pneumopéritoine, et ulcère de l’intestin grêle.
Le déplacement de la sonde intestinale vers l’arrière en direction de l’estomac ou l’occlusion du dispositif conduit à la réapparition de fluctuations motrices.
Les effets indésirables supplémentaires suivants ont été observés avec la lévodopa/carbidopa par voie orale et classés comme rares (≥ 1/10 000, < 1/1000) : anémie hémolytique, trismus, syndrome de Claude Bernard-Horner, mydriase, crises oculogyres, et purpura rhumatoïde (syndrome de Schönlein-Henoch). L’effet indésirable supplémentaire suivant a été rapporté comme très rare (< 1/10 000) : agranulocytose.
Examens biologiques :
Les anomalies biologiques suivantes ont été notifiées avec un traitement par la lévodopa/carbidopa : augmentation de l’urée, des phosphatases alcalines, de I’ASAT, de l’ALAT, de la LDH, de la bilirubine, de la glycémie, de la créatinine, de l’acide urique, test de Coombs positif, et diminution des valeurs de l’hémoglobine et de l’hématocrite. La présence de leucocytes, de bactéries et de sang dans l’urine a été notifiée.
Description d’effets indésirables sélectionnés
L’introduction d’entacapone au sein d’un traitement en cours par lévodopa/inhibiteur de la DDC peut provoquer une majoration initiale de l’activité dopaminergique (par exemple, dyskinésies, nausées et vomissements). La réduction de la dose de lévodopa diminue la sévérité et la fréquence de ces réactions dopaminergiques.
Troubles du contrôle des pulsions
Le jeu pathologique, une augmentation de la libido, une hypersexualité, des dépenses ou des achats compulsifs, une consommation excessive de nourriture et une alimentation compulsive peuvent survenir chez les patients traités par des agonistes dopaminergiques et/ou d’autres traitements dopaminergiques contenant de la lévodopa, tels que LECIGIMON (voir rubrique 4.4).
Somnolence et attaques de sommeil
L’entacapone en association à la lévodopa a été associé à une somnolence et à des épisodes d’endormissement brutal chez des patients atteints de la maladie de Parkinson et la prudence s’impose donc en cas de conduite de véhicules ou d’utilisation de machines (voir rubriques 4.4 et 4.7).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Les principaux symptômes cliniques d’un surdosage de lévodopa/carbidopa sont les dystonies et les dyskinésies. Le blépharospasme peut être un signe précoce de surdosage. La pyridoxine ne parvient pas à inhiber les effets de LECIGIMON. Une surveillance électrocardiographique doit être utilisée et le patient doit faire l'objet d'un suivi attentif afin de déceler l'éventuel développement d'arythmies cardiaques. Le cas échéant, un traitement antiarythmique approprié doit être instauré. Il convient d’envisager que le patient ait pu prendre d’autres médicaments en plus de LECIGIMON. L’intérêt de la dialyse dans le traitement du surdosage n’est pas connu.
Les données incluent des cas isolés de surdosage, dans lesquels les doses journalières les plus élevées de lévodopa et d’entacapone par voie orale qui ont été rapportées étaient respectivement d’au moins 10 000 mg et 40 000 mg. Les signes et symptômes aigus de ces cas de surdosage ont été les suivants : agitation, confusion, coma, bradycardie, tachycardie ventriculaire, respiration de Cheyne-Stokes, modifications de coloration de la peau, de la langue et de la conjonctive et chromaturie.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : médicaments antiparkinsoniens, dopa et dérivés de la dopa, code ATC : N04BA03.
Mécanisme d’action
LECIGIMON est une association de lévodopa, de carbidopa monohydratée et d’entacapone (ratio de 4/1/4) sous forme de gel pour perfusion intestinale continue dans la maladie de Parkinson de stade avancé avec fluctuations motrices et hyper-/dyskinésies sévères.
Selon les connaissances actuelles, les symptômes de la maladie de Parkinson sont liés à une déplétion en dopamine dans le corps strié. La dopamine ne traverse pas la barrière hémato-encéphalique.
La lévodopa, précurseur de la dopamine, traverse cette barrière et atténue les symptômes de la maladie. En raison de l’important métabolisme périphérique de la lévodopa, seule une fraction peu importante d’une dose donnée atteint le système nerveux central quand on administre de la lévodopa sans inhibiteurs des enzymes métaboliques.
La carbidopa est un inhibiteur de la DDC périphérique qui diminue la transformation périphérique de la lévodopa en dopamine, ce qui fait qu’une quantité plus importante de lévodopa est disponible pour le cerveau. Quand la décarboxylation de la lévodopa est diminuée grâce à la co-administration d’un inhibiteur de la DDC, il est possible d’utiliser une dose moindre de lévodopa, ce qui réduit la fréquence des événements indésirables tels que les nausées.
Avec l’inhibition de la décarboxylase par un inhibiteur de la DDC, la catéchol-O-méthyl transférase (COMT) devient la principale voie métabolique périphérique. L’entacapone est un inhibiteur réversible spécifique de la COMT qui agit essentiellement en périphérie, conçu pour être associé à la lévodopa. L’entacapone ralentit la clairance sanguine de la lévodopa, ce qui entraîne une augmentation de l’aire sous la courbe (ASC) du profil pharmacocinétique de la lévodopa. La réponse clinique à la lévodopa est donc prolongée.
La perfusion entérale de doses individualisées de LECIGIMON maintient les concentrations plasmatiques de lévodopa à un niveau stable à l’intérieur des fenêtres thérapeutiques individuelles.
5.2. Propriétés pharmacocinétiques
LECIGIMON est administré via une sonde introduite directement dans le duodénum ou le jéjunum supérieur. Il existe d’importantes variations inter- et intra-individuelles de l’absorption de la lévodopa, de la carbidopa et de l’entacapone. La lévodopa et l’entacapone sont rapidement absorbés et éliminés. La carbidopa est absorbée et éliminée un peu plus lentement que la lévodopa. Les repas riches en acides aminés neutres de grande taille peuvent retarder et diminuer l’absorption de la lévodopa. Les aliments ne modifient pas significativement l’absorption de l’entacapone.
Dans un essai clinique randomisé (n=11) en ouvert avec une méthodologie croisée incluant Duodopa® comme comparateur, l’administration intestinale de LECIGIMON a rapidement permis d’obtenir des concentrations plasmatiques thérapeutiques de lévodopa. Des taux comparables de lévodopa ont été maintenus avec la perfusion de LECIGIMON et de Duodopa®, mais une augmentation graduelle des concentrations plasmatiques de lévodopa a été observée durant la journée avec LECIGIMON par rapport à Duodopa®. Durant la perfusion, une biodisponibilité significativement supérieure a été calculée avec LECIGIMON par rapport à Duodopa®, sur la base de l’ASC0-14h pour chaque dose (ratio : 1,38 ; intervalle de confiance [IC] à 95 % : 1,26– 1,51). Après la fin de la perfusion, les concentrations de lévodopa ont diminué rapidement. La variabilité intra-individuelle des concentrations plasmatiques de lévodopa était faible (13,8 %) au cours de l’intervalle entre 3 et 14 heures après le début de la perfusion de LECIGIMON.
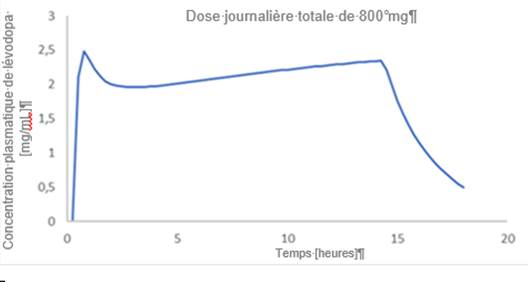
Un exemple du profil attendu de concentrations plasmatiques en fonction du temps avec une dose d’entretien constante est présenté à la figure 1. Si nécessaire, il est possible d’utiliser des doses d’entretien multiples par jour/période de 24 heures (voir description à la rubrique 4.2 Posologie).
Temps [heures]
Distribution
Les volumes de distribution de la lévodopa (0,36– 1,6 L/kg) et de l’entacapone (0,27 L/kg) à l’état d’équilibre sont relativement faibles, tandis qu’on ne dispose d’aucune donnée pour la carbidopa.
La lévodopa n’est que faiblement liée aux protéines plasmatiques (10– 30 % environ) ; la liaison de la carbidopa est de l’ordre de 36 %, tandis que l’entacapone est fortement lié aux protéines du plasma (98 % environ), essentiellement à l’albumine sérique. Aux concentrations thérapeutiques, l’entacapone n’interfère pas avec les autres substances actives fortement liées aux protéines (par exemple, la warfarine, l’acide salicylique, la phénylbutazone ou le diazépam) et n’est pas significativement altéré par l’une de ces substances aux concentrations thérapeutiques ou supérieures.
Biotransformation et élimination
La lévodopa est fortement dégradée en différents métabolites, les principales voies étant la décarboxylation par la dopa décarboxylase (DDC) et l’O-méthylation par la catéchol-O-méthyl transférase (COMT).
La carbidopa est métabolisée en deux métabolites principaux qui sont excrétés dans l’urine sous la forme de glucuronides ou de composés non conjugués. La carbidopa inchangée représente 30 % de l’excrétion urinaire totale.
L’entacapone est presque entièrement métabolisé, les métabolites sont excrétés par voie urinaire (10– 20 %) ou par voie biliaire/dans les fèces (80– 90 %). La principale voie métabolique est la glucuroconjugaison de l’entacapone et de son métabolite actif, l’isomère cis, qui représente 5 % environ de la quantité plasmatique totale.
La clairance totale de la lévodopa est de l’ordre de 0,55– 1,38 L/kg/h et celle de l’entacapone de l’ordre de 0,70 L/kg/h. La demi-vie est de 0,6– 1,3 heure pour la lévodopa, de 2– 3 heures pour la carbidopa et de 0,4– 0,7 heure pour l’entacapone, tous trois étant administrés séparément. La demi-vie moyenne estimée de la lévodopa lors du traitement par LECIGIMON était de 2,0 heures.
Les résultats d’études in vitro utilisant des préparations de microsomes de foie humain indiquent que l’entacapone inhibe l’isoforme 2C9 du cytochrome P450 (CI50 ~4 μM). L’entacapone n’a induit que peu ou pas d’inhibition des autres types d’isoenzymes du P450 (CYP1A2, CYP2A6, CYP2D6, CYP2E1, CYP3A et CYP2C19).
Populations particulières
Sujets âgés
En l’absence de carbidopa et d’entacapone, l’absorption de la lévodopa est plus importante et son élimination est plus lente chez les patients âgés que chez les patients jeunes. Cependant, après l’association de carbidopa à la lévodopa, l’absorption de cette dernière est identique chez les patients âgés et jeunes, mais l’ASC reste 1,5 fois plus élevée chez les patients âgés en raison de la diminution d’activité de la DDC et de la diminution de la clairance liée au vieillissement. Aucune différence significative de l’ASC de la carbidopa et de l’entacapone n’a été observée entre les patients jeunes (45– 64 ans) et âgés (65– 75 ans).
Sexe
La biodisponibilité de la lévodopa est significativement plus importante chez les femmes que chez les hommes, même en présence d’entacapone, essentiellement en raison de la différence de poids corporel. Il n’y a pas de différence liée au sexe pour la biodisponibilité de la carbidopa ou l’entacapone.
Insuffisance hépatique
Le métabolisme de l’entacapone est ralenti chez les patients présentant une insuffisance hépatique légère à modérée (classes A et B de Child-Pugh), ce qui entraîne une augmentation de sa concentration plasmatique au cours des phases d’absorption et d’élimination (voir rubriques 4.2, 4.3 et 4.4). Aucune étude spécifique des paramètres pharmacocinétiques de la carbidopa et de la lévodopa n’a été rapportée chez les insuffisants hépatiques, mais il convient d’être prudent en administrant LECIGIMON aux patients atteints d’insuffisance hépatique légère à modérée. LECIGIMON ne doit pas être utilisé chez les patients atteints d’insuffisance hépatique sévère (voir rubrique 4.3).
Insuffisance rénale
L’insuffisance rénale ne modifie pas la pharmacocinétique de l’entacapone. Aucune étude particulière de la pharmacocinétique de la lévodopa et de la carbidopa n’a été réalisée chez des patients atteints d’insuffisance rénale. La prudence est donc de mise lors de la titration de la dose chez les patients présentant une insuffisance rénale sévère, y compris chez les patients dialysés (voir rubrique 4.2).
5.3. Données de sécurité préclinique
Les études de toxicité générale après administration répétée d’entacapone ont révélé une anémie, très probablement due aux propriétés de chélation du fer de cette molécule. En ce qui concerne la toxicité de l’entacapone sur la reproduction, une diminution du poids des fœtus et un léger retard du développement osseux ont été constatés chez des lapins soumis à des niveaux d’exposition systémique en concentration thérapeutique.
La lévodopa et les associations de carbidopa et de lévodopa ont entraîné des malformations viscérales et squelettiques chez le lapin.
L’hydrazine est un produit de dégradation de la carbidopa. Au cours des études chez l’animal, l’hydrazine a montré une toxicité systémique notable, en particulier en cas d’exposition par inhalation. Ces études ont mis en évidence une hépatotoxicité de l’hydrazine, une toxicité au niveau du système nerveux central (bien que non retrouvée après traitement par voie orale), et une génotoxicité ainsi qu’un pouvoir carcinogène (voir également rubrique 4.4).
26 semaines
Après ouverture de la cartouche : utiliser immédiatement. Le produit peut être utilisé pendant 24 heures au maximum une fois sorti du réfrigérateur. Une fois la cartouche installée, la pompe d’administration peut être portée près du corps pendant une durée allant jusqu’à 16 heures. Pour le traitement durant la nuit, la pompe ne doit pas être portée près du corps mais peut être posée, par exemple, sur la table de nuit. Eliminer tout produit non utilisé.
6.4. Précautions particulières de conservation
Conservation et transport réfrigérés (entre 2 °C et 8 °C). Ne pas congeler.
Conserver dans l’emballage d’origine à l’abri de la lumière.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
47 ml de gel contenu dans une cartouche en polypropylène. L’extrémité large est fermée par un bouchon-piston en polyisoprène et l’ouverture du connecteur de sortie ENFit est fermée au moyen d’un bouchon en polypropylène.
Boîte de 7 cartouches.
6.6. Précautions particulières d’élimination et de manipulation
Cartouches à usage unique. Ne pas réutiliser une cartouche ouverte.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE ALEXANDER FLEMING
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 356 1 4 : 47 ml de gel contenu dans une cartouche (polypropylène) - Boîte de 7
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 05/04/2024
LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
Lévodopa/carbidopa monohydratée/entacapone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu’est-ce que LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal ?
3. Comment utiliser LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal ET DANS QUELS CAS EST-IL UTILISE ?
LECIGIMON est utilisé pour le traitement de la maladie de Parkinson. Il est utilisé lorsque la maladie est au stade avancé et lorsque les médicaments pris par voie orale (pris par la bouche) n’ont plus un effet suffisant.
LECIGIMON est un gel administré de façon continue au moyen d’une pompe et d’une sonde directement dans votre intestin grêle.
LECIGIMON contient trois substances actives :
· lévodopa
· carbidopa (sous forme de carbidopa monohydratée)
· entacapone
Comment agit LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
Chez une personne atteinte de la maladie de Parkinson, les taux de dopamine dans le cerveau sont faibles. La lévodopa est convertie en dopamine dans le cerveau, atténuant ainsi les symptômes de la maladie de Parkinson. La carbidopa et l’entacapone améliorent les effets antiparkinsoniens de la lévodopa.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal ?
N’utilisez jamais LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal :
· si vous êtes allergique à la lévodopa, la carbidopa, l’entacapone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· si vous avez un trouble oculaire appelé « glaucome à angle fermé » (type de glaucome aigu) ;
· si vous avez une insuffisance cardiaque sévère ;
· si vous avez des troubles sévères du rythme cardiaque (arythmie) ;
· si vous avez récemment eu un accident vasculaire cérébral (AVC) ;
· si vous avez une maladie hépatique grave ;
· si vous prenez certains médicaments pour traiter une dépression appelés inhibiteurs sélectifs de la MAO-A (tels que le moclobémide) et inhibiteurs non sélectifs de la MAO (tels que la phénelzine). Le traitement par ces médicaments doit être interrompu au moins deux semaines avant de débuter l’administration de LECIGIMON. Voir également la rubrique « Autres médicaments et LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal » ;
· si vous avez une tumeur des glandes surrénales qui entraîne une production excessive d’adrénaline et de noradrénaline (phéochromocytome) ;
· si votre organisme produit trop de cortisol (syndrome de Cushing) ;
· si vos taux d’hormones thyroïdiennes sont trop élevés (hyperthyroïdie) ;
· si vous avez déjà présenté un syndrome malin des neuroleptiques (réaction rare et grave survenant pendant ou à l’arrêt du traitement par certains médicaments) ;
· si vous avez déjà eu une rhabdomyolyse (affection musculaire rare et sévère qui touche les reins) ;
· si vous avez déjà eu un cancer de la peau ou présentez des marques ou grains de beauté inhabituels sur votre peau qui n’ont pas été examinés par votre médecin.
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal si vous avez ou avez déjà eu :
· une crise cardiaque ou toute autre maladie cardiovasculaire, y compris un angor ou des troubles du rythme cardiaque ;
· de l’asthme ou tout autre problème pulmonaire ;
· une maladie rénale ou hépatique ;
· un problème hormonal ;
· un ulcère gastrique ;
· des crises convulsives (convulsions) ;
· un problème psychologique grave, comme une psychose ;
· un problème oculaire appelé glaucome à angle ouvert ;
· une intervention chirurgicale dans la partie supérieure de l’abdomen ;
· Une polyneuropathie ou un état médical associé à une polyneuropathie.
· Une faiblesse progressive, une douleur, un engourdissement ou une perte de sensation dans les doigts ou les pieds (symptômes de polyneuropathie) ont été rapportés chez des patients traités par le gel intestinal de lévodopa/carbidopa. Votre médecin recherchera les signes et symptômes d’une neuropathie avant et régulièrement après le début de votre traitement par LECIGIMON. Informez votre médecin si vous avez déjà présenté une neuropathie ou une affection associée à une neuropathie.
Contactez un médecin immédiatement si vous présentez l’un des symptômes suivants au cours de votre traitement par LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal :
· Syndrome malin des neuroleptiques :
Affection grave associant une raideur musculaire, des crampes, des tremblements, des sueurs, de la fièvre, un pouls rapide, des fluctuations importantes de la pression artérielle, un comportement agressif, une confusion, une perte de conscience.
· Rhabdomyolyse :
Affection grave avec des douleurs musculaires, des crampes musculaires ou une faiblesse musculaire inexpliquées.
· La rhabdomyolyse peut être causée par un syndrome malin des neuroleptiques.
o Pour plus d’informations concernant le syndrome malin des neuroleptiques et la rhabdomyolyse, voir la rubrique 3 « Si vous arrêtez d’utiliser ou réduisez votre dose de LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal » et la rubrique 4 « Quels sont les effets indésirables éventuels ? ».
· Problèmes liés à la sonde et à l’intervention chirurgicale :
Douleurs abdominales, nausées ou vomissements. Ceux-ci peuvent être liés à des problèmes graves causés par la sonde ou par l’intervention chirurgicale, par exemple à cause d’une obstruction, d’une lésion au niveau de l’intestin ou de la plaie.
Adressez-vous à votre médecin si vous présentez l’un des symptômes suivants au cours du traitement par LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal :
· Vous vous sentez déprimé(e), avez des pensées suicidaires ou si vous ou d’autres personnes remarquez chez vous des troubles mentaux.
· Vous remarquez des marques ou grains de beauté inhabituels sur votre peau apparus soudainement ou s’étant détériorés.
· Vous développez des mouvements involontaires (dyskinésies). Si vous n’avez jamais été traité(e) par entacapone (l’une des substances actives de LECIGIMON) auparavant, les symptômes pourraient être liés à la majoration des effets de la lévodopa et de la carbidopa (autres substances actives de LECIGIMON) par l’entacapone.
Le médecin pourra avoir besoin de réduire votre dose.
· Vous pensez que l’effet du traitement se dégrade brutalement ou progressivement, par exemple si vous avez des difficultés pour vous mouvoir ou si vos mouvements sont ralentis (bradykinésie). Cela peut survenir si la sonde s’est déplacée et n’est plus positionnée correctement dans l’intestin grêle ou si elle est obstruée. Cela pourrait également être lié à un dysfonctionnement de la pompe.
· Vous présentez des diarrhées. Il pourrait être nécessaire de surveiller votre poids afin d’éviter une perte de poids significative, et votre traitement devra peut-être être interrompu. Des diarrhées prolongées ou persistantes peuvent être le signe d’une inflammation de l’intestin. Dans ce cas, votre médecin devra reconsidérer votre traitement par LECIGIMON.
· Vous présentez une perte d’appétit s’aggravant avec le temps, un sentiment de faiblesse et une perte de poids en l’espace de peu de temps. Un examen médical général, y compris un bilan de la fonction hépatique, seront peut-être nécessaires.
Si vous ne pouvez pas gérer la pompe et la sonde, vous devez être aidé d’un soignant (par ex., infirmier/ère, aide-soignant[e] ou parent[e] proche) afin d’éviter des complications (problèmes).
Troubles du contrôle des pulsions modifications de votre comportement
Informez votre médecin si vous, votre famille ou votre soignant, constatez que vous développez des envies irrésistibles qui vous conduisent à vous comporter d’une manière inhabituelle ou si vous ne pouvez pas résister à une pulsion ou à la tentation de réaliser certaines activités qui pourraient être dangereuses pour vous ou votre entourage. Ces comportements sont appelés « troubles du contrôle des pulsions » et peuvent inclure : jeu pathologique, ingestion de nourriture ou dépenses excessives, libido anormalement élevée ou augmentation des pensées ou désirs sexuels. Votre médecin pourrait avoir besoin de modifier votre dose ou d’interrompre votre traitement. Pour plus d’informations, voir rubrique 4 « Quels sont les effets indésirables éventuels ? ».
Syndrome de dysrégulation dopaminergique
Informez votre médecin si vous ou votre famille/soignant constatez que vous développez des symptômes de type addictif conduisant à une envie irrépressible de prendre des doses de plus en plus élevées de LECIGIMON et d’autres médicaments utilisés pour traiter la maladie de Parkinson.
Bilans réguliers
Lors du traitement à long terme par LECIGIMON, votre médecin pourra avoir besoin de réaliser des bilans réguliers de votre fonction hépatique et rénale, de vos paramètres hématologiques, de votre cœur et vos vaisseaux sanguins, et examiner votre peau pour détecter tout changement éventuel.
LECIGIMON et cancer
LECIGIMON contient de l’hydrazine, qui se forme lors de la dégradation de la carbidopa (une des substances actives de LECIGIMON). L’hydrazine pourrait endommager vos gènes, ceci pouvant provoquer un cancer. Cependant, on ignore si la quantité d’hydrazine produite lors de l’utilisation de la dose recommandée de LECIGIMON peut provoquer des lésions ou une maladie.
Chirurgie
Avant de subir une opération, y compris une intervention dentaire, veuillez prévenir le médecin ou le dentiste que vous utilisez LECIGIMON.
Analyses d’urine
La lévodopa et la carbidopa (deux des substances actives de LECIGIMON) peuvent fausser les résultats des analyses d’urine. Prévenez les professionnels de santé que vous utilisez LECIGIMON si vous devez fournir un échantillon d’urine.
Enfants et adolescents
LECIGIMON ne doit pas être administré aux enfants ou adolescents de moins de 18 ans.
Autres médicaments et LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
N’utilisez pas LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal si vous prenez :
· des médicaments pour la dépression appelés inhibiteurs sélectifs de la MAO-A (tels que le moclobémide) et inhibiteurs non sélectifs de la MAO (tels que la phénelzine). Le traitement par ces médicaments doit être interrompu au moins deux semaines avant de débuter le traitement par LECIGIMON.
LECIGIMON peut augmenter l’efficacité et les effets indésirables d’autres médicaments et d’autres médicaments peuvent augmenter l’efficacité et les effets indésirables de LECIGIMON. Avertissez votre médecin si vous prenez :
· des médicaments pour la dépression appelés antidépresseurs tricycliques (tels que la clomipramine, l’amitriptyline et la nortriptyline). D’autres types d’antidépresseurs peuvent également avoir un effet sur LECIGIMON ou être influencés par LECIGIMON ;
· des médicaments pour la maladie de Parkinson appelés inhibiteurs sélectifs de la MAO-B (tels que la sélégiline), de l’amantadine et des agonistes dopaminergiques (tels que le piribédil) ou des anticholinergiques (tels que le bipéride) ;
· des médicaments pour l’incontinence urinaire (tels que l’oxybutynine), pour l’asthme et la broncho-pneumopathie chronique obstructive ou BPCO (tels que l’ipratropium et le tiotropium). Ces médicaments sont appelés anticholinergiques ;
· certains médicaments pour l’asthme et les allergies (tels que le salbutamol et la terbutaline) ou de l’adrénaline. Ces médicaments sont appelés sympathomimétiques ;
· des médicaments pour réduire la pression artérielle (appelés antihypertenseurs). L’utilisation simultanée de ces médicaments et de LECIGIMON peut entraîner une chute de la pression artérielle lors du passage de la position assise ou allongée à la position debout. Il pourrait être nécessaire d’ajuster la dose de votre médicament antihypertenseur ;
· de la warfarine (un médicament utilisé pour la prévention des caillots sanguins). Si vous êtes traité(e) par LECIGIMON, ou en cas d’instauration, d’arrêt ou de modification de votre traitement par LECIGIMON, l’effet de la warfarine devra être vérifié.
Certains médicaments peuvent réduire l’efficacité de LECIGIMON. Avertissez votre médecin si vous prenez :
· une préparation martiale (à base de fer) prise par voie orale (comprimés, gélules, solution). Le fer peut altérer l’absorption de la lévodopa dans le système digestif (et inversement). Vous devez donc prendre LECIGIMON et vos compléments à base de fer à au moins 2 ou 3 heures d’intervalle. Si vous n’utilisez pas la pompe la nuit, vous pouvez prendre vos compléments à base de fer avant d’aller vous coucher ;
· des médicaments pour la psychose (tels que les phénothiazines, les butyrophénones (par exemple, l’halopéridol) ou de la rispéridone) ;
· des médicaments pour les nausées (tels que le métoclopramide) ;
· des médicaments pour l’épilepsie (tels que le clonazépam et la phénytoïne) ;
· des médicaments pour l’anxiété ou les troubles du sommeil, appelés benzodiazépines (tels que le diazépam, l’oxazépam et le nitrazépam) ;
· des médicaments pour la tuberculose (isoniazide) ;
· des médicaments pour les crampes abdominales (papavérine).
LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal avec des aliments et boissons
LECIGIMON n’est pas bien absorbé s’il est pris immédiatement après des repas riches en protéines (tels que viande, poisson, produits laitiers, graines et noix). Adressez-vous à votre médecin si vous avez une alimentation riche en protéines.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
LECIGIMON n’est pas recommandé pendant la grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception sauf si le médecin détermine que les bénéfices pour la mère dépassent les risques éventuels pour le fœtus.
Vous ne devez pas allaiter au cours de votre traitement par LECIGIMON.
Conduite de véhicules et utilisation de machines
LECIGIMON est susceptible d’avoir une influence importante sur l’aptitude à conduire des véhicules et à utiliser des machines.
Ne conduisez pas de véhicules ou n’utilisez pas de machines tant que vous n’êtes pas sûr(e) des effets que LECIGIMON a sur vous.
· LECIGIMON peut vous rendre très somnolent(e) ou peut provoquer un endormissement de façon soudaine (attaques de sommeil).
· LECIGIMON peut provoquer une baisse de votre pression artérielle, par exemple quand vous passez de la position assise ou allongée à la position debout, et peut entraîner des sensations vertigineuses.
Ne conduisez pas de véhicules, n’utilisez pas d’outils ni de machines, et ne faites pas d’activités lors desquelles un manque de concentration pourrait faire courir un risque à vous-même ou d’autres personnes jusqu’à ce que vous vous sentiez à nouveau complètement éveillé(e) ou jusqu’à ce que vous ne ressentiez plus ces étourdissements ou ces sensations vertigineuses.
LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal contient du sodium
Ce médicament contient 166 mg de sodium (principal composant du sel de cuisine/de table) dans chaque cartouche, ce qui équivaut à 8,3 % de l'apport alimentaire quotidien maximal recommandé en sodium.
3. COMMENT UTILISER LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal ?
Comment est administré LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
LECIGIMON est un gel qui est administré au moyen d’une pompe portable (Crono LECIG) et d’une sonde directement dans la partie supérieure de votre intestin. Le gel est contenu dans une cartouche connectée à la pompe. La pompe est connectée à une sonde placée à l’intérieur de votre intestin à travers la paroi abdominale lors d’une intervention chirurgicale.
La pompe vous administre une petite dose tout au long de la journée. Cela signifie que la quantité de médicament dans votre sang reste la même. Cela signifie également que certains effets indésirables, tels que ceux affectant la mobilité, sont plus faibles qu’avec les médicaments pris par voie orale.
Avant l’insertion de la sonde dans votre intestin grêle, le médecin pourra vouloir vérifier si le traitement par LECIGIMON fonctionne chez vous. Dans ce cas, le gel sera administré dans votre intestin grêle au moyen d’une sonde (un tube) en passant par votre nez, votre gorge et votre estomac.
Un manuel contenant des instructions pour l’utilisation de la pompe est fourni avec celle-ci.
Posologie
Votre médecin déterminera vos doses individuellement sur la base de votre traitement antérieur. Il pourra être nécessaire d’ajuster la dose durant les premières semaines de traitement.
En règle générale, une dose importante (appelée « dose bolus ») est administrée le matin au début du traitement. Cela permet d’obtenir rapidement la bonne quantité de médicament dans votre sang. Après l’administration de cette dose, une dose d’entretien continue est administrée durant la journée (généralement pendant 16 heures environ). Si nécessaire, votre médecin pourra décider de vous administrer LECIGIMON jusqu’à 24 heures par jour.
Des doses supplémentaires pourront également vous être administrées si nécessaire. Chez certaines personnes, il pourra également être nécessaire d’augmenter ou de diminuer la dose d’entretien continue durant la journée. Après vous avoir consulté(e), votre médecin décidera des modalités et des heures de prise des doses supplémentaires ou de l’ajustement de la dose durant la journée.
La dose journalière totale, y compris la dose matinale (dose bolus), la dose d’entretien et les doses supplémentaires, ne pourra pas dépasser 100 mL (ce qui correspond à 2000 mg de lévodopa, 500 mg de carbidopa et 2000 mg d’entacapone).
Si l’utilisateur(-trice) est atteint(e) de démence, le médecin pourra décider que la pompe doit exclusivement être manipulée par un professionnel de santé ou un(e) proche. La pompe peut être verrouillée pour empêcher un dépassement accidentel de la dose journalière recommandée.
Après ouverture de la cartouche
La cartouche est à usage unique et ne doit pas être utilisée pendant plus de 24 heures, même s’il reste du médicament. Une fois la cartouche installée, la pompe d’administration peut être portée près du corps pendant une durée allant jusqu’à 16 heures. Pour le traitement durant la nuit, la pompe ne doit pas être portée près du corps mais peut être posée, par exemple, sur la table de nuit. En cas d’interruption du traitement pendant la nuit, vous pourrez continuer à utiliser la cartouche ouverte le jour suivant, mais sans dépasser une durée maximale de 24 heures à compter de la première ouverture. Ne dissociez pas la cartouche de la pompe avant d’avoir terminé de l’utiliser (soit au bout de 24 heures après l’ouverture, soit lorsqu’elle est vide, selon ce qui survient en premier).
Le gel peut prendre une couleur légèrement jaune/rougeâtre à la fin de sa durée de conservation. Cela n’a pas d’impact sur l’effet du traitement.
Si vous avez utilisé plus de LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal que vous n’auriez dû
Consultez votre médecin si vous présentez des signes de surdosage.
Les signes de surdosage incluent :
· tressautement ou crampes des paupières avec difficultés pour ouvrir les yeux ;
· contractions musculaires involontaires et persistantes entraînant des mouvements de torsion répétés et des postures anormales (dystonies) ;
· mouvements involontaires (dyskinésies) ;
· rythme cardiaque inhabituellement rapide, lent ou irrégulier (arythmie) ;
· confusion ou inquiétude/agitation ;
· coloration anormale de la peau, de la langue, des yeux et des urines.
Si vous oubliez d’utiliser LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
Démarrez la pompe en suivant votre prescription dès que possible. N’augmentez pas la dose pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser ou réduisez votre dose de LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
N’arrêtez pas le traitement et ne diminuez pas les doses de LECIGIMON sans en parler avec votre médecin.
En effet, un arrêt brutal ou une diminution trop rapide des doses de LECIGIMON pourrait entraîner des troubles graves appelés syndrome malin des neuroleptiques et rhabdomyolyse. Le risque de développer ces troubles est plus important si vous êtes traité(e) pour un problème psychologique grave en même temps. Pour plus d’informations au sujet de ces troubles, voir rubrique 4 « Quels sont les effets indésirables éventuels ? ».
En cas d’arrêt du traitement, vous recevrez un autre traitement en remplacement. En cas d’arrêt définitif du traitement par LECIGIMON, la sonde sera retirée et on laissera la plaie cicatriser.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables graves de LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
Contactez un médecin immédiatement si vous présentez l’un des symptômes suivants au cours de votre traitement par LECIGIMON car vous pourriez avoir besoin d’un traitement médical en urgence :
· Démangeaisons, urticaire, gonflement du visage, des lèvres, de la langue ou de la gorge, pouvant entraîner des difficultés pour respirer ou avaler. Chute de la pression artérielle. Cela pourrait être le signe d’une réaction allergique sévère (effet indésirable rare).
· Ensemble de symptômes associant une raideur musculaire, des crampes, des tremblements, des sueurs, de la fièvre, un pouls rapide, des fluctuations sévères de la pression artérielle, un comportement agressif, une confusion, une perte de conscience. Il peut s’agir de symptômes d’une affection grave appelée syndrome malin des neuroleptiques (affectant un nombre indéterminé d’utilisateurs).
· Douleurs musculaires, crampes musculaires ou faiblesse musculaire inexpliquées pouvant être le signe d’une rhabdomyolyse, un trouble musculaire rare et sévère avec dégradation des cellules musculaires pouvant avoir des conséquences sévères au niveau des reins (fréquence indéterminée [ne peut être estimée sur la base des données disponibles]). La rhabdomyolyse peut être causée par un syndrome malin des neuroleptiques.
Pour plus d’informations concernant le syndrome malin des neuroleptiques et la rhabdomyolyse, voir la rubrique 3 « Si vous arrêtez d’utiliser ou réduisez votre dose de LECIGIMON ».
· Douleurs abdominales, nausées ou vomissements. Ceux-ci peuvent être liés à des problèmes graves causés par la sonde ou par l’intervention chirurgicale, par exemple à cause d’une obstruction, de la plaie ou d’une lésion au niveau de l’intestin (effet indésirable fréquent).
· Infection avec des symptômes tels que de la fièvre et une altération sévère de l’état général ou de la fièvre avec des symptômes d’infection locale, tels que des maux de gorge, des douleurs dans la bouche ou des difficultés pour uriner. Ceux-ci peuvent être le signe d’un trouble des globules blancs appelé agranulocytose (fréquence indéterminée ne peut être estimée sur la base des données disponibles). Votre médecin vous prélèvera un échantillon de sang pour vérifier.
· Idées suicidaires ou tentatives de suicide (effet indésirable peu fréquent).
Autres effets indésirables de LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
Très fréquent (pouvant affecter plus de 1 personne sur 10) :
· Perte de poids.
· Anxiété, dépression, insomnie.
· Mouvements involontaires (dyskinésies).
· Aggravation des symptômes de la maladie de Parkinson.
· Sensations vertigineuses, quand vous vous levez ou que vous changez de position (hypotension orthostatique) – cela est dû à une baisse de la pression artérielle.
· Nausées, constipation, diarrhée.
· Douleurs dans les muscles, les tissus et les os.
· Coloration anormale des urines (chromaturie).
· Risque de chutes.
· Infection des voies urinaires
Fréquent (pouvant affecter jusqu’à 1 personne sur 10) :
· Anémie.
· Taux élevés d’acides aminés (par exemple, homocystéine) dans le sang, carence en vitamines B6 et B12.
· Perte d’appétit, prise de poids.
· Cauchemars, comportement agressif, agitation, confusion, hallucinations, troubles psychotiques.
· Attaques de sommeil, somnolence, troubles du sommeil.
· Sensations vertigineuses, évanouissement, maux de tête.
· Diminution de la sensibilité au toucher, sensation de fourmillement ou d’engourdissement de la peau.
· Trouble nerveux avec gêne, douleur et fourmillement, en particulier dans les pieds (polyneuropathie).
· Contractions musculaires involontaires et persistantes entraînant des mouvements de torsion répétés et des postures anormales (dystonies), mouvements excessifs (hyperkinésies), tremblements.
· Variations de l’effet sur les symptômes parkinsoniens (épisodes « on/off »).
· Vision floue.
· Rythme cardiaque irrégulier, maladie cardiovasculaire autre que crise cardiaque (par exemple, angor).
· Pression artérielle élevée ou basse.
· Difficultés respiratoires, pneumonie due à la présence d’éléments étrangers dans les poumons.
· Douleurs dans la bouche ou la gorge.
· Distension abdominale, douleur abdominale, gêne abdominale, sensibilité abdominale avec douleur, brûlures d’estomac, ballonnements, vomissements.
· Sécheresse de la bouche, altération de la perception du goût.
· Difficultés pour avaler, maux de gorge.
· Dermatite de contact, démangeaisons, éruption cutanée.
· Transpiration importante.
· Douleur, douleurs articulaires, douleurs cervicales, spasmes musculaires.
· Fuites urinaires (incontinence urinaire), difficultés pour uriner.
· Sensation de faiblesse, fatigue, douleur dans la poitrine.
· Troubles de la marche.
· Gonflement des jambes ou des pieds.
Troubles du contrôle des pulsions modifications de votre comportement. Fréquent (pouvant affecter jusqu’à 1 personne sur 10) :
Incapacité à résister à l’impulsion de faire une action qui pourrait vous nuire, ce qui peut inclure :
· forte impulsion à jouer (de l’argent) excessivement en dépit de conséquences graves pour vous ou votre famille ;
· intérêt sexuel altéré ou augmenté, et comportement préoccupant pour vous ou pour les autres, par exemple, une augmentation des pulsions sexuelles ;
· dépenses ou achats excessifs incontrôlables ;
· manger de façon excessive (manger de grosses quantités de nourriture dans un court laps de temps) ou manger de façon compulsive (manger plus de nourriture que d’habitude et plus qu’il n’en faut pour satisfaire votre faim).
Informez votre médecin si vous, votre famille ou votre soignant remarquez l’un de ces comportements. Votre médecin discutera des moyens de gérer ou de réduire les symptômes.
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100) :
· Taux faible de globules blancs ou de plaquettes dans le sang pouvant entraîner des saignements.
· Suicide.
· Confusion, exaltation de l’humeur (humeur euphorique), peur, cauchemars.
· Difficultés pour coordonner les mouvements des muscles, convulsions.
· Tressautement ou crampes des paupières avec difficultés pour ouvrir les yeux, vision double, lésion du nerf optique, glaucome à angle fermé (élévation aiguë de la pression intraoculaire).
· Palpitations cardiaques, crise cardiaque.
· Inflammation des veines.
· Modification de la voix.
· Inflammation du côlon, saignement dans l’appareil digestif.
· Production anormalement importante de salive.
· Résultats anormaux aux tests de la fonction hépatique.
· Rougeur cutanée, urticaire.
· Perte de cheveux, coloration anormale des ongles, de la peau, des cheveux ou de la sueur.
· Malaise.
Rare (pouvant affecter jusqu’à 1 personne sur 1 000) :
· Pensées étranges.
· Irrégularité du rythme respiratoire.
· Grincement des dents, langue douloureuse, coloration anormale de la salive.
· Hoquet.
· Cancer cutané (mélanome malin) (voir rubrique 2 « N’utilisez jamais LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal »).
· Érection douloureuse et prolongée.
Fréquence indéterminée (affectant un nombre indéterminé d’utilisateurs) :
· Inflammation du foie (hépatite).
· Résultats anormaux aux analyses biologiques de sang et d’urine.
· Troubles de la mémoire, démence.
· Envie irrépressible de prendre de fortes doses de LECIGIMON, supérieures à celle requise pour contrôler les symptômes moteurs, connue sous le nom de syndrome de dysrégulation dopaminergique. Certains patients présentent des mouvements involontaires anormaux sévères (dyskinésies), des sautes d’humeur ou d’autres effets secondaires après la prise de fortes doses de LECIGIMON.
Effets indésirables liés à la pompe, la sonde ou la chirurgie :
Très fréquent (pouvant affecter plus de 1 personne sur 10) :
· Douleur abdominale
· Infection de la plaie après l’intervention chirurgicale.
· Épaississement de la cicatrice à l’endroit de l’incision.
· Problèmes liés à l’insertion de la sonde, tels que des douleurs ou un gonflement au niveau de la bouche ou de la gorge, des difficultés pour avaler, une gêne au niveau de l’abdomen, des douleurs ou un gonflement, des lésions au niveau de la gorge, de la bouche ou de l’estomac, une hémorragie interne, des vomissements, des ballonnements, de l’anxiété.
· Problèmes à l’endroit de l’incision, rougeur, sensibilité, fuite au niveau de la stomie, douleur ou irritation.
Fréquent (pouvant affecter jusqu’à 1 personne sur 10) :
· Gêne abdominale, douleurs abdominales hautes.
· Infection au site opératoire ou dans l’intestin, infection suite à l’intervention une fois que la sonde a été placée dans l’intestin.
· Inflammation du péritoine (péritonite).
· Déplacement de la sonde hors de l’intestin, par exemple dans l’estomac, ou obstruction de la sonde, ce qui peut entraîner une diminution de la réponse au traitement.
· Problèmes au niveau de l’appareil digestif en raison de la stomie (endroit où la sonde entre dans l’abdomen), douleur au site d’incision, arrêt des selles après l’intervention chirurgicale, et problèmes, gêne ou saignements consécutifs à l’intervention chirurgicale.
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100) :
· Inflammation du côlon ou du pancréas.
· Inflammation du pancréas (pancréatite).
· Pénétration de la sonde dans la paroi du gros intestin.
· Occlusion intestinale, saignement ou ulcère dans l’intestin grêle.
· Pénétration d’un segment de l’intestin dans une partie de l’intestin située plus bas (invagination intestinale).
· Accumulation d’aliments non digérés autour de la sonde entraînant son obstruction.
· Abcès après l’insertion de la sonde dans l’intestin.
Fréquence indéterminée (affectant un nombre indéterminé d’utilisateurs) :
· Réduction du débit sanguin dans l’intestin grêle.
· Pénétration de la sonde dans la paroi de l’estomac ou de l’intestin grêle.
· Infection du sang (septicémie).
Effets indésirables liés à la lévodopa et la carbidopa administrées par voie orale
Les effets indésirables suivants ont été rapportés avec la lévodopa et la carbidopa (les mêmes substances actives que pour LECIGIMON) administrées par voie orale. Ces effets pourraient également survenir avec LECIGIMON.
Rare (pouvant affecter jusqu’à 1 personne sur 1 000) :
· Anémie due à une augmentation de la dégradation des globules rouges.
· Incapacité à ouvrir la bouche complètement.
· Symptômes d’un côté du visage, y compris chute de la paupière (syndrome de Claude Bernard-Horner).
· Augmentation du diamètre de la pupille, mouvement convulsif des globes oculaires vers une position fixe, généralement vers le haut.
· Inflammation des petits vaisseaux sanguins causant, entre autres, des bleus en relief (purpura rhumatoïde ou syndrome de Schönlein-Henoch).
Très rare (pouvant affecter jusqu’à 1 personne sur 10 000) :
· Changements des résultats des tests sanguins.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette de la cartouche et la boîte après EXP.
Avant ouverture de la cartouche : Conservation et transport réfrigérés (entre 2 °C et 8 °C). Ne pas congeler.
A conserver dans l’emballage d’origine, à l’abri de la lumière.
Après ouverture de la cartouche : utiliser immédiatement. La cartouche peut être utilisée pendant 24 heures au maximum une fois sortie du réfrigérateur. Une fois la cartouche installée, la pompe d’administration peut être portée près du corps pendant une durée allant jusqu’à 16 heures. Pour le traitement durant la nuit, la pompe ne doit pas être portée près du corps mais peut être posée, par exemple, sur la table de nuit. Tout produit non utilisé doit être éliminé après 24 heures.
Cartouches à usage unique. Ne pas réutiliser une cartouche ouverte.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
· Les substances actives sont :
Lévodopa.............................................................................................................................. 20 mg
Carbidopa monohydratée......................................................................................................... 5 mg
Entacapone........................................................................................................................... 20 mg
Pour 1 mL de gel intestinal
· Les autres composants sont : carmellose sodique, acide chlorhydrique (pour ajustement du pH), hydroxyde de sodium (pour ajustement du pH), et eau.
Qu’est-ce que LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal et contenu de l’emballage extérieur
LECIGIMON en gel intestinal est un gel visqueux opaque jaune ou rouge-jaunâtre.
Il est conditionné en cartouche en plastique contenant 47 mL de gel intestinal.
Une boîte contient 7 cartouches.
Titulaire de l’autorisation de mise sur le marché
1 RUE ALEXANDER FLEMING
69007 LYON
Exploitant de l’autorisation de mise sur le marché
LABORATOIRE AGUETTANT
1 RUE ALEXANDER FLEMING
69007 LYON
BORRGATAN 31
211 24 MALMÖ
SUEDE
ou
STADA ARZNEIMITTEL AG
STADASTRASSE 2-18
61118 BAD VILBEL
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).