Dernière mise à jour le 08/01/2026
SCOPODERM TTS 1 mg/72 heures, dispositif transdermique
Indications thérapeutiques
Classe pharmacothérapeutique – ANTICHOLINERGIQUE (A : appareil digestif et métabolisme) (R : appareil respiratoire)
Ce médicament est indiqué dans la prévention des symptômes du mal des transports.
Il peut également être utilisé pour le traitement de l’encombrement des voies aériennes supérieures par excès de sécrétions salivaires dans le cadre des soins palliatifs.
Présentations
> un étui de 5 sachets polytéréphtalate (PET) polyéthylène basse densité (PEBD) aluminium de 1 dispositif
Code CIP : 328 494-3 ou 34009 328 494 3 7
Déclaration de commercialisation : 01/12/1998
Cette présentation est agréée aux collectivités
> boîte carton de 30 sachets polytéréphtalate (PET) polyéthylène basse densité (PEBD) aluminium de 1 dispositif
Code CIP : 575 848-6 ou 34009 575 848 6 3
Déclaration de commercialisation : 04/07/2011
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 18/11/2009 | Inscription (CT) | Le service médical rendu par SCOPODERM TTS dans le traitement des râles agoniques est important. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 18/11/2009 | Inscription (CT) | Cette spécialité est un complément de gamme qui n'apporte pas d'amélioration du service médical rendu (ASMR V). |
ANSM - Mis à jour le : 25/04/2025
SCOPODERM TTS 1 mg/72 heures, dispositif transdermique
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Scopolamine......................................................................................................................... 1,3 mg
Pour un dispositif transdermique.
Chaque dispositif transdermique libère environ 1 mg de scopolamine pendant 72 heures.
Pour la liste complète des excipients, voir rubrique 6.1.
Dispositif transdermique plat et rond.
Une des faces est couleur beige, l’autre est couleur argenté et recouverte d’un film carré clair et surdimensionné.
4.1. Indications thérapeutiques
· Prévention des symptômes du mal des transports.
· Traitement en soins palliatifs, des râles agoniques liés à l’encombrement des voies aériennes supérieures par excès de sécrétions salivaires.
4.2. Posologie et mode d'administration
· Prévention des symptômes du mal des transports
o Appliquer le dispositif derrière l'oreille à un endroit sec, sain et dépourvu de cheveux, la veille au soir pour un départ matinal ou le plus longtemps possible avant le départ (entre 6 et 12 heures).
o Le dispositif sera retiré dès la fin du voyage.
o La pose d'un seul dispositif est suffisante pour assurer une protection pendant 72 heures. En cas de voyage plus long, au bout de 72 heures retirer le dispositif et mettre en place un nouveau dispositif derrière l'autre oreille.
o Dans un certain nombre de cas, les effets subsistent plus de 12 heures après le retrait du dispositif.
· Soins palliatifs
Le dispositif sera appliqué sur un endroit sec, sain et dépourvu de poils.
Lors de l'application du dispositif, la scopolamine est délivrée durant une période 72 heures. Il convient de débuter le traitement par la pose d’un dispositif et de réévaluer l'efficacité et la tolérance clinique toutes les 24 heures afin d'adapter la posologie optimale. Il est possible que 2 ou 3 dispositifs soient ainsi appliqués simultanément. Dans ce cas, il faut évidemment tenir compte des doses cumulées et du fait que la vitesse de délivrance de la scopolamine est variable et plus élevée dans les 24 premières heures suivant la pose du dispositif.
Populations particulières :
Personnes âgées :
SCOPODERM TTS 1 mg/72 heures, dispositif transdermique peut être utilisé chez les personnes âgées bien qu’elles soient plus susceptibles aux effets indésirables de la scopolamine (voir rubrique 4.4).
Insuffisance rénale et hépatique :
L’utilisation de SCOPODERM TTS 1 mg/72 heures, dispositif transdermique doit être utilisé avec précaution en cas d’insuffisance rénale ou hépatique.
Mode d'utilisation
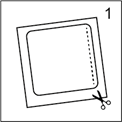
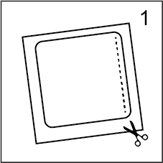
· Couper le sachet (l'emballage) le long de la ligne pointillée. Retirer tout le dispositif, de couleur chair, avec son feuillet de protection carré transparent (figure 1). Attention retirer entièrement le feuillet de protection. Ne pas découper, ni plier le dispositif.
|
|
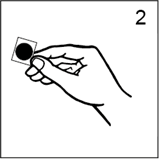
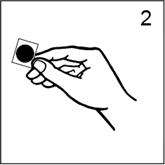
· Prendre soin de saisir le dispositif par le bord, en touchant le moins possible la face adhésive argentée (figure 2) et décoller le feuillet carré de protection.
|
|
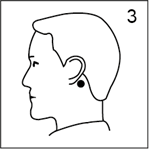
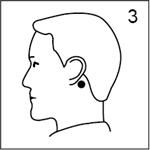
· Appliquer par une pression énergique la face adhésive (argentée) sur la peau saine, sèche et dépourvue de poils derrière l'oreille (figure 3).
|
|
· Pour éviter tout contact de la substance active avec l'œil (risque de légers troubles transitoires de la vue et dilatation pupillaire) éviter de toucher le dispositif après qu'il ait été appliqué ; se laver les mains et nettoyer le lieu d'application après chaque pose ou retrait d'un dispositif.
· En cas de décollement spontané, il convient de remettre en place un nouveau dispositif.
· Tout dispositif avant ou après son utilisation doit être soigneusement tenu hors de portée des enfants.
· Risque de glaucome par fermeture de l’angle.
· Risque de rétention urinaire lié à des troubles urétroprostatiques.
· Enfant de moins de 15 ans.
· Hypersensibilité à la scopolamine ou à l’un des excipients (voir rubrique 6).
Il est déconseillé de prendre de l'alcool pendant le traitement (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
SCOPODERM sera utilisé avec prudence en cas de sténose du pylore, de constipation ou d’occlusion intestinale, dûe aux effets anticholinergiques, ou de dysurie (par exemple en cas de troubles prostatiques), ainsi que chez les sujets âgés et les personnes présentant des troubles métaboliques ou une atteinte fonctionnelle hépatique ou rénale.
En cas d'antécédents d'élévation de la pression intra-oculaire (douleur à la pression, vision floue, halo glaucomateux), n'employer SCOPODERM qu'après un examen ophtalmologique.
Dans de rares cas, des états confusionnels et / ou des hallucinations visuelles peuvent survenir. Dans de tels cas, le dispositif SCOPODERM doit être enlevé. Si, malgré cela, les symptômes persistent sous une forme grave, des mesures thérapeutiques appropriées doivent être prises : par exemple, administration de physostigmine à la posologie de 1 à 4 mg, par injection intraveineuse lente, à répéter si nécessaire.
Dans des cas isolés, une augmentation de la fréquence des crises chez les patients épileptiques a été signalée.
Les réactions idiosyncrasiques peuvent survenir avec des doses thérapeutiques de scopolamine.
Après le retrait du dispositif, des précautions doivent être prises car les effets de la scopolamine peuvent persister jusqu'à 24 heures ou plus.
En raison de la présence d'aluminium dans l'une des couches du dispositif, celui-ci doit être retiré avant la réalisation d’un scanner ou d’une IRM.
Après l'application, le retrait ou la manipulation de SCOPODERM TTS 1 mg/72 heures, dispositif transdermique, les mains et le site d'application doivent être soigneusement lavés, ceci afin de prévenir que des traces de substance active ne parviennent aux yeux, ce qui pourrait entraîner passagèrement de légers troubles visuels et une dilatation de la pupille (parfois uniquement sur un œil).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Médicaments atropiniques
Il faut prendre en compte le fait que les substances atropiniques peuvent additionner leurs effets indésirables et entraîner plus facilement une rétention urinaire, une poussée aiguë de glaucome, une constipation, une sécheresse de la bouche, etc
Les divers médicaments atropiniques sont représentés par les antidépresseurs imipraminiques, la plupart des antihistaminiques H1 atropiniques, les antiparkinsoniens, anticholinergiques, les antispasmodiques atropiniques, le disopyramide, les neuroleptiques phénothiaziniques ainsi que la clozapine.
Associations déconseillées
+ Alcool
Risque de majoration de l'effet sédatif des neuroleptiques. L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines.
Eviter la prise de boissons alcoolisées et de médicaments contenant de l'alcool.
Associations à prendre en compte
+ Autres médicaments atropiniques
Addition des effets indésirables atropiniques à type de rétention urinaire, constipation, sécheresse de la bouche
- + Anticholinestérasiques
Risque de moindre efficacité de l’anticholinestérasique par antagonisme des récepteurs de l’acétylcholine par l’atropinique.
- + Morphiniques
Risque important d'akinésie colique, avec constipation sévère.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'y a pas de données sur l’utilisation de la scopolamine chez la femme enceinte. Les études animales chez la souris et le rat n'ont pas révélé de toxicité pour la reproduction ou le développement à des doses comparables à la dose clinique recommandée (voir section 5.3).
La scopolamine, traverse facilement le placenta. En conséquence, par mesure de précaution, il est préférable de ne pas utiliser la scopolamine pendant la grossesse.
Chez les nouveau-nés de mères traitées au long cours par de fortes posologies de médicaments à propriétés anticholinergiques ont été rarement décrits des signes liés aux propriétés atropiniques (distension abdominale, iléus méconial, tachycardie, hyperexcitabilité, rétention urinaire).
En conséquence, il semble raisonnable d'essayer de limiter les doses et les durées de prescription pendant la grossesse.
En cas de traitement prolongé et/ou à doses élevées et/ou proche du terme, il semble justifié d'observer une période de surveillance du nouveau-né tenant compte des effets précédemment décrits.
En cas de grossesse, la patiente doit parler à un médecin avant d’utiliser SCOPODERM.
Allaitement
La scopolamine passe dans le lait maternel à l'état de traces. Toutefois, en raison d'une marge thérapeutique étroite et de la longue demi-vie du produit, le traitement par SCOPODERM TTS 1 mg/72 h, dispositif transdermique doit être déconseillé pendant le l’allaitement.
En cas d’allaitement, la patiente doit parler à un médecin avant d’utiliser SCOPODERM.
Fertilité
Chez le rat, il n'a pas été mis en évidence d'effet indésirable sur la fertilité femelle (voir section 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
En raison des risques de somnolence et de troubles visuels liés à l'administration de scopolamine, l'utilisation de ce produit est déconseillée chez les conducteurs de véhicules et les utilisateurs de machines (voir rubrique 4.8).
Les patients doivent donc être avertis. Une mise en garde concernant les activités telles que la conduite d’un véhicule ou l’utilisation de machines est nécessaire.
Les effets indésirables sont listés ci-dessous par type d’organe et par fréquence. Les fréquences sont définies comme suit : très fréquent (≥1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1000 à 1/100), rare (≥ 1/10 000 à 1/1000), très rare (< 1/10 000), ou fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Dans chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
|
Système de classification MedDRA |
Très fréquent (≥ 1/10) |
Fréquent (≥ 1/100 à < 1/10) |
Peu fréquent (≥ 1/1 000 à < 1/100) |
Rare (≥ 1/10 000 à < 1/1 000 |
Très rare (< 1/10 000) |
Fréquence indéterminée (ne peut être estimée à partir des données disponibles) |
|
Affections psychiatriques |
|
|
|
désorientation, confusion, hallucinations. |
|
|
|
Affections du système nerveux (plus particulièrement chez le sujet âgé)
|
somnolence, sensations de vertige. |
|
|
troubles de la mémoire et de l’attention et agitation |
|
Anomalies de coordination, maux de tête, |
|
Troubles généraux et anomalies au site d’administration |
|
|
|
|
|
réactions au site d’application, y compris éruption cutanée, prurit, érythème et brûlure. |
|
Affections oculaires |
cycloplégie (troubles de l'accommodation visuelle) incluant vision floueet mydriase (parfois unilatérale, en particulier lorsque des traces de substances actives restées sur les doigts parviennent aux yeux ou sur les lentilles de contact). |
Irritation des paupières. |
|
|
glaucome par fermeture de l’angle |
|
|
Affections gastro-intestinales |
sécheresse buccale passagère |
|
|
|
|
constipation |
|
Affections de la peau et du tissu sous-cutané |
|
irritations de la peau |
|
|
exanthèmes généralisés |
|
|
Affections du rein et des voies urinaires |
|
|
|
rétention urinaire. |
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|
|
|
|
hyperviscosité des sécrétions bronchiques. |
Effets indésirables après retrait du dispositif :
A l'arrêt du traitement après une utilisation pendant quelques jours, de rares cas de vertiges, nausées, vomissements, céphalées et troubles de l'équilibre ont été rapportés.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Signes et symptômes
Compte tenu du dispositif d'administration et de la libération contrôlée de la scopolamine, le risque de surdosage est très faible.
Les actions centrales de la scopolamine à fortes doses sont similaires à celles de l’atropine.
Elles se manifestent d’abord par l’agitation, des états d’excitation et de la confusion.
A des doses plus élevées, des délires, des hallucinations ainsi que des convulsions peuvent survenir.
A doses très élevées, un coma et une paralysie respiratoire peuvent apparaître.
Traitement
En cas de surdosage (application accidentelle de plusieurs dispositifs), l'apparition d'effets indésirables liés au blocage muscarinique nécessite le retrait immédiat des dispositifs et la mise en route d'un traitement symptomatique.
En effet, certains symptômes de surdosage peuvent persister jusqu'à 24 heures ou plus, même après le retrait du dispositif.
L'antidote le plus efficace est la physostigmine, qui, selon la gravité de l'intoxication, doit être injecté en IV lente à des doses de 1 à 4 mg (chez l’enfant 0,5 mg en cas d’exposition accidentelle). Comme la physostigmine est rapidement métabolisée, le patient peut tomber dans le coma à nouveau dans les 1 à 2 heures suivantes, ce qui nécessite de nouvelles injections physostigmine.
En cas d’excitation et de convulsions, l’administration de diazépam à faible dose peut s’avérer utile.
Des doses trop élevées doivent être évitées en raison d’un risque supplémentaire de dépression respiratoire.
Dans les cas graves, le recours à la respiration artificielle peut être nécessaire. En présence d’une hyperthermie, il faut dissiper la chaleur rapidement (bains froids).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTICHOLINERGIQUE (A : appareil digestif et métabolisme)
(R : appareil respiratoire).
5.2. Propriétés pharmacocinétiques
Le dispositif transdermique permet le passage contrôlé de la substance active à travers la peau dans la circulation générale.
Après l’application du Scopoderm, l’équilibre entre la quantité de substance active absorbée et éliminée est atteint après environ 6 heures.
Ce dispositif délivre in vivo approximativement 1,0 mg de scopolamine en 72 heures.
Si la vitesse de délivrance est constante de la 24ème à la 72ème heure (cinétique d'ordre 0) avec un taux plasmatique en plateau allant de 0,17 à 0,33 nmol/l (cœfficients de variation inter et intra-sujets de 30 et 25 pour cent environ), elle est en revanche nettement plus élevée pendant les 24 premières heures en raison d'une dose de charge de scopolamine dans la couche adhésive.
Peu de données sur la répartition de la scopolamine est disponible, mais le médicament distribue bien et atteint le système nerveux central. La scopolamine semble être liée aux protéines plasmatiques de manière réversible. Le métabolisme de la scopolamine n'a pas été entièrement caractérisé. Le médicament semble être métabolisé dans le foie (glucuronide ou conjugaison de sulfate).
La scopolamine est excrétée dans l'urine. La vitesse d'excrétion urinaire entre la 24ème et 72ème heure est voisine de celle de la perfusion I.V.
La quantité de substance active se trouvant dans l'organisme diminue lentement, à environ 1/3 de la valeur précédente, au cours des 24 heures qui suivent le retrait du dispositif, car la scopolamine, encore présente dans la peau, diffuse dans la circulation sanguine.
Le taux d'excrétion urinaire de la scopolamine sous forme libre et totale (libre et conjugué) a été d'environ 0,7 et 3,8 microgrammes / heure, respectivement, après l'application d'un seul dispositif de scopolamine. Moins de 10% de la dose totale est excrétée dans l'urine sous forme inchangée et de ses métabolites après 108 heures. Après une seule application de deux dispositifs de scopolamine, la demi-vie d’élimination moyenne du médicament (scopolamine libre) était de 9,5 heures.
5.3. Données de sécurité préclinique
Les données non cliniques basées sur des études conventionnelles de toxicité à doses répétées ne révèlent aucun risque particulier pour l'homme d’irritation cutanée, de génotoxicité, de cancérogénèse et de toxicité pour la reproduction. Un effet marginal embryotoxique a été observé chez le lapin avec du bromhydrate de scopolamine administré par injection intraveineuse quotidienne à des doses qui étaient environ 100 fois le niveau atteint avec les dispositifs. Aucun effet indésirable n’a été enregistré dans les études de reprotoxicité après administration intraveineuse chez le rat.
Les études de fertilité menées chez des rats femelles n'ont pas révélé d’effet sur la fertilité après administration sous-cutanée quotidienne de bromhydrate de scopolamine. Le poids corporel a été réduit chez les femelles du groupe recevant la dose la plus élevée induisant une exposition systémique 500 fois plus élevés que le niveau atteint à la posologie recommandée chez l’Homme
Contenu du réservoir : huile de paraffine fluide, polyisobutylène de haute masse moléculaire, polyisobutylène de faible masse moléculaire, crospovidone, palmitate d’isopropyle.
Membrane laminaire : aluminium, polyester.
Membrane perméable : copolymère d’éthylène-acétate de vinyle .
Adhésif : huile de paraffine fluide, polyisobutylène de haute masse moléculaire, polyisobutylène de faible masse moléculaire, crospovidone, palmitate d’isopropyle.
Membrane de protection : polyester.
Sans objet.
36 mois.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
Boîte carton de 2, 6, 15, 30 ou 60 dispositifs en sachet unitaire (complexe aluminium).
Un étui de 5 dispositifs en sachet unitaire (complexe aluminium).
Le matériau du sachet est un laminé de PET, de polyéthylène basse densité, d'une feuille d'aluminium enduite et d'un film déshydratant.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
BAXTER S.A.S
IMMEUBLE BERLIOZ
4 BIS RUE DE LA REDOUTE
78280 GUYANCOURT
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 328 299 6 5 : boîte carton de 2 dispositifs en sachet unitaire (complexe aluminium).
· 34009 328 300 4 6 : boîte carton de 6 dispositifs en sachet unitaire (complexe aluminium).
· 34009 328 494 3 7 : un étui de 5 dispositifs en sachet unitaire (complexe aluminium).
· 34009 575 849 2 4 : boîte carton de 15 dispositifs en sachet unitaire (complexe aluminium).
· 34009 575 848 6 3 : boîte carton de 30 dispositifs en sachet unitaire (complexe aluminium).
· 34009 575 850 0 6 : boîte carton de 60 dispositifs en sachet unitaire (complexe aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.
ANSM - Mis à jour le : 25/04/2025
SCOPODERM TTS 1 mg/72 heures, dispositif transdermique
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que SCOPODERM TTS 1 mg/72 heures, dispositif transdermique et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser SCOPODERM TTS 1 mg/72 heures, dispositif transdermique ?
3. Comment utiliser SCOPODERM TTS 1 mg/72 heures, dispositif transdermique ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SCOPODERM TTS 1 mg/72 heures, dispositif transdermique ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SCOPODERM TTS 1 mg/72 heures, dispositif transdermique ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique – ANTICHOLINERGIQUE (A : appareil digestif et métabolisme) (R : appareil respiratoire)
Ce médicament est indiqué dans la prévention des symptômes du mal des transports.
Il peut également être utilisé pour le traitement de l’encombrement des voies aériennes supérieures par excès de sécrétions salivaires dans le cadre des soins palliatifs.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER SCOPODERM TTS 1 mg/72 heures, dispositif transdermique ?
N’utilisez jamais SCOPODERM TTS 1 mg/72 heures, dispositif transdermique :
· Si vous avez un glaucome par fermeture de l’angle (pression anormalement élevée à l'intérieur de l'œil),
· en cas de risque de difficultés pour uriner, d'origine prostatique ou autre,
· chez les enfants de moins de 15 ans en raison de leur sensibilité particulière,
· si vous êtes allergique (hypersensible) à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés à la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou votre pharmacien avant d’utiliser SCOPODERM TTS 1 mg/ 72 heures, dispositif transdermique si vous :
· Etes une personne âgée ou présentant des maladies du métabolisme du foie ou des reins,
· Souffrez d’une sténose du pylore (rétrécissement de l’orifice faisant communiquer l’estomac et le duodénum),
· Avez une occlusion intestinale (blocage partiel ou complet du petit ou du gros intestin), dûe aux effets anticholinergiques.
· Avez des difficultés à uriner (par exemple en raison d’une augmentation du volume de la prostate),
· Avez ou avez eu des douleurs au niveau des yeux, une vision floue, ou la vision de halos multicolores autour d’une lumière (SCOPODERM ne devrait être utilisé qu’après un examen des yeux par un médecin),
· Souffrez ou avez souffert d’épilepsie ou eu des crises d’épilepsie (une augmentation du nombre de crises a été rapportée chez les patients traités par SCOPODERM),
· Prenez d’autres médicaments.
Dans ces circonstances, le SCOPODERM peut être inadapté à votre cas.
Dans de rares cas, des états confusionnels et / ou hallucinations visuelles peuvent se produire. Si cela devait arriver, retirez le SCOPODERM immédiatement et parlez-en à un médecin.
Après le retrait du dispositif, des précautions doivent être prises car les effets secondaires peuvent persister jusqu’à 24 heures ou plus.
Retirez le dispositif avant les scanners et les IRM.
Après l’application, le retrait ou la manipulation de SCOPODERM TTS 1mg.72 heures, dispositif transdermique, les mains et le site d’application doivent être soigneusement lavés, ceci afin de prévenir que des traces de substance active ne parviennent aux yeux, ce qui pourrait entraîner passagèrement de légers troubles visuels et une dilatation de la pupille (parfois uniquement sur un œil)..
Autres médicaments et SCOPODERM TTS 1 mg/72 heures, dispositif transdermique
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
En particulier, informez votre médecin si vous prenez l'un des médicaments ou substances suivants, car le patch peut interagir avec eux:
· Alcool
· autre médicament agissant sur le système nerveux central, en particulier les médicaments présentant une activité anticholinergique comme:
o autres alcaloïdes de belladone
o antihistaminiques,
o antidépresseur (par exemple amitriptyline et imipramine)
o amantadine
o quinidine
o autres médicaments contre le mal des transports
SCOPODERM TTS 1 mg/72 heures, dispositif transdermique avec des aliments et boissons
Il est déconseillé de prendre de l'alcool pendant le traitement.
Grossesse, allaitement et fertilité
Il est préférable de ne pas utiliser ce médicament pendant la grossesse.
Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin car lui seul peut juger de la nécessité de le poursuivre.
L'allaitement est déconseillé pendant le traitement.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
En raison des risques de somnolence, de confusion, d’étourdissements et de troubles de la vue liés à la scopolamine, l'utilisation de ce produit est déconseillée chez les conducteurs de véhicules et les utilisateurs de machines.
3. COMMENT UTILISER SCOPODERM TTS 1 mg/72 heures, dispositif transdermique ?
Veillez à toujours utiliser ce médicament en suivant exactement les instructions de cette notice ou les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Posologie
Prévention des symptômes du mal des transports :
· SCOPODERM doit être appliqué la veille au soir pour un départ matinal ou 6 à 12 heures avant le début du voyage ; coller le SCOPODERM derrière l'oreille, sur la peau sèche et saine, à un endroit dépourvu de cheveux.
· SCOPODERM protège contre le mal des transports pendant 3 jours, mais il doit être retiré plus tôt si le voyage dure moins longtemps. Si la protection doit durer plus de 3 jours, il suffit d'enlever le premier SCOPODERM et d'en coller un nouveau derrière l'autre oreille.
· Dans un certain nombre de cas, les effets subsistent plus de 12 heures après le retrait du dispositif.
Soins palliatifs :
Le dispositif sera appliqué sur un endroit sec, sain et dépourvu de poils.
Lors de l'application du dispositif, la scopolamine est délivrée durant une période 72 heures.
Le traitement sera débuté par la pose d’un dispositif, puis l'efficacité et la tolérance clinique seront réévaluées par l'équipe soignante toutes les 24 heures afin d'adapter la posologie optimale. Il est possible que 2 ou 3 patchs soient ainsi appliqués simultanément.
Populations particulières :
Personnes âgées :
SCOPODERM TTS 1 mg/72 heures, dispositif transdermique peut être utilisé chez les personnes âgées bien qu’elles soient plus susceptibles aux effets indésirables de la scopolamine (voir rubriques 2 et 4).
Insuffisance rénale et hépatique :
L’utilisation de SCOPODERM TTS 1 mg/72 heures, dispositif transdermique doit être utilisé avec précaution en cas d’insuffisance rénale ou hépatique.
Mode d'administration
Voie transdermique.
· Couper le sachet (l'emballage) le long de la ligne pointillée. Retirer tout le dispositif, de couleur chair, avec son feuillet de protection carré transparent (figure 1). Attention, retirer entièrement le feuillet de protection. Ne pas découper, ni plier le dispositif.
|
|
· Prendre soin de saisir le dispositif par le bord, en touchant le moins possible la face adhésive argentée (figure 2) et décoller le feuillet carré de protection.
|
|
· Appliquer par une pression énergique la face adhésive (argentée) sur la peau sèche, derrière l'oreille (figure 3). Veiller à ce que le dispositif soit bien collé ; une fois fixé, il ne doit plus être déplacé.
|
|
· Si SCOPODERM TTS, qui normalement adhère bien, se détache, il faut le remplacer par un nouveau dispositif.
· Eviter de toucher le dispositif après qu’il ait été appliqué car la pression exercée pourrait provoquer le suintement de la scopolamine sur le bord du dispositif.
· Il est important de se laver soigneusement les mains après l'application et le retrait du dispositif (laver aussi le lieu d'application après le retrait), pour empêcher que des traces de substance active restées sur les doigts ne parviennent aux yeux, ce qui pourrait entraîner passagèrement de légers troubles visuels et une dilatation de la pupille.
· Les bains, douches ou shampoings n'altèrent ni l'adhérence, ni l'action de SCOPODERM.
Tout dispositif, utilisé ou non, doit être tenu hors de la portée des enfants.
Si vous avez pris plus de SCOPODERM TTS 1 mg/72 heures, dispositif transdermique que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Ne pas dépasser la dose indiquée. Si vous avez appliqué trop de dispositifs en même temps accidentellement, vous pouvez vous sentir agité, excité ou confus.
Dans le cas d’un surdosage plus important, vous pouvez être désorienté, avoir des hallucinations ou faire une crise convulsive.
Dans les cas graves de surdosage, un coma et des difficultés respiratoires peuvent survenir.
Retirez le/les dispositif(s) immédiatement (certains symptômes du surdosage peuvent persister jusqu’à 24h ou plus après le retrait du dispositif), et informez-en votre médecin ou contactez immédiatement le service des urgences le plus proche. Prenez les dispositifs restants avec vous.
Si vous oubliez de prendre SCOPODERM TTS 1 mg/72 heures, dispositif transdermique
Sans objet.
Si vous arrêtez d’utiliser SCOPODERM TTS 1 mg/72 heures, dispositif transdermique
Dans de rares cas, généralement après plusieurs jours d'utilisation, des symptômes tels que des sensations de vertiges, des nausées (envie de vomir), des vomissements, des maux de tête et des troubles de l'équilibre ont été signalés après l'arrêt du traitement. Si cela arrive, consultez un médecin.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d’informations à votre médecin ou votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Cessez d'utiliser SCOPODERM et cherchez de l'aide médicale immédiatement si vous ou le patient présente l'un des symptômes suivants qui peuvent être signe d'une réaction allergique :
· difficulté à respirer ou à avaler,
· œdème du visage, des lèvres, de la langue ou de la gorge,
· démangeaisons de la peau, avec des rougeurs ou des papules.
Certains effets indésirables peuvent être graves, ils sont très rares (pouvant affecter 1 personne sur 10 000) :
· Changements de la vision avec une pression accrue dans l'œil (signes possibles de glaucome)
Si vous rencontrez ces effets indésirables, prévenez votre médecin immédiatement.
Certains effets secondaires sont très fréquents (pouvant affecter plus d'1 personne sur 10) :
· sécheresse de la bouche,
· somnolence, sensations de vertiges,
· perturbation de la vision de près et dilatation de la pupille (parfois uniquement sur un œil)
· perte de la capacité à se concentrer sur des objets de près ou de loin (troubles de l’accommodation).
Certains effets secondaires sont fréquents (pouvant affecter entre 1 et 10 personnes sur 100) :
· irritation des paupières,
· irritation de la peau.
Certains effets secondaires sont rares (peuvent affecter entre 1 et 10 personnes sur 10 000) :
· difficultés à uriner,
· troubles de la mémoire ou de concentration (dans cette éventualité, retirer le dispositif), agitation, désorientation, confusion ou hallucinations.
· Plus particulièrement chez les sujets âgés ou dans le cadre des soins palliatifs, peuvent survenir des états de confusion et/ou des hallucinations visuelles.
Certains effets secondaires sont très rares (pouvant affecter moins de 1 personne sur 10 000) :
· éruption cutanée.
Peuvent également survenir :
· des réactions cutanées localisées,
· très exceptionnellement: rougeur de la peau généralisée,
· des anomalies de coordination, des maux de tête,
· une légère baisse de la pression artérielle,
· une augmentation de la viscosité des sécrétions bronchiques,
· une constipation.
Si vous ressentez des effets indésirables qui vous inquiètent (même des effets non répertoriés dans cette notice), retirez le dispositif transdermique et parlez-en à votre médecin ou pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SCOPODERM TTS 1 mg/72 heures, dispositif transdermique ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date d’expiration fait référence au dernier jour du mois.
A conserver à une température ne dépassant pas 25°C.
A conserver dans l’emballage d’origine.
Le patch doit être plié en deux (face adhésive vers l'intérieur) avant d'être jeté.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SCOPODERM TTS 1 mg/72 heures, dispositif transdermique
· La substance active est :
Scopolamine................................................................................................................... 1,3 mg
Pour un dispositif transdermique.
Chaque dispositif transdermique libère environ 1 mg de scopolamine pendant 72 heures.
· Les autres composants sont :
Contenu du réservoir : huile de paraffine fluide, polyisobutylène de haute masse moléculaire, polyisobutylène de faible masse moléculaire, crospovidone, palmitate d’isopropyle.
Membrane laminaire : aluminium, polyester.
Membrane perméable : copolymère d’éthylène-acétate de vinyle.
Adhésif : huile de paraffine fluide, polyisobutylène de haute masse moléculaire, polyisobutylène de faible masse moléculaire, crospovidone, palmitate d’isopropyle.
Membrane de protection : polyester.
Ce médicament se présente sous forme de dispositif transdermique.
Boîte de 2, 5, 6, 15, 30 ou 60 sachets unitaires.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
BAXTER S.A.S
IMMEUBLE BERLIOZ
4 BIS RUE DE LA REDOUTE
78280 GUYANCOURT
Exploitant de l’autorisation de mise sur le marché
BAXTER S.A.S
IMMEUBLE BERLIOZ
4 BIS RUE DE LA REDOUTE
78280 GUYANCOURT
FAMAR A.V.E. - AVLON PLANT 48TH KM NATIONAL LAMIA
AVLON PLANT
48TH KM NATIONAL
ROAD ATHENS-LAMIA
19011 AVLONAS, ATTIKI
GRECE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).