Dernière mise à jour le 01/12/2025
AMIRIOX 0,3 mg/mL, collyre en solution
Indications thérapeutiques
AMIRIOX contient la substance active bimatoprost qui est un médicament antiglaucomateux. Il fait partie d’un groupe de médicaments appelé prostamides.
AMIRIOX est utilisé pour réduire une tension élevée dans l’œil dans la population adulte. Ce médicament peut être utilisé seul ou en association avec d’autres gouttes appelées « bêtabloquants », qui réduisent également la tension dans l’œil.
Ce médicament fonctionne en augmentant le liquide drainé à partir de l’œil en évitant une hyperpression dans l’œil. Cela diminue la tension à l’intérieur de l’œil. Si cette tension excessive n’est pas réduite, elle peut entraîner une maladie appelée glaucome et conduire finalement à la détérioration de la vision.
Ce médicament ne contient pas de conservateur.
Présentations
> 1 flacon(s) polyéthylène basse densité (PEBD) avec fermeture à témoin d'effraction de 3 ml avec compte-gouttes multidose(s)
Code CIP : 34009 302 346 0 0
Déclaration de commercialisation : 15/09/2022
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 7,17 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 8,19 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 06/04/2022 | Inscription (CT) | Cette spécialité est un hybride qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité de référence LUMIGAN (bimatoprost) 0,3 mg/ml, collyre en solution. |
ANSM - Mis à jour le : 04/10/2024
AMIRIOX 0,3 mg/mL, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un mL de solution contient 0,3 mg de bimatoprost.
Excipient à effet notoire : phosphates.
Un mL de solution contient 0,95 mg de phosphates.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution incolore limpide.
pH 6.8 à 7.8
Osmolalité: 280 à 320 mOsmol/kg
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
La posologie recommandée est d’une goutte dans l’œil ou les yeux atteints une fois par jour, administrée le soir. La dose ne doit pas dépasser une instillation par jour, un usage plus fréquent pouvant diminuer l’efficacité sur la baisse de pression intraoculaire.
Population pédiatrique
La sécurité et l’efficacité de AMIRIOX chez les enfants âgés de 0 à 18 ans n’ont pas encore été établies.
Patients présentant une insuffisance hépatique ou rénale
Bimatoprost n’a pas été étudié chez les malades atteints d’insuffisance rénale ou d’insuffisance hépatique modérée à sévère. En conséquence, il doit être utilisé avec précaution chez ces patients.
Chez les patients ayant un antécédent de maladie hépatique bénigne ou des taux de base anormaux d’alanine aminotransférase (ALAT), d’aspartate aminotransférase (ASAT) et/ou de bilirubine, aucun effet délétère sur la fonction hépatique n’a été observé avec bimatoprost 0,3 mg/ml, collyre en solution (flacon multidose avec conservateur) sur 24 mois.
Mode d’administration
Voie ophtalmique uniquement.
AMIRIOX est une solution stérile qui ne contient pas de conservateur.
L’occlusion du canal lacrymo‑nasal ou la fermeture des paupières pendant deux minutes permet de réduire l’absorption systémique. Cela peut diminuer les effets indésirables systémiques et augmenter l’action locale.
Vous devez retirer vos lentilles de contact avant d’utiliser ce médicament et attendre 15 minutes après avoir instillé les gouttes avant de remettre vos lentilles.
En cas d’utilisation concomitante de plusieurs médicaments ophtalmiques à usage local, chacun doit être administré à un intervalle d’au moins 5 minutes. Les pommades doivent être appliquées en dernier.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Avant le début du traitement, les patients doivent être informés que AMIRIOX est susceptible d’entraîner une périorbitopathie associée aux analogues des prostaglandines (PAP) et une augmentation de la pigmentation de l’iris, comme cela a pu être observé chez les patients traités par bimatoprost. Certains de ces changements peuvent être définitifs et peuvent entraîner une altération du champ de vision et des différences d’apparence entre les yeux si un seul œil est traité (voir rubrique 4.8).
Des cas d’œdème maculaire cystoïde ont été rapportés peu fréquemment (≥ 1/1 000 à < 1/100) après traitement avec bimatoprost 0,3 mg/ml, collyre en solution (flacon multidose avec conservateur). En conséquence, AMIRIOX doit être utilisé avec précaution chez les patients présentant un facteur de risque connu d’œdème maculaire (par exemple : patients aphaques, pseudophaques avec rupture capsulaire postérieure).
De rares cas de réactivation d’anciens infiltrats cornéens ou d’anciennes infections oculaires ont été spontanément rapportés avec bimatoprost 0,3 mg/ml, collyre en solution (flacon multidose avec conservateur). AMIRIOX doit être utilisé avec précaution par les patients ayant des antécédents d’infections oculaires virales importantes (par exemple : herpès simplex) ou d’uvéite/iritis.
AMIRIOX n’a pas été étudié chez les patients présentant une inflammation oculaire, un glaucome néovasculaire et inflammatoire, un glaucome à angle fermé, un glaucome congénital ou un glaucome à angle étroit.
Cutanées
Une augmentation de la pilosité peut survenir aux endroits de contacts répétés de la solution AMIRIOX avec la peau. Il est donc important d’appliquer AMIRIOX selon les instructions et d’éviter qu’il ne coule sur la joue ou d’autres endroits de la peau.
Respiratoires
AMIRIOX n’a pas été étudié chez les malades souffrant d’insuffisance respiratoire. Bien que les données disponibles chez les patients présentant des antécédents d’asthme ou de BPCO soient limitées, des cas d’exacerbation de l’asthme, de la dyspnée et de la BPCO, ainsi que la survenue de crises d’asthme, ont été rapportés depuis la mise sur le marché. La fréquence de ces symptômes est indéterminée. Les patients atteints de BPCO, asthmatiques ou dont la fonction respiratoire est altérée en raison d’autres affections doivent être traités avec précaution.
Cardiovasculaires
AMIRIOX n’a pas été étudié chez les patients présentant un bloc cardiaque plus sévère qu’un bloc de premier degré ou une insuffisance cardiaque congestive non contrôlée. Il y a eu un nombre limité de rapports spontanés de cas de bradycardie ou d’hypotension lors de l’utilisation du bimatoprost 0,3 mg/ml, collyre en solution (flacon multidose avec conservateur). AMIRIOX doit être utilisé avec précaution par les patients présentant des prédispositions à un rythme cardiaque lent ou à une pression artérielle basse.
Informations complémentaires
Dans des études portant sur le bimatoprost 0,3 mg/ml chez des patients présentant un glaucome ou une hypertension oculaire, il a été montré qu’une exposition plus fréquente de l’œil au bimatoprost (c’est- à-dire à plus d’une dose par jour) peut diminuer l’effet de réduction de la pression intraoculaire. Les patients chez qui AMIRIOX est associé avec d’autres analogues des prostaglandines doivent de ce fait être suivis afin de surveiller l’évolution de leur pression intraoculaire.
Bimatoprost n’a pas été étudié chez les patients portant des lentilles de contact.
Les lentilles de contact doivent être retirées avant l’instillation et peuvent être remises 15 minutes après l’administration.
Des kératites bactériennes associées à l’utilisation de conditionnements multidoses de produits ophtalmiques topiques ont été signalées. Ces conditionnements avaient été accidentellement contaminés par les patients, qui, dans la plupart des cas, présentaient une pathologie oculaire sousjacente. Chez les patients qui présentent une atteinte de la surface épithéliale oculaire, le risque de développer une kératite bactérienne est plus élevé.
Les patients doivent recevoir des instructions afin d’éviter que l’embout du flacon n’entre en contact avec l’oeil ou les structures avoisinantes, pour éviter une lésion de l’oeil ou une contamination de la solution.
Ce médicament ne doit pas être utilisé chez les patients ayant des antécédents d’hypersensibilité de contact à l’argent car les gouttes instillées peuvent contenir des traces d’argent.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
Aucune interaction n’est attendue chez l’homme, car les concentrations systémiques de bimatoprost sont extrêmement faibles (moins de 0,2 ng/ml) après administration par voie ophtalmique du bimatoprost 0,3 mg/ml, collyre en solution (flacon multidose avec conservateur). Le bimatoprost est transformé par différentes voies métaboliques, mais aucun effet sur les enzymes impliqués dans le métabolisme hépatique n’a été observé dans les études précliniques.
Dans les études cliniques, bimatoprost 0,3 mg/ml (flacon multidose avec conservateur) a été utilisé simultanément avec plusieurs bêtabloquants à usage ophtalmique sans mise en évidence d’interactions.
En dehors des bêtabloquants à usage local, l’association de AMIRIOX avec d’autres agents antiglaucomateux n’a pas été étudiée dans le traitement du glaucome.
L’effet de réduction de la pression intraoculaire exercé par les analogues des prostaglandines (par exemple AMIRIOX) risque d’être moindre s’ils sont utilisés avec d’autres analogues des prostaglandines chez les patients présentant un glaucome ou une hypertension oculaire (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données pertinentes sur l’utilisation du bimatoprost chez la femme enceinte. Les études menées chez l’animal ont mis en évidence une toxicité sur la reproduction à des doses maternotoxiques élevées (voir rubrique 5.3).
AMIRIOX ne doit pas être utilisé pendant la grossesse, sauf en cas d’absolue nécessité.
Allaitement
On ne sait pas si le bimatoprost est excrété dans le lait maternel. Des essais sur des animaux ont mis en évidence un passage du bimatoprost dans le lait. La décision d’interrompre l’allaitement ou d’arrêter le traitement par AMIRIOX doit être prise en tenant compte du bénéfice de l’allaitement pour l’enfant et du bénéfice du traitement pour la mère.
Fertilité
Il n’existe pas de données sur les effets du bimatoprost sur la fertilité humaine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Dans une étude clinique sur 3 mois, environ 29 % des patients traités par bimatoprost 0,3 mg/ml en récipient unidose (sans conservateur) ont rapporté des effets indésirables. Les effets indésirables les plus fréquemment rapportés ont été une hyperhémie conjonctivale (la plupart du temps minime à légère et considérée comme étant de nature non inflammatoire) chez 24 % des patients et un prurit oculaire chez 4 % des patients.
Environ 0,7 % des patients du groupe traités par bimatoprost 0,3 mg/ml en récipient unidose (sans conservateur) ont arrêté le traitement en raison d’un effet indésirable survenu au cours des 3 mois de l’étude.
Les effets indésirables décrits ci-dessous ont été rapportés pendant les essais cliniques sur bimatoprost 0,3 mg/ml en récipient unidose (sans conservateur) ou après la mise sur le marché. La plupart étaient oculaires, d’intensité légère et aucun n’était grave.
Les effets indésirables très fréquents (≥ 1/10) ; fréquents (≥ 1/100 à < 1/10) ; peu fréquents (≥ 1/1 000 à < 1/100) ; rares (≥ 1/10 000 à < 1/1 000) ; très rares (< 1/10 000) et de fréquence indéterminée (qui ne peut pas être évaluée sur la base des données disponibles) sont classés dans le tableau 1, conformément aux classes de systèmes d’organes. Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Tableau 1
|
Classe de systèmes d’organes |
Fréquence |
Effet indésirable |
|
Affections du système nerveux |
peu fréquent |
Céphalées |
|
indéterminée |
Sensations vertigineuses |
|
|
Affections oculaires |
très fréquent |
Hyperhémie conjonctivale, périorbitopathie associée aux analogues des prostaglandines |
|
fréquent |
Kératite ponctuée, irritation oculaire, sensation de corps étranger, sécheresse oculaire, douleur oculaire, prurit oculaire, croissance des cils, érythème de la paupière |
|
|
peu fréquent |
Asthénopie, œdème conjonctival, photophobie, augmentation du larmoiement, hyperpigmentation de l’iris, trouble de la vision, prurit de la paupière, œdème de la paupière |
|
|
indéterminée |
Écoulement oculaire, gêne oculaire |
|
|
Affections respiratoires, thoraciques et médiastinales |
indéterminée |
Asthme, exacerbation de l’asthme, exacerbation de la BPCO et dyspnée |
|
Affections de la peau et des tissus sous-cutanés |
fréquent |
Hyperpigmentation de la peau (périoculaire) |
|
peu fréquent |
Croissance anormale des cheveux |
|
|
indéterminée |
Décoloration de la peau (périoculaire) |
|
|
Affections du système immunitaire |
indéterminée |
Réaction d’hypersensibilité incluant des signes et des symptômes d’allergie oculaire et de dermatite allergique |
|
Affections vasculaires |
indéterminée |
Hypertension |
Description des effets indésirables sélectionnés
Périorbitopathie associée aux analogues des prostaglandines (PAP)
Les analogues des prostaglandines, y compris AMIRIOX, peuvent entraîner des modifications lipodystrophiques périorbitaires qui peuvent provoquer un approfondissement du sillon palpébral, un ptosis, une énophtalmie, une rétraction de la paupière, une involution du dermatochalasis et une exposition sclérale inférieure. Ces modifications sont généralement modérées, peuvent se produire dès un mois après le début du traitement par AMIRIOX et peuvent entraîner une altération du champ de vision même sans reconnaissance de la part du patient. La PAP est également associée à une hyperpigmentation ou décoloration de la peau périoculaire et à une hypertrichose.
Il a été constaté que ces modifications sont partiellement ou totalement réversibles en cas d’arrêt du traitement ou de recours à un autre traitement.
Hyperpigmentation de l’iris
L’augmentation de la pigmentation de l’iris sera probablement permanente. La modification de la pigmentation est due à une augmentation de la teneur en mélanine dans les mélanocytes plutôt qu’à un nombre accru de mélanocytes. Les effets à long terme de l’augmentation de la pigmentation de l’iris ne sont pas connus. Les modifications de la couleur de l’iris observées avec l’administration ophtalmique de bimatoprost peuvent ne pas être visibles avant plusieurs mois ou plusieurs années. Habituellement, la pigmentation brune autour des pupilles s’étend de manière concentrique vers la périphérie de l’iris, et la totalité ou une partie de l’iris prend une couleur brunâtre. Le traitement paraît ne pas affecter les nævi et les éphélides de l’iris. L’incidence de l’hyperpigmentation de l’iris après 12 mois de traitement par un collyre contenant 0,1 mg/ml de bimatoprost était de 0,5 %. Avec le collyre contenant 0,3 mg/ml de bimatoprost, l’incidence qui était de 1,5 % à 12 mois (voir rubrique 4.8, Tableau 2), n’a pas augmenté pendant les 3 années de traitement.
Dans les études cliniques, plus de 1 800 patients ont été traités par bimatoprost 0,3 mg/ml (flacon multidose avec conservateur). En regroupant les données des études cliniques de phase III de bimatoprost 0,3 mg/ml (flacon multidose avec conservateur), en monothérapie ou en association, les effets indésirables les plus fréquents étaient :
· croissance des cils jusqu’à 45 % la première année avec une incidence de nouveaux cas réduite à 7 % à 2 ans et 2 % à 3 ans,
· hyperhémie conjonctivale (la plupart du temps minime à légère et considérée comme étant de nature non inflammatoire) jusqu’à 44 % des patients la première année avec une incidence de nouveaux cas réduite à 13 % à 2 ans et 12 % à 3 ans,
· prurit oculaire jusqu’à 14 % des patients la première année avec une incidence de nouveaux cas réduite à 3 % à 2 ans et 0 % à 3 ans.
Moins de 9 % des patients ont dû arrêter le traitement en raison d’un évènement indésirable la première année, avec une incidence d’arrêts supplémentaires de 3 % la deuxième et la troisième année.
Le Tableau 2 répertorie les effets indésirables constatés lors d’une étude clinique sur 12 mois réalisée avec bimatoprost 0,3 mg/ml (flacon multidose avec conservateur) et rapportés plus fréquemment qu’avec bimatoprost 0,3 mg/ml (récipient unidose - sans conservateur). La plupart étaient oculaires, d’intensité légère à modérée et aucun n’était grave.
Tableau 2
|
Classe de systèmes d’organes |
Fréquence |
Effet indésirable |
|
Affections du système nerveux |
Fréquent |
Céphalées |
|
Affections oculaires |
Très fréquent |
Prurit oculaire, croissance des cils |
|
Fréquent |
Asthénopie, œdème conjonctival, photophobie, larmoiement, augmentation de la pigmentation de l’iris, trouble de la vision |
|
|
Affections de la peau et des tissus sous-cutanés |
Fréquent |
Prurit de la paupière |
Outre ces effets indésirables constatés avec bimatoprost 0,3 mg/ml en récipient unidose (sans conservateur), le Tableau 3 répertorie les autres effets indésirables rapportés avec bimatoprost 0,3 mg/ml (flacon multidose avec conservateur). La plupart étaient oculaires, d’intensité légère à modérée et aucun n’était grave.
Tableau 3
|
Classe de systèmes d’organes |
Fréquence |
Effet indésirable |
|
Affections du système nerveux |
Peu fréquent |
Vertiges |
|
Affections oculaires |
Fréquent |
Érosion de la cornée, brûlure oculaire, conjonctivite allergique, blépharite, baisse de l’acuité visuelle, écoulement oculaire, trouble visuel, assombrissement des cils |
|
Peu fréquent |
Hémorragie rétinienne, uvéite, œdème maculaire cystoïde, iritis, blépharospasme, rétraction de la paupière |
|
|
Affections vasculaires |
Fréquent |
Hypertension |
|
Affections gastro-intestinales |
Peu fréquent |
Nausées |
|
Affections de la peau et des tissus sous-cutanés |
Indéterminée |
Érythème périorbitaire |
|
Troubles généraux et anomalies au site d’administration |
Peu fréquent |
Asthénie |
|
Investigations |
Fréquent |
Anomalies des tests de l’exploration fonctionnelle hépatique |
Effets indésirables rapportés avec les collyres contenant du phosphate:
Des cas de calcification cornéenne ont été très rarement rapportés lors de l’utilisation de collyres contenant du phosphate chez certains patients présentant des altérations significatives de la cornée.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Aucune information concernant un surdosage n’a été rapportée chez l’Homme. Ces incidents ont peu de chance de se produire lors d’une instillation oculaire.
En cas de surdosage, un traitement symptomatique et de soutien doit être mis en place. Si bimatoprost 0,3 mg/ml collyre en solution est ingéré accidentellement, les informations suivantes peuvent être utiles : dans les études par voie orale de deux semaines menées chez des rats et des souris, des doses allant jusqu’à 100 mg/kg/jour n’ont entraîné aucune toxicité. Cette dose exprimée en mg/m2 est au moins 70 fois supérieure à la dose correspondant à l’ingestion accidentelle d’une boîte de bimatoprost 0,3 mg/ml collyre en solution par un enfant de 10 kg.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le bimatoprost réduit la pression intraoculaire chez l’Homme en augmentant l’écoulement de l’humeur aqueuse par le trabeculum et en améliorant l’écoulement uvéoscléral. La réduction de la pression intraoculaire commence environ 4 heures après la première administration et l’effet maximum est obtenu en 8 à 12 heures environ. L’action persiste pendant au moins 24 heures.
Le bimatoprost est un agent hypotenseur oculaire puissant. C’est un prostamide synthétique, structurellement apparenté à la prostaglandine F2(PGF2) qui n’agit pas par l’intermédiaire de récepteurs aux prostaglandines connus. Le bimatoprost reproduit de façon sélective les effets de nouvelles substances biosynthétiques récemment découvertes et appelées prostamides. Cependant, la structure des récepteurs aux prostamides n’a pas encore été identifiée.
Efficacité et sécurité clinique
Une étude clinique sur 12 semaines (en double aveugle, randomisée et en groupe parallèle) a comparé l’efficacité et la sécurité de bimatoprost 0,3 mg/ml en récipient unidose (sans conservateur) par rapport à celles de bimatoprost 0,3 mg/ml (flacon multidose avec conservateur). Bimatoprost 0,3 mg/ml en récipient unidose s’est montré non inférieur à bimatoprost 0,3 mg/ml (flacon multidose avec conservateur) en termes d’efficacité sur la réduction de la PIO, par rapport à l’état initial, sur l’œil le plus atteint chez les patients présentant un glaucome ou une hypertension oculaire. bimatoprost 0,3 mg/ml en récipient unidose a également prouvé son équivalence à bimatoprost 0,3 mg/ml (flacon multidose avec conservateur) en termes de réduction de la PIO moyenne lors de chaque suivi aux semaines 2, 6 et 12.
Lors des 12 mois de traitement en monothérapie par bimatoprost 0,3 mg/ml (flacon multidose avec conservateur), chez des adultes, versus timolol, le matin (à 8 h), la variation moyenne de la pression intraoculaire par rapport à la valeur à l’inclusion était comprise entre -7,9 et -8,8 mmHg. Lors de chaque visite, les valeurs moyennes de la PIO diurne sur les douze mois de la période de suivi n’ont pas varié de plus de 1,3 mmHg tout au long de la journée et n’ont jamais dépassé 18,0 mmHg.
Lors d’une étude clinique sur 6 mois avec bimatoprost 0,3 mg/ml en flacon multidose, versus latanoprost, la baisse moyenne de la PIO matinale (allant de -7,6 à -8,2 mmHg pour le bimatoprost versus -6,0 à -7,2 mmHg pour le latanoprost) était statistiquement supérieure à toutes les visites de l’étude. L’hyperhémie conjonctivale, la croissance des cils et le prurit oculaire étaient statistiquement plus fréquents avec le bimatoprost qu’avec le latanoprost, cependant, le taux d’arrêt de traitement dû à ces événements indésirables était très bas et sans différence statistiquement significative.
Comparativement au traitement par bêtabloquant seul, le traitement associant bimatoprost 0,3 mg/ml (flacon multidose avec conservateur), au bêtabloquant réduit de -6,5 à -8,1 mmHg la pression intraoculaire moyenne du matin (8 h).
Il existe peu de données disponibles chez les patients présentant un glaucome pseudo-exfoliatif et un glaucome pigmentaire à angle ouvert, ainsi que chez les patients présentant un glaucome chronique à angle fermé ayant subi une iridotomie.
Aucun effet cliniquement significatif n’a été observé sur la fréquence cardiaque et sur la pression artérielle dans les études cliniques.
Population pédiatrique
La sécurité et l’efficacité de bimatoprost 0,3 mg/ml chez les enfants âgés de 0 à 18 ans n’ont pas encore été établies.
5.2. Propriétés pharmacocinétiques
Le bimatoprost pénètre bien dans la cornée et la sclère humaine in vitro. Après administration par voie ophtalmique chez l’adulte, l’exposition systémique au bimatoprost est très faible et aucune accumulation n’est observée. Après administration répétée pendant deux semaines, d’une goutte par jour de bimatoprost 0,3 mg/ml dans les deux yeux, le pic plasmatique est obtenu 10 minutes après la dernière instillation. Les concentrations plasmatiques circulantes deviennent inférieures à la limite de détection(0,025ng/ml) au bout de 1 h 30 environ. Les valeurs moyennes de la Cmax et de l’ASC0‑24h (Aire Sous Courbe) étaient comparables au 7e jour et au 14e jour (environ 0,08 ng/ml et 0,09 ngh/ml) indiquant qu’une concentration stable de bimatoprost est atteinte au bout de la première semaine de traitement.
Distribution
Le bimatoprost diffuse modérément vers le compartiment extravasculaire. Chez l’Homme, le volume de distribution systémique à l’état d’équilibre est de 0,67 l/kg. Au niveau sanguin, le bimatoprost est retrouvé principalement dans le plasma sous forme liée aux protéines circulantes (environ 88 %).
Biotransformation
Au niveau plasmatique, le bimatoprost est faiblement métabolisé. La forme inchangée représente l’entité circulante majoritaire après administration oculaire. Le bimatoprost subit une métabolisation par voie oxydative (N-déséthylation et glucuronidation) aboutissant à la formation de divers métabolites.
Élimination
Le bimatoprost est principalement éliminé par excrétion rénale. Jusqu’à 67 % d’une dose administrée par voie intraveineuse à des volontaires adultes sains sont éliminés dans l’urine et 25 % sont excrétés dans les fèces. La demi-vie d’élimination déterminée après administration intraveineuse est d’environ 45 minutes ; la clairance sanguine totale est de 1,5 l/h/kg.
Caractéristiques chez les sujets âgés :
Lors de l’administration au rythme de 2 instillations par jour de bimatoprost 0,3 mg/ml en flacon multidose, l’exposition systémique au bimatoprost observée chez le sujet âgé de plus de 65 ans (ASC0- 24h : 0,0634 ngh/ml) est nettement supérieure à celle observée chez l’adulte jeune (ASC0-24h : 0,0218 ngh/ml).
Toutefois, en raison du faible passage systémique par voie oculaire, cette exposition systémique au bimatoprost reste faible dans les deux groupes et donc sans conséquence clinique. Compte tenu de l’absence d’accumulation du bimatoprost dans le sang, le profil de sécurité serait comparable chez les patients âgés et les patients jeunes.
5.3. Données de sécurité préclinique
Les effets observés chez l’animal à des expositions largement supérieures à l’exposition maximale chez l’Homme n’ont que peu de signification clinique.
Chez le singe, l’administration quotidienne par voie ophtalmique de bimatoprost à des concentrations ≥ 0,3 mg/ml pendant un an a entraîné une augmentation de la pigmentation de l’iris et des modifications périoculaires réversibles, dose-dépendante, caractérisées par une proéminence des culs- de-sac supérieurs ou inférieurs et un élargissement de la fente palpébrale. Le processus d’augmentation de la pigmentation de l’iris est dû à une grande stimulation de la production de mélanine dans les mélanocytes et non à une augmentation du nombre de mélanocytes. Il n’a pas été observé de modification fonctionnelle ou microscopique liée à ces effets périoculaires. Le mécanisme à l’origine de ces effets périoculaires est inconnu.
Le bimatoprost ne s’est pas révélé mutagène ou cancérogène dans les études in vitro et in vivo.
Le bimatoprost n’a pas eu d’incidence sur la fertilité des rats pour des doses allant jusqu’à 0,6 mg/kg/jour (au moins 103 fois supérieures à l’exposition humaine). Dans des études portant sur le développement de l’embryon et du fœtus chez des souris et des rates gravides, on a observé des avortements, mais pas d’effets sur le développement, à des doses au moins 860 et 1 700 fois supérieures, respectivement, aux doses administrées chez l’Homme. Ces doses représentaient, respectivement chez la souris et chez la rate, une exposition systémique au moins 33 fois et 97 fois supérieure à l’exposition chez l’Homme. Dans des études périnatales ou postnatales chez les rats, la toxicité maternelle a entraîné une diminution du temps de gestation, une mort fœtale et une diminution du poids chez les petits de femelles ayant reçu une dose ≥ 0,3 mg/kg/jour (au moins 41 fois supérieure à l’exposition humaine). Les fonctions neuro-comportementales des petits n’ont pas été affectées.
2 ans
Eliminer le flacon 90 jours après la première ouverture.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
Après ouverture du flacon : le produit se conserve au maximum, 90 jours à une température ne dépassant pas 25 °C.
6.5. Nature et contenu de l'emballage extérieur
Flacon en polyéthylène basse densité (PEBD) blanc (5 mL) contenant 3 mL de solution muni d’un embout compte gouttes multidose en PEBD et d’un bouchon à vis avec bague d’inviolabilité en PEBD.
L’embout compte gouttes est muni d’un système de valve en silicone qui empêche le reflux du liquide contaminé dans le flacon et permet une entrée d’air filtré.
Présentations:
Boîtes de 1 ou 3 flacons contenant chacun 3 mL de solution.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières pour l’élimination.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
VIA ERCOLE PATTI, 36
95025 ACI SANT'ANTONIO (CT)
ITALIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 346 0 0 : 3 mL en flacon (PEBD).
· 34009 302 346 1 7 : 3 mL en flacon (PEBD). Boîte de 3.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 04/10/2024
AMIRIOX 0,3 mg/mL, collyre en solution
Bimatoprost
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que AMIRIOX 0,3 mg/mL, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser AMIRIOX 0,3 mg/mL, collyre en solution?
3. Comment utiliser AMIRIOX 0,3 mg/mL, collyre en solution?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver AMIRIOX 0,3 mg/mL, collyre en solution?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE AMIRIOX 0,3 mg/mL, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
AMIRIOX contient la substance active bimatoprost qui est un médicament antiglaucomateux. Il fait partie d’un groupe de médicaments appelé prostamides.
AMIRIOX est utilisé pour réduire une tension élevée dans l’œil dans la population adulte. Ce médicament peut être utilisé seul ou en association avec d’autres gouttes appelées « bêtabloquants », qui réduisent également la tension dans l’œil.
Ce médicament fonctionne en augmentant le liquide drainé à partir de l’œil en évitant une hyperpression dans l’œil. Cela diminue la tension à l’intérieur de l’œil. Si cette tension excessive n’est pas réduite, elle peut entraîner une maladie appelée glaucome et conduire finalement à la détérioration de la vision.
Ce médicament ne contient pas de conservateur.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER AMIRIOX 0,3 mg/mL, collyre en solution ?
N’utilisez jamais ce médicament :
· Si vous êtes allergique au bimatoprost, ou à l’un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser AMIRIOX.
Signalez à votre médecin ou à votre pharmacien
· si vous avez des problèmes respiratoires
· si vous avez des troubles hépatiques ou rénaux
· si vous avez subi une chirurgie de la cataracte dans le passé
· si vous avez ou avez eu une tension artérielle basse ou un rythme cardiaque lent
· si vous avez eu une infection virale ou une inflammation de l’œil
Pendant le traitement, AMIRIOX peut entraîner une perte de graisse autour de l’œil, ce qui peut provoquer un approfondissement du pli palpébral, un enfoncement de l’œil dans l’orbite (énophtalmie), un affaissement de la paupière supérieure (ptosis), un resserrement de la peau autour de l’œil (involution du dermatochalasis) et une plus grande visibilité de la partie inférieure blanche de l’œil (exposition sclérale inférieure). Les modifications sont généralement modérées, mais si elles sont marquées, elles peuvent altérer votre champ de vision. Les modifications peuvent disparaître si vous arrêtez le traitement par AMIRIOX. AMIRIOX peut également provoquer un assombrissement et un allongement de vos cils, et assombrir également la peau qui entoure vos paupières. La couleur de votre iris peut aussi s’assombrir. Ces modifications peuvent être permanentes. Le changement peut être encore plus visible si vous ne traitez qu’un seul œil.
Si vous avez des antécédents d’allergie de contact à l’argent, vous ne devez pas utiliser ce médicament.
Enfants et adolescents
AMIRIOX n’a pas fait l’objet d’études sur les enfants de moins de 18 ans et ne devrait donc pas être utilisé par des patients de moins de 18 ans.
Autres médicaments et AMIRIOX
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Si vous utilisez autre médicament ophtalmique attendez au moins 5 minutes entre l’utilisation de AMIRIOX et l’utilisation de l’autre médicament ophtalmique
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou à votre pharmacien avant de prendre ce médicament.
AMIRIOX peut passer dans le lait maternel, et l’allaitement est donc déconseillé pendant que vous prenez ce médicament.
Conduite de véhicules et utilisation de machines
Votre vue peut devenir trouble pendant un court moment juste après l’utilisation de AMIRIOX. Il est déconseillé de conduire ou manipuler un outil ou une machine jusqu’à ce que vous ayez retrouvé une vue normale.
AMIRIOX contient des phosphates
Ce médicament contient environ 0,95 mg de phosphates par millilitre. Si vous souffrez de dommages sévères de la cornée (couche transparente située à l’avant de l’œil) les phosphates peuvent causer, dans de très rares cas, des troubles de la vision en raison de l’accumulation de calcium pendant le traitement (nuage).
3. COMMENT UTILISER AMIRIOX 0,3 mg/mL, collyre en solution ?
AMIRIOX est destiné à être instillé seulement dans l’œil. La dose recommandée est d’une goutte de AMIRIOX chaque soir, une fois par jour dans l`œil á traiter.
AMIRIOX n'a pas été étudié chez les patients portant des lentilles de contact. Vous devez retirer vos lentilles de contact avant d’utiliser ce médicament et attendre 15 minutes après avoir instillé les gouttes avant de remettre vos lentilles.
Si vous utilisez AMIRIOX avec un autre médicament ophtalmique, attendez au moins 5 minutes entre l’utilisation de AMIRIOX et l’utilisation de l’autre médicament ophtalmique.
Ne l’utilisez pas plus d’une fois par jour, car l’efficacité du traitement pourrait diminuer.
AMIRIOX est une solution stérile qui ne contient pas de conservateur. Voir la rubrique 6 Aspect de AMIRIOX et contenu de l’emballage extérieur.
Avant l’instillation du collyre :
· Lors de la première utilisation, exercez‑vous à utiliser le flacon compte‑gouttes en pressant lentement le flacon pour libérer une goutte dans l’air, à distance de votre œil.
· Une fois certain(e) de pouvoir libérer une seule goutte à la fois, choisissez la position que vous trouvez la plus confortable pour instiller le collyre (position assise, allongée sur le dos ou debout devant un miroir).
Mode d’emploi:
1. Lavez vous les mains soigneusement avant d’utiliser ce médicament.
2. N’utilisez pas le médicament si l’emballage ou le flacon est endommagé.
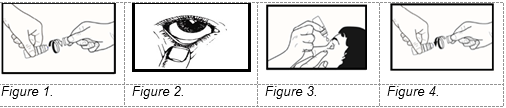
3. Lors de la première utilisation du médicament, dévissez le bouchon après avoir vérifié que la bague scellée sur le bouchon n’a pas été brisée. Vous devez sentir une légère résistance jusqu’à ce que cette bague d’inviolabilité se brise (voir figure 1).
4. Si la bague d’inviolabilité est lâche, jetez la, car elle pourrait tomber dans votre œil.
5. Penchez la tête en arrière et tirez doucement votre paupière inférieure pour former une poche entre l’œil et la paupière (voir figure 2). Ne laissez pas l’embout du flacon toucher votre œil, vos paupières ou vos doigts.
6. Instillez une goutte dans la poche formée entre l’œil et la paupière en tirant sur la paupière inférieure. Appuyez lentement sur le milieu du flacon (voir schéma 3) et faites tomber une goutte dans votre œil. Il peut y avoir quelques secondes de délai entre le moment où vous pressez le flacon et la sortie d’une goutte. Ne pas presser trop fort. Si vous n’êtes pas sûr de la façon d’administrer le produit, demander à votre médecin, à votre pharmacien ou à une infirmière.
7. Pressez le conduit lacrymal pendant 2 minutes environ (en appuyant avec un doigt dans le coin de l’œil près du nez) fermez votre œil et gardez l’œil fermé durant ce laps de temps. Cela garantit que la goutte est absorbée dans l’œil et empêche le médicament de passer dans la circulation générale.
8. Répétez les étapes 5, 6 et 7 pour traiter l’autre œil si votre médecin vous l’a prescrit.
9. Après utilisation, retournez le flacon une fois sans toucher l’embout compte gouttes afin d’éliminer tout reste de solution sur l’embout. Cela garantira que les gouttes suivantes sont libérées correctement. Revissez le bouchon sur le flacon (voir figure 4).
Si une goutte n’est pas entrée dans l’œil, essayez à nouveau.
Pour éviter les infections et les lésions de l’oeil, ne touchez pas votre oeil ou quoi que ce soit avec l’embout du flacon. Remettez le bouchon et refermez le flacon aussitôt après l’avoir utilisé.
|
|
Si vous avez utilisé plus de AMIRIOX 0,3 mg/mL, collyre en solution que vous n’auriez dû
Si vous avez utilisé plus de AMIRIOX que vous n’auriez dû, il est peu probable que ceci entraîne des effets néfastes. Instillez la goutte suivante à l’heure habituelle. Si vous êtes inquiet, parlez-en à votre médecin ou à votre pharmacien.
Si vous oubliez d’utiliser AMIRIOX 0,3 mg/mL, collyre en solution
Si vous oubliez d’utiliser AMIRIOX, mettez une seule goutte dès que vous vous en souvenez, et ensuite reprenez votre traitement comme d’habitude. Ne prenez pas une dose double pour compenser une goutte oubliée.
Si vous arrêtez d’utiliser AMIRIOX 0,3 mg/mL, collyre en solution
AMIRIOX doit être utilisé chaque jour pour agir correctement. Si vous arrêtez d’utiliser AMIRIOX, votre pression intraoculaire risque d’augmenter. Vous devez informer votre médecin avant d’interrompre ce traitement.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’information à votre médecin ou votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice.
Très fréquents : ils peuvent affecter plus d’1 patient sur 10.
Effets oculaires
· Légère rougeur (jusqu’à 24 % des personnes).
· Perte de graisse autour de l’ l’œil qui peut provoquer un approfondissement du pli de la paupière, un enfoncement de l’œil dans l’orbite (énophtalmie), un affaissement de la paupière (ptosis), un resserrement de la peau autour de l’œil (involution du dermatochalasis) et une plus grande visibilité de la partie inférieure blanche de l’œil (exposition sclérale inférieure).
Fréquents : ils peuvent affecter jusqu'à 1 patient sur 10.
Effets oculaires
· Petites érosions ponctuées superficielles de l’œil, avec ou sans inflammation.
· Irritation.
· Démangeaison des yeux.
· Douleur oculaire.
· Sécheresse oculaire.
· Impression de corps étrangers dans l’œil.
· Cils plus longs.
· Couleur de la peau plus sombre autour de l’œil.
· Paupières rouges.
Peu fréquents: ils peuvent affecter jusqu'à 1 patient sur 100
Effets oculaires
· Fatigue des yeux.
· Sensibilité à la lumière.
· Couleur plus sombre de l’iris.
· Démangeaison et gonflement des paupières.
· Larmoiement.
· Gonflement de la membrane transparente qui recouvre la surface de l’œil.
· Trouble de la vision.
Effets généraux
· Céphalées.
· Pilosité autour de l’œil.
Non connue: ne peut être estimée à partir des données disponibles
Effets oculaires
· Ecoulement oculaire.
· Gêne oculaire.
Effets généraux
· Asthme.
· Aggravation de l’asthme.
· Aggravation de l’affection pulmonaire appelée «Bronchopneumopathie chronique obstructive (BPCO)».
· Essoufflement.
· Symptômes de réaction allergique (œdème, rougeur de l’œil et éruption cutanée).
· Sensations vertigineuses.
· Augmentation de la pression artérielle.
· Décoloration de la peau (autour de l’œil).
Outre ces effets indésirables rapportés pour bimatoprost0,3 mg/ml, collyre en solution en récipient unidose sans conservateur, les effets indésirables suivants ont été rapportés lors de l’utilisation de bimatoprost 0,3 mg/ml et peuvent survenir chez les patients traités avec bimatoprost 0,3 mg/ml en flacon multidose sans conservateur :
· Sensation de brûlure dans l’œil.
· Réaction allergique dans l’œil.
· Paupières inflammées.
· Difficulté à voir clairement.
· Détérioration de la vision.
· Assombrissement des cils.
· Hémorragie rétinienne.
· Inflammation dans l’œil.
· Œdème maculaire cystoïde (gonflement de la rétine à l’intérieur de l’œil conduisant à une détérioration de la vision).
· Inflammation de l’iris.
· Contractions de la paupière.
· Rétraction de la paupière de la surface de l’œil.
· Nausées.
· Rougeur de la peau autour de l’œil.
· Faiblesse.
· Augmentation des résultats des tests sanguins qui évaluent le fonctionnement du foie.
Autres effets indésirables rapportés avec les collyres contenant du phosphate
Dans de très rares cas, certains patients présentant des lésions graves de la couche claire située à l’avant de l’œil (la cornée) ont développé des taches opaques sur la cornée en raison d’une accumulation de calcium pendant le traitement.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER AMIRIOX 0,3 mg/mL, collyre en solution ?
Ce médicament ne nécessite pas de précautions particulières de conservation.
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette du flacon et sur l’emballage extérieur. La date de péremption fait référence au dernier jour de ce mois.
Après première ouverture du flacon - conserver à une température ne dépassant pas 25 °C pendant 90 jours au maximum.
Eliminer le flacon 90 jours après la première ouverture.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient AMIRIOX 0,3 mg/mL, collyre en solution
· La substance active est le bimatoprost.
Un millilitre de solution contient 0,3 mg de bimatoprost.
· Les autres composants sont :
Phosphate disodique dodécahydraté, acide citrique monohydraté, chlorure de sodium, acide chlorhydrique dilué (pour l’ajustement du pH), eau pour injection.
Qu’est-ce que AMIRIOX 0,3 mg/mL, collyre en solution et contenu de l’emballage extérieur
AMIRIOX est une solution incolore limpide.
Ce médicament se présente en flacons en polyéthylène basse densité (PEBD) blanc (5 mL) contenant chacun 3 mL de solution, munis d’un embout compte gouttes multidose en PEBD et d’un bouchon à vis avec bague d’inviolabilité en PEBD.
L’embout compte gouttes est muni d’un système de valve en silicone qui empêche le reflux du liquide contaminé dans le flacon et permet une entrée d’air filtré.
Présentations :
Boîtes de 1 ou 3 flacon(s) contenant chacun 3 mL de solution.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
VIA ERCOLE PATTI, 36
95025 ACI SANT'ANTONIO (CT)
ITALIE
Exploitant de l’autorisation de mise sur le marché
SIFI FRANCE S.A.S.
8 RUE DES GRANDES TERRES
92500 RUEIL MALMAISON
Via Ercole Patti 36
95025 Aci Sant'antonio (CT)
ITALIE
et
RAFARM S.A.
THESI POUSI XATZI AGIOU LOUKA
190 02 PAIANIA
GRECE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).