Dernière mise à jour le 02/02/2026
PRIMALAN, sirop
Indications thérapeutiques
Classe pharmacothérapeutique - antihistaminique à usage systémique code ATC : R06AD07.
PRIMALAN, sirop contient une substance active : la méquitazine, qui appartient à la famille de médicaments appelée antihistaminique H1. La méquitazine s'oppose aux effets de certaines substances (histamine) libérées dans l'organisme au cours de l'allergie. Ce médicament est réservé à l’adulte, à l’adolescent et à l’enfant à partir de 2 ans.
PRIMALAN, sirop est utilisé pour traiter les symptômes de la rhinite allergique, de la conjonctivite allergique et/ou l’urticaire :
· La rhinite allergique est une inflammation du nez entrainant une sensation de nez bouché (sensation d’obstruction nasale), une irritation du nez, un écoulement nasal clair et des éternuements. Elle peut être saisonnière c'est-à-dire survenir à certaines périodes de l'année (exemple : rhume des foins) ou perannuelle, c'est-à-dire survenir en cas d'exposition à certains éléments déclenchants (par exemple poussière, poils d'animaux, acariens...) à n'importe quel moment de l'année.
· La conjonctivite allergique est une inflammation de la conjonctive de l’œil (membrane recouvrant le blanc de l'œil et le dessous des paupières) entrainant, des yeux rouges, irrités et qui démangent et des larmoiements.
· L'urticaire est une forme de réaction allergique cutanée avec apparition de plaques rouges sur la peau qui démangent (ressemblant à une piqûre d'orties).
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
Présentations
> 1 flacon(s) en verre teinté avec fermeture de sécurité enfant de 60 ml avec cuillère-mesure
Code CIP : 326 368-0 ou 34009 326 368 0 8
Déclaration de commercialisation : 19/01/1984
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 1,40 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 2,42 €
- Taux de remboursement :30%
> 1 flacon(s) en verre teinté avec fermeture de sécurité enfant de 125 ml avec cuillère-mesure
Code CIP : 362 730-8 ou 34009 362 730 8 5
Déclaration de commercialisation : 18/06/2004
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 2,28 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,30 €
- Taux de remboursement :30%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 25/05/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités PRIMALAN reste faible dans la conjonctivite allergique. |
| Modéré | Avis du 25/05/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités PRIMALAN reste modéré dans le traitement de la rhinite allergique saisonnière et perannuelle et l’urticaire. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 23/05/2024
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Méquitazine........................................................................................................................... 0,5 mg
Pour 1 ml de sirop.
Une cuillère-mesure de 2,5 ml contient 1,25 mg de méquitazine
Excipients à effet notoire : parahydroxybenzoate de méthyle (E218) (2,5 mg par cuillère-mesure), parahydroxybenzoate de propyle (E216) (0,5 mg par cuillère-mesure), saccharose (1,95 g par cuillère-mesure), éthanol issu de l’excipient essence soluble de mandarine (22,25 mg par cuillère-mesure).
Pour la liste complète des excipients, voir rubrique 6.1.
Sirop liquide de transparent à jaune pâle avec une odeur fruitée.
4.1. Indications thérapeutiques
· rhinite allergique (saisonnière ou perannuelle),
· conjonctivite,
· urticaire.
4.2. Posologie et mode d'administration
RESERVE A L'ADULTE, A L’ADOLESCENT ET A L'ENFANT A PARTIR DE 2 ANS.
Utiliser la cuillère-mesure fournie avec le médicament pour mesurer et administrer la dose. Une cuillère-mesure de 2,5 ml contient 1,25 mg de méquitazine.
Adultes :
Population Pédiatrique :
Adolescents âgés de 12 ans et plus et pesant plus de 40 kg :
La dose quotidienne est de 8 cuillères-mesures de 2,5 ml (1,25 mg) répartie en une ou deux prises par jour.
Enfants et adolescents âgés de moins de 12 ans et pesant moins de 40kg
- Entre 30 et 40 kg de poids corporel (environ 10-12 ans) : la dose quotidienne est de 1,25 mg/5kg/jour, soit entre 7,5 et 10 mg correspondant à 1 cuillère-mesure/5 kg/jour, soit 6 à 8 cuillères-mesures par jour, réparties en une ou deux prises par jour.
- Entre 20 et 30 kg de poids corporel (environ 6-10 ans) : la dose quotidienne est de 1,25 mg/5 kg/jour, soit 5 à 7,5 mg correspondant à 1 cuillère-mesure/5 kg/jour, soit 4 à 6 cuillères-mesures par jour, réparties en une ou deux prises par jour.
- Entre 10 et 20 kg de poids corporel (environ 2-6 ans) : la dose quotidienne est de 1,25 mg/5 kg/jour, soit 2,5 à 5 mg correspondant à 1 cuillère-mesure/5 kg/jour, soit 2 à 4 cuillères-mesures par jour, réparties en une ou deux prises par jour.
Enfants âgés de moins de 2 ans : PRIMALAN sirop est contre-indiqué chez les enfants de moins de 2 ans (voir rubrique 4.3).
Mode d’administration
Voie orale.
Il peut être souhaitable de privilégier les prises vespérales en raison d'un éventuel effet sédatif de la méquitazine chez certains sujets plus sensibles (enfants, sujets âgés).
Avant la première utilisation, rincer et sécher la cuillère-mesure.
Après utilisation :
o Refermer le flacon avec son bouchon.
o Rincer à l’eau la cuillère-mesure et la sécher après chaque utilisation. Puis ranger la cuillère-mesure avec le flacon dans l’étui.
o Ranger le médicament dans un endroit sûr, hors de portée des enfants.
Ne pas séparer la cuillère-mesure du reste de l’emballage du médicament (étui et notice).
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1,
· Enfant de moins de 2 ans,
· Traitement concomitant avec un médicament connu pour allonger l'intervalle QT (voir rubrique 4.5.),
· Patients présentant un syndrome du QT long congénital,
· Patients ayant un allongement connu ou suspecté de l'intervalle QT ou un déséquilibre électrolytique, en particulier une hypokaliémie,
· Bradycardie cliniquement significative,
· Antécédents d’agranulocytose liés à la prise de phénothiazines,
· Risque de glaucome par fermeture de l'angle,
· Risque de rétention urinaire liée à des troubles urétro-prostatiques,
· Allaitement.
4.4. Mises en garde spéciales et précautions d'emploi
PRIMALAN est un racémique dont l'énantiomère lévogyre (lévoméquitazine), a montré, lors d'une étude clinique spécifique avec électrocardiogramme, un allongement significatif de l'intervalle QT, en particulier chez le métaboliseur lent du cytochrome P-450 2 D6 (CYP2D6). L'utilisation de PRIMALAN doit, dans ces conditions, être prudente au-delà de dix jours en raison d'un risque d'accumulation de l'énantiomère L (lévoméquitazine).
PRIMALAN doit être déconseillée chez les patients connus comme étant des métaboliseurs lents du cytochrome P-450 2 D6 (CYP2D6) ou prenant des médicaments inhibiteurs du CYP2D6 (paroxétine, fluoxétine, bupropion, duloxétine, terbinafine, cinacalcet) (voir rubrique 4.5). Par analogie avec la cinétique de la lévoméquitazine, des concentrations sanguines élevées chez ces patients peuvent induire un risque d'allongement du QT.
Compte tenu de ce risque, la prise de méquitazine avec la méthadone, certains neuroleptiques et certains antiparasitaires est déconseillée (voir rubrique 4.5).
La prise de ce médicament est déconseillée avec des boissons alcoolisées et des médicaments contenant de l’alcool (voir rubrique 4.5).
La prise de ce médicament est déconseillée avec l'oxybate de sodium, en raison du risque de majoration de la dépression du système nerveux central (voir rubrique 4.5).
En cas de persistance ou d'aggravation des symptômes d’allergie, la conduite thérapeutique devra être réévaluée.
Des cas d'agranulocytoses ont été décrits avec les phénothiazines. Il convient d'avertir le patient qu'en cas d'apparition de fièvre ou d'une infection sous traitement, il doit consulter un médecin le plus rapidement possible. En cas de modifications franches de l'hémogramme, le traitement devra être interrompu.
Ce médicament contient :
· du parahydroxybenzoate de méthyle (E218) et du parahydroxybenzoate de propyle (E216) qui peuvent provoquer des réactions allergiques (éventuellement retardées),
· 1,95 g de saccharose par cuillère-mesure. Ceci est à prendre en compte pour les patients atteints de diabète sucré. Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase-isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament,
Précautions d'emploi
La méquitazine doit être utilisée avec prudence :
· chez le sujet âgé, du fait d'une plus grande sensibilité à la sédation,
· en cas d'insuffisance hépatique sévère, en raison du risque de diminution de la clairance et d'accumulation de la méquitazine,
· chez les sujets épileptiques en raison de la possibilité d'abaissement du seuil épileptogène connue avec les phénothiazines.
Ce médicament contient des dérivés terpéniques comme excipients qui peuvent abaisser le seuil épileptogène en cas d’ingestion de fortes doses.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Médicaments susceptibles de donner des torsades de pointes
Ce trouble du rythme cardiaque grave peut être provoqué par un certain nombre de médicaments, antiarythmiques ou non.
L'hypokaliémie (voir médicaments hypokaliémiants) est un facteur favorisant, de même que la bradycardie (voir médicaments bradycardisants) ou un allongement préexistant de l'intervalle QT congénital ou acquis.
Les médicaments à l’origine de cet effet indésirable sont notamment des antiarythmiques de classes IA et Ill, certains neuroleptiques. D’autres molécules n’appartenant pas à ces classes sont également en cause. Pour l'érythromycine et la vincamine, seules les formes administrées par voie intraveineuse sont concernées par cette interaction.
L'utilisation d'un médicament torsadogène avec un autre médicament torsadogène est contre-indiquée en règle générale.
Certains d'entre eux, en raison de leur caractère incontournable, font exception à la règle, en étant seulement déconseillés avec les autres torsadogènes. Il s'agit des antiparasitaires (chloroquine, halofantrine, luméfantrine, pentamidine), de l’arsénieux, de l’hydroxychloroquine, de la méthadone, du crizotinib, du cotrimoxazole et des neuroleptiques. Cependant, le citalopram, l'escitalopram, la dompéridone, l'hydroxyzine et la pipéraquine ne suivent pas cet assouplissement et sont contre-indiqués avec tous les torsadogènes, suite à un arbitrage européen.
Associations contre-indiquées
Médicaments torsadogènes (sauf antiparasitaires (chloroquine, halofantrine, luméfantrine, pentamidine) et neuroleptiques susceptibles d'entraîner des torsades de pointes, les dérivés d’arsenic, l’hydroxychloroquine, le crizotinib, le cotrimoxazole et la méthadone, voir « associations déconseillées ») (voir rubrique 4.3) :
· Antiarythmiques de classe IA (par exemple, disopyramide, hydroquinidine, quinidine),
· Antiarythmiques de classe III (par exemple, amiodarone, dronédarone, sotalol),
· Certains antiparasitaires (exemple, pipéraquine, dihydroartémisinine),
· Certains antibiotiques (par exemple, érythromycine par voie intraveineuse, moxifloxacine, spiramycine),
· Certains antiémétiques (par exemple, dompéridone),
· Certains médicaments utilisés en cancérologie (par exemple, torémifène, vandétanib),
· Certains vasodilatateurs (par exemple, vincamine par voie intraveineuse),
· Certains antidépresseurs (par exemple, citalopram, escitalopram, hydroxyzine),
· Antihistaminiques (par exemple, mizolastine).
+ Antiparasitaires susceptibles de donner des torsades de pointes (chloroquine, halofantrine, luméfantrine, pentamidine) :
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes. Si cela est possible, interrompre l'un des deux traitements.
Si l'association ne peut être évitée, contrôle préalable du QT et surveillance ECG monitorée.
+ Hydroxychloroquine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Méthadone
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Neuroleptiques susceptibles de donner des torsades de pointes (amisulpride, chlorpromazine, cyamémazine, dropéridol, fluphénazine, flupentixol, halopéridol, lévomépromazine, pimozide, pipampérone, pipotiazine, , sulpiride, tiapride, zuclopenthixol)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Parce que PRIMALAN, sirop est principalement métabolisé par le CYP2D6, la prise concomitante de médicaments connus pour être des inhibiteurs puissants de cette enzyme, tels que la paroxétine, fluoxétine, duloxétine ou le bupropion, cinacalcet, terbinafine, n’est pas recommandée (voir rubrique 4.4).
Le risque de majoration des effets indésirables de la méquitazine est dû à l’inhibition de son métabolisme
+ Alcool
Majoration par l'alcool de l'effet sédatif de la méquitazine. L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines.
Eviter la prise de boissons alcoolisées et de médicaments contenant de l'alcool.
+ Arsénieux
Augmentation du risque d’arythmies ventriculaires, surtout de torsades de pointe.
+ Cotrimoxazole (sulfaméthoxazole + triméthoprime)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Si l’association ne peut être évitée, contrôle clinique et électrocardiographique régulier.
+ Crizotinib
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Si l’association ne peut être évitée, contrôle clinique et électrocardiographique régulier.
+ Délamanid
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Si l’association ne peut être évitée, contrôle clinique et électrocardiographique régulier.
+ Oxybate de sodium
Majoration de la dépression centrale. L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines.
Associations faisant l'objet de précautions d’emploi
+ Anagrélide
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
+ Azithromycine, clarithromycine, roxithromycine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
+ Bêta-bloquants dans l'insuffisance cardiaque (bisoprolol, carvédilol, métoprolol, nébivolol) et autres agents bradycardisants
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l’association.
+ Ciprofloxacine, lévofloxacine, norfloxacine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
+ Glasdégib
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l’association.
+ Hypokaliémiants (diurétiques hypokaliémiants, seuls ou associés, des laxatifs stimulants, des glucocorticoïdes, du tétracosactide et de l'amphotéricine B (par voie intraveineuse))
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Corriger toute hypokaliémie avant d'administrer le produit et réaliser une surveillance clinique, électrolytique et électrocardiographique.
+ Médicament à l’origine d’un hypogonadisme masculin
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
+ Ondansétron
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
Associations à prendre en compte
+ Inhibiteur de la cholinestérase (donézépil, rivastigmine, galantamine)
Risque possible de moindre efficacité de l’inhibiteur de la cholinestérase dû à l'effet antagoniste de la méquitazine sur le récepteur de l'acétylcholine. Surveillance clinique et électrocardiographique pendant l’association.
+ Médicaments atropiniques et substances apparentées
Antidépresseurs imipraminiques, la plupart des antihistaminiques H1 atropiniques, antiparkinsoniens anticholinergiques, antispasmodiques atropiniques, neuroleptiques phénothiaziniques ainsi que clozapine : Addition des effets indésirables atropiniques à type de rétention urinaire, poussée aiguë de glaucome, constipation, sécheresse de la bouche, etc.
+ Autres médicaments dépresseurs du système nerveux central
Dérivés morphiniques (analgésiques, antitussifs et traitements de substitution), neuroleptiques, barbituriques, benzodiazépines, anxiolytiques autres que les benzodiazépines (par exemple le méprobamate), hypnotiques, des antidépresseurs sédatifs (amitriptyline, doxépine, miansérine, mirtazapine, trimipramine), des antihistaminiques H1 sédatifs, antihypertenseurs centraux, baclofène et thalidomide.
Majoration des effets dépresseurs du système nerveux central. L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études effectuées chez l'animal sont insuffisantes pour permettre de conclure concernant la toxicité sur la reproduction (voir rubrique 5.3.).
En clinique, il n'existe pas actuellement de données suffisamment pertinentes pour évaluer un éventuel effet malformatif ou fœtotoxique de la méquitazine lorsqu'elle est administrée pendant la grossesse.
Chez les nouveau-nés de mères traitées au long cours par de fortes posologies de médicaments anticholinergiques ont été rarement décrits des signes liés aux propriétés atropiniques (distension abdominale, iléus méconial, retard à l'émission du méconium, difficulté de la mise en route de l'alimentation, tachycardie, troubles neurologiques...).
Compte-tenu de ces données, l'utilisation de PRIMALAN n'est pas recommandée pendant la grossesse et chez les femmes en âge de procréer n'utilisant pas de contraception.
Si l'administration de ce médicament a eu lieu en fin de grossesse, il semble justifié d'observer une période de surveillance des fonctions neurologiques et digestives du nouveau-né.
Le passage de la méquitazine/ses métabolites dans le lait maternel n'est pas connu.
Compte tenu des possibilités de sédation ou d'excitation paradoxale du nouveau-né, et des risques d'apnée du sommeil évoqués avec les phénothiazines, un risque pour les nouveau-nés/nourrissons allaités ne peut être exclu.
La méquitazine est contre-indiquée pendant l'allaitement (voir rubrique 4.3).
Fertilité
Les études effectuées chez l'animal sont insuffisantes pour permettre de conclure concernant la toxicité sur la fertilité chez l’homme et chez la femme.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
PRIMALAN a une influence sur l’aptitude à conduire des véhicules et à utiliser des machines.
Les patients doivent être informés, en particulier les conducteurs de véhicules et les utilisateurs de machines, sur les risques de somnolence associés à la prise de ce médicament, surtout en début de traitement.
Ce phénomène est accentué par la prise de boissons alcoolisées ou de médicaments contenant de l'alcool.
Les effets indésirables sont classés selon la classification de systèmes d’organes MedDRA en fonction de leur fréquence, selon la convention suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Système de classe d’organe
|
Termes MedDRA Fréquence indéterminée
|
|
Affections du système immunitaire |
Choc anaphylactique |
|
Affections psychiatriques |
Hallucination et état confusionnel en particulier chez les sujets âgés Nervosité Agitation Insomnie |
|
Affections du système nerveux |
Sédation ou somnolence plus marquées en début de traitement Dyskinésie Tremblements Des cas de troubles extrapyramidaux ont été rapportés avec les phénothiazines |
|
Affections oculaires |
Trouble de l’accommodation Mydriase |
|
Affections cardiaques |
Tachycardie Une publication a rapporté une observation de torsades de pointes chez un patient présentant un syndrome du QT long congénital au cours d’un traitement associant la méquitazine et un macrolide |
|
Affections gastro-intestinales |
Bouche sèche Constipation |
|
Affections de la peau et du tissu sous-cutané |
Réaction de photosensibilisation Erythème Eczéma Prurit Purpura Urticaire Angiœdème |
|
Affections du rein et des voies urinaires |
Rétention urinaire |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En cas de surdosage, une surveillance symptomatique générale, avec une surveillance cardiaque, incluant intervalle QT et rythme cardiaque pendant 48 heures, est recommandée.
Un traitement symptomatique en milieu spécialisé est recommandé.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTIHISTAMINIQUE A USAGE SYSTEMIQUE, code ATC : R06AD07.
La méquitazine est un antihistaminique H1 phénothiazinique qui se caractérise par :
· un effet sédatif d'origine histaminergique et adrénolytique centrale, qui est moindre que celui des autres antihistaminiques H1 de première génération. L'absence de sédation a été mise en évidence à la dose de 5 mg sur un effectif limité de volontaires sains. Elle pourrait ne pas se vérifier chez certains sujets plus sensibles (enfants, sujets âgés). La méquitazine est habituellement non sédative à la posologie de 5 mg, mais la marge thérapeutique est faible, car elle est sédative à 10 mg,
· un effet anticholinergique à l'origine d'effets indésirables périphériques : Les antihistaminiques ont en commun la propriété de s'opposer, par antagonisme compétitif aux effets de l'histamine (voir rubrique 4.8).
5.2. Propriétés pharmacocinétiques
La méquitazine est rapidement absorbée dans le tractus gastro-intestinal.
Distribution
Le volume apparent de distribution a une valeur élevée, traduisant une très forte diffusion de la méquitazine vers les milieux extravasculaires.
Biotransformation
La biotransformation constitue la voie d'élimination essentielle du produit.
In vitro, la méquitazine subie une hydroxylation par les microsomes du foie chez l’homme. Les CYP2D6 et CYP3A4 catalysent de façon majoritaire le métabolisme in vitro de la méquitazine en métabolites hydroxylés et S-oxydés respectivement.
In vivo, la méquitazine est le principal composant circulant, les métabolites hydroxylés et S-oxydés sont quantifiés approximativement 9 fois moins après administration de doses répétées.
Élimination
La demi-vie apparente d'élimination moyenne, après une prise unique et répétée, varie entre 18 et 38 heures.
L'excrétion de la méquitazine et de ses métabolites se fait principalement par voie biliaire. L'excrétion urinaire de la méquitazine inchangée est très faible.
Interactions médicamenteuses
In vitro, la méquitazine présent une activité inhibitrice puissante du CYP2D6 (IC50 moyen d’environ 2,5 µM). Il n’y a pas de preuve d’inhibition du CYP3A4 (IC50 > 50 µM).
5.3. Données de sécurité préclinique
Dans les études de toxicologie en administration répétée, des effets n'ont été observés qu'à des expositions considérées comme suffisamment supérieures à l'exposition maximale observée chez l'homme, et ont peu de signification clinique.
Les études des fonctions de reproduction conduites avec la méquitazine n'ont pas mis en évidence d'effet sur la fertilité des mâles et des femelles. Concernant l'embryotoxicité et le développement post natal, les données chez l'animal sont insuffisantes pour évaluer le risque chez l'humain.
24 mois à l’abri de la lumière.
6.4. Précautions particulières de conservation
A conserver à l'abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
60 ml en flacon (verre teinté) fermé par un bouchon à vis sécurité enfant avec une cuillère-mesure de 2,5 ml.
120 ml en flacon (verre teinté) fermé par un bouchon à vis sécurité enfant avec une cuillère-mesure de 2,5 ml.
125 ml en flacon (verre teinté) fermé par un bouchon à vis sécurité enfant avec une cuillère-mesure de 2,5 ml.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
Tout médicament non utilisé ou déchet (la cuillère-mesure incluse) doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LES CAUQUILLOUS
81500 LAVAUR
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 32636808 : 60 ml en flacon (verre teinté) fermé par un bouchon à vis sécurité enfant + cuillère-mesure
· 34009 34734663 : 120 ml en flacon (verre teinté) fermé par un bouchon à vis sécurité enfant + cuillère-mesure
· 34009 36273085 : 125 ml en flacon (verre teinté) fermé par un bouchon à vis sécurité enfant + cuillère-mesure
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 23/05/2024
Méquitazine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que PRIMALAN, sirop et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre PRIMALAN, sirop ?
3. Comment prendre PRIMALAN, sirop ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver PRIMALAN, sirop ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE PRIMALAN, sirop ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - antihistaminique à usage systémique code ATC : R06AD07.
PRIMALAN, sirop contient une substance active : la méquitazine, qui appartient à la famille de médicaments appelée antihistaminique H1. La méquitazine s'oppose aux effets de certaines substances (histamine) libérées dans l'organisme au cours de l'allergie. Ce médicament est réservé à l’adulte, à l’adolescent et à l’enfant à partir de 2 ans.
PRIMALAN, sirop est utilisé pour traiter les symptômes de la rhinite allergique, de la conjonctivite allergique et/ou l’urticaire :
· La rhinite allergique est une inflammation du nez entrainant une sensation de nez bouché (sensation d’obstruction nasale), une irritation du nez, un écoulement nasal clair et des éternuements. Elle peut être saisonnière c'est-à-dire survenir à certaines périodes de l'année (exemple : rhume des foins) ou perannuelle, c'est-à-dire survenir en cas d'exposition à certains éléments déclenchants (par exemple poussière, poils d'animaux, acariens...) à n'importe quel moment de l'année.
· La conjonctivite allergique est une inflammation de la conjonctive de l’œil (membrane recouvrant le blanc de l'œil et le dessous des paupières) entrainant, des yeux rouges, irrités et qui démangent et des larmoiements.
· L'urticaire est une forme de réaction allergique cutanée avec apparition de plaques rouges sur la peau qui démangent (ressemblant à une piqûre d'orties).
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE PRIMALAN, sirop ?
Ne prenez jamais PRIMALAN, sirop
· si vous êtes allergique à la substance active (méquitazine) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· si vous allaitez votre enfant,
· si vous présentez ou suspectez un allongement de l’intervalle QT (ou syndrome du QT long congénital ou acquis) qui est une anomalie au niveau du cœur détecté lors de la réalisation d’un électrocardiogramme (ECG) par le médecin,
· si vous avez un faible taux de potassium dans le sang (hypokaliémie),
· si vous avez un ralentissement du rythme des battements cardiaques (bradycardie),
· si vous avez ou avez déjà eu une diminution importante du taux de certains globules blancs (granulocytes) dans le sang (agranulocytose),
· si vous avez un risque de glaucome à angle fermé (pression élevée à l’intérieur de l’œil détectée lors d’un examen par l’ophtalmologue),
· si vous avez des difficultés à uriner,
· si vous prenez certains médicaments pouvant provoquer de troubles du rythme cardiaque (voir rubrique ci-dessous « Autres médicaments et PRIMALAN, sirop »).
Ne donnez pas PRIMALAN, sirop à votre enfant s’il a moins de 2 ans.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre PRIMALAN, sirop.
Avant de commencer le traitement
Prévenez votre médecin ou votre pharmacien :
· si vous avez une maladie grave du foie (insuffisance hépatique sévère),
· si vous êtes épileptique (convulsions),
· si vous êtes âgé(e) de plus de 65 ans (notamment en raison du risque augmenté de somnolence, d'hallucination, de confusion mentale et de constipation chez les sujets âgés),
· si vous avez des difficultés à uriner.
Informez votre médecin avant de prendre ce médicament si vous avez ou avez eu des crises d’épilepsies parce que PRIMALAN contient des dérivés terpéniques qui peuvent entrainer des troubles neurologiques sous forme de convulsions, dans le cas de prises de doses excessives.
Pendant le traitement
Il est préférable de ne pas vous exposer au soleil car ce médicament peut provoquer une réaction exagérée de la peau après exposition au soleil et aux UV (photosensibilisation).
Prévenez immédiatement votre médecin et arrêtez de prendre PRIMALAN :
· si vous ressentez des palpitations, des battements irréguliers du cœur, une accélération importante du rythme des battements cardiaques (tachycardie) ou si vous avez un malaise avec sensation de perte de connaissance. Le médecin vous demandera éventuellement de faire réaliser un électrocardiogramme (également appelé ECG) qui est un examen mesurant l'activité électrique du cœur et qui enregistre les battements cardiaques,
si vous avez de la fièvre accompagnée ou non de signes d'infection survenant en cours de traitement par ce médicament. Cela peut être le signe d’une diminution induite par le médicament, du taux sanguin de globules blancs (granulocytes), qui sont importants dans la lutte contre l’infection.
Si les symptômes d’allergie persistent ou s’aggravent, n’augmentez pas la dose, mais CONSULTEZ VOTRE MÉDECIN.
La prise de ce médicament est déconseillée avec des boissons alcoolisées et des médicaments contenant de l’alcool (voir paragraphe « PRIMALAN, sirop avec l’alcool »).
La prise de ce médicament est déconseillée avec la prise de certains autres médicaments (voir paragraphe « Autres médicaments et PRIMALAN, sirop »).
Autres médicaments et PRIMALAN, sirop
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
|
Ce médicament contient de la méquitazine (antihistaminique). D'autres médicaments contiennent de la méquitazine ou un autre antihistaminique. Ne les associez pas à votre traitement en cours, afin de ne pas dépasser la dose maximale recommandée (voir paragraphe "Comment prendre PRIMALAN"). Si vous devez prendre d'autres médicaments contenant cette substance ou un autre antihistaminique, vous devez d'abord demandez conseil à votre médecin ou à votre pharmacien. |
Vous ne devez jamais prendre PRIMALAN, sirop en même temps que certains médicaments pouvant donner des troubles graves du rythme cardiaque tels que :
· certains médicaments destinés à traiter les troubles du rythme cardiaque (quinidine, hydroquinidine, disopyramide, amiodarone, sotalol, dronédarone,
· certains antiparasitaires (arténimol (ou dihydroartémisinine), pipéraquine),
· certains antibiotiques : érythromycine administrée directement dans le sang (voie intraveineuse), spiramycine, la moxifloxacine,
· certains vasodilatateurs (vincamine administrée directement dans le sang (voie intraveineuse)),
· certains médicaments utilisés pour traiter les nausées et les vomissements (dompéridone),
· certains médicaments utilisés dans le traitement des cancers (vantédanib, torémifène),
· certains antidépresseurs (citalopram, escitalopram, hydroxyzine),
· d’autres médicaments antihistaminiques (mizolastine).
Sauf avis contraire de votre médecin, vous ne devez pas prendre PRIMALAN, en même temps que :
· certains médicaments pour traiter une infection parasitaire (chloroquine, halofantrine, luméfantrine, pentamidine),
· certains médicaments destinés à traiter les troubles psychiatriques (amisulpride, chlorpromazine, cyamémazine, dropéridol, flupentixol, fluphénazine, halopéridol, lévomépromazine, pimozide, pipampérone, pipotiazine, sulpiride, tiapride, zuclopenthixol),
· la méthadone (médicament pour lutter contre la dépendance aux drogues),
· certains médicaments pour traiter certaines dépressions (paroxétine, fluoxétine, duloxétine),
· le bupropion (médicament qui aide à arrêter de fumer),
· les médicaments dérivés de l'arsenic pouvant être prescrits en homéopathie (arsénieux),
· certains médicaments utilisés pour traiter un mauvais fonctionnement des glandes parathyroïdes qui sont les petites glandes situées près de la thyroïde au niveau du cou (cinacalcet),
· certains médicaments pour traiter une infection par des champignons (terbinafine),
· certains médicaments pour le traitement de la narcolepsie qui est un trouble rare et grave du sommeil (oxybate de sodium) en raison du risque d’altération de la vigilance en cas de conduite de véhicule ou d'utilisation de machine,
· certains médicaments pour traiter certaines maladies rhumatismales ou le lupus (hydroxychloroquine),
· certains antibiotiques (cotrimoxazole - sulfaméthoxazole + triméthoprime),
· certains médicaments utilisés dans le traitement du cancer du poumon (crizotinib),
· certains médicaments utilisés dans le traitement de la tuberculose (delamanid).
Contactez votre médecin si vous prenez :
· des médicaments qui diminuent la quantité de potassium dans le sang (tels que certains diurétiques et laxatifs),
· certains médicaments destinés à traiter l’hypertension et les médicaments qui ralentissent la fréquence cardiaque,
· certains médicaments antibiotiques,
· des anxiolytiques et des antipsychotiques,
· certains antidépresseurs,
· des somnifères,
· des dérivés de la morphine,
· certains médicaments destinés à traiter la maladie de Parkinson,
· certains médicaments pour traiter la maladie Alzheimer et contre la myasthénie (maladie neuro-musculaire),
· certains antispasmodiques,
· certains médicaments pour traiter les nausées et vomissements,
· un médicament qui interfère avec le développement des plaquettes sanguines (Anagrélide),
· un traitement contre la maladie du sang appelée leucémie (Glasdégib),
· des médicaments provoquant une baisse des hormones sexuelles males,
· le médicament contenant de la thalidomide, qui est utilisé en association avec d’autres médicaments pour le traitement de myélomes (type de cancer),
· les médicaments contenant du baclofene, relaxant musculaire indiqué pour réduire les contractions musculaires involontaires et relâcher la tension excessive des muscles (spasmes). Il est aussi indiqué pour réduire la dépendance à l’alcool.
PRIMALAN, sirop avec l’alcool
Vous devez éviter de consommer des boissons alcoolisées pendant toute la durée du traitement.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou que vous envisagez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
Il est préférable de ne pas utiliser ce médicament pendant la grossesse, ni chez les femmes en âge de procréer n'utilisant pas de contraception.
Si vous découvrez que vous êtes enceinte pendant le traitement, consultez rapidement votre médecin, lui seul pourra adapter le traitement en fonction de votre état.
En fin de grossesse, la prise abusive de ce médicament (doses dépassant celles recommandées ou durée de traitement trop longue) peut entraîner des effets néfastes chez le nouveau-né. Par conséquent, il convient de toujours demander l'avis de votre médecin avant de l'utiliser et de ne jamais dépasser la dose et la durée de traitement préconisées.
Allaitement
L'utilisation de ce médicament est contre-indiquée pendant l'allaitement.
Conduite de véhicules et utilisation de machines
Les patients doivent être informés, en particulier les conducteurs de véhicules et les utilisateurs de machines, sur les risques de somnolence associés à la prise de ce médicament, surtout en début de traitement.
Le risque de somnolence est augmenté si vous consommez des boissons alcoolisées ou des médicaments contenant de l'alcool.
PRIMALAN, sirop contient
Ce médicament contient :
· 1,95 g de saccharose par cuillère-mesure. Ceci est à prendre en compte pour les patients atteints de diabète sucré. Si votre médecin vous a informé(e) que vous avez une intolérance à certains sucres, contactez votre médecin avant de prendre ce médicament,
· du parahydroxybenzoate de méthyle (E218) et du parahydroxybenzoate de propyle (E216) qui peuvent provoquer des réactions allergiques (éventuellement retardées),
· jusqu’à 178 mg d'alcool (éthanol) par dose journalière (jusqu’à 8 cuillères mesure par jour). La quantité maximale d’alcool contenue dans une dose journalière équivaut à moins de 5 ml de bière ou 2 ml de vin. La faible quantité d'alcool contenue dans ce médicament n’est pas susceptible d’entraîner d’effet notable aux doses thérapeutiques.
3. COMMENT PRENDRE PRIMALAN, sirop ?
RESERVE A L'ADULTE, A L’ADOLESCENT ET A L'ENFANT A PARTIR DE 2 ANS.
Utilisez la cuillère-mesure fournie avec le médicament pour mesurer et administrer la dose.
Une cuillère-mesure de 2,5 ml contient 1,25 mg de méquitazine.
La dose quotidienne recommandée est fonction du poids corporel :
· Si vous pesez plus de 40 kg (et âgé de plus de 12 ans) : 8 cuillères-mesures de 2,5 ml (1,25 mg) réparties en 1 ou 2 prises par jour (soit 4 cuillères-mesures matin et soir ou 8 cuillères-mesures le soir).
· Si vous pesez moins de 40 kg (et âgé de moins de 12 ans) : 1 cuillère mesure de 2,5 ml (1,25 mg) par 5 kg de poids corporel répartie en 1 ou 2 prises par jour, soit à titre indicatif :
o enfants de poids corporel compris entre 30 et 40 kg (environ 10-12 ans) : 6 à 8 cuillères-mesures de 2,5 ml par jour réparties en 1 ou 2 prises dans la journée,
o enfants de poids corporel compris entre 20 et 30 kg (environ 6-10 ans) : 4 à 6 cuillères-mesures de 2,5 ml par jour réparties en 1 ou 2 prises dans la journée,
o enfants de poids corporel compris entre 10 et 20 kg (environ 2-6 ans) : 2 à 4 cuillères-mesures de 2,5 ml par jour réparties en 1 ou 2 prises dans la journée.
Si les symptômes persistent ou s'aggravent, n'augmentez pas les doses mais consultez votre médecin.
Vérifiez que la cuillère-mesure fournie avec le médicament ne soit pas endommagée. Si elle est endommagée, ne l’utilisez pas et ramenez l’ensemble (cuillère-mesure + médicament) chez votre pharmacien.
Avant la première utilisation, rincez et sécher la cuillère-mesure. La cuillère-mesure ne doit pas être mise au lave-vaisselle ou exposée à une température supérieure à 50°C (ne pas la faire bouillir).
|
|
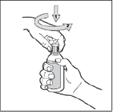
Le flacon est muni d'un bouchon sécurité-enfant. Pour l'ouvrir : appuyer sur le bouchon en plastique (1) tout en le tournant (2).
|
Après utilisation :
o Refermez le flacon avec son bouchon.
o Après chaque utilisation, rincez à l’eau la cuillère-mesure puis séchez la. Puis, rangez la cuillère-mesure avec le flacon dans l’étui du médicament, hors de portée des enfants.
Gardez la cuillère-mesure dans l’emballage du médicament (étui et notice).
Voie d'administration
Ce médicament est à prendre par voie orale.
Fréquence d'administration
Il peut être souhaitable de prendre ce médicament plutôt le soir car ce médicament peut provoquer des somnolences chez certaines personnes plus sensibles (enfants, personnes âgées).
Durée du traitement
· Votre médecin vous dira pendant combien de temps vous devrez prendre ce médicament.
· Ne poursuivez pas le traitement au bout de 10 jours de traitement sans l'avis de votre médecin.
Si vous avez pris plus de PRIMALAN, sirop que vous n’auriez dû
Consultez immédiatement un médecin.
Un risque de trouble du rythme cardiaque grave, de convulsion, de trouble de la conscience pouvant aller jusqu’au coma, peuvent survenir en cas de surdosage.
Le risque d'anomalies du rythme cardiaque peut être plus important en augmentant la dose de ce médicament.
C'est pourquoi vous devez respecter la dose indiquée par votre médecin.
Si vous oubliez de prendre PRIMALAN, sirop
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre PRIMALAN, sirop
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Arrêtez le traitement et consultez immédiatement un médecin si vous présentez l’un des effets indésirables suivants après avoir pris ce médicament :
· des signes d'allergie au médicament tels que :
o des rougeurs de la peau (érythème), de l'eczéma, des démangeaisons (prurit), des taches pourpres sur la peau (purpura), une urticaire (éruption cutanée avec sensation de brûlure et démangeaison ressemblant à une piqûre d'ortie),
o l’apparition brutale de gonflements au niveau du visage, de la langue et/ou de la gorge, des bras et/ou des jambes (angiœdème) qui au niveau de la bouche ou de la gorge peuvent gêner la respiration. Une intervention médicale peut être nécessaire en urgence,
o un choc anaphylactique : réaction allergique généralisée soudaine au cours de laquelle peuvent apparaitre une éruption cutanée (telle que l’urticaire), des démangeaisons, un gonflement, des difficultés à respirer, une accélération du rythme cardiaque, des étourdissements, des sueurs, une chute de la tension artérielle et/ou une perte de conscience/évanouissement. Une intervention médicale est nécessaire en urgence,
· une réaction exagérée de la peau après exposition au soleil et aux UV (réaction de photosensibilisation),
· des problèmes cardiaques : accélération du rythme du cœur (tachycardie),
· malaise avec perte de connaissance pouvant être lié à un trouble du rythme cardiaque induit par le médicament (voir rubrique « Mises en garde spéciales »)
Si l’un des effets indésirables ci-dessous survient, contactez votre médecin dès que possible :
· somnolence, sédation, baisse de la vigilance, plus marquées en début de traitement,
· confusion mentale, hallucinations (en particulier chez les sujets âgés),
· difficultés à dormir (insomnie),
· bouche sèche,
· troubles de la vue : (trouble de l’accommodation), élargissement de la pupille (mydriase),
· difficultés à uriner,
· constipation,
· difficultés à contrôler ses mouvements (dyskinésie),
· tremblements,
· troubles associant des contractions musculaires, des tremblements et/ou des mouvements anormaux des bras et/ou jambes ou du corps (troubles extrapyramidaux).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER PRIMALAN, sirop ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP {MM/AAAA}. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament doit être conservé à l'abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
Une fois le traitement terminé, ramenez chez votre pharmacien, tous les étuis que vous avez entamés, y compris les cuillères-mesures et les flacons, pour une destruction appropriée de ce médicament.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient PRIMALAN, sirop
· La substance active est :
Méquitazine ..................................................................................................................... 0,05 g
Pour 100 ml de sirop.
Une cuillère-mesure de 2,5 ml contient 1,25 mg de méquitazine.
· Les autres composants sont :
L'acide ascorbique, le parahydroxybenzoate de méthyle (E218)*, le parahydroxybenzoate de propyle (E216)*, l'essence soluble de mandarine (contenant de l’alcool)*, le saccharose liquide* et l'eau purifiée (* voir rubrique 2).
Qu’est-ce que PRIMALAN, sirop et contenu de l’emballage extérieur
Aspect de PRIMALAN et contenu de l'emballage extérieur
Ce médicament se présente sous forme de sirop liquide de transparent à jaune pâle avec une odeur fruitée.
Chaque boîte contient un flacon de 60 ml, 120 ml ou 125 ml de sirop fermé par un bouchon à vis sécurité enfant et une cuillère-mesure.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
LES CAUQUILLOUS
81500 LAVAUR
FRANCE
Exploitant de l’autorisation de mise sur le marché
PARC INDUSTRIEL DE LA CHARTREUSE
81100 CASTRES
FRANCE
PIERRE FABRE MEDICAMENT PRODUCTION
SITE PROGIPHARM
RUE DU LYCEE
45500 GIEN
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).