Dernière mise à jour le 02/03/2026
MYCOSTATINE 100 000 UI/ml, suspension buvable
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : ANTIMYCOSIQUE A07 : ANTI – INFECTIEUX INTESTINAUX
Indications thérapeutiques
Ce médicament est plus particulièrement destiné aux nourrissons, aux jeunes enfants et aux sujets porteurs de candidoses buccales ou pharyngées importantes.
Ce médicament est un antimycosique qui lutte contre la prolifération de certains champignons microscopiques, les candida.
Il est indiqué dans certaines situations :
· certains cas de candidoses digestives
· traitement complémentaire de candidoses vaginales et cutanées,
· prévention des candidoses chez certains sujets (immunodéprimés, prématurés).
Ce médicament ne doit pas être utilisé pour traiter des candidoses généralisées.
Présentations
> 1 flacon(s) polyéthylène haute densité (PEHD) de 24 ml avec pipette(s) graduée(s) polypropylène avec adaptateur polyéthylène basse densité (PEBD)
Code CIP : 351 790-4 ou 34009 351 790 4 3
Déclaration de commercialisation : 25/02/2000
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 2,00 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,02 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 29/04/2015 | Renouvellement d'inscription (CT) | Le service médical rendu par MYCOSTATINE 100 000 UI/mL, suspension buvable reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 02/02/2024
MYCOSTATINE 100 000 UI/ml, suspension buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Nystatine ....................................................................................................................... 100 000 U.I
Pour 1 ml de suspension buvable
Excipients à effet notoire : éthanol, saccharose (0,5 g/ml), parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216).
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension buvable.
4.1. Indications thérapeutiques
Ce médicament est destiné à l'administration orale de nystatine chez les nourrissons, les jeunes enfants et les sujets porteurs de candidoses buccales ou pharyngées importantes.
· Traitement des candidoses digestives à l'exclusion de la candidose œsophagienne de l'immunodéprimé.
· Traitement complémentaire des candidoses vaginales et cutanées, dans le but d'obtenir la stérilisation d'une candidose intestinale associée.
· Prévention des candidoses chez les sujets à très haut risque : prématurés, immunodéprimés, malades soumis à une chimiothérapie antinéoplasique.
La nystatine administrée par voie orale ne doit pas être utilisée dans le traitement des candidoses systémiques (voir rubrique 5.2).
4.2. Posologie et mode d'administration
Posologie
· Nourrisson : 1 à 2 ml (soit 100 000 à 200 000 UI) 4 fois par jour.
· Enfant et Adulte : 1 à 6 ml (soit 100 000 à 600 000 UI) 4 fois par jour.
Cette posologie doit être maintenue au moins 48 heures après que les symptômes ont disparu. Si les symptômes (après 14 jours de traitement) persistent ou s’aggravent, le patient doit être ré évalué et une alternative thérapeutique envisagée.
En cas de candidose buccale, cette suspension peut être utilisée en badigeonnage local 4 à 6 fois par jour.
Les données cliniques concernant l’utilisation de la nystatine chez les nouveau-nés et les prématurés étant limitées, il convient de tenir compte des recommandations officielles en vigueur.
Mode d’administration
Voie orale. Bien agiter avant l’emploi.
La pipette pour administration orale et l’adaptateur doivent être utilisés uniquement avec cette spécialité. La pipette est graduée de 0,5 mL à 5 mL tous les 0,5 mL.
· en cas d'hypersensibilité à la nystatine ou à l’un des excipients mentionnés à la rubrique 6.1.
· en cas d'intolérance au fructose, de syndrome de malabsorption du glucose et du galactose ou de déficit en sucrase-isomaltase, en raison de la présence de saccharose.
4.4. Mises en garde spéciales et précautions d'emploi
Mises en garde :
· En l'absence d'une symptomatologie clinique évocatrice, la seule constatation d'un Candida sur la peau ou les muqueuses ne peut constituer en soi une indication.
· La candidose confirmée, il faut rechercher avec soin les facteurs écologiques permettant et favorisant le développement du champignon. Pour éviter les rechutes, l'éradication ou la compensation des facteurs favorisant est indispensable.
· Il est souhaitable de traiter simultanément tout foyer associé à Candida, reconnu pathogène.
· Ce médicament contient du parahydroxybenzoate de méthyle (E218) et du parahydroxybenzoate de propyle (E216) et peut provoquer des réactions allergiques (éventuellement retardées).
Précautions d'emploi :
Lors de l'administration per os de nystatine, les modificateurs du transit intestinal, les pansements digestifs et, d'une manière générale, tous les agents pouvant isoler la muqueuse de l'action du principe actif doivent être évités pendant la durée du traitement car ils peuvent diminuer l'action thérapeutique de la nystatine.
Ce médicament contient 182 mg d’alcool (éthanol) dans 24 ml, équivalent à 0,76 g dans 100 ml. La quantité dans 1 ml de ce médicament équivaut à moins de 0,2 ml de bière ou 0,1 ml de vin.
La faible quantité d’alcool contenue dans ce médicament n’est pas susceptible d’entrainer d’effet notable.
Ce médicament contient 0,5 g de saccharose par ml. Ceci est à prendre en compte pour les patients atteints de diabète sucré.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par prise, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les données disponibles à ce jour ne laissent pas supposer l’existence d’interactions cliniquement significatives.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'y a pas de données fiables de tératogenèse chez l'animal. En clinique, aucun effet malformatif ou fœtotoxique particulier n'est apparu à ce jour. Toutefois, le suivi de grossesses exposées à la nystatine est insuffisant pour exclure tout risque.
En conséquence, l'utilisation de la nystatine per os ne doit être envisagée au cours de la grossesse que si nécessaire.
Allaitement
Il n'existe pas de données concernant le passage de ce médicament dans le lait maternel.
Toutefois, en raison d'une absorption digestive très faible, l'allaitement est possible, tout en surveillant l'apparition d'éventuelles manifestations d'intolérance chez le nouveau-né (diarrhée, rejet du lait maternel, etc...).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les données sur l’effet de la nystatine sur l’aptitude à conduire des véhicules et à utiliser des machines sont limitées. Cependant, les propriétés pharmacodynamiques et pharmacocinétiques ne sont pas de nature à modifier l’aptitude à conduire des véhicules et à utiliser des machines.
· Affections gastro-intestinales : nausées, diarrhées, vomissements,
· Affections de la peau et du système cutané : rash, urticaire, pustulose exanthématique aiguë généralisée, très rarement syndrome de Stevens-Johnson,
· Affections du système immunitaire : réactions d’hypersensibilité, angioedème (incluant œdème de la face).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Des doses orales de nystatine supérieures à 5 millions d’unités par jour ont provoqué des nausées et des troubles gastro-intestinaux (voir rubriques 5.1 et 5.2).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTIMYCOSIQUE, code ATC : A 07 : ANTI-INFECTIEUX INTESTINAUX
Le principe actif de Mycostatine est la nystatine, antibiotique antifongique de contact de la famille des polyènes, extrait de culture de Streptomyces noursei.
Spectre d'action antifongique: active in vitro sur une large variété de champignons levuriformes et filamenteux, son action in vivo s'exerce essentiellement sur le genre Candida et Géotrichum.
Son activité est essentiellement locale (de contact).
5.2. Propriétés pharmacocinétiques
Son action anticandidosique est essentiellement locale.
Absorption
Administrée per os, la nystatine n'est pratiquement pas absorbée par la muqueuse digestive.
Élimination
La nystatine est retrouvée sous forme inchangée dans les selles.
5.3. Données de sécurité préclinique
Aucune étude n'a été réalisée pour déterminer le potentiel mutagène de la nystatine.
Aucune étude animale long-terme n'a été réalisée pour évaluer le potentiel cancérogène de la nystatine.
De même, il n’y a pas d’étude permettant d’évaluer l’impact de la nystatine sur la fertilité mâle ou femelle.
Saccharose, glycérol, carmellose sodique, phosphate disodique anhydre, parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), éthanol, huile essentielle de menthe poivrée, arôme cerise (aldéhyde C14, butyl butyrate, éthyl heptanoate, aldéhyde C16, huile de Ylang, huile d'écorce de cannelle, vanilline, benzyl acétate, éthyl acétate, amyl acétate, amyl butyrate, benzaldéhyde, tolyl aldéhyde, alcool benzylique), arôme cinnamaldéhyde (alcool éthylique, propylène glycol, aldéhyde cinnamique, acétal de propylène glycol, acétate d'aldéhyde cinnamique, eugénol), hydroxyde de sodium et/ou acide chlorhydrique, eau purifiée.
Sans objet.
2 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30°C.
Après ouverture, à conserver maximum 7 jours à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
24 ml en flacon HDPE de 40 mL fermé par un bouchon et fourni avec une pipette polypropylène (graduée de 0,5 mL à 5 mL tous le 0,5 mL) et un adaptateur LDPE.
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SUBSTIPHARM
24 RUE ERLANGER
75016 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 351 790 4 3:24 ml de suspension en flacon (HDPE) avec pipette et adaptateur.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I
ANSM - Mis à jour le : 02/02/2024
MYCOSTATINE 100 000 UI/ml, suspension buvable
Nystatine
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que MYCOSTATINE 100 000 UI/ml, suspension buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre MYCOSTATINE 100 000 UI/ml, suspension buvable ?
3. Comment prendre MYCOSTATINE 100 000 UI/ml, suspension buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver MYCOSTATINE 100 000 UI/ml, suspension buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MYCOSTATINE 100 000 UI/ml, suspension buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : ANTIMYCOSIQUE A07 : ANTI – INFECTIEUX INTESTINAUX
Indications thérapeutiques
Ce médicament est plus particulièrement destiné aux nourrissons, aux jeunes enfants et aux sujets porteurs de candidoses buccales ou pharyngées importantes.
Ce médicament est un antimycosique qui lutte contre la prolifération de certains champignons microscopiques, les candida.
Il est indiqué dans certaines situations :
· certains cas de candidoses digestives
· traitement complémentaire de candidoses vaginales et cutanées,
· prévention des candidoses chez certains sujets (immunodéprimés, prématurés).
Ce médicament ne doit pas être utilisé pour traiter des candidoses généralisées.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE MYCOSTATINE 100 000 UI/ml, suspension buvable ?
Ne prenez jamais MYCOSTATINE 100 000 UI/ml, suspension buvable :
· si vous êtes allergique à l’un des composants. Si des signes d’intolérance apparaissent, le traitement doit être interrompu.
· d’intolérance au fructose, de syndrome de malabsorption du glucose et du galactose ou de déficit en sucrase-isomaltase, en raison de la présence de saccharose.
EN CAS DE DOUTE N’HESITEZ PAS A DEMANDER L’AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN
Avertissements et précautions
Faites attention avec MYCOSTATINE 100 000 UI/ml, suspension buvable :
Précautions particulières d'emploi :
L'action du médicament dans le tube digestif peut être diminuée par l'huile de paraffine, les pansements digestifs ou d'autres médicaments en faisant écran entre le médicament et la paroi interne du tube digestif.
Ce médicament contient 0,5 g de saccharose par ml. Ceci est à prendre en compte pour les patients atteints de diabète sucré.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par prise, c’est-à-dire qu’il est essentiellement « sans sodium ».
Mises en garde :
Ce médicament contient 182 mg d’alcool (éthanol) dans 24 ml, équivalent à 0,76 g dans 100 ml. La quantité dans 1 ml de ce médicament équivaut à moins de 0,2 ml de bière ou 0,1 ml de vin.
La faible quantité d’alcool contenue dans ce médicament n’est pas susceptible d’entrainer d’effet notable.
Ce médicament contient du parahydroxybenzoate de méthyle (E218) et du parahydroxybenzoate de propyle (E216) et peut provoquer des réactions allergiques (éventuellement retardées).
Adressez-vous à votre médecin ou pharmacien avant de prendre MYCOSTATINE 100 000 UI/ml, suspension buvable.
Enfants et adolescents
Sans objet.
Autres médicaments et MYCOSTATINE 100 000 UI/ml, suspension buvable
AFIN D’EVITER D’EVENTUELLES INTERACTIONS ENTRE PLUSIEURS MEDICAMENTS IL FAUT SIGNALER SYSTEMATIQUEMENT TOUT AUTRE TRAITEMENT EN COURS A VOTRE MEDECIN OU A VOTRE PHARMACIEN
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
MYCOSTATINE 100 000 UI/ml, suspension buvable avec des aliments et des boissons
Sans objet.
Grossesse et allaitement
Grossesse :
Ce médicament ne sera utilisé pendant la grossesse que sur les conseils de votre médecin.
Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin car lui seul peut juger de la nécessité de le poursuivre.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Allaitement :
L'allaitement est possible en cas de traitement par ce médicament. Toutefois, en cas de survenue d'effets indésirables chez votre enfant (intolérance au lait, diarrhée,...), prévenez votre médecin.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
MYCOSTATINE 100 000 UI/ml, suspension buvable contient du saccharose (0,5 g/ml), de l’éthanol, du sodium, du parahydroxybenzoate de méthyle (E218) et du parahydroxybenzoate de propyle (E216).
3. COMMENT PRENDRE MYCOSTATINE 100 000 UI/ml, suspension buvable ?
· Nourrisson : 1 à 2 ml (soit 100 000 à 200 000 UI) 4 fois par jour.
· Enfant et Adulte : 1 à 6 ml (soit 100 000 à 600 000 UI) 4 fois par jour.
Si votre enfant est nouveau-né ou prématuré, veuillez suivre les instructions de votre médecin.
Mode et/ou voie(s) d'administration
Voie orale. Bien agiter avant l’emploi.
Une pipette doseuse pour administration orale graduée de 0,5 mL à 5 mL (tous les 0,5 mL) avec un adaptateur à fixer sur le flacon est fournie dans l’étui.
Lors de la première utilisation :
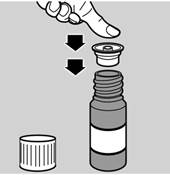
1. Retirer l’adaptateur de la pipette (voir image 1)
2. Enlever le bouchon du flacon
3. Clipser l'adaptateur sur le flacon (voir image 2)
4. Reboucher le flacon
Lors de chaque utilisation :
Préparation du dispositif d’administration
1. Agiter la suspension avant chaque utilisation
2. Enlever le bouchon du flacon
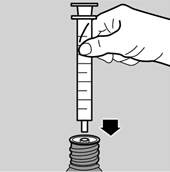
3. Fixer la pipette dans l'adaptateur (voir image 3)
4. Retourner l’ensemble flacon/pipette (voir image 4)
5. Remplir la pipette avec une petite quantité de médicament en tirant sur le piston puis repousser le piston vers le haut afin d’éviter l’apparition d’éventuelles bulles d’air
Préparation de la dose
1. S’assurer que le piston est au bout de la pipette (voir image 5)
2. Tirer lentement sur le piston pour prélever la dose nécessaire avec la pipette doseuse
3. Une fois la dose prélevée, retourner l’ensemble flacon/pipette et retirer en tournant délicatement la pipette contenant la dose à administrer
4. lntroduire directement l'extrémité de la pipette dans la bouche
5. Administrer immédiatement la totalité du volume prélevé en appuyant lentement sur le piston
Après chaque utilisation :
1. Refermer le flacon avec le bouchon tout en laissant l’adaptateur sur le flacon.
2. Rincer la pipette avec de l'eau en l’actionnant plusieurs fois.
3. Ranger la pipette sèche dans l’étui
Ne jamais séparer la pipette doseuse des autres éléments de conditionnement du médicament (boîte, notice)
Image 1 Image 2 Image 3
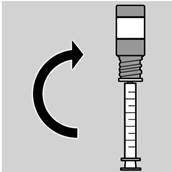
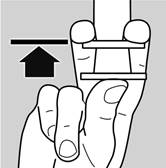
Image 4 Image 5
En cas de candidose buccale, cette suspension peut être utilisée en badigeonnage local 4 à 6 fois par jour.
Durée de traitement
Vous devez respecter la durée de traitement prescrite par votre médecin.
Si les symptômes (après 14 jours de traitement) persistent ou s’aggravent, le patient doit être ré-évalué et une alternative thérapeutique envisagée.
En cas de doute ou de persistance des symptômes, consultez votre médecin ou votre pharmacien.
Dispositif de mesure
La pipette (graduée de 0,5 à 5 mL) pour administration orale et l’adaptateur doivent être utilisés uniquement avec cette spécialité.
Veillez à toujours prendre ce médicament en suivant exactement les instructions de cette notice ou les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Si vous avez pris plus de MYCOSTATINE 100 000 UI/ml, suspension buvable que vous n’auriez dû
Un surdosage éventuel risque d’entrainer des nausées et troubles gastro-intestinaux.
Si vous avez pris plus de MYCOSTATINE 100 000 UI/ml, suspension buvable, consultez votre médecin.
Si vous oubliez de prendre MYCOSTATINE 100 000 UI/ml, suspension buvable
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre MYCOSTATINE 100 000 UI/ml, suspension buvable
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
· Réactions allergiques (urticaire, gonflement du visage ou de la gorge)
· Dans de rares cas, possibilité d’éruption cutanée sévère pouvant conduire à la formation importante de vésicules et à un décollement de la peau (syndrome de Stevens Johnson) ou s’accompagner de boutons ou d’ampoules remplis de pus.
· Troubles digestifs (diarrhées, nausées, vomissements)
S’il apparait des signes d’intolérance, le traitement devra être interrompu.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MYCOSTATINE 100 000 UI/ml, suspension buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le conditionnement extérieur.
A conserver à une température ne dépassant pas 30°C.
Après ouverture, à conserver maximum 7 jours à une température ne dépassant pas 25°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient MYCOSTATINE 100 000 UI/ml, suspension buvable
· La substance active est :
Nystatine ........................................................................................................................ 100 000 UI
Pour 1 ml de suspension buvable
· Les autres composants sont :
Saccharose, glycérol, carmellose sodique, phosphate disodique anhydre, parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), éthanol, huile essentielle de menthe poivrée, arôme cerise (aldéhyde C14, butyl butyrate, éthyl heptanoate, aldéhyde C16, huile de Ylang, huile d'écorce de cannelle, vanilline, benzyl acétate, éthyl acétate, amyl acétate, amyl butyrate, benzaldéhyde, tolyl aldéhyde, alcool benzylique), arôme cinnamaldéhyde (alcool éthylique, propylène glycol, aldéhyde cinnamique, acétal de propylène glycol, acétate d'aldéhyde cinnamique, eugénol), hydroxyde de sodium et/ou acide chlorhydrique, eau purifiée.
Qu’est-ce que MYCOSTATINE 100 000 UI/ml, suspension buvable et contenu de l’emballage extérieur
Ce médicament se présente sous forme de suspension buvable ; flacon de 40 mL contenant 24 ml de suspension buvable avec un bouchon, fourni avec une pipette graduée de 0,5 mL à 5 mL tous les 0,5 mL et un adaptateur.
Titulaire de l’autorisation de mise sur le marché
SUBSTIPHARM
24 RUE ERLANGER
75016 PARIS
Exploitant de l’autorisation de mise sur le marché
SUBSTIPHARM
24 RUE ERLANGER
75016 PARIS
VETPROM AD
THE VPHARMA SITE,
26 OTETS PAISIY STR.,
RADOMIR, 2400,
BULGARIE
Ou
SUBSTIPHARM
24, RUE ERLANGER
75016 PARIS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
L’ANSM réévaluera chaque année toute nouvelle information sur ce médicament et si nécessaire cette notice sera mise à jour.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).