Dernière mise à jour le 02/02/2026
FINCREZO 2,275 mg/mL, solution pour pulvérisation cutanée
Indications thérapeutiques
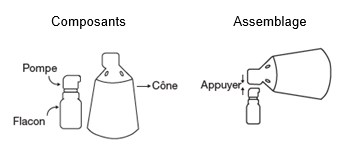
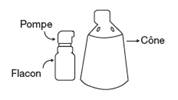
FINCREZO contient comme substance active le finastéride. Il est administré sur la peau du cuir chevelu dégarni à l’aide d’un spray applicateur composé d’un flacon muni d’une pompe et d’un cône.
FINCREZO est utilisé pour le traitement de la calvitie masculine légère à modérée (également appelée alopécie androgénétique). FINCREZO favorise la croissance des cheveux sur le cuir chevelu et empêche toute nouvelle chute des cheveux chez les hommes. FINCREZO est réservé aux hommes âgés de 18 à 41 ans.
La calvitie masculine est une affection courante probablement provoquée par une combinaison de facteurs génétiques et d’une hormone particulière, la dihydrotestostérone (DHT). En cas de calvitie masculine, le cuir chevelu contient des quantités plus élevées de DHT. On pense que cette hormone contribue à diminuer la durée de la croissance des cheveux et contribue également à la diminution de l’épaisseur de ces derniers. Au fur et à mesure que les follicules pileux deviennent plus petits (miniaturisés), la calvitie apparaît. FINCREZO abaisse le taux de DHT dans le cuir chevelu. Cela aide à inverser le processus de calvitie, entraînant une augmentation de la croissance des cheveux et prévenant toute nouvelle chute des cheveux.
Présentations
> 1 flacon polypropylène de 18 mL (180 pulvérisations) avec une pompe munie d’un pulvérisateur en polypropylène et un applicateur (polypropylène)
Code CIP : 34009 302 929 6 9
Déclaration de commercialisation : 03/03/2025
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 22/07/2024
FINCREZO 2,275 mg/mL, solution pour pulvérisation cutanée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque mL de solution contient 2,275 mg de finastéride.
Chaque pulvérisation délivre 50 microlitres, qui contiennent 114 microgrammes de finastéride.
Excipient à effet notoire :
Une pulvérisation de 50 microlitres de solution contient 25 mg d’éthanol (à 96 pour cent).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour pulvérisation cutanée.
Solution incolore, limpide et légèrement visqueuse.
4.1. Indications thérapeutiques
Fincrezo est indiqué dans le traitement topique des hommes adultes âgés de 18 à 41 ans présentant une calvitie masculine (alopécie androgénétique) légère à modérée pour augmenter la croissance des cheveux et prévenir toute nouvelle chute des cheveux.
4.2. Posologie et mode d'administration
Fincrezo doit être appliqué une fois par jour sur les zones dégarnies du cuir chevelu. Selon la surface de la zone dégarnie, 1 à 4 pulvérisations (50 à 200 microlitres de solution) peuvent être utilisées sur des zones distinctes ne se chevauchant pas.
La dose prescrite pour la zone dégarnie ne doit pas être supérieure à 4 pulvérisations. L’efficacité et la durée du traitement doivent être constamment évaluées par le médecin traitant.
En général, 3 à 6 mois de traitement appliqué une fois par jour sont nécessaires avant de s’attendre à une croissance des cheveux. En l’absence de réponse claire, le patient devra consulter son médecin pour la suite du traitement.
Une utilisation continue est recommandée pour maintenir le bénéfice du traitement. On ne dispose d’aucune expérience clinique avec Fincrezo au-delà de 6 mois.
En cas d’arrêt du traitement, les effets bénéfiques commenceront à s’inverser dans un délai de 6 mois et un retour à l’état initial sera observé dans un délai de 9 à 12 mois.
Le flacon contient jusqu’à 180 pulvérisations (délivrant 50 microlitres chacune), ce qui est suffisant pour 45 jours de traitement lorsque la dose maximale de 4 pulvérisations une fois par jour est administrée, 60 jours de traitement pour 3 pulvérisations une fois par jour, 90 jours de traitement pour 2 pulvérisations une fois par jour, et 180 jours de traitement pour 1 pulvérisation une fois par jour. Le flacon ne doit pas être utilisé au-delà de 180 pulvérisations, car cela pourrait conduire à l’administration d’une dose insuffisante. Les patients doivent en être informés.
Patients atteints d’insuffisance rénale ou hépatique
Aucun ajustement posologique n’est nécessaire chez les patients présentant une insuffisance rénale ou hépatique (voir rubrique 5.2).
Population pédiatrique
La sécurité et l’efficacité de Fincrezo chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies (voir rubrique 4.4).
Mode d’administration
Fincrezo doit être utilisé par voie cutanée. Il ne doit être utilisé que sur le cuir chevelu.
Assemblage du spray applicateur
La présentation de Fincrezo contient 2 composants distincts : un flacon muni d’une pompe doseuse fixée et un cône. Ces composants nécessitent un assemblage avant la première utilisation.
|
|
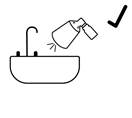
Avant la première utilisation de Fincrezo, la pompe doit être amorcée au moyen de 4 pulvérisations complètes, en dirigeant la solution pulvérisée vers le lavabo de la salle de bains (le lavabo doit être rincé par la suite). Lorsque Fincrezo n’a pas été utilisé depuis au moins 2 semaines, la pompe doit être réamorcée au moyen de 1 pulvérisation complète. En dehors de cela, il n’est pas nécessaire d’agiter le flacon ou d’amorcer la pompe à chaque utilisation.
Manipulation du spray applicateur
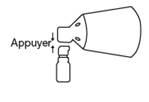
Fincrezo doit être administré par le patient lui-même. Les cheveux et le cuir chevelu doivent être complètement secs avant l’application de la solution. La solution ne doit pas être pulvérisée en direction du visage et ne doit pas entrer en contact avec les mains ou toute partie du corps autre que la zone à traiter sur le cuir chevelu. Le bout des doigts ne doit pas être utilisé pour l’application de Fincrezo. En cas de contact involontaire avec la solution, la partie du corps concernée doit être lavée soigneusement.
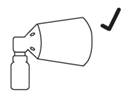
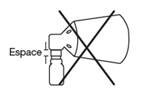
Lors de la pulvérisation sur le cuir chevelu, le cône doit être plaqué sur le cuir chevelu pour éviter la dispersion du finastéride dans l’air. La zone dégarnie du cuir chevelu recouverte par le cône limite la zone maximale de traitement pour 1 pulvérisation. Pour couvrir une zone dont la superficie est supérieure au diamètre du cône, 2, 3 ou 4 pulvérisations peuvent être prescrites. Dans ces cas, avant d’appliquer la deuxième, troisième ou quatrième pulvérisation, le cône doit être déplacé vers une nouvelle zone du cuir chevelu proche des zones de pulvérisations précédentes sans les toucher, et ce, afin d’éviter tout chevauchement.
Immédiatement après l’application, le patient doit éviter tout contact entre le cuir chevelu traité et des surfaces (par. ex. oreillers, casques, chapeaux, etc.) jusqu’à ce que la solution ait séché. Une fois appliqué, Fincrezo doit rester en place pendant au moins 6 heures.
Voir rubrique 4.4 pour des conseils si le patient est peut être en contact avec une femme enceinte ou susceptible de débuter une grossesse, ou avec des enfants et des adolescents.
Fincrezo n’est pas destiné à être utilisé par des femmes.
Femmes enceintes ou susceptibles de débuter une grossesse (voir rubriques 4.4, 4.6 et 5.3).
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Fincrezo ne doit pas être utilisé en même temps que d’autres médicaments appliqués sur le cuir chevelu. Il est uniquement indiqué dans le traitement de l’alopécie androgénétique et ne doit pas être utilisé pour un autre type de chute de cheveux.
Il faut éviter d’inhaler la brume pulvérisée.
L’utilisation d’une dose supérieure à la dose recommandée ou une application plus fréquente ne permettront pas d’obtenir de meilleurs résultats.
Transfert possible de FINCREZO
Les femmes enceintes ou susceptibles de débuter une grossesse ne doivent pas entrer en contact avec FINCREZO, ni avec le cuir chevelu ou les surfaces exposés à Fincrezo, en raison de la possibilité d’absorption du finastéride et du risque ultérieur potentiel pour un fœtus de sexe masculin (voir rubrique 5.3). En cas de contact involontaire avec la solution, la partie du corps concernée doit être lavée soigneusement.
Les enfants et les adolescents de moins de 18 ans ne doivent pas entrer en contact avec FINCREZO, ni avec le cuir chevelu ou les surfaces exposés à FINCREZO, en raison de la possibilité d’absorption du finastéride et de ses effets indésirables potentiels (voir rubrique 5.1). En cas de contact involontaire avec la solution, la partie du corps concernée doit être lavée soigneusement.
Effets sur l’antigène prostatique spécifique (PSA)
Dans les études cliniques portant sur l’utilisation du finastéride oral à la dose de 1 mg chez des hommes âgés de 18 à 41 ans, la valeur moyenne de l’antigène sérique spécifique de la prostate (PSA) a diminué de 0,7 ng/mL à l’inclusion à 0,5 ng/mL au mois 12. Bien que l’exposition systémique au finastéride soit très faible après une administration topique par rapport à une administration orale (voir rubrique 5.2), aucune donnée n’est disponible sur l’effet de FINCREZO sur les taux de PSA, et cela doit être pris en compte lors de l’interprétation des résultats des dosages du PSA.
Effets sur la dihydrotestostérone (DHT) sérique
La dihydrotestostérone est un androgène, un métabolite, et la forme biologiquement la plus active de la testostérone. Dans l’étude clinique de phase III, à la semaine 24, on a observé une diminution du taux de DHT sérique dans le groupe FINCREZO. Le pourcentage de diminution de la concentration sérique moyenne en DHT par rapport à l’inclusion était plus élevé dans le groupe finastéride oral, mais la diminution était cliniquement significative aussi bien avec FINCREZO (34,5 %) qu’avec le finastéride oral (55,6 %), ce qui indique la possibilité d’effets indésirables systémiques de nature sexuelle liés à une diminution du taux de DHT, avec toutefois une fréquence plus faible avec FINCREZO qu’avec le finastéride oral (voir rubriques 4.8 et 5.1). Le schéma posologique doit être respecté (voir rubrique 4.2).
Cancer du sein
Aucun cas de cancer du sein n’a été rapporté chez les patients traités par FINCREZO dans les études cliniques. Cependant, étant donné que le cancer du sein chez l’homme est un risque connu associé au finastéride oral, il convient de recommander aux patients de signaler rapidement toute modification de leur tissu mammaire, telle que des masses, une douleur, une gynécomastie ou un écoulement du mamelon (voir rubrique 4.8).
Altérations de l’humeur et dépression
Aucun cas d’altérations de l’humeur ou de dépression n’a été rapporté chez les patients traités par FINCREZO dans les études cliniques. Cependant, des altérations de l’humeur, telles qu’une humeur dépressive, une dépression et, moins fréquemment, des idées suicidaires, ayant été rapportées chez des patients traités par finastéride oral à la dose de 1 mg, il doit être recommandé aux patients de consulter un médecin s’ils présentent des symptômes psychiatriques (voir rubrique 4.8).
Teneur en éthanol
FINCREZO contient 25 mg d’éthanol (à 96 pour cent) pour chaque pulvérisation, soit 0,5 mg/microlitres (55 pour cent). Cela peut provoquer une sensation de brûlure sur une peau endommagée.
Ce produit est inflammable. Il doit être tenu à l’écart de toute flamme nue, de toute cigarette allumée et de toute source de chaleur intense (voir rubrique 6.4).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L’utilisation concomitante sur la même zone de FINCREZO et d’autres produits topiques, tels que des produits cosmétiques, des écrans solaires ou d’autres médicaments topiques, n’a pas été étudiée. L’utilisation de tels produits sur les zones traitées par FINCREZO doit être évitée.
Aucune donnée n’est disponible concernant l’utilisation concomitante de FINCREZO et de finastéride oral à la dose de 1 mg ou de minoxidil topique dans le traitement de la calvitie masculine.
4.6. Fertilité, grossesse et allaitement
FINCREZO n’est pas destiné à être utilisé par des femmes.
Grossesse
FINCREZO est contre-indiqué chez les femmes enceintes ou susceptibles de débuter une grossesse en raison du risque de tératogénicité pendant la grossesse pour les fœtus de sexe masculin (voir rubriques 4.3, 4.4 et 5.3).
Les femmes enceintes ou susceptibles de débuter une grossesse ne doivent pas entrer en contact avec FINCREZO, ni avec le cuir chevelu ou les surfaces exposés à FINCREZO, en raison de la possibilité d’absorption du finastéride et du risque ultérieur potentiel pour un fœtus de sexe masculin (voir rubrique 5.3). En cas de contact involontaire avec la solution, la partie du corps concernée doit être lavée soigneusement.
Sans objet car FINCREZO est indiqué dans le traitement topique des hommes adultes.
Fertilité
La fertilité chez l’homme n’a pas été étudiée avec FINCREZO.
Bien que les études effectuées chez l’animal n’aient pas mis en évidence d'effets néfastes sur la fertilité (voir rubrique 5.3), des déclarations spontanées d’infertilité et/ou de mauvaise qualité du sperme ont été reçues post-commercialisation dans le cas du finastéride oral. Dans certains cas, le patient présentait d’autres facteurs de risque ayant pu contribuer à une infertilité.
Une amélioration ou un retour à la normale de la qualité du sperme ont été rapportés après l’arrêt du traitement par finastéride oral.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
FINCREZO n’a pas d’effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
Résumé du profil de sécurité
Le profil de sécurité de FINCREZO est basé sur les données de 229 patients atteints d’alopécie androgénétique et de 97 sujets sains qui ont été exposés à FINCREZO dans le programme de développement clinique. Dans l’étude clinique de phase III, 181 patients ont été exposés à FINCREZO pendant une période allant jusqu’à 6 mois, 181 patients traités par placebo et 84 patients traités par finastéride oral. Des cas de prurit et d’érythème, dont la plupart touchaient le cuir chevelu, ont été rapportés dans cette étude. Parmi les 181 patients sous FINCREZO, un prurit est survenu chez 5 patients (2,8 %) et un érythème chez 4 patients (2,2 %).
Liste tabulée des effets indésirables
Les effets indésirables rapportés au cours du programme de développement clinique sont énumérés ci-dessous en utilisant les catégories de fréquence suivantes : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes d’organes (SOC) |
Fréquence |
Effet indésirable |
|
Affections de la peau et du tissu sous-cutané |
Fréquent |
Prurit |
|
Fréquent |
Érythème |
|
|
Investigations |
Très fréquent |
Dihydrotestostérone diminuée |
Description de certains effets indésirables
Pour le finastéride oral, des effets indésirables de nature sexuelle sont répertoriés (diminution de la libido, troubles de l’érection et de l’éjaculation [y compris diminution du volume de l’éjaculat]). Dans l’étude clinique pivot de phase III portant sur FINCREZO, de tels événements indésirables de nature sexuelle liés au traitement (perte de la libido, diminution de la libido, troubles de l’érection, dysfonction sexuelle) ont également été rapportés et présentaient une fréquence globale de 2,8 % chez les patients traités par FINCREZO, 3,3 % chez les patients traités par placebo et 4,8 % chez les patients traités par le finastéride oral à la dose de 1 mg. Veuillez également consulter les rubriques 4.4 et 5.1.
D’autres effets indésirables systémiques en lien avec le finastéride oral rapportés au cours des essais cliniques et/ou après la commercialisation peuvent également survenir avec FINCREZO : réactions d’hypersensibilité, notamment rash, prurit, urticaire et angiœdème ; dépression ; anxiété ; palpitations ; enzymes hépatiques augmentées ; sensibilité mammaire et augmentation du volume mammaire ; douleur testiculaire ; hématospermie ; infertilité.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
L’absorption du finastéride topique est très faible. En cas de surdosage, on s’attend à ce que les taux sériques de DHT diminuent, ce qui peut entraîner une augmentation de la probabilité d’effets systémiques.
En cas de surdosage par Fincreso, aucun traitement spécifique n’est recommandé.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le finastéride est un inhibiteur compétitif et spécifique de la 5α-réductase de type II, l’isoenzyme qui convertit la testostérone, un androgène, en son métabolite le plus actif biologiquement, à savoir la dihydrotestostérone (DHT). Chez les hommes présentant une calvitie masculine, le cuir chevelu dégarni contient des follicules pileux miniaturisés et des quantités accrues de DHT. Le finastéride inhibe un processus responsable de la miniaturisation des follicules pileux du cuir chevelu, ce qui peut conduire à une inversion du processus de chute des cheveux.
Effets pharmacodynamiques
Dans les études pharmacologiques cliniques, les principaux paramètres pharmacodynamiques étaient les concentrations en DHT dans le cuir chevelu en tant que marqueur de substitution de l’efficacité dans le tissu cible, et les concentrations sériques en DHT en tant que marqueur de substitution potentiel pour la sécurité, la diminution des concentrations systémiques en DHT ayant été associée au profil d’effets indésirables du finastéride oral. À l’aide de ces marqueurs de substitution, la dose optimale de FINCREZO a été identifiée comme étant jusqu’à une dose de 200 microlitres une fois par jour (4 pulvérisations).
Il existe une forte variabilité interindividuelle en ce qui concerne les concentrations sériques en DHT. Dans l’étude clinique de phase III, à la semaine 24, le pourcentage de diminution de la concentration sérique moyenne en DHT par rapport à l’inclusion était plus élevé dans le groupe traité par finastéride oral (55,6 %) que dans le groupe traité par FINCREZO (34,5 %), mais la diminution était cliniquement significative pour les deux traitements. Parmi les patients qui se situaient dans la fourchette normale à l’inclusion, une proportion plus élevée de patients du groupe finastéride oral (55,2 %) par rapport au groupe FINCREZO (15,3 %) a présenté des valeurs sériques de DHT inférieures à la normale (DHT sérique < 14 ng/dl) après 24 semaines de traitement, ce qui indique la possibilité d’événements indésirables systémiques liés à une baisse du taux de DHT dans les deux groupes, avec toutefois une fréquence plus faible pour FINCREZO que pour le finastéride oral.
Efficacité et sécurité clinique
L’efficacité et la sécurité clinique de FINCREZO ont été évaluées dans le cadre d’une étude de phase III, multicentrique, en double aveugle, à double placebo, randomisée et contrôlée, menée chez des patients adultes de sexe masculin atteints d’alopécie androgénétique (PM1541). Les patients devaient être traités une fois par jour pendant 24 semaines, randomisés selon un rapport de 2:2:1 comme suit : groupe FINCREZO (jusqu’à 200 microlitres de FINCREZO + placebo oral), groupe placebo (placebo topique + placebo oral) et groupe finastéride par voie orale (placebo topique + 1 mg de finastéride oral). À l’inclusion, une zone cible de calvitie circulaire de 1 cm2 a été marquée à l’aide de petits points tatoués constituant la zone de référence pour les mesures du nombre des cheveux.
L’efficacité a été évaluée à la semaine 24 à l’aide du nombre de cheveux dans la zone cible (critère d’évaluation primaire de l’efficacité) et le diamètre des cheveux dans la zone cible, tels qu’évalués par macrophotographie, l’évaluation des patients sur la base du questionnaire « Male Hair Growth Questionnaire » (qui comprenait des questions sur la croissance, la chute et l’aspect des cheveux) et les évaluations de l’amélioration par l’investigateur et l’évaluateur en aveugle (reposant sur la croissance/chute des cheveux du patient).
Sur les 458 patients randomisés, 446 (97,4 %) ont reçu au moins 1 dose du traitement à l’étude et ont été inclus dans l’analyse de la sécurité, et 323 (70,5 %) ont terminé l’étude. Le taux d’arrêt prématuré était élevé dans tous les groupes, avec 32,3 % des patients randomisés dans le groupe FINCREZO et 29,4 % dans le groupe finastéride oral. Dans l’ensemble, seuls 250 patients (54,6 %) avaient des mesures du nombre des cheveux évaluables à la fois à l’inclusion et sous traitement et ont été considérés comme satisfaisant aux critères d’inclusion dans la population en intention de traiter (ITT) : 105 patients dans le groupe FINCREZO, 97 patients dans le groupe placebo et 48 patients dans le groupe finastéride oral. Presque tous les patients étaient caucasiens (98,0 %), l’âge moyen global était d’environ 32 ans (de 19 à 41 ans) et la calvitie du vertex la plus fréquente était celle de type III (environ 50 % des patients) selon l’échelle modifiée de Hamilton-Norwood. Le nombre moyen de cheveux à l’inclusion dans le groupe FINCREZO était de 201 cheveux/cm², ce qui était similaire aux autres groupes.
FINCREZO a présenté une efficacité clinique modérée supérieure à celle du placebo et numériquement similaire à celle du groupe finastéride oral, qui a été inclus en tant que bras comparateur descriptif exploratoire. La variation moyenne du nombre de cheveux dans la zone cible à 24 semaines par rapport à l’inclusion (critère d’évaluation primaire) était de manière statistiquement significative plus élevée chez les patients du groupe FINCREZO que dans le groupe placebo et était numériquement similaire à celle observée dans le groupe finastéride oral dans la population en ITT. Des résultats similaires ont été observés pour la population utilisée dans l’analyse de la sécurité à 24 semaines, pour la variation moyenne du nombre de cheveux dans la zone cible à 12 semaines par rapport à l’inclusion, et dans toutes les analyses de sensibilité effectuées selon différentes méthodes de gestion des données manquantes.
Variation par rapport à l’inclusion du nombre de cheveux dans la zone cible à 12 et 24 semaines de traitement (population en ITT)
|
Durée du traitement |
Fincrezo |
Placebo |
Finastéride oral |
|
12 semaines |
|
|
|
|
Variation de la MMC par rapport à l’inclusion (nombre de cheveux) |
19,4 |
7,4 |
22,3 |
|
Différence pour la MMC par rapport au placebo (IC à 95 %) |
12,0 (5,7 ; 18,3) |
- |
|
|
24 semaines |
|
|
|
|
Variation de la MMC par rapport à l’inclusion (nombre de cheveux) |
16,3 |
6,3 |
18,7 |
|
Différence pour la MMC par rapport au placebo (IC à 95 %) |
10,0 (2,2 ; 17,7) |
- |
|
Taille de la zone cible (circulaire) : 1 cm2
IC = intervalle de confiance ; ITT = intention de traiter ; MMC = moyenne des moindres carrés ; N = nombre total de patients par groupe de traitement
Remarque : des différences statistiquement significatives en faveur de FINCREZO vs placebo ont été observées aussi bien après 12 qu’après 24 semaines de traitement (p<0,001 et p=0,012 respectivement).
Critères d’évaluation secondaires
Pour les critères d’évaluation secondaires, une analyse post-hoc a été réalisée pour évaluer la réponse en fonction du degré d’amélioration. Dans la population utilisée pour l’analyse de la sécurité (446 patients), des différences ont été observées en faveur de FINCREZO par rapport au placebo en ce qui concerne la proportion de patients présentant un degré d’amélioration de la croissance des cheveux sur la base de l’évaluation de l’investigateur et de l’évaluateur en aveugle après 24 semaines de traitement. Aucune différence de changement global de la croissance des cheveux n’a été observée dans l’auto-évaluation par le patient à la semaine 24. Dans l’ensemble, les résultats du groupe FINCREZO étaient similaires à ceux du groupe finastéride oral pour les évaluations des répondeurs, mais les différences par rapport au placebo étaient généralement faibles (voir le tableau ci-dessous).
Pourcentage de répondeursa pour les critères d’évaluation secondaires à la semaine 24 (population utilisée dans l’analyse de la sécurité)
|
Groupe de traitement |
N |
% de répondeurs |
||||
|
|
|
Évaluation de l’investigateur |
Évaluation de l’évaluateur en aveugle |
MHGQ - Évaluation du patient |
||
|
|
Aspect des cheveux |
Croissance des cheveux |
Évolution globale |
|||
|
Fincrezo |
181 |
42,0b |
26,0c |
40,9c |
39,8 |
26,5 |
|
Finastéride oral |
84 |
35,7 |
28,6 |
36,9 |
31,0 |
25,0 |
|
Placebo |
181 |
27,6 |
16,0 |
28,7 |
32,0 |
19,9 |
MHGQ = questionnaire portant sur la croissance des cheveux chez les hommes (« Male Hair Growth Questionnaire »)
a La réponse pour chaque paramètre a été définie comme le fait de présenter un degré d’amélioration.
b Valeur p <0,005 dans le cadre d’une comparaison FINCREZO vs placebo à l’aide du test du Chi2.
c Valeur p <0,05 dans le cadre d’une comparaison FINCREZO vs placebo à l’aide du test du Chi2.
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec FINCREZO dans tous les sous-groupes de la population pédiatrique dans le traitement de l’alopécie androgénétique. Voir rubrique 4.2 pour les informations concernant l’usage pédiatrique.
5.2. Propriétés pharmacocinétiques
L’absorption systémique du finastéride suite à l’application topique de FINCREZO sur une peau normale et intacte du cuir chevelu est minime. Après administration de FINCREZO à la dose prévue (c’est-à-dire jusqu’à 200 microlitres une fois par jour), les concentrations plasmatiques maximales moyennes de finastéride sont plus de 100 fois inférieures à celles observées après l’administration par voie orale de 1 mg de finastéride une fois par jour (environ < 50 pg/mL contre 7 000 pg/mL) à tous les moments de prélèvement des échantillons sur 6 mois de traitement. La biodisponibilité relative du finastéride après administration de doses multiples de FINCREZO par rapport au finastéride oral est également minime (environ 2 à 3 %).
Distribution
La liaison aux protéines est d’environ 90 %. Le volume de distribution du finastéride est d’environ 76 litres.
Biotransformation
Le finastéride est métabolisé principalement par la sous-famille des enzymes du cytochrome CYP3A4, mais n’affecte pas ces enzymes. Après l’administration à des hommes d’une dose orale de finastéride marqué au 14C, il a été possible d’identifier 2 métabolites qui ne possèdent qu’une petite fraction de l’activité inhibitrice du finastéride sur la 5α réductase. Par rapport au finastéride oral, les taux plasmatiques de ces 2 métabolites (et de tout finastéride inchangé) devraient être négligeables après administration topique de FINCREZO en raison de l’exposition systémique significativement plus faible au finastéride avec FINCREZO.
Élimination
Après administration à des hommes d’une dose orale de finastéride marqué au 14C, 39 % de la dose ont été excrétés dans les urines sous forme de métabolites (quasi-absence d’excrétion de médicament inchangé dans les urines) et 57 % de la dose totale ont été excrétés dans les selles. Après administration topique de FINCREZO, tout finastéride inchangé et les métabolites dérivés seront éliminés de l’organisme par voie fécale et urinaire, de manière similaire à ce qui est observé pour un traitement oral.
Après l’arrêt de l’administration, environ 95 % du finastéride absorbé après administration topique de FINCREZO seront éliminés dans les 24 à 36 heures.
Chez les hommes traités par finastéride oral, moins de 0,001 % de la dose de 1 mg par éjaculation a été détecté dans le liquide séminal. Les concentrations plasmatiques maximales moyennes de finastéride après administration topique de FINCREZO étant plus de 100 fois inférieures à celles observées avec 1 mg de finastéride oral, il est peu probable que du finastéride provenant de FINCREZO soit excrété dans le liquide séminal.
Insuffisance rénale ou hépatique
Aucune étude clinique n’a été réalisée avec FINCREZO chez les patients présentant une insuffisance rénale ou hépatique. En raison de la très faible absorption systémique du finastéride par voie topique, aucun ajustement posologique n’est nécessaire.
5.3. Données de sécurité préclinique
Études de toxicologie en administration répétée
Les résultats en matière de toxicité observés lors des études de toxicologie en administration répétée après administration orale de finastéride étaient liés aux effets pharmacologiques du finastéride entraînant des déséquilibres hormonaux. Des études de toxicité cutanée réalisées avec FINCREZO chez le lapin pendant une durée maximale de 4 semaines et chez le cochon nain pendant une durée maximale de 39 semaines ont confirmé son profil de sécurité et sa tolérance globale après une application quotidienne répétée sur la peau.
Un changement de couleur de la peau après traitement topique a été observé dans tous les groupes dans les études de 4 et 13 semaines menées chez le cochon nain, mais dans aucun groupe dans l’étude de 39 semaines. Ce changement a été interprété comme un composite brunâtre des excipients non volatils contenus dans le produit. Aucun changement de couleur de la peau n’a été rapporté dans le programme de développement clinique.
Photosensibilisation
D’après les résultats observés chez des cochons d’Inde après une exposition cutanée en association avec de la lumière, on peut en conclure que la solution topique de finastéride peut induire une photosensibilisation chez le cochon d’Inde. Cependant, lors des essais cliniques, aucun potentiel de photosensibilisation n’a été constaté chez les sujets sains traités par FINCREZO.
Toxicité pour la reproduction
Avec une dose de 2 mg/kg de poids corporel de finastéride administrée par voie orale une fois par jour (> 200 fois la dose topique quotidienne maximale recommandée de FINCREZO) chez des singes gravides, des anomalies des organes génitaux externes chez les fœtus mâles ont été observées. Aucune autre anomalie n’a été observée chez les fœtus mâles et aucune anomalie liée au finastéride n’a été observée chez les fœtus femelles, quelle que soit la dose administrée.
L’administration intraveineuse de finastéride à des singes rhésus gravides à des doses allant jusqu’à 800 ng une fois par jour pendant toute la période de développement embryonnaire et fœtal n’a entraîné aucune anomalie chez les fœtus mâles (cette dose correspond à une exposition 39 fois supérieure au niveau d’exposition estimé chez l’homme suivant un traitement par FINCREZO à la dose maximale recommandée).
Les études effectuées chez le rat mâle pour évaluer l’effet sur la reproduction ont présenté une réduction légère à modérée de la fertilité, mais cette baisse a été totalement réversible à l’arrêt du traitement. Cette diminution de la fertilité serait secondaire aux effets sur la prostate et les vésicules séminales, ce qui entraîne l’échec de la formation d’un bouchon séminal. Cependant, la formation du bouchon n’est pas pertinente pour la fertilité humaine.
Génotoxicité
Les études in vitro et in vivo n’ont révélé aucun risque génotoxique.
Carcinogénicité
Les études de carcinogénicité ont montré que le finastéride ne présentait aucun risque carcinogène pour l’homme.
Propylèneglycol
Hydroxypropyl chitosane
Eau purifiée
3 ans
Après première ouverture du flacon : 6 mois
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
FINCREZO contient de l’éthanol, qui est inflammable. FINCREZO ne doit pas être pulvérisé à proximité de flammes nues ou lorsque le patient fume.
6.5. Nature et contenu de l'emballage extérieur
Flacon en polypropylène contenant 18 mL de solution, avec une pompe pour pulvérisation mécanique clipsable et un cône en polypropylène séparé. Ces composants nécessitent un assemblage avant la première utilisation.
Présentations :
1 flacon (correspondant à 180 pulvérisations) avec une pompe clipsée munie d’un pulvérisateur mécanique et 1 cône séparé.
3 flacons (correspondant à 3 x 180 pulvérisations) avec une pompe clipsée munie d’un pulvérisateur mécanique et 3 cônes séparés.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
FINCREZO ne doit pas être utilisé au-delà de 180 pulvérisations.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
14-16 Avenue Pasteur
L-2310 Luxembourg
LUXEMBOURG
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 551 012 4 6 : 18 mL (180 pulvérisations) en flacon avec une pompe munie d’un pulvérisateur en polypropylène et un applicateur (polypropylène). Boîte de 3.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Informations importantes
Les informations importantes disponibles pour ce médicament sont les suivantes :
- Finastéride et risque d'idées suicidaires : nouvelles mesures
- Retour d'information sur le PRAC de mai 2025 (5 - 8 mai)
- Réévaluation européenne de la balance bénéfice/risque des médicaments contenant du finastéride ou du dutastéride
- Retour d'information sur le PRAC d'octobre 2024 (30 septembre - 3 octobre)
ANSM - Mis à jour le : 22/07/2024
FINCREZO 2,275 mg/mL, solution pour pulvérisation cutanée
Finastéride
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FINCREZO 2,275 mg/mL, solution pour pulvérisation cutanée et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FINCREZO 2,275 mg/mL, solution pour pulvérisation cutanée ?
3. Comment utiliser FINCREZO 2,275 mg/mL, solution pour pulvérisation cutanée ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FINCREZO 2,275 mg/mL, solution pour pulvérisation cutanée ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FINCREZO 2,275 mg/mL, solution pour pulvérisation cutanée ET DANS QUELS CAS EST-IL UTILISE ?
FINCREZO contient comme substance active le finastéride. Il est administré sur la peau du cuir chevelu dégarni à l’aide d’un spray applicateur composé d’un flacon muni d’une pompe et d’un cône.
FINCREZO est utilisé pour le traitement de la calvitie masculine légère à modérée (également appelée alopécie androgénétique). FINCREZO favorise la croissance des cheveux sur le cuir chevelu et empêche toute nouvelle chute des cheveux chez les hommes. FINCREZO est réservé aux hommes âgés de 18 à 41 ans.
La calvitie masculine est une affection courante probablement provoquée par une combinaison de facteurs génétiques et d’une hormone particulière, la dihydrotestostérone (DHT). En cas de calvitie masculine, le cuir chevelu contient des quantités plus élevées de DHT. On pense que cette hormone contribue à diminuer la durée de la croissance des cheveux et contribue également à la diminution de l’épaisseur de ces derniers. Au fur et à mesure que les follicules pileux deviennent plus petits (miniaturisés), la calvitie apparaît. FINCREZO abaisse le taux de DHT dans le cuir chevelu. Cela aide à inverser le processus de calvitie, entraînant une augmentation de la croissance des cheveux et prévenant toute nouvelle chute des cheveux.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FINCREZO 2,275 mg/mL, solution pour pulvérisation cutanée ?
· si vous êtes allergique au finastéride ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous êtes une femme et si vous êtes enceinte ou êtes susceptible de débuter une grossesse (ce médicament étant indiqué uniquement pour les hommes, voir la rubrique « Grossesse, allaitement et fertilité »). Les études cliniques ont montré que le finasteride n’avait aucun effet sur la chute des cheveux chez la femme.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser FINCREZO.
FINCREZO doit uniquement être utilisé sur un cuir chevelu sain. Il ne doit pas être appliqué sur un cuir chevelu enflammé, infecté ou irrité.
FINCREZO ne doit pas être utilisé en même temps que d’autres médicaments appliqués sur le cuir chevelu. Il est uniquement indiqué dans le traitement de l’alopécie androgénétique et ne doit pas être utilisé pour un autre type de chute de cheveux.
Il faut éviter d’inhaler la brume pulvérisée.
L’utilisation d’une dose supérieure à la dose recommandée ou une application plus fréquente ne permettront pas d’obtenir de meilleurs résultats.
En cas d’arrêt du traitement, les effets bénéfiques commenceront à s’inverser dans un délai de 6 mois et le retour à l’état initial sera observé entre 9 et 12 mois.
Transfert possible de FINCREZO
Ce médicament peut entraîner la naissance d’un enfant de sexe masculin présentant des anomalies des organes sexuels si la substance active le finastéride est absorbée par la peau d’une femme enceinte. Évitez tout contact entre la zone traitée et une femme qui est enceinte ou susceptible de débuter une grossesse. Vous devez également lui dire de ne pas toucher des surfaces exposées à FINCREZO. En cas de contact avec FINCREZO, la femme concernée doit laver rapidement et soigneusement la partie de son corps qui a été en contact avec le médicament.
Les enfants et les adolescents ne doivent pas entrer en contact avec FINCREZO. En cas de contact avec FINCREZO, l’enfant ou l’adolescent concerné doit laver rapidement et soigneusement la partie de son corps qui a été en contact avec le médicament.
Effets sur l’antigène spécifique de la prostate (PSA)
Si vous faites une analyse sanguine évaluant l’antigène prostatique spécifique (PSA) effectuée dans le cadre du dépistage du cancer de la prostate, informez votre médecin que vous utilisez FINCREZO, car ce dernier peut affecter l’interprétation des résultats.
Effet sur l’hormone masculine dihydrotestostérone (DHT)
FINCREZO entraîne une diminution de la concentration sanguine de l’hormone masculine DHT, souvent jusqu’à des valeurs inférieures à la normale. Cependant, cela se produit moins fréquemment qu’avec le finastéride en comprimés et la diminution est elle aussi moins importante. Des effets indésirables de nature sexuelle connus pour être associés au finastéride en comprimés peuvent également survenir avec FINCREZO, mais ils sont moins probables (voir rubrique 4). Par conséquent, respectez la dose prescrite par votre médecin. N’utilisez pas plus de 4 pulvérisations par jour.
Effets sur la fertilité
Des cas d’infertilité ont été rapportés chez des hommes ayant pris du finastéride par voie orale pendant une période prolongée et présentant d’autres facteurs de risque pouvant affecter la fertilité. Une amélioration ou un retour à la normale de la qualité du sperme ont été rapportés après l’arrêt du traitement par finastéride oral. Aucune étude à long terme sur l’effet du finastéride oral sur la fertilité n’a été effectuée chez l’homme.
Cancer du sein
Bien qu’aucun cas de cancer du sein n’ait été observé chez les hommes traités par FINCREZO dans les études cliniques, des cas ont été rapportés pendant le traitement par finastéride en comprimés. Si vous présentez des modifications de votre tissu mammaire, telles que des grosseurs, une douleur, une augmentation du volume des seins ou un écoulement du mamelon (voir rubrique 4), contactez votre médecin dès que possible.
Altération de l’humeur et dépression
Bien qu’aucun cas d’altération de l’humeur (comme humeur dépressive, dépression et idées suicidaires) n’ait été observé dans les études cliniques chez les patients traités par FINCREZO, des cas ont été rapportés pendant le traitement par finastéride en comprimés. Si vous présentez des symptômes tels qu’une baisse de moral, une dépression ou des pensées suicidaires (voir rubrique 4), demandez conseil à votre médecin dès que possible.
Enfants et adolescents
FINCREZO ne doit pas être utilisé par des enfants ou des adolescents. Il n’existe aucune donnée démontrant l’efficacité ou la sécurité du finastéride chez les enfants de moins de 18 ans.
Autres médicaments et FINCREZO
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
N’appliquez pas FINCREZO si vous utilisez d’autres produits topiques, tels que des produits cosmétiques, des écrans solaires ou d’autres médicaments, sur la même zone.
FINCREZO avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
FINCREZO ne doit pas être utilisé par des femmes. Pour connaître les effets sur la fertilité masculine, voir la rubrique « Effets sur la fertilité ».
Les femmes enceintes ou susceptibles de débuter une grossesse doivent éviter tout contact avec le cuir chevelu traité ou les surfaces exposées à FINCREZO. Voir la rubrique « Transfert possible de FINCREZO » ci-dessus. En cas de contact direct avec ce médicament, la femme doit laver rapidement et soigneusement la partie de son corps concernée et demander conseil à son médecin.
Conduite de véhicules et utilisation de machines
FINCREZO n’a pas d’effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
FINCREZO contient de l’éthanol
Ce médicament contient 25 mg d’éthanol (à 96 pour cent) par pulvérisation, ce qui équivaut à 0,5 mg/microlitre (55 pour cent). Cela peut provoquer une sensation de brûlure sur une peau endommagée.
Ce produit est inflammable. Il doit être tenu à l’écart de toute flamme nue, de toute cigarette allumée et de toute source de chaleur intense (voir rubrique 5).
3. COMMENT UTILISER FINCREZO 2,275 mg/mL, solution pour pulvérisation cutanée ?
En fonction de la surface de votre cuir chevelu dégarni, votre médecin vous prescrira entre 1 et 4 pulvérisations par jour, qui doivent être réalisées sur des zones distinctes. N’utilisez pas plus de 4 pulvérisations par jour.
En général, 3 à 6 mois de traitement appliqué une fois par jour sont nécessaires avant de s’attendre à des signes de croissance des cheveux. En l’absence de réponse claire, consultez votre médecin pour la suite du traitement.
FINCREZO doit être utilisé par voie cutanée. Il ne doit être utilisé que sur le cuir chevelu.
FINCREZO est composé de deux parties distinctes : un flacon muni d’une pompe fixée et un cône. Ces composants doivent être assemblés avant la première utilisation. Avant la première application, lisez l’intégralité des instructions de manipulation ci-dessous.
Assurez-vous que les cheveux et le cuir chevelu sont parfaitement secs avant l’application. Réalisez vous-même l’application de Fincreso sur votre cuir chevelu. Si plusieurs pulvérisations sont prescrites, réalisez celles-ci sur des zones qui ne se chevauchent pas. N’appliquez pas la solution sur des zones du corps autres que le cuir chevelu. Une fois appliqué, laissez FINCREZO agir pendant au moins 6 heures.
FINCREZO peut être transféré par contact avec des tissus, des mains ou d’autres surfaces et objets. Évitez tout contact entre le cuir chevelu traité et des oreillers, casques, chapeaux, etc. jusqu’à ce que la solution ait séché.
FINCREZO peut être transféré de votre corps vers d’autres personnes si elles touchent votre cuir chevelu traité ou d’autres surfaces exposées. En cas de contact avec FINCREZO, la personne doit laver rapidement et soigneusement la partie de son corps qui a été en contact avec le médicament.
Conservez FINCREZO dans un endroit sûr et sécurisé, hors de portée des enfants. Informez les membres de votre famille ou toute autre personne ayant accès au lieu de stockage des précautions de contact.
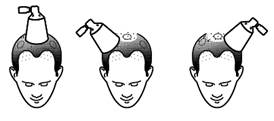
Composants et assemblage du spray applicateur
|
|
Assemblage du spray applicateur
|
A Alignez et appuyez
Alignez le cône avec le bouton de la pompe et appuyez fermement sur le cône. |
|
|
|
B Assemblage correct
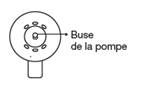
Le spray applicateur est correctement assemblé lorsque vous entendez un clic après avoir appuyé sur le cône. La buse de pulvérisation de la pompe est alors située au centre du cône.
|
|
|
C Assemblage correct
Le bas du bouton de la pompe est aligné avec le bas du cône sans aucun écart. |
|
|
D Incorrect, espace. Réalignez et appuyez à nouveau
Si vous n’entendez pas de clic pendant l’assemblage ou si vous pouvez voir un écart entre le bas du bouton de la pompe et le cône, réalignez les composants et appuyez à nouveau.
|
Amorçage de la pompe
· Après l’assemblage du spray applicateur, la pompe doit être amorcée pour la première utilisation. Si le spray applicateur n’a pas été utilisé pendant 2 semaines ou plus, la pompe devra être à nouveau amorcée. Il n’est pas nécessaire de réamorcer la pompe à chaque utilisation.
· Pour amorcer la pompe pour la première fois, appuyez entièrement sur la pompe quatre fois avec le pouce ou l’index, en dirigeant la solution pulvérisée dans un lavabo. Puis rincez le lavabo à l’eau. Pour réamorcer la pompe après une absence d’utilisation de 2 semaines ou plus, appuyez complètement sur la pompe une seule fois.
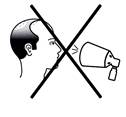
· Ne pulvérisez pas FINCREZO en direction de votre visage.
· Si de la solution a été libérée pendant l’assemblage ou l’amorçage, nettoyez les surfaces où elle a pu se déposer.
|
Ne pulvérisez pas en direction du visage |
|
|
|
|
Application de la dose
· En fonction de la taille de la zone dégarnie de votre cuir chevelu, votre médecin vous prescrira entre 1 et 4 pulvérisations par jour.
· Il n’est pas nécessaire d’agiter le flacon avant utilisation.
· Tenez le spray applicateur avec le cône plaqué contre le cuir chevelu pour éviter la dispersion de la solution dans l’air.
· Appuyez complètement sur la pompe une fois pour obtenir une pulvérisation.
· Déplacez le cône sur d’autres zones de votre cuir chevelu pour appliquer les éventuelles doses supplémentaires en fonction du nombre de pulvérisations prescrites par votre médecin. Ne créez pas de chevauchements et ne traitez pas les zones déjà pulvérisées.
· Après utilisation, ne retirez pas le cône de la pompe. Remettez le spray applicateur dans la boîte.
· Une fois FINCREZO appliqué, ne lavez pas votre cuir chevelu pendant au moins 6 heures.
|
Déplacez le cône vers la prochaine zone sans créer de chevauchements |
|
|
|
|
Assurez-vous que FINCREZO n’entre pas en contact avec vos mains ou toute autre partie de votre corps. Lavez immédiatement et soigneusement toute partie de votre corps autre que votre cuir chevelu qui aurait été exposée.
N’utilisez le bout des doigts pour faciliter l’application de FINCREZO.
Si le cône est sale, essuyez-le avec un mouchoir propre et sec. Jetez le mouchoir usagé dans une poubelle fermée et lavez-vous soigneusement les mains.
Dose et nombre de jours de traitement en fonction de la dose
Le flacon contient jusqu’à 180 pulvérisations. Le nombre de jours de traitement dépend de la dose prescrite, qui peut aller de 1 à 4 pulvérisations par jour. N’utilisez pas le flacon au-delà de 180 pulvérisations, car toute solution restante dans le flacon peut ne pas correspondre à une dose complète, ce qui pourrait limiter l’effet de votre traitement.
|
Jours de traitement |
|
|
1 |
180 |
|
2 |
90 |
|
3 |
60 |
|
4 |
45 |
· La dose prescrite et le nombre de jours correspondants à votre durée de traitement seront inscrits sur la boîte par le pharmacien.
· À la date de début du traitement par FINCREZO, notez dans votre calendrier la dose prescrite (1 à 4 pulvérisations) et calculez la date à laquelle un nouveau flacon sera nécessaire. Contactez votre médecin avant que votre stock ne soit épuisé, de sorte qu’il n’y ait pas de pause dans votre traitement.
Si vous avez utilisé plus de FINCREZO que vous n’auriez dû
Si vous avez appliqué plus de FINCREZO que recommandé, parlez-en à votre médecin. FINCREZO ne fonctionnera pas plus rapidement ou mieux si vous l’appliquez plus d’une fois par jour, mais l’apparition d’effets indésirables est plus probable.
Si vous oubliez d’utiliser FINCREZO
Si vous oubliez d’appliquer FINCREZO, n’appliquez pas une double dose pour compenser l’application oubliée. Continuez à utiliser FINCREZO à la dose recommandée par votre médecin.
Si vous arrêtez d’utiliser FINCREZO
Un traitement d’une durée de 3 mois peut être nécessaire pour voir un effet du traitement. Il est important de continuer à utiliser FINCREZO pendant la durée prescrite par votre médecin. Si vous arrêtez d’appliquer FINCREZO, vous risquez de perdre les cheveux qui ont repoussé.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Très fréquents (pouvant affecter plus de 1 personne sur 10)
· Baisse d’une hormone masculine (dihydrotestostérone) dans le sang
Fréquents (pouvant affecter jusqu’à 1 personne sur 10)
· Démangeaisons ou rougeurs du cuir chevelu
D’autres effets indésirables connus pour être associés au finastéride oral peuvent également survenir avec FINCREZO. Cela inclut :
· Réactions allergiques (hypersensibilité), notamment éruption cutanée, démangeaisons, gonflement autour de la bouche (angiœdème)
· Humeur dépressive
· Anxiété
· Battements cardiaques perceptibles (palpitations)
· Augmentation des enzymes hépatiques
· Sensibilité et augmentation du volume des seins
· Douleurs au niveau des testicules
· Présence de sang dans l’éjaculat (hématospermie)
· Troubles du désir sexuel
· Difficultés d’érection
· Trouble de l’éjaculation, notamment diminution de la quantité d’éjaculat
· Infertilité.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FINCREZO 2,275 mg/mL, solution pour pulvérisation cutanée ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon et l’emballage après {EXP}. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
FINCREZO contient de l’alcool et est donc inflammable. Évitez de pulvériser le médicament à proximité de flammes nues ou pendant que vous fumez.
N’utilisez pas FINCREZO pendant plus de 6 mois après la première ouverture du flacon.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FINCREZO 2,275 mg/mL, solution pour pulvérisation cutanée
· La substance active est : finastéride.
Chaque mL de solution contient 2,275 mg de finastéride. Chaque pulvérisation délivre 50 microlitres, qui contiennent 114 microgrammes de finastéride.
· Les autres composants sont : éthanol (à 96 pour cent), eau purifiée, propylène glycol, hydroxypropyl chitosane.
FINCREZO est une solution pour pulvérisation cutanée incolore, limpide et légèrement visqueuse.
Présentations :
1 flacon (correspondant à 180 pulvérisations) avec une pompe clipsée munie d’un pulvérisateur mécanique et 1 cône séparé.
3 flacons (correspondant à 3 x 180 pulvérisations) avec une pompe clipsée munie d’un pulvérisateur mécanique et 3 cônes séparés.
Avant la première utilisation, fixez le cône à la pompe du flacon, comme décrit dans la rubrique 3.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
14-16 Avenue Pasteur
L-2310 Luxembourg
LUXEMBOURG
Exploitant de l’autorisation de mise sur le marché
LABORATOIRES BAILLEUL
264 Rue du Faubourg Saint Honoré
75008 Paris
Scholtzstrasse 3
21465 Reinbek
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).