Dernière mise à jour le 02/02/2026
ALONEST 1,5 mg/mL, solution pour pulvérisation nasale
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : R01AC03.
Il est préconisé dans les rhinites allergiques chez les adultes, les adolescents et les enfants de 6 ans ou plus. Il s’agit de réactions allergiques à des substances comme par exemple le pollen, les acariens, ou les poils d’animaux.
Généralement les symptômes sont : écoulement nasal, éternuements, démangeaisons nasales, nez bouché. ALONEST 1,5 mg/mL, solution pour pulvérisation nasale devrait aider à maitriser ces symptômes.
Présentations
> 1 flacon(s) en verre brun de 20 ml avec pompe(s) doseuse(s) polypropylène polyéthylène polyoxyméthylène élastomère acier inoxydable
Code CIP : 34009 301 855 3 7
Déclaration de commercialisation : 22/08/2022
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 6,22 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 7,24 €
- Taux de remboursement :30 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 17/11/2021 | Inscription (CT) | Le service médical rendu par CHLORHYDRATE D'AZELASTINE MYLAN MEDICAL 1,5 mg/ml (chlorhydrate d’azélastine) est modéré dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 17/11/2021 | Inscription (CT) | Compte tenu : • de la démonstration d’une supériorité du chlorhydrate d’azélastine 1,5 mg/ml, uniquement versus placebo, dans le traitement symptomatique de la rhinite saisonnière ou perannuelle, chez les adultes, adolescents et les enfants à partir de 6 ans, en termes d’amélioration du rTNSS (critère de jugement principal), avec une quantité d’effet modeste . • de l’absence de donnée comparative robuste au dosage de 1,0 mg/ml . CHLORHYDRATE D'AZELASTINE MYLAN MEDICAL 1,5 mg/ml (chlorhydrate d’azélastine) n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à ALLERGODIL (chlorhydrate d’azélastine 1,0 mg/ml). |
ANSM - Mis à jour le : 02/08/2024
ALONEST 1,5 mg/mL, solution pour pulvérisation nasale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Solution qui contient 1,5 mg/mL de chlorhydrate d'azélastine.
Chlorhydrate d'azélastine................................................................................................. 0,2100 mg
Quantité correspondante en azélastine base...................................................................... 0,1900 mg
Pour 1 dose de 0,14 mL de solution.
Excipients à effet notoire : sorbitol, citrate de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour pulvérisation nasale.
Solution claire et incolore.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
ALONEST 1,5 mg/mL, solution pour pulvérisation nasale est convenable pour un usage à long terme. La durée du traitement est fonction de la sévérité des symptômes, la sécurité et la durée d’exposition à l’allergène.
Adultes et adolescents de 12 ans et plus :
2 pulvérisations dans chaque narine, une fois par jour. Dans certains cas, 2 pulvérisations dans chaque narine, 2 fois par jour peuvent être nécessaires. La dose quotidienne maximale recommandée est de 2 pulvérisations dans chaque narine, 2 fois par jour.
Population pédiatrique
Enfants de 6 à 11 ans :
1 pulvérisation dans chaque narine 2 fois par jour.
L’efficacité et la sécurité après 4 semaines d’administration chez l’enfant de plus de 6 ans ont été démontrées au cours d’un essai clinique. Il n’existe pas de données disponibles au-delà de 4 semaines d’administration chez l’enfant de plus de 6 ans ; toutefois, des essais cliniques d’une durée maximale d’un an utilisant une dose quotidienne deux fois plus élevée ont montré la sécurité de ALONEST 1,5 mg/mL, solution pour pulvérisation nasale chez les adultes et les adolescents.
Ce médicament ne doit pas être utilisé chez l’enfant de moins de 6 ans compte-tenu de l’absence de données de sécurité et/ou d’efficacité.
L'utilisation pendant une durée supérieure à 4 semaines n'est pas recommandée chez les enfants de 6 à 11 ans en raison de l’absence de données cliniques.
Mode d’administration
Voie nasale (administration topique - muqueuse nasale)
Précautions à prendre avant la manipulation ou l’administration du médicament :
Tenir la tête droite lors de l’administration.
Avant la première utilisation, amorcer la pompe en appuyant six fois. Quand ALONEST 1,5 mg/mL, solution pour pulvérisation nasale n’a pas été utilisé pendant 3 jours ou plus, la pompe doit être amorcée de nouveau pour obtenir un jet régulier.
4.4. Mises en garde spéciales et précautions d'emploi
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
Des études d’interactions à des doses orales élevées ont été menées. Néanmoins, leurs résultats sont sans conséquence pour ALONEST 1,5 mg/mL, solution pour pulvérisation nasale, solution pour pulvérisation nasale puisque le taux systémique après administration nasale reste inférieur au 1/5 du taux bien toléré après administration orale.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’y a aucune ou seulement peu d’informations portant sur l’utilisation d'azélastine chez des femmes enceintes. A des doses orales élevées chez l'animal, des effets toxiques sur la reproduction ont été observés (voir rubrique 5.3). En conséquence, la prudence est de rigueur lors l’utilisation de ce médicament pendant la grossesse.
On ignore si l’azélastine ou ses métabolites sont excrétés dans le lait humain. Comme beaucoup de médicaments sont excrétés dans le lait humain, la prudence est de rigueur lors de l’administration de ALONEST 1,5 mg/mL, solution pour pulvérisation nasale chez la femme allaitante.
Fertilité
Des effets sur la fertilité ont été observés dans des études chez l’animal (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Rarement, il est possible que surviennent les symptômes suivants somnolence, fatigue épuisement, vertiges ou faiblesse dus à la maladie elle-même ou à l’administration de ALONEST 1,5 mg/mL, solution pour pulvérisation nasale. Dans ces cas, l’aptitude à conduire des véhicules et à utiliser des machines peut être altérée. L'attention des patients sera attirée sur le fait que l’alcool peut augmenter ces effets.
La dysgueusie (amertume) peut être communément éprouvée après administration (le plus souvent en raison d’une méthode d’administration inadéquate telle que, pencher la tête trop en arrière au cours de l’administration) ce qui peut, dans de rares cas, provoquer des nausées.
Les effets indésirables sont classés ci-dessous par système-organe et regroupés selon la fréquence :
· Très fréquents (≥ 1/10);
· Fréquents (≥ 1/100 to < 1/10);
· Peu fréquents (≥ 1/1,000 to < 1/100);
· Rares (≥ 1/10,000 to < 1/1,000);
· Très rares (< 1/10,000), fréquence indéterminée (ne peut être estimé sur la base des données disponibles).
|
Affections du système immunitaire |
Très rare |
Hypersensibilité |
|
Affections du système nerveux |
Fréquent |
Dysgueusie (amertume) |
|
Rare |
Vertige*, somnolence (assoupissement, envie de dormir) |
|
|
Affections respiratoires, thoraciques et médiastinaux |
Peu fréquent |
Gêne nasale, (sensation de picotements et démangeaisons) Eternuement, Epistaxis |
|
Affections gastro-intestinaux |
Rare |
Nausées |
|
Affections généraux |
Rare |
Somnolence** (lassitude, épuisement) Faiblesse** |
|
Affections de la peau et du tissu sous-cutané |
Très rare |
rash prurit urticaire |
* peut aussi être causé par la maladie elle-même (voir rubrique 4.7)
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/ .
Des incidents de surdosage après administration par voie nasale sont très peu probables. Les résultats des études chez l'animal ont montré qu’en cas de surdosage accidentel par voie orale, des troubles neurologiques (assoupissement, confusion, coma, tachycardie et hypotension) peuvent survenir. Un traitement symptomatique doit être instauré. Le lavage gastrique est recommandé selon la quantité avalée. Il n'existe aucun antidote spécifique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : décongestionnants et autres préparations nasales pour un usage topique, antihistaminiques, à l’exclusion des corticostéroïdes, code ATC : R01AC03.
Mécanisme d’action
L’azélastine, dérivé des phtalazinones est un anti-allergique puissant, de longue durée d’action, avec des propriétés s anti-H1. L’azélastine est également anti-inflammatoire après administration topique oculaire.
Efficacité et sécurité clinique
Des donnés d’études in vivo (précliniques) et in vitro montrent que l’azélastine inhibe la synthèse ou la libération des médiateurs chimiques impliqués à stade précoce et à un stade avancé dans les réactions allergiques, i.e. les leucotriènes, l’histamine, PAF, la sérotonine.
Des donnés d’études cliniques montrent que l’azélastine, solution pour pulvérisation nasale a une action plus rapide que la desloratadine et la mométasone, administrées par voie nasale. Un soulagement des symptômes allergiques est observé dans les 15 minutes suivant l’administration.
5.2. Propriétés pharmacocinétiques
Après administration orale, l'azélastine est rapidement absorbée. La biodisponibilité absolue est de 81 %. L'alimentation n'interfère pas sur l'absorption. Le volume de distribution est élevé indiquant une distribution préférentielle vers les tissus périphériques. Le taux de liaison aux protéines est relativement bas (soit 80 % - 90 %, taux trop faible pour provoquer des interactions par déplacement).
Élimination
Les demi-vies d'élimination plasmatique après administration unique d'azélastine sont d’environ de 20 heures pour l'azélastine et de 45 heures pour le N-déméthylazélastine (métabolite actif). L'élimination est surtout fécale. L'excrétion fécale prolongée de petites quantités de la dose administrée suggère l'existence d'un cycle entéro-hépatique.
Linéarité/non-linéarité
Après administration nasale de 2 pulvérisations dans chaque narine (0,822 mg dose totale) de ALONEST 1,5 mg/mL, solution pour pulvérisation nasale le pic moyen des taux plasmatiques d'azélastine est de 409 pg/mL (Cmax) chez des sujets sains, la moyenne de l’exposition systémique (AUC) est de 9312 pg*hr/mL et le temps médian pour atteindre le Cmax (tmax) est de 4 heures.
5.3. Données de sécurité préclinique
Le chlorhydrate d'azélastine ne montre aucun phénomène de sensibilisation chez le cochon d’Inde. Aucun potentiel génotoxique n’a été observé par des tests in vitro et in vivo pour l’azélastine, ni aucun potentiel cancérogène chez les rats ou la souris. Chez les rats mâles et femelles, l’azélastine, à des doses orales supérieures à 3,0 mg/kg/jour ont causé une diminution liée à la dose de l’indice de fertilité ; aucun changement lié à la substance n’a été observé dans les organes reproductifs de mâles ou femelles pendant les études de toxicité répétées.
Des effets embryotoxiques et tératogènes chez des rats, souris et lapins ont seulement été observés aux doses toxiques pour la mère (par exemple chez la souris et les rats, à des taux de 68,6 mg/kg/jour). A des doses orales élevés chez les animaux, 1095 fois plus élevé que la dose nasale maximale quotidienne et recommandée chez l’homme, la mort fœtale, le retard de croissance et l’augmentation de la fréquence d’anomalies squelettiques ont été observés au cours des tests de toxicité pour la reproduction.
Hypromellose, sucralose (E 955), sorbitol liquide (cristallisant), édétate disodique, citrate de sodium, eau purifiée.
3 ans.
Durée de conversation (après la première utilisation) : 6 mois.
6.4. Précautions particulières de conservation
Ne pas conserver au réfrigérateur ni congeler.
6.5. Nature et contenu de l'emballage extérieur
Flacon en verre brun avec pompe doseuse (la pompe en contact avec la solution est composée de : polypropylène, polyéthylène, polyoxyméthylène, élastomère, acier inoxydable).
· 5 mL dans un flacon de 10 mL
· 10 mL dans un flacon de 10 mL
· 17 mL dans un flacon de 20 mL
· 20 mL dans un flacon de 20 mL
· 22 mL dans un flacon de 20 mL
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 847 4 5 : 5 mL de solution dans un flacon en verre de 10 mL.
· 34009 301 855 1 3 : 10 mL de solution dans un flacon en verre de 10 mL.
· 34009 301 855 2 0 : 7 mL de solution dans un flacon en verre de 20 mL.
· 34009 301 855 3 7 : 20 mL de solution dans un flacon en verre de 20 mL.
· 34009 301 855 4 4 : 22 mL de solution dans un flacon en verre de 20 mL.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicaments soumis à prescription médicale.
Liste I.
ANSM - Mis à jour le : 02/08/2024
ALONEST 1,5 mg/mL, solution pour pulvérisation nasale
Chlorhydrate d’azélastine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ALONEST 1,5 mg/mL, solution pour pulvérisation nasale et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ALONEST 1,5 mg/mL, solution pour pulvérisation nasale ?
3. Comment utiliser ALONEST 1,5 mg/mL, solution pour pulvérisation nasale ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ALONEST 1,5 mg/mL, solution pour pulvérisation nasale ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ALONEST 1,5 mg/mL, solution pour pulvérisation nasale ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : R01AC03.
Il est préconisé dans les rhinites allergiques chez les adultes, les adolescents et les enfants de 6 ans ou plus. Il s’agit de réactions allergiques à des substances comme par exemple le pollen, les acariens, ou les poils d’animaux.
Généralement les symptômes sont : écoulement nasal, éternuements, démangeaisons nasales, nez bouché. ALONEST 1,5 mg/mL, solution pour pulvérisation nasale devrait aider à maitriser ces symptômes.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ALONEST 1,5 mg/mL, solution pour pulvérisation nasale ?
N’utilisez jamais ALONEST 1,5 mg/mL, solution pour pulvérisation nasale:
· si vous êtes allergique au chlorhydrate d’azélastine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Pour que ce médicament soit actif, les fosses nasales doivent être libres. Il convient par conséquent de se moucher avant l'instillation du produit.
Ce médicament contient 64,000 mg de sorbitol pour 1 mL d’une solution pour pulvérisation nasale.
Ce médicament contient moins de 1 mmol (23 mg) de sodium pour 1 mL d’une solution pour pulvérisation nasale, c.-à-d. qu’il est essentiellement « sans sodium ».
Adressez-vous à votre médecin ou pharmacien avant d’utiliser ALONEST 1,5 mg/mL, solution pour pulvérisation nasale.
Enfants
L’utilisation n’est pas recommandée chez des enfants âgés de moins de 6 ans.
Autres médicaments et ALONEST 1,5 mg/mL, solution pour pulvérisation nasale
Bien que l’effet de ALONEST 1,5 mg/mL, solution pour pulvérisation nasale ne semble pas être modifié par d'autres médicaments, informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre d'autres médicaments.
ALONEST 1,5 mg/mL, solution pour pulvérisation nasale avec des aliments et boissons
Sans objet.
Il n'existe que peu d'information sur les effets de l'azélastine S sur l'enfant à naître ou l’enfant allaité.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
ALONEST 1,5 mg/mL, solution pour pulvérisation nasale a une influence mineure sur l’aptitude à conduire des véhicules et à utiliser des machines.
Rarement, il se peut que le patient ressente de la fatigue ou des vertiges en raison de la maladie elle-même ou bien en utilisant ALONEST 1,5 mg/mL, solution pour pulvérisation nasale. Dans ces cas-là, ne conduisez pas des véhicules et n’utilisez pas des machines. L'attention des patients sera attirée sur le fait que l’alcool peut augmenter ces effets.
ALONEST 1,5 mg/mL, solution pour pulvérisation nasale contient du sorbitol et du citrate de sodium.
3. COMMENT UTILISER ALONEST 1,5 mg/mL, solution pour pulvérisation nasale ?
Adulte et adolescent de 12 ans et plus :
· La dose recommandée est de 2 pulvérisations dans chaque narine, 1 fois par jour, ou 2 pulvérisations dans chaque narine, deux fois par jour selon la gravité des symptômes.
· La dose quotidienne maximale recommandée est de 2 pulvérisations dans chaque narine, 2 fois par jour.
Utilisation chez les enfants et les adolescents
Enfants de 6 à 11 ans :
La dose recommandée est de 1 pulvérisation dans chaque narine, 2 fois par jour.
L’expérience clinique a montré une efficacité et une sécurité d’utilisation satisfaisante chez les enfants jusqu’à 4 semaines de traitement. Il n’existe pas de données disponibles au-delà de 4 semaines d’utilisation; toutefois, des essais cliniques d’une durée maximale d’un an utilisant une dose quotidienne deux fois plus élevée ont montré une sécurité satisfaisante chez les adultes et les adolescents.
ALONEST 1,5 mg/mL, solution pour pulvérisation nasale ne doit pas être utilisé chez l’enfant de moins de 6 ans compte-tenu de l’absence de données de sécurité et/ou d’efficacité du traitement.
Si possible, vous devriez utiliser ALONEST 1,5 mg/mL, solution pour pulvérisation nasale régulièrement jusqu'à ce que vos symptômes aient disparu. Si vous interrompez l'utilisation de ALONEST 1,5 mg/mL, solution pour pulvérisation nasale, vos symptômes risquent de réapparaître.
ALONEST 1,5 mg/mL, solution pour pulvérisation nasale convient pour une utilisation à long terme.
L'utilisation pendant plus de 4 semaines n'est pas recommandée chez les enfants de 6 à 11 ans en raison du manque de données cliniques disponibles..
Comment utiliser le spray nasal
1. Mouchez-vous le nez en premier.
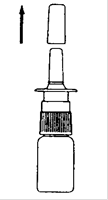
2. Otez le capuchon protecteur du pulvérisateur (Schéma 1).
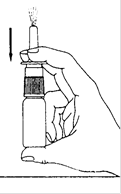
3. Avant la première utilisation, amorcez la pompe en appuyant 6 fois jusqu’à l’obtention d’un jet régulier (Schéma 2). Quand ALONEST 1,5 mg/mL, solution pour pulvérisation nasale n’a pas été utilisé pendant 3 jours ou plus, la pompe doit être amorcée de nouveau pour obtenir un jet régulier.
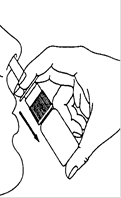
4. Pulvérisez dans chaque narine en gardant la tête droite. Ne pas pencher la tête en arrière (Schéma 3).
5. Essuyez l'applicateur nasal et remettez le capuchon protecteur.
|
|
|
|
|
|
Schéma 1 |
Schéma 2 |
Schéma 3 |
|
Si vous avez pris plus de ALONEST 1,5 mg/mL, solution pour pulvérisation nasale que vous n’auriez dû
En cas de surdosage, il est peu probable que vous ayez des effets néfastes. En cas de doute, contactez votre médecin.
Si quiconque, en particulier un enfant, avale ALONEST 1,5 mg/mL, solution pour pulvérisation nasale de manière accidentelle, consultez immédiatement un médecin ou le service d’urgence de l’hôpital le plus proche.
Si vous oubliez de prendre ALONEST 1,5 mg/mL, solution pour pulvérisation nasale
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
Si vous arrêtez de prendre ALONEST 1,5 mg/mL, solution pour pulvérisation nasale
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Ces effets peuvent inclure :
Fréquent : (peut apparaître jusqu’à 1 personne sur 10)
· sensation de goût amer (en particulier si vous avez penché la tête trop en arrière lors de l’utilisation)
Peu fréquent (peut apparaître jusqu’à 1 personne sur 100)
· légère gêne nasale, (sensations de picotements et de démangeaisons), éternuements, saignement de nez
Rare (peut apparaître jusqu’à 1 personne sur 1000)
· Le goût amer peut vous donner la sensation d’être malade. Des somnolences (lassitude et épuisement), vertige, faiblesse, ou le sentiment d’assoupissement peuvent apparaitre mais peuvent aussi être causés par la maladie elle-même.
Très rare (peut apparaître jusqu’à 1 personne sur 10,000)
· Réaction allergique, éruptions, démangeaisons, urticaires
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ALONEST 1,5 mg/mL, solution pour pulvérisation nasale?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et le flacon après EXP.
N’utilisez plus ce qu'il reste du médicament, 6 mois après la première ouverture de la solution pour pulvérisation nasale.
Ne pas conserver au réfrigérateur et ne pas congeler.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ALONEST 1,5 mg/mL, solution pour pulvérisation nasale
ALONEST 1,5 mg/mL, solution pour pulvérisation nasale est une solution claire et incolore.
Ce médicament se présente sous forme de flacon en verre brun avec pompe doseuse. Le flacon de 10 mL contient 5 ou 10 mL de la solution pour pulvérisation nasale. Le flacon de 20 mL contient 17 mL, 20 mL ou 22 mL de la solution pour pulvérisation nasale. Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
Exploitant de l’autorisation de mise sur le marché
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
Lütticher Straße 5
53842 Troisdorf
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).