Dernière mise à jour le 08/01/2026
BRIMAZED 2 mg/mL, collyre en solution en récipient unidose
Présentations
> 60 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 0,35 ml
Code CIP : 34009 301 500 8 5
Déclaration de commercialisation : 03/05/2021
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 09/09/2020 | Inscription (CT) | Le service médical rendu par BRIMAZED (tartrate de brimonidine) est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 09/09/2020 | Inscription (CT) | Cette spécialité est un hybride qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport au médicament de référence, ALPHAGAN 0,2 % (brimonidine), collyre en solution. |
ANSM - Mis à jour le : 21/11/2023
BRIMAZED 2 mg/mL, collyre en solution en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Tartrate de brimonidine.......................................................................................................... 2,0 mg
Quantité correspondant à brimonidine base............................................................................ 1,3 mg
Pour 1 mL de collyre en solution.
Une goutte contient 0,06‑0,07 mg de tartrate de brimonidine.
Pour la liste complète des excipients, voir rubrique 6.1.
Collyre en solution en récipient unidose (collyre).
Solution claire, légèrement jaune‑verdâtre (pH 5,5‑6,5, osmolalité 275‑315 mOsm/kg).
4.1. Indications thérapeutiques
· En monothérapie chez les patients présentant une contre indication aux bêtabloquants à usage local.
· En association à d'autres traitements diminuant la pression intraoculaire dans le cas où une monothérapie ne permet pas d'atteindre la PIO cible (voir rubrique 5.1).
4.2. Posologie et mode d'administration
Dosage recommandé chez l'adulte (y compris le patient âgé)
La posologie recommandée est d'une goutte de BRIMAZED deux fois par jour dans l'œil ou les yeux atteint(s), les deux instillations devant être espacées d'environ 12 heures. L'utilisation du collyre chez les patients âgés ne requiert aucune adaptation posologique.
Utilisation en cas d'insuffisance rénale ou hépatique
BRIMAZED n'a pas été étudié chez les patients ayant une insuffisance rénale ou hépatique (voir rubrique 4.4).
Population pédiatrique
Il n'a pas été conduit d'études cliniques chez les adolescents (12 à 17 ans).
BRIMAZED n'est pas recommandé chez les enfants en dessous de 12 ans et est contre indiqué chez les nouveau‑nés et les nourrissons (moins de 2 ans) (voir rubriques 4.3, 4.4, 4.9). Des effets indésirables sévères ont été rapportés chez les nouveau‑nés. La sécurité et l'efficacité de BRIMAZED chez les enfants âgés de 2 à 12 ans n'ont pas été établies.
Mode d’administration
Voie ophtalmique.
Comme c'est le cas avec tous les collyres, afin de réduire une absorption systémique possible, il est recommandé de comprimer le sac lacrymal au niveau du canthus interne (point d'occlusion) pendant une minute. Ceci doit être fait immédiatement après l'instillation de chaque goutte. Cela pourrait entrainer une diminution des effets indésirables systémiques et une augmentation de l'activité locale. Pour éviter la contamination de l'œil ou du collyre, ne laissez pas l'embout du récipient unidose entrer en contact avec une quelconque surface.
En cas d'utilisation de plusieurs produits ophtalmiques à usage local, les instillations des différents produits doivent être espacées de 5 à 15 minutes.
· Hypersensibilités à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
· Nouveau-nés et nourrissons (moins de 2 ans) (voir rubrique 4.8),
· Patients recevant un traitement inhibiteur de la mono-amine oxydase (IMAO) et patients sous antidépresseurs affectant la transmission noradrénergique (par exemple antidépresseurs tricycliques et miansérine).
4.4. Mises en garde spéciales et précautions d'emploi
Une attention particulière est nécessaire chez les patients atteints d'une maladie cardio‑vasculaire sévère ou instable et incontrôlée.
Troubles oculaires
Lors des essais cliniques, quelques patients (12,7 %) ont présenté une réaction de type allergique oculaire avec un collyre de brimonidine avec conservateur en solution multidose (voir rubrique 4.8). En cas de réaction allergique, le traitement avec BRIMAZED doit être arrêté.
Des réactions d'hypersensibilité oculaires retardées ont été rapportées avec un collyre de brimonidine avec conservateur en solution multidose, certaines étaient associées à une augmentation de la pression intra‑oculaire.
Troubles vasculaires
BRIMAZED doit être utilisé avec précaution chez les patients souffrant de dépression, d'insuffisance cérébrale ou coronarienne, de phénomène de Raynaud, d'hypotension orthostatique ou de thromboangéite oblitérante.
Insuffisance rénale et hépatique
BRIMAZED n'a pas été étudié chez les patients présentant des troubles hépatiques ou rénaux. Une attention particulière est nécessaire en cas de traitement de ces patients.
Population pédiatrique
Les enfants de deux ans ou plus, en particulier ceux âgés de 2 à 7 ans et/ou de poids inférieur ou égal à 20 kg, doivent être traités avec précaution et étroitement surveillés en raison de l'incidence élevée et de la sévérité de la somnolence (voir rubrique 4.8).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Bien qu'il n'y ait pas d'étude spécifique sur les interactions médicamenteuses avec la brimonidine, la possibilité d'un effet additif ou potentialisateur en cas de prise de dépresseurs du système nerveux central (SNC) (alcool, barbituriques, opiacés, sédatifs ou anesthésiques) doit être prise en compte.
On ne dispose d'aucune information concernant le niveau des catécholamines circulantes après l'instillation d’un collyre contenant de la brimonidine. En conséquence, il convient de faire preuve de vigilance avec les patients prenant des médicaments risquant d'affecter le métabolisme et la fixation des amines circulantes (ex: chlorpromazine, méthylphénidate, réserpine).
Après l'instillation d’un collyre contenant de la brimonidine, on a observé chez quelques patients des diminutions de la tension artérielle non significatives du point de vue clinique. Il convient d'être vigilant en cas de prise concomitante de BRIMAZED et d'antihypertenseurs et/ou de glucosides cardiotoniques.
Une attention particulière est recommandée lors de l'instauration (ou de la modification de la posologie) d'un traitement systémique concomitant (quelle que soit la forme pharmaceutique) susceptible d'interagir avec des agonistes α-adrénergiques ou d'interférer avec leur activité, tels que les agonistes ou antagonistes des récepteurs adrénergiques (ex.: isoprénaline, prazosine).
4.6. Fertilité, grossesse et allaitement
Grossesse
La sécurité d'utilisation chez la femme durant la grossesse n'a pas été établie. Lors des études chez l'animal, le tartrate de brimonidine n'a pas provoqué d'effet tératogène. Chez le lapin, le tartrate de brimonidine, à des concentrations plasmatiques supérieures à celles obtenues lors du traitement chez l'homme, a provoqué des pertes plus importantes lors de la période de préimplantation et une réduction de la croissance postnatale. BRIMAZED ne doit être utilisé que lorsque les bénéfices potentiels pour la mère dépassent les risques potentiels encourus par le fœtus. Pour réduire l’absorption systémique, voir rubrique 4.2.
On ne sait pas si la brimonidine est excrétée dans le lait maternel. Le produit est excrété dans le lait des rates allaitantes. BRIMAZED ne doit pas être utilisé pendant l'allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Les événements indésirables les plus communément rapportés pour un collyre contenant de la brimonidine avec conservateur sont sécheresse buccale, hyperhémie oculaire, sensations de brûlure, sensations de picotement, survenant chez 22 à 25 % des patients. Ils sont généralement transitoires et rarement assez sévères pour nécessiter l'arrêt du traitement.
Dans les études cliniques, pour un collyre contenant de la brimonidine avec conservateur, des symptômes de réactions allergiques sont apparus chez 12,7 % des patients (entraînant l'arrêt du traitement chez 11,5 % des patients) et sont survenus dans les 3 à 9 mois de traitement chez la majorité des patients.
Dans chaque catégorie, les effets indésirables sont présentés dans l'ordre décroissant de gravité. Pour classer la fréquence des effets indésirables les terminologies suivantes ont été utilisées: très fréquents (≥ 1/10); fréquents (≥ 1/100, < 1/10); peu fréquents (≥ 1/1 000, < 1/100); rares (≥ 1/10 000, < 1/1 000); très rares (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau des effets indésirables
Les effets indésirables suivants ont été rapportés pour un collyre contenant de la brimonidine avec conservateur et peuvent aussi se produire avec BRIMAZED sans conservateur :
|
Affections cardiaques |
|
|
Peu fréquent: |
palpitations/arythmie (incluant bradycardie et tachycardie) |
|
Affections du système nerveux |
|
|
Très fréquent: |
maux de tête, somnolence |
|
Fréquent: |
vertiges, goût anormal |
|
Très rare: |
syncope |
|
Affections oculaires |
|
|
Très fréquent: |
- irritation oculaire (hyperhémie, brûlures et picotements, prurit, sensation de corps étranger, follicules conjonctivaux) - vision trouble - blépharite allergique, blépharoconjonctivite allergique, conjonctivite allergique, réaction allergique oculaire et conjonctivite folliculaire |
|
Fréquent: |
- irritation locale (hyperhémie et œdème de la paupière, blépharite, œdème et sécrétions conjonctivaux, douleur oculaire et larmoiement) - photophobie - érosion et coloration cornéenne - sécheresse oculaire - blanchiment conjonctival - vision anormale - conjonctivite |
|
Très rare: |
- iritis - myosis |
|
Fréquence indéterminée* |
- irido‑cyclite (uvéite antérieure) - prurit des paupières |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Fréquent: |
symptômes des voies respiratoires supérieures |
|
Peu fréquent: |
sécheresse nasale |
|
Rare: |
dyspnée |
|
Affections gastro‑intestinales |
|
|
Très fréquent: |
sécheresse buccale |
|
Fréquent: |
symptômes gastro‑intestinaux |
|
Affections vasculaires |
|
|
Très rare: |
hypertension, hypotension |
|
Affections de la peau et du tissus sous‑cutané |
|
|
Fréquence indéterminée* |
réaction cutanée incluant érythème, œdème facial, prurit, rash et vasodilatation |
|
Troubles généraux et anomalies au site d'administration |
|
|
Très fréquent: |
fatigue |
|
Fréquent: |
asthénie |
|
Affections du système immunitaire |
|
|
Peu fréquent: |
réactions allergiques systémiques |
|
Affections psychiatriques |
|
|
Peu fréquent: |
dépression |
|
Très rare: |
insomnie |
*Ces effets indésirables ont été signalés en pratique clinique après la commercialisation d'un collyre contenant de la brimonidine avec conservateur. Sachant qu'ils ont été rapportés sur la base des notifications spontanées, une estimation de leur fréquence n'a pu être effectuée.
Dans des cas où la brimonidine a été utilisée dans le cadre du traitement médical d'un glaucome congénital, des symptômes de surdosage à la brimonidine tels que perte de conscience, léthargie, somnolence, hypotension, hypotonie, bradycardie, hypothermie, cyanose, pâleur, dépression respiratoire et apnée ont été rapportés chez des nouveau‑nés et nourrissons qui avaient reçu de la brimonidine (voir rubrique 4.3).
Dans une étude de phase III d'une durée de 3 mois, chez des enfants âgés de 2 à 7 ans, présentant un glaucome non contrôlé sous bêta‑bloquants, une prévalence importante (55 %) de somnolence a été rapportée avec un collyre de brimonidine avec conservateur en solution multidose utilisé en association. Chez 8 % des enfants, celle‑ci était sévère et a conduit à un arrêt du traitement dans 13 % des cas. L'incidence de la somnolence a diminué avec l'augmentation de l'âge, en étant minimale dans le groupe de sujets âgés de 7 ans (25 %) mais elle était plus liée au poids, apparaissant plus fréquemment chez les enfants d'un poids inférieur ou égal à 20 kg (63 %) que chez ceux d'un poids supérieur à 20 kg (25 %) (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Surdosage ophtalmique (adultes)
Dans de tels cas, les événements rapportés ont été généralement listés parmi les effets indésirables.
Surdosage systémique résultant d'une ingestion accidentelle (adultes)
Il existe très peu d'information concernant l'ingestion accidentelle de brimonidine chez les adultes. Le seul effet indésirable rapporté à ce jour est l'hypotension. Cet épisode hypotensif a été suivi d'une hypertension réactionnelle.
Le traitement d'un surdosage par voie orale repose sur des mesures symptomatiques et de support. Les voies respiratoires doivent être surveillées.
Les cas rapportés de surdosage oral avec d'autres alpha‑2‑stimulants ont été associés aux symptômes suivants: hypotension, asthénie, vomissements, léthargie, sédation, bradycardie, arythmies, myosis, apnée, hypotonie, hypothermie, dépression respiratoire et convulsion.
Population pédiatrique
Des notifications d'effets indésirables graves consécutifs à l'ingestion accidentelle d'un collyre de brimonidine avec conservateur par des enfants ont été publiées ou rapportés. Les sujets ont présenté des symptômes de dépression du système nerveux central (SNC), typiquement coma temporaire ou faible niveau de conscience, léthargie, somnolence, hypotonie, bradycardie, hypothermie, pâleur, dépression respiratoire et apnée, ayant nécessité une admission en soins intensifs avec intubation si nécessaire. Un rétablissement complet a été rapporté chez tous les sujets, en général dans les 6 à 24 heures.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
La brimonidine est un agoniste des récepteurs alpha‑2 adrénergiques 1 000 fois plus sélectif pour les récepteurs alpha‑2 adrénergiques que pour les récepteurs alpha‑1 adrénergiques.
Du fait de cette sélectivité, on n'observe aucune mydriase ni vasoconstriction des microvaisseaux, associée aux xénogreffes de rétine humaine.
Une administration locale de tartrate de brimonidine diminue la pression intra‑oculaire (PIO) chez l'homme et n'affecte que de façon minime les paramètres cardio‑vasculaires ou pulmonaires.
Des données restreintes sur des patients atteints d'asthme bronchique n'ont pas mis en évidence d'effet néfaste.
La brimonidine a un délai d'action rapide, l'effet hypotenseur oculaire maximum est observé deux heures après l'administration d’un collyre de brimonidine en solution avec conservateur. Dans 2 études cliniques d'un an, les diminutions moyennes de PIO obtenues avec un collyre contenant de la brimonidine avec conservateur étaient approximativement comprises entre 4 et 6 mmHg.
Des études fluorophotométriques menées chez l'animal et chez l'homme suggèrent que le tartrate de brimonidine possède un double mécanisme d'action. On pense que la brimonidine diminue la PIO en réduisant la formation d'humeur aqueuse et en augmentant l'écoulement de l'humeur aqueuse par la voie uvéosclérale.
Des études cliniques montrent que la brimonidine est efficace en association aux bêtabloquants à usage local. Des études plus courtes montreraient également que la brimonidine a un effet additionnel cliniquement significatif en association avec travoprost (6 semaines) et latanoprost (3 mois).
5.2. Propriétés pharmacocinétiques
Après une administration oculaire d'un collyre de tartrate de brimonidine en solution à 0,2 % avec conservateur deux fois par jour pendant 10 jours, les concentrations plasmatiques étaient faibles (Cmax moyenne égale à 0,06 ng/mL). On a observé une légère accumulation dans le sang après de multiples instillations (2 fois par jour pendant 10 jours). L'aire sous la courbe «concentration plasmatique/temps» sur 12 heures à l'état d'équilibre (AUC0-12h) était égale à 0,31 ng·h/mL, par rapport à 0,23 ng·h/mL après la première dose. La demi‑vie apparente moyenne dans la circulation générale était d'environ 3 heures chez l'homme après administration locale.
Chez l'homme, le taux de fixation aux protéines plasmatiques de la brimonidine après une administration locale est d'environ 29 %.
La brimonidine est liée de façon réversible à la mélanine dans les tissus oculaires, in vitro et in vivo. Après 2 semaines d'instillations oculaires, les concentrations de brimonidine dans l'iris, le corps ciliaire et la choroïde‑rétine, étaient 3 à 17 fois supérieures à celles observées après instillation unique. Il n'y a pas d'accumulation en l'absence de mélanine.
L'importance de la liaison avec la mélanine chez l'homme est mal connue. Cependant, aucun effet oculaire néfaste n'a été trouvé lors de l'examen biomicroscopique des yeux de patients traités avec un collyre de brimonidine avec conservateur pendant des périodes allant jusqu'à un an; de même, aucune toxicité oculaire significative n'a été trouvée durant une étude de tolérance oculaire d'un an chez le singe recevant environ quatre fois la dose recommandée de tartrate de brimonidine.
Après administration orale chez l'homme, la brimonidine est bien absorbée et rapidement éliminée. La plus grande partie de la dose (environ 75 %) a été excrétée dans l'urine sous forme de métabolites en cinq jours; aucun produit non métabolisé n'a été détecté dans l'urine. Des études in vitro, utilisant du foie animal et humain montrent que le métabolisme fait largement intervenir l'aldéhyde oxydase et le cytochrome P450. En conséquence, l'élimination systémique semble être due en priorité à un métabolisme hépatique.
Profil cinétique
Après une instillation oculaire unique de la solution avec conservateur à des concentrations de 0,08 %, 0,2 % et 0,5 %, aucun écart significatif de la linéarité de la cinétique d'absorption (mesurée par les Cmax plasmatiques et les AUC) n'est observé.
Caractéristiques chez les patients
Caractéristiques chez les patients âgés
Chez les patients âgés (sujets de 65 ans ou plus), la Cmax, l’AUC, et la demi-vie apparente de la brimonidine sont similaires, après une instillation unique, à celles observées chez les adultes jeunes, ce qui indique que l'âge n'influe pas sur l'absorption et l'élimination systémiques du produit.
D'après les données d'une étude clinique de 3 mois qui incluait des patients âgés, l'exposition systémique à la brimonidine a été très faible.
5.3. Données de sécurité préclinique
Chlorure de sodium
Citrate de sodium
Acide citrique monohydraté
Acide chlorhydrique (pour ajuster le pH) ou
Hydroxyde de sodium (pour ajuster le pH)
Eau pour préparations injectables
4 ans
Ne pas utiliser plus de 3 mois après ouverture du sachet en aluminium.
6.4. Précautions particulières de conservation
A conserver dans l’emballage d’origine à l’abri de la lumière.
Le contenu d’un récipient unidose doit être utilisé immédiatement après ouverture.
6.5. Nature et contenu de l'emballage extérieur
BRIMAZED est conditionné dans des récipients unidoses transparents en polyéthylène de basse densité (PEBD). Deux rangées de 5 récipients unidoses chacun sont emballés dans un sachet en aluminium laminé.
Boites de 10, 20, 30, 50, 60, 100 ou 120 récipients unidoses contenant chacun 0,35 mL de solution.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
WERKSSTRASSE 3
92551 STULLN
ALLEMAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 500 6 1 : Récipients unidoses transparents (PEBD) contenant 0,35 mL de collyre. Boîte de 20
· 34009 301 500 7 8 : Récipients unidoses transparents (PEBD) contenant 0,35 mL de collyre. Boîte de 30
· 34009 550 561 1 9 : Récipients unidoses transparents (PEBD) contenant 0,35 mL de collyre. Boîte de 50
· 34009 301 500 8 5 : Récipients unidoses transparents (PEBD) contenant 0,35 mL de collyre. Boîte de 60
· 34009 550 561 2 6 : Récipients unidoses transparents (PEBD) contenant 0,35 mL de collyre. Boîte de 100
· 34009 550 561 3 3 : Récipients unidoses transparents (PEBD) contenant 0,35 mL de collyre. Boîte de 120
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[À compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[À compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 21/11/2023
BRIMAZED 2 mg/mL, collyre en solution en récipient unidose
Tartrate de brimonidine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que BRIMAZED 2 mg/mL, collyre en solution en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser BRIMAZED 2 mg/mL, collyre en solution en récipient unidose?
3. Comment utiliser BRIMAZED 2 mg/mL, collyre en solution en récipient unidose?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver BRIMAZED 2 mg/mL, collyre en solution en récipient unidose?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE BRIMAZED 2 mg/mL, collyre en solution en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
Il peut être utilisé soit seul quand un collyre bêtabloquant est contre‑indiqué, soit en association avec un autre collyre quand celui‑ci n'a pas assez réduit la pression à l'intérieur de l'œil, dans le traitement du glaucome à angle ouvert ou d'hypertension oculaire.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER BRIMAZED 2 mg/mL, collyre en solution en récipient unidose ?
N’utilisez jamais BRIMAZED 2 mg/mL, collyre en solution en récipient unidose:
· si vous êtes allergique au tartrate de brimonidine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous prenez des inhibiteurs de la mono‑amine‑oxydase (IMAO), ou certains autres antidépresseurs. Vous devez informer votre médecin si vous prenez un médicament antidépresseur.
· si vous allaitez.
· chez les nouveau-nés et les nourrissons (de la naissance jusqu'à 2 ans).
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser BRIMAZED :
· si vous souffrez ou avez souffert de dépression, d'une réduction de vos capacités mentales, d'une réduction de la circulation sanguine au niveau du cerveau, de problèmes cardiaques, de troubles circulatoires des membres, ou de troubles de la tension artérielle.
· si vous avez ou avez eu des maladies du foie ou des reins.
Enfants et adolescents
L’utilisation de BRIMAZED n'est pas recommandée chez les enfants âgés de 2 à 12 ans.
BRIMAZED ne doit généralement pas être utilisé chez les adolescents âgés de 12 à 17 ans car sa sécurité et son efficacité n’ont pas été établies dans ce groupe d’âge.
Autres médicaments et BRIMAZED 2 mg/mL, collyre en solution en récipient unidose
Informez votre médecin ou pharmacien si vous prenez/utilisez, avez récemment pris/utilisé ou pourriez prendre/utiliser tout autre médicament.
Indiquez à votre médecin si vous prenez l'un des médicaments suivants:
· antidouleurs, sédatifs, opiacés, barbituriques ou si vous consommez régulièrement de l'alcool.
· anesthésiques.
· traitement pour le cœur ou pour réduire la tension artérielle.
· médicament qui affecte le métabolisme tel la chlorpromazine, méthylphénidate et réserpine.
· médicament qui agît sur les mêmes récepteurs que BRIMAZED par exemple: isoprénaline et prazosine.
· inhibiteurs de la monoamine oxydase (IMAO) et d'autres antidépresseurs.
· tout médicament, même s'il ne s'agit pas d'un médicament destiné à l'œil.
· ou si la posologie d'un de vos médicaments actuels est changée.
Ceci peut affecter votre traitement avec BRIMAZED.
BRIMAZED 2 mg/mL, collyre en solution en récipient unidose avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament. N’utilisez pas BRIMAZED si vous êtes enceinte sauf si votre médecin le juge nécessaire.
BRIMAZED ne doit pas être utilisé si vous allaitez.
Conduite de véhicules et utilisation de machines
· BRIMAZED est susceptible de provoquer une vision trouble ou anormale. Cet effet semblerait plus important la nuit ou en cas de réduction de la luminosité.
· BRIMAZED peut aussi provoquer une certaine fatigue ou une somnolence chez certains patients.
· Si vous présentez un de ces symptômes, ne conduisez pas ou n'utilisez pas de machines jusqu'au retour à une vision normale.
BRIMAZED 2 mg/mL, collyre en solution en récipient unidose contient
Sans objet.
3. COMMENT UTILISER BRIMAZED 2 mg/mL, collyre en solution en récipient unidose ?
Utilisation chez les adultes
La dose recommandée est d'une goutte deux fois par jour dans l'œil ou les yeux atteint(s), les deux instillations devant être espacées d'environ 12 heures. Ne modifiez pas la posologie ou n’arrêtez pas d’utiliser BRIMAZED avant d’en parler à votre médecin.
Utilisation chez les enfants de moins de 12 ans
BRIMAZED ne doit pas être utilisé chez les nourrissons de moins de 2 ans.
BRIMAZED n'est pas recommandé chez les enfants (de 2 à 12 ans).
Mode d'administration
1. Lavez‑vous les mains.
2. Ouvrez le sachet en aluminium et sortez la plaquette de récipients unidoses.
3. Détachez un des récipients unidoses de la rangée (Fig. 1).
4. Remettez les autres récipients unidoses dans le sachet et fermez‑le en repliant le bord supérieur. Rangez le sachet dans la boîte.
5. Ouvrez le récipient unidose en tournant l’extrémité. Ne touchez‑pas l’embout du récipient après l’avoir ouvert (Fig. 2).
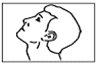
6. Penchez votre tête en arrière (Fig. 3).
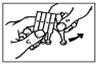
7. Tirez doucement votre paupière inférieure vers le bas avec votre doigt et tenez le récipient unidose dans votre autre main. Pressez le récipient afin de faire tomber une goutte dans l’œil (Fig. 4).
8. Fermez les yeux et appuyez l’extrémité d’un doigt contre le coin interne de l’œil pendant environ 1 minute. Cela empêchera la goutte de couler dans votre gorge par le canal lacrymal et la plus grande partie de la goutte restera dans l'œil (Fig. 5). Si nécessaire, répétez les étapes 6 à 8 dans l’autre œil.
9. Jeter le récipient unidose après utilisation.
|
|
|
|
|
|
|
Fig. 1 |
Fig. 2 |
Fig. 3 |
Fig. 4 |
Fig. 5 |
Si une goutte tombe à côté de votre œil, répétez la procédure.
Si vous utilisez BRIMAZED avec un autre collyre, attendez 5 à 15 minutes avant d’appliquer le second collyre.
Si vous avez utilisé plus de BRIMAZED 2 mg/mL, collyre en solution en récipient unidose que vous n’auriez dû
Adultes
Chez les adultes ayant instillé plus de gouttes que le nombre prescrit, les effets indésirables rapportés étaient ceux déjà connus avec la brimonidine.
Les adultes ayant accidentellement avalé de la brimonidine en collyre ont présenté une diminution de la pression sanguine, suivi chez certains par une augmentation de cette pression.
Enfants
Des effets indésirables graves ont été rapportés chez les enfants ayant accidentellement avalé de la brimonidine en collyre. Les signes observés comprennent une somnolence, une mollesse, une baisse de la température corporelle, une pâleur et des difficultés respiratoires. Si l'un de ces signes se manifeste, consultez immédiatement votre médecin.
Adultes et enfants
En cas d'ingestion accidentelle de BRIMAZED, ou si vous avez utilisé plus de BRIMAZED que nécessaire, contactez immédiatement votre médecin.
Si vous oubliez d’utiliser BRIMAZED 2 mg/mL, collyre en solution en récipient unidose
Si vous avez oublié de prendre une goutte, instillez la goutte omise le plus tôt possible après l'oubli. Cependant, s'il est presque l'heure de l'instillation suivante, vous ne devez pas prendre la goutte omise et procédez simplement à l'instillation suivante à l'heure habituelle.
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser BRIMAZED 2 mg/mL, collyre en solution en récipient unidose
BRIMAZED doit être utilisé chaque jour pour agir correctement. N'interrompez pas votre traitement sans l'avis de votre médecin.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants peuvent être observés avec un collyre de brimonidine avec conservateur en récipient multidose et pourraient également être observés avec un collyre de brimonidine sans conservateur en récipient unidose :
Effets affectant les yeux
Très fréquent (pouvant affecter plus d’1 personne sur 10):
· Irritation de l'œil (œil rouge, brûlures, picotements, sensation de corps étranger dans l'œil, démangeaisons, follicules ou points blancs sur la membrane transparente qui couvre la surface de l'œil)
· Vision trouble
· Réaction allergique dans l'œil
Fréquent (pouvant affecter jusqu’à 1 personne sur 10):
· Irritation locale (inflammation et gonflement de la paupière, gonflement de la membrane transparente qui couvre la surface de l'œil, œil collé, douleur et larmoiement)
· Sensibilité à la lumière
· Erosion de la surface de l'œil et coloration des larmes
· Sécheresse oculaire
· Blanchiment de la membrane transparente qui couvre la surface de l'œil
· Vision anormale
· Inflammation de la membrane transparente qui couvre la surface de l'œil
Très rare (pouvant affecter jusqu’à 1 personne sur 10 000):
· Inflammation dans l'œil
· Rétrécissement de la pupille
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles):
· Démangeaisons des paupières
· Inflammation de l’iris, c.-à-d. de la partie colorée de l’œil, et du corps ciliaire c.-à-d. des muscles et des tissus impliqués dans la focalisation de l’œil (iridocyclite). Cette affection est également appelée "uvéite antérieure".
Effets affectant le corps entier
Très fréquent (pouvant affecter plus d’1 personne sur 10):
· Maux de tête
· Sécheresse de la bouche
· Fatigue/somnolence
Fréquent (pouvant affecter jusqu’à 1 personne sur 10):
· Vertiges
· Symptômes de rhume
· Symptômes au niveau de l'estomac ou de la digestion
· Altération du goût
· Faiblesse générale
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100):
· Dépression
· Palpitations ou troubles du rythme du cœur
· Sécheresse du nez
· Réactions allergiques générales
Rare (pouvant affecter jusqu’à 1 personne sur 1 000):
· Essoufflement
Très rare (pouvant affecter jusqu’à 1 personne sur 10 000):
· Insomnie
· Evanouissement
· Augmentation de la tension artérielle
· Diminution de la tension artérielle
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles):
· Réactions cutanées incluant rougeur, gonflement du visage, démangeaisons, rash et dilatation des vaisseaux sanguins
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER BRIMAZED 2 mg/mL, collyre en solution en récipient unidose ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Conserver les récipients unidoses dans le sachet en aluminium à l’abri de la lumière.
Ne pas utiliser plus de 3 mois après ouverture du sachet en aluminium.
BRIMAZED ne contient pas de conservateur. Après ouverture, le contenu du récipient unidose devra être utilisé immédiatement. Jetez le reste de la solution du récipient unidose après utilisation.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage extérieur, le sachet et le récipient unidose après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient BRIMAZED 2 mg/mL, collyre en solution en récipient unidose
· La substance active est :
Tartrate de brimonidine.................................................................................................... 2,0 mg
Quantité correspondant à brimonidine base..................................................................... 1,3 mg
Pour 1 mL de collyre en solution.
Une goutte contient 0,06‑0,07 mg de tartrate de brimonidine.
· Les autres composants sont : Poly(alcool vinylique), chlorure de sodium, citrate de sodium, acide citrique monohydraté, eau pour préparations injectables et acide chlorhydrique ou hydroxyde de sodium (pour ajuster le pH).
BRIMAZED se présente sous forme de solution claire, légèrement jaune‑verdâtre. Chaque récipient unidose contient 0,35 mL de solution. Deux rangées de 5 récipients unidoses chacun sont emballés dans un sachet en aluminium laminé.
BRIMAZED est disponible en boîtes de 10, 20, 30, 50, 60, 100 ou 120 récipients unidoses contenant chacun 0,35 mL de solution.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
WERKSSTRASSE 3
92551 STULLN
ALLEMAGNE
Exploitant de l’autorisation de mise sur le marché
HORUS PHARMA
22 ALLÉE CAMILLE MUFFAT
INEDI 5
06200 NICE
WERKSSTRASSE 3
92551 STULLN
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).