Dernière mise à jour le 02/03/2026
PERIKABIVEN, émulsion pour perfusion
Indications thérapeutiques
Il fournit l’énergie (sous forme de graisses et de sucres), ainsi que les acides aminés nécessaires à votre organisme lorsque vous ne pouvez pas vous alimenter normalement.
Il est utilisé dans le cadre d’une alimentation parentérale (intraveineuse) équilibrée, en association à des sels, des oligoéléments et des vitamines, pour couvrir l’ensemble de vos besoins nutritionnels.
Composition en substances actives
-
Compartiment 1 : acides aminés et électrolytes ( Composition pour 300 ml )
- > alanine 4,8 g
- > arginine 3,4 g
- > acide aspartique 1 g
- > acide glutamique 1,7 g
- > glycine 2,4 g
- > histidine 2 g
- > isoleucine 1,7 g
- > leucine 2,4 g
- lysine2,7 g
- sous forme de : chlorhydrate de lysine3,4 g
- > méthionine 1,7 g
- > phénylalanine 2,4 g
- > proline 2 g
- > sérine 1,4 g
- > thréonine 1,7 g
- > tryptophane L 0,57 g
- > tyrosine 0,069 g
- > valine 2,2 g
- chlorure de calcium anhydre0,22 g
- sous forme de : chlorure de calcium0,29 g
- sous forme de : sulfate de magnésium heptahydraté0,99 g
- sous forme de : acétate de sodium trihydraté2,5 g
- > huile de soja raffinée 51 g
- glucose anhydre97 g
- sous forme de : glucose monohydraté107 g
Présentations
> 4 poche(s) polypropylène-co-éthylène suremballée/surpochée de 1920 ml à 3 compartiments
Code CIP : 377 747-9 ou 34009 377 747 9 6
Déclaration de commercialisation : 11/02/2009
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 123,92 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 124,94 €
- Taux de remboursement :65%
> 3 poche(s) polypropylène-co-éthylène suremballée/surpochée de 2400 ml à 3 compartiments
Code CIP : 377 749-1 ou 34009 377 749 1 8
Déclaration de commercialisation : 11/02/2009
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 100,28 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 101,30 €
- Taux de remboursement :65%
> 4 poche(s) polypropylène-co-éthylène suremballée/surpochée de 1440 ml à 3 compartiments
Code CIP : 377 745-6 ou 34009 377 745 6 7
Déclaration de commercialisation : 11/02/2009
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 112,90 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 113,92 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 07/02/2018 | Renouvellement d'inscription (CT) | Le service médical rendu par KABIVEN et PERIKABIVEN reste important pour la nutrition parentérale à domicile dans l’indication de l’AMM et administrées par voie centrale. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 25/06/2008 | Inscription (CT) | Ces spécialités sont des compléments de gamme qui n'apportent pas d'amélioration du service médical rendu. |
ANSM - Mis à jour le : 24/11/2023
PERIKABIVEN, émulsion pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Ce médicament se présente sous la forme d’une poche à 3 compartiments. Il existe trois présentations dont les différents volumes sont les suivants :
|
Volume total de la poche trois compartiments |
2400 ml |
1920 ml |
1440 ml |
|
Volumes respectifs de chaque compartiment : |
|||
|
Glucose (glucose 11%) |
1475 ml |
1180 ml |
885 ml |
|
Acides aminés et électrolytes (Vamin 18 Novum) |
500 ml |
400 ml |
300 ml |
|
Emulsion lipidique (Intralipide 20%) |
425 ml |
340 ml |
255 ml |
Ce qui correspond aux compositions complètes suivantes :
|
Principes actifs |
2400 ml |
1920 ml |
1440 ml |
|
Huile de soja purifiée |
85 g |
68 g |
51 g |
|
Glucose monohydraté |
178 g |
143 g |
107 g |
|
équivalent à Glucose anhydre |
162 g |
130 g |
97 g |
|
Alanine |
8,0 g |
6,4 g |
4,8 g |
|
Arginine |
5,6 g |
4,5 g |
3,4 g |
|
Acide Aspartique |
1,7 g |
1,4 g |
1,0 g |
|
Acide Glutamique |
2,8 g |
2,2 g |
1,7 g |
|
Glycine |
4,0 g |
3,2 g |
2,4 g |
|
Histidine |
3,4 g |
2,7 g |
2,0 g |
|
Isoleucine |
2,8 g |
2,2 g |
1,7 g |
|
Leucine |
4,0 g |
3,2 g |
2,4 g |
|
Chlorhydrate de Lysine |
5,6 g |
4,5 g |
3,4 g |
|
équivalent à Lysine |
4,5 g |
3,6 g |
2,7 g |
|
Méthionine |
2,8 g |
2,2 g |
1,7 g |
|
Phénylalanine |
4,0 g |
3,2 g |
2,4 g |
|
Proline |
3,4 g |
2,7 g |
2,0 g |
|
Sérine |
2,2 g |
1,8 g |
1,4 g |
|
Thréonine |
2,8 g |
2,2 g |
1,7 g |
|
Tryptophane |
0,95 g |
0,76 g |
0,57 g |
|
Tyrosine |
0,12 g |
0,092 g |
0,069 g |
|
Valine |
3,6 g |
2,9 g |
2,2 g |
|
|
|
|
|
|
Chlorure de calcium (sous forme dihydratée) |
0,37 g |
0,30 g |
0,22 g |
|
Glycérophosphate de sodium (sous forme hydratée) |
2,5 g |
2,0 g |
1,5 g |
|
|
|
|
|
|
sulfate de magnésium (Sous forme heptahydratée) |
0,80 g |
0,64 g |
0,48 g |
|
Chlorure de potassium |
3,0 g |
2,4 g |
1,8 g |
|
|
|
|
|
|
acétate de sodium (sous forme trihydratée) |
2,4 g |
2,0 g |
1,5 g |
|
Quantité correspondant à :
|
2 400 ml |
1 920 ml
|
1 440 ml
|
|
Acides aminés : |
57 g |
45 g |
34 g |
|
Azote : |
9,0 g |
7,2 g |
5,4 g |
|
Lipides : |
85 g |
68 g |
51 g |
|
Glucides : · Glucose (anhydre) |
162 g |
130 g |
97 g |
|
Apport calorique : |
|
|
|
|
· total (environ) |
1 700 kcal |
1 400 kcal |
1 000 kcal |
|
· non-protéique (environ) |
1 500 kcal |
1 200 kcal |
900 kcal |
|
Electrolytes : |
|
|
|
|
· sodium |
53 mmol |
43 mmol |
32 mmol |
|
· potassium |
40 mmol |
32 mmol |
24 mmol |
|
· magnésium |
6,7 mmol |
5,3 mmol |
4,0 mmol |
|
· calcium |
3,3 mmol |
2,7 mmol |
2,0 mmol |
|
· phosphate1 |
18 mmol |
14 mmol |
11 mmol |
|
· sulfate |
6,7 mmol |
5,3 mmol |
4,0 mmol |
|
· chlorure |
78 mmol |
62 mmol |
47 mmol |
|
· acétate |
65 mmol |
52 mmol |
39 mmol |
· Osmolalité : environ 830 mosmol/kg d’eau
· Osmolarité : environ 750 mosmol/l
· pH : environ 5,6.
1 apportés par Intralipide et Vamin
Pour la liste complète des excipients, voir rubrique 6.1.
PERIKABIVEN est constitué d’une poche à trois compartiments.
Chaque compartiment contient respectivement une solution de glucose, une solution d’acides aminés et une émulsion lipidique. Les solutions de glucose et d’acides aminés sont limpides et incolores à légèrement jaunes, et l’émulsion lipidique est blanche et homogène.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
La capacité des patients à éliminer les lipides et à métaboliser le glucose déterminera la posologie et le débit de perfusion, voir rubrique 4.4.
La dose administrée doit être individualisée et le choix du volume de poche doit être fait en fonction de l’état clinique du patient, du poids corporel et des besoins nutritionnels.
Chez l’adulte
Les besoins en azote pour maintenir la masse protéique corporelle dépendent de l’état clinique du patient (exemple : l’état nutritionnel et le degré de catabolisme lié au stress). Les besoins sont de 0,10-0,15 g d’azote/kg de poids corporel/jour pour un état nutritionnel normal. Pour les patients dans un état de stress métabolique modéré à élevé et présentant ou non une malnutrition, les besoins sont de l’ordre de 0,15-0,30 g d’azote par kg de poids corporel/jour (1,0-2,0 g d’acides aminés par kg de poids corporel/jour). Les besoins habituellement estimés en glucose et en lipide sont de 2,0-6,0 g pour le glucose et de 1,0-2,0 g pour les lipides par kilo de poids corporel/jour.
Les besoins énergétiques totaux dépendent de l’état clinique du patient et sont le plus souvent compris entre 20-30 kcal/kg de poids corporel/jour. Chez les patients obèses les apports doivent être basés sur le poids idéal estimé.
PeriKabiven existe sous trois présentations destinées aux patients dont les besoins nutritionnels sont modérément augmentés, de base ou peu élevés. Dans le cadre d’une nutrition parentérale totale, il peut être nécessaire d’apporter en complément des oligo-éléments, des vitamines et des électrolytes.
La dose de 0,10-0,15 g d’azote/kg de poids corporel/jour (0,7-1,0 g d’acides aminés par kg de poids corporel/jour) et un apport énergétique total de 20-30 kcal/kg de poids corporel/jour correspondent à environ 27-40 ml de PeriKabiven par kg de poids corporel/jour.
Population pédiatrique
La capacité à métaboliser les nutriments doit déterminer la posologie.
Généralement, pour les jeunes enfants (2-10 ans), la perfusion doit débuter avec une posologie faible telle que 14-28 ml/kg (ce qui correspond à 0,49-0,98 g de lipide/kg/j, 0,34-0,67 g d’acides aminés/kg/jour et 0,95-1,9 g de glucose/kg/jour) puis sera augmentée par palier de 10-15 ml/kg/jour jusqu’à une posologie maximale de 40 ml/kg/jour.
Pour les enfants âgés de plus de 10 ans, la posologie adulte peut être utilisée.
Pour les enfants de moins de 2 ans, l’utilisation de PeriKabiven n’est pas recommandée en raison de l’absence de cystéine qui peut être considéré comme un acide aminé essentiel.
Débit de perfusion
Le débit de perfusion maximum pour le glucose est de 0,25 g/kg/heure. L’apport d’acides aminés ne doit pas dépasser 0,1 g/kg/heure. L’apport de lipides ne doit pas dépasser 0,15 g/kg/heure.
Le débit de perfusion de cette émulsion ne doit pas dépasser 3,7 ml/kg de poids corporel/heure (correspondant à 0,25 g de glucose ; 0,09 g d’acides aminés et 0,13 g de lipides/kg de poids corporel).
La durée de perfusion recommandée d’une poche de PeriKabiven est de 12 à 24 heures.
Posologie journalière maximale
Elle est de 40 ml/kg/jour. Ceci correspond à l’administration d’une poche (de la plus grande contenance) pour un patient de 64 kg qui recevra 0,96 g d’acides aminés/kg/jour (0,16 g d’azote/kg/jour), un apport calorique non-protéique de 25 kcal/kg/jour (2,7 g de glucose/kg/jour et 1,4 g de lipide/kg/jour).
La posologie journalière maximale varie en fonction de l’état clinique du patient et peut même être modifiée d’un jour à l’autre.
Mode d’administration
PERFUSION PAR VEINE CENTRALE OU PERIPHERIQUE
L’administration pourra être poursuivie aussi longtemps que l’état clinique du patient le rendra nécessaire.
Afin de diminuer le risque de thrombophlébite (en veine périphérique), il est conseillé de changer quotidiennement le site de perfusion.
· Hyperlipidémie sévère
· Insuffisance hépatique sévère
· Troubles sévères de la coagulation sanguine
· Anomalies congénitales du métabolisme des acides aminés
· Insuffisance rénale sévère sans possibilité d’hémofiltration ou de dialyse
· Etat de choc en phase aiguë
· Hyperglycémie nécessitant l’administration de plus de 6 unités d’insuline/heure.
· Taux plasmatiques élevés et pathologiques de l’un des électrolytes inclus dans le produit.
· Syndrome d’activation macrophagique.
· Contre-indications générales d’un traitement par perfusion : œdème pulmonaire aigu, hyperhydratation, insuffisance cardiaque décompensée, et déshydratation hypotonique.
· Etats instables, par exemple : état post-traumatique sévère, diabète décompensé, phase aiguë d’infarctus du myocarde, acidose métabolique, infection sévère et coma hyperosmolaire.
· Nouveau-né et enfant de moins de 2 ans d’âge.
4.4. Mises en garde spéciales et précautions d'emploi
La taille de la poche, en particulier son volume et sa composition quantitative doivent être choisis soigneusement en fonction du statut hydrique et nutritionnel de l’enfant. La poche reconstituée est à usage unique.
Les troubles de la balance hydro-électrolytique (à savoir des taux plasmatiques anormalement élevés ou anormalement bas d’électrolytes) doivent être corrigés avant de commencer la perfusion.
Une surveillance clinique particulière est nécessaire au début de toute perfusion intraveineuse. La perfusion doit être arrêtée en cas d’apparition de tout signe anormal. En raison de l’augmentation du risque infectieux lié à l’utilisation d’une veine centrale, des précautions d’asepsie strictes devront être prises pour éviter toute contamination lors de l’insertion ou de la manipulation du cathéter.
PERIKABIVEN doit être administré avec précaution chez les patients ayant un métabolisme lipidique altéré pouvant survenir chez les patients souffrant d’insuffisance rénale, de diabète sucré incontrôlé, de pancréatite, de fonction hépatique altérée, d’hypothyroïdisme (avec hypertriglycéridémie) et de septicémie. Une surveillance attentive des triglycérides est nécessaire en cas d’administration de PERIKABIVEN chez ce type de patients.
La glycémie, les électrolytes et l’osmolarité ainsi que la balance hydro-électrolytique, l’équilibre acido-basique et les tests de la fonction hépatique (phosphatases alcalines, ASAT, ALAT) doivent être surveillés régulièrement.
La numération globulaire et les facteurs de coagulation devront être surveillés si les lipides sont administrés sur une longue période.
Chez les insuffisants rénaux, les apports en phosphate et en potassium doivent être contrôlés soigneusement pour prévenir une hyperphosphatémie et une hyperkaliémie.
Les apports individuels en électrolytes, qui doivent être réalisés en complément, dépendent de l’état clinique du patient et de la surveillance fréquente des taux plasmatiques.
Cette émulsion ne contient pas de vitamines ni oligo-éléments. Un apport complémentaire d’oligo-éléments et de vitamines est toujours nécessaire.
La nutrition parentérale doit être réalisée avec précaution en cas d’acidose métabolique, (exemple : acidose lactique), d’augmentation de l’osmolarité sérique et chez les patients qui nécessitent l’administration de solutions de remplissage en réanimation.
PERIKABIVEN doit être administré avec précaution aux patients ayant une tendance à la rétention hydro-électrolytique.
Tout signe ou symptôme de réaction anaphylactique (tel que fièvre, frissons, éruption cutanée ou dyspnée) doit conduire à l’arrêt immédiat de la perfusion.
Les lipides contenus dans PERIKABIVEN peuvent interférer avec les résultats de certains examens de laboratoire (par exemple : bilirubine, lactate déshydrogénase, saturation en oxygène, hémoglobinémie) si le prélèvement sanguin est réalisé avant que les lipides aient été éliminés du torrent sanguin de façon adéquate. Les lipides sont éliminés après une période sans apport de lipides de 5 à 6 heures chez la plupart des patients.
Ce médicament contient de l’huile de soja et des phospholipides d’œufs, qui peuvent provoquer de rares réactions allergiques. Des réactions d’allergie croisée ont été observées entre le soja et l’arachide.
La perfusion intraveineuse d’acides aminés s’accompagne d’une augmentation de l’excrétion urinaire de certains oligo-éléments comme le cuivre et, plus particulièrement le zinc. Un apport complémentaire en oligo-éléments peut être nécessaire particulièrement chez les patients en nutrition intraveineuse de longue durée.
Chez les patients dénutris, la mise en place d’une nutrition parentérale peut aggraver un déséquilibre liquidien et entraîner un œdème pulmonaire ou une syncope congestive.
De plus, une diminution de la concentration plasmatique en potassium, phosphore, magnésium et vitamines hydrosolubles peut survenir dans les 24 à 48 heures. C’est pourquoi il est recommandé de commencer la nutrition parentérale lentement et avec précaution ainsi que d’assurer une surveillance attentive et un ajustement approprié des liquides, électrolytes, éléments minéraux et vitamines.
PERIKABIVEN ne doit pas être administré simultanément avec du sang ou des produits sanguins par la même tubulure de perfusion en raison d’un risque de pseudo-agglutination.
Chez les patients en hyperglycémie, l’administration d’insuline exogène peut être nécessaire.
Perfusion en veine périphérique
Comme pour toute solution hypertonique, des thrombophlébites peuvent se produire si les veines périphériques sont utilisées pour réaliser des perfusions intraveineuses. Plusieurs facteurs contribuent à la survenue des thrombophlébites. Parmi ceux-ci interviennent le type de cathéter utilisé, son diamètre et sa longueur, la durée de perfusion, le pH et l’osmolarité du mélange à perfuser, l’état infectieux et le nombre des manipulations.
Il est recommandé de ne pas utiliser les sites d’accès veineux de la nutrition parentérale pour administrer d’autres additifs ou solutions.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Certains médicaments tels que l’insuline, peuvent influencer l’activité lipasique. Cependant, ce type d’interaction semble n’avoir que peu de signification sur le plan clinique.
L’huile de soja renferme naturellement de la vitamine K1 qui pourrait avoir un effet sur la coagulation en particulier chez les patients traités avec des dérivés de la coumarine. Cette situation est rare en pratique mais dans ce cas il est recommandé d’effectuer une étroite surveillance des facteurs de coagulation chez les patients traités par de tels médicaments.
Il n’existe aucune donnée montrant que les interactions mentionnées ci-dessus aient une quelconque conséquence clinique.
4.6. Fertilité, grossesse et allaitement
Aucune donnée permettant d’évaluer la sécurité de PERIKABIVEN chez la femme enceinte et lors de l’allaitement n’est disponible. Le prescripteur doit évaluer le rapport bénéfice/risque avant d’administrer PERIKABIVEN en cas de grossesse ou d’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
|
|
Fréquents >1/100 à <1/10 |
Peu fréquents >1/1000 à <1/100 |
Très rares <1/10000 |
|
Troubles sanguin et du système lymphatique |
|
|
Hémolyse, réticulocytose |
|
Troubles respiratoires, thoraciques et médiastinaux |
|
|
Tachypnée |
|
Troubles gastro-intestinaux |
|
Douleurs abdominales, nausées, vomissements |
|
|
Troubles du système immunitaire |
|
|
Réactions d’hypersensibilité (réaction anaphylactique, rash cutané, urticaire) |
|
Investigations |
|
Augmentation des taux plasmatiques d’enzymes hépatiques |
|
|
Troubles du système nerveux |
|
Maux de tête |
|
|
Troubles génitaux et mammaires |
|
|
Priapisme |
|
Troubles vasculaires |
Thrombophlébites |
|
Hypotension, hypertension |
|
Troubles généraux et anomalies au site d’administration |
Élévation de la température corporelle |
Frissons, fatigue |
|
Comme avec toute solution hypertonique des thrombophlébites peuvent apparaître dans le cas d’une administration par veine périphérique.
Syndrome de surcharge graisseuse
Une diminution de la capacité d’élimination des lipides (contenus dans PERIKABIVEN) peut conduire à un « syndrome de surcharge graisseuse » qui peut avoir pour origine un surdosage, mais qui peut également, au débit de perfusion recommandé, être associé à une brusque modification de l’état clinique du patient, telle qu’une altération de la fonction rénale ou hépatique.
La survenue d’un syndrome de surcharge graisseuse se caractérise par : hyperlipidémie, fièvre, hépatomégalie, splénomégalie, anémie, leucopénie, thrombocytopénie, troubles de la coagulation et coma.
Tous ces symptômes sont réversibles si la perfusion de l’émulsion lipidique est interrompue.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Voir rubrique 4.8 « Syndrome de surcharge graisseuse ».
Nausées, vomissements et sudation excessive ont été observés lors de la perfusion d’acides aminés à des débits dépassant le débit maximal recommandé.
Si les symptômes de surcharge apparaissaient, la perfusion doit être ralentie ou interrompue.
De plus, un surdosage peut entraîner une surcharge liquidienne, un déséquilibre de la balance électrolytique, une hyperglycémie et une hyperosmolarité.
Dans les rares cas sévères, une hémodialyse, une hémofiltration ou une hémo-diafiltration peuvent être nécessaires.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : solution pour nutrition parentérale, code ATC : B05BA10.
Lipides
L’émulsion lipidique utilisée dans PERIKABIVEN, apporte des acides gras à chaîne longue essentiels et non essentiels, nécessaires au métabolisme énergétique et à l’intégrité structurelle des membranes cellulaires.
A la dose recommandée, cette émulsion lipidique n’entraîne pas de modifications hémodynamiques. Aucune modification clinique significative de la fonction pulmonaire n’a été décrite quand l’émulsion lipidique est utilisée de façon adéquate.
L’augmentation transitoire des enzymes hépatiques observée chez certains patients sous nutrition parentérale est réversible et disparaît à l’arrêt de la nutrition parentérale. Des modifications similaires ont aussi été observées en nutrition parentérale n’apportant pas d’émulsion lipidique.
Acides aminés et électrolytes
Les acides aminés, constituants des protéines de l’alimentation, sont utilisés pour la synthèse du tissu protéique et tout excès est orienté vers la néoglucogenèse. Les perfusions d’acides aminés entraînent de faibles augmentations du métabolisme et de la thermogenèse.
Glucose
Le glucose n’a pas d’effet pharmacodynamique, hormis celui de contribuer à maintenir une homéostasie normale.
5.2. Propriétés pharmacocinétiques
L’émulsion lipidique contenue dans PeriKabiven a des propriétés biologiques similaires à celles des chylomicrons endogènes. Contrairement aux chylomicrons, elle ne contient pas d’esters du cholestérol ou d’apolipoprotéines, tandis que son contenu en phospholipides est significativement plus élevé.
L’émulsion lipidique est éliminée de la circulation sanguine par une voie similaire à celle des chylomicrons endogènes. Les particules lipidiques exogènes sont d’abord hydrolisées au niveau de la circulation et transportées jusqu’aux récepteurs LDL au niveau périphérique et au foie. Le taux d’élimination est fonction de la composition des particules lipidiques, du statut nutritionnel et clinique du patient et du débit de perfusion.
Chez les volontaires sains, la clairance maximale de l’émulsion lipidique contenue dans PeriKabiven après une nuit de jeûne est équivalente à 3,8 ± 1,5 g de triglycérides par kg de poids corporel et par 24 heures.
Les taux d’élimination et d’oxydation dépendent de l’état clinique des patients : l’élimination est plus rapide et l’oxydation est augmentée dans les états infectieux et traumatiques, tandis que les patients atteints d’insuffisance rénale ou d’hypertriglycéridémie montrent une élimination et une oxydation ralenties.
Acides aminés et électrolytes
Le principe des propriétés pharmacocinétiques des acides aminés et des électrolytes administrés par la voie intraveineuse est essentiellement le même que pour les acides aminés et les électrolytes apportés par l’alimentation orale. Cependant, les acides aminés des protéines de l’alimentation passent d’abord par la veine porte puis dans la circulation systémique, tandis que les acides aminés administrés par voie intraveineuse atteignent directement la circulation systémique.
Glucose
Les propriétés pharmacocinétiques du glucose sont essentiellement les mêmes que celles du glucose apporté dans l’alimentation.
5.3. Données de sécurité préclinique
2 ans, lorsque la poche est conservée dans son suremballage.
Durée de conservation après mélange des compartiments
Après rupture des soudures délimitant les compartiments, il a été démontré que le mélange était chimiquement et physiquement stable 48 heures à une température de 20- 25°C, incluant la durée d’administration. Toutefois du point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, la durée et les conditions de conservation avant utilisation relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C, sauf si les mélanges ont été effectués en conditions d’asepsie dûment contrôlées et validées.
Durée de conservation après mélange avec des additifs
Après ouverture des soudures pelables et mélange des trois solutions, des additifs peuvent être ajoutés par l’intermédiaire du site de supplémentation.
La stabilité physicochimique dans la poche à trois compartiments après mélange avec des additifs (voir section 6.6) a été démontrée pendant 8 jours, c'est-à-dire 6 jours à 2°-8°C suivis de 48 heures à 20-25°C, incluant la durée d'administration. Du point de vue microbiologique, le produit doit être utilisé immédiatement quand un ajout a été effectué. En cas d’utilisation non immédiate, les durées et conditions de conservation avant administration relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C sauf si les mélanges ont été effectués en conditions d'asepsie dûment contrôlées et validées
6.4. Précautions particulières de conservation
6.5. Nature et contenu de l'emballage extérieur
Le récipient est constitué d’une poche multi-compartiment et d’un suremballage. La poche est divisée en trois compartiments par des soudures pelables. Un absorbeur d’oxygène est placé entre la poche et le suremballage.
Le matériau constitutif de la poche est un film polymère multicouches en polymère Biofine.
Le film Biofine de la poche est en poly (propylène-co-éthylène), caoutchouc synthétique poly [styrène-bloc-(butylène-co-éthylène)] (SEBS) et caoutchouc synthétique poly (styrène-bloc-isoprène) SIS. Les sites de perfusion et de supplémentation sont en polypropylène et en caoutchouc synthétique poly [stryrène-block-(butylène-co-éthylène)] (SEBS) munis de bouchons synthétiques en polyisoprène (sans latex). Le site condamné, utilisé uniquement lors de la fabrication, est en polypropylène muni d’un bouchon synthétique en polyisoprène (sans latex).
Tailles de conditionnement : poches Excel ou Biofine :
Boîte de 1 ou 4 poches de 1440 ml
Boîte de 1 poche de 1920 ml ou 4 poches de 1920 ml
Boîte de 1 poche de 2400 ml ou 3 poches de 2400 ml
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
A usage unique.
Ne pas utiliser si l’emballage est défectueux. Les contenus des trois compartiments doivent être mélangés avant administration.
Après séparation des soudures pelables, la poche doit être retournée plusieurs fois pour s’assurer que le mélange est homogène.
N’utiliser la poche à trois compartiments que si les solutions d’acides aminés et de glucose sont limpides et incolores à légèrement jaunes et l’émulsion lipidique blanche et homogène.
COMPATIBILITE :
Des données de compatibilité sont disponibles avec les produits nommés Dipeptiven, Suppliven, Glycophos, Addiphos, Vitalipide Adultes/Enfants et Soluvit en quantités définies et avec des électrolytes en concentrations définies. Lors des ajouts d'électrolytes, les quantités déjà présentes dans la poche doivent être prises en compte pour répondre aux besoins cliniques du patient. Les données générées obtenues justifient les ajouts dans la poche indiqués dans le tableau récapitulatif ci-dessous :
Intervalle de compatibilité : stable pendant 8 jours, c'est-à-dire 6 jours de stockage à 2-8°C suivis de 48 heures à 20-25°C
|
|
Unités |
Quantité maximale totale |
||
|
Taille de la poche de Perikabiven |
ml |
1440 |
1920 |
2400 |
|
Additif |
|
Volume |
||
|
Dipeptiven |
ml |
0 - 200 |
0 - 300 |
0 - 300 |
|
Suppliven |
ml |
0 - 10 |
0 - 10 |
0 - 10 |
|
Soluvit |
flacon |
0 - 1 |
0 - 1 |
0 - 1 |
|
Vitalipide Adultes/Enfants |
ml |
0 - 10 |
0 - 10 |
0 - 10 |
|
Electrolytes1 |
|
Quantité par poche |
||
|
Sodium |
mmol |
≤ 216 |
≤ 288 |
≤ 360 |
|
Potassium |
mmol |
≤ 216 |
≤ 288 |
≤ 360 |
|
Calcium |
mmol |
≤ 7,2 |
≤ 9,6 |
≤ 12 |
|
Magnésium |
mmol |
≤ 7,2 |
≤ 9,6 |
≤ 12 |
|
Phosphate inorganique (Addiphos) OU Phosphate organique (Glycophos) |
mmol |
≤ 22 |
≤ 29 |
≤ 36 |
1 inclut les quantités de tous les produits
Remarque : ce tableau est destiné à indiquer la compatibilité. Il ne s'agit pas de recommandations posologiques.
Pour les médicaments cités, avant de prescrire, se référer aux informations de prescription approuvées au niveau national.
La compatibilité avec d’autres additifs et la durée de conservation de divers mélanges seront communiquées sur demande.
Tout ajoutdoit être réalisée dans des conditions aseptiques.
Tout mélange restant après la perfusion d’une poche doit être jeté
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
5, PLACE DU MARIVEL
92316 SEVRES CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 377 743 3 8: 1440 ml en poche à trois compartiments (Polypropylène-co-éthylène) ; boîte de 1
· 34009 377 745 6 7: 1440 ml en poche à trois compartiments (Polypropylène-co-éthylène) ; boîte de 4
· 34009 377 746 2 8: 1920 ml en poche à trois compartiments (Polypropylène-co-éthylène) ; boîte de 1
· 34009 377 747 9 6: 1920 ml en poche à trois compartiments (Polypropylène-co-éthylène) ; boîte de 4
· 34009 377 748 5 7: 2400 ml en poche à trois compartiments (Polypropylène-co-éthylène) ; boîte de 1
· 34009 377 749 1 8: 2400 ml en poche à trois compartiments (Polypropylène-co-éthylène) ; boîte de 3
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 24/11/2023
PERIKABIVEN, émulsion pour perfusion
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que PERIKABIVEN, émulsion pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser PERIKABIVEN, émulsion pour perfusion ?
3. Comment utiliser PERIKABIVEN, émulsion pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver PERIKABIVEN, émulsion pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE PERIKABIVEN, émulsion pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Il fournit l’énergie (sous forme de graisses et de sucres), ainsi que les acides aminés nécessaires à votre organisme lorsque vous ne pouvez pas vous alimenter normalement.
Il est utilisé dans le cadre d’une alimentation parentérale (intraveineuse) équilibrée, en association à des sels, des oligoéléments et des vitamines, pour couvrir l’ensemble de vos besoins nutritionnels.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER PERIKABIVEN, émulsion pour perfusion ?
N’utilisez jamais PERIKABIVEN, émulsion pour perfusion :
· si vous êtes allergique aux substances actives ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous êtes allergique aux produits contenant de l’œuf, du soja ou de l’arachide
· si vous avez trop de lipides (comme le cholestérol) dans le sang
· si le fonctionnement de votre foie (fonction hépatique) est gravement perturbé
· si vous souffrez de choc aigu (résultant d’une perte sanguine importante ou d'une réaction allergique)
· si vous souffrez de troubles de la coagulation (syndrome hémophagocytaire) ou si votre sang ne coagule pas bien
· si vous avez une maladie qui empêche votre corps d’utiliser correctement les protéines ou les acides aminés
· si vous avez de graves problèmes rénaux
· si vous souffrez d’hyperglycémie (trop de sucre dans le sang), nécessitant l’administration de plus de 6 unités d’insuline par heure
· si vous avez des concentrations élevées d'électrolytes (sels) dans le sang
· si vous êtes atteint(e) d’acidose métabolique (les concentrations d’acides deviennent trop élevées dans les liquides et les tissus du corps)
· si vous avez trop de liquide dans le corps (hyperhydratation)
· si vous avez du liquide dans les poumons (œdème pulmonaire aigu)
· si vous souffrez de déshydratation associée à des concentrations faibles en sels
· si vous avez des problèmes cardiaques
· si vous êtes dans le coma
· si vous avez un sepsis sévère (situation dans laquelle l'organisme combat une infection sévère)
Avertissements et précautions
Adressez-vous à votre médecin, à votre pharmacien ou à votre infirmier/ère avant d’utiliser PERIKABIVEN, émulsion pour perfusion si vous souffrez des maladies suivantes :
· insuffisance hépatique
· diabète non-traité
· maladie empêchant votre corps d’utiliser correctement les graisses
· troubles rénaux
· troubles pancréatiques
· problèmes de thyroïde - hypothyroïdie
· sepsis (situation dans laquelle l'organisme combat une infection sévère)
· problèmes d’élimination des électrolytes
· maladie conduisant à une insuffisance d’apport en oxygène pour les cellules de l’organisme
· augmentation de l’osmolarité sérique
Si, pendant la perfusion, vous constatez de la fièvre, une éruption cutanée, des frissons ou des difficultés à respirer, signalez-le immédiatement au professionnel de santé responsable de vous car ces symptômes peuvent être dus à une réaction allergique ou signifier que vous avez reçu trop de médicament (voir rubrique 4).
Ce médicament peut interférer sur les résultats d’autres examens ou analyses que vous pourriez effectuer. Il est donc essentiel d’avertir le médecin effectuant ces examens ou analyses que vous utilisez PERIKABIVEN.
Votre médecin vous demandera peut-être d’effectuer régulièrement des analyses sanguines pour vérifier l’efficacité du traitement par PERIKABIVEN.
Enfants
PERIKABIVEN ne doit pas être utilisé chez le nouveau-né ou l’enfant de moins de deux ans
Autres médicaments et PERIKABIVEN, émulsion pour perfusion
Informez votre médecin ou votre pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Vous devez informer votre médecin si vous utilisez un des médicaments suivants :
· héparine, destinée à empêcher la formation des caillots sanguins et contribuer à leur dispersion
· warfarine, en raison de l’interférence possible de la vitamine K1, contenue dans l’huile de soja, sur la capacité de coagulation
· insuline, pour le traitement du diabète
PERIKABIVEN, émulsion pour perfusion avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Il n'existe pas de données sur l'utilisation de PERIKABIVEN chez la femme enceinte ou en cours d’allaitement. Par conséquent, ce médicament ne sera prescrit qu'avec prudence chez une femme enceinte ou allaitant, uniquement si l’alimentation parentérale (par perfusion dans une veine) s’avère absolument nécessaire.
Conduite de véhicules et utilisation de machines
Sans objet.
PERIKABIVEN, émulsion pour perfusion contient
Sans objet.
3. COMMENT UTILISER PERIKABIVEN, émulsion pour perfusion ?
Vous recevrez le produit par perfusion « goutte-à-goutte » intraveineux.
La dose de PERIKABIVEN et la taille de la poche utilisée dépendront de votre poids corporel en kilogrammes et de la capacité de votre corps à utiliser les graisses et les sucres. PERIKABIVEN sera perfusé lentement pendant une période de 12 à 24 heures. Votre médecin décidera de la dose la plus appropriée à vous administrer ou à administrer à votre enfant.
Vous pourrez faire l’objet d’une surveillance pendant votre traitement.
Utilisation chez les enfants
PERIKABIVEN ne convient pas au nouveau-né ou à l’enfant de moins de deux ans
Si vous avez utilisé plus de PERIKABIVEN, émulsion pour perfusion que vous n’auriez dû
Il est très improbable que vous receviez une perfusion d’un volume plus important que vous n’auriez dû puisque votre médecin ou votre infirmière vous surveilleront pendant le traitement. Les effets d’un surdosage peuvent se manifester par des nausées, des vomissements, des sueurs et une rétention de liquides. On a également décrit des cas d’hyperglycémie (trop de sucre dans le sang) et de déséquilibre électrolytique. Le surdosage peut s’accompagner d’un risque d’apports excessifs de graisses. Il s’agit alors d’un « syndrome de surcharge graisseuse ». Pour plus d’informations, voir la rubrique 4 « Quels sont les effets indésirables éventuels ». Si vous ressentez un des effets mentionnés ci-dessus ou si vous pensez avoir reçu trop de PERIKABIVEN, veuillez en informer immédiatement votre médecin ou votre infirmière. La perfusion pourra alors être arrêtée immédiatement ou poursuivie à dose réduite. Ces symptômes disparaissent généralement après arrêt ou diminution du débit de la perfusion
Si vous oubliez d’utiliser PERIKABIVEN, émulsion pour perfusion
Si vous arrêtez d’utiliser PERIKABIVEN, émulsion pour perfusion
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Très rarement (qui peuvent affecter jusqu’à 1 patient sur 10 000), PERIKABIVEN peut provoquer une réaction allergique. Informez immédiatement votre médecin si :
· une éruption bulleuse et prurigineuse (qui provoque des démangeaisons) apparaît sur votre corps
· vous avez une très forte fièvre
· vous avez des difficultés à respirer
Effets indésirables fréquents (qui peuvent affecter jusqu’à 1 patient sur 100)
· légère augmentation de la température corporelle
· inflammation de la veine dans laquelle la perfusion est administrée
Effets indésirables peu fréquents (qui peuvent affecter jusqu’à 1 patient sur 100)
· frissons
· fatigue
· douleur à l’estomac
· maux de tête
· nausées ou vomissements
· augmentation des enzymes hépatiques. Si cela se produit, votre médecin en discutera avec vous.
Effets indésirables très rares (qui peuvent affecter jusqu’à 1 patient sur 10 000)
· augmentation ou diminution de la pression artérielle
· difficultés à respirer
· chez l’homme, érections prolongées et douloureuses
· problèmes sanguins
Syndrome de surcharge graisseuse
Ce syndrome peut se produire si votre organisme ne parvient pas à utiliser correctement les graisses et que vous avez reçu trop de PERIKABIVEN. Il peut également survenir lors d’une variation brutale de votre état de santé (par exemple, apparition de problèmes rénaux ou d’une infection). Ce syndrome peut se manifester par une fièvre, des concentrations élevées de lipides (graisses) dans le sang, les cellules et les tissus, ainsi que des perturbations au niveau des organes, voire un coma. Tous ces symptômes disparaissent généralement à l’arrêt de la perfusion.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER PERIKABIVEN, émulsion pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la poche après EXP. La date de péremption fait référence au dernier jour de ce mois.
Votre médecin et le pharmacien hospitalier sont responsables de la conservation, de l’utilisation et de l’élimination appropriées de Perikabiven.
A conserver à une température ne dépassant pas 25°C. Ne pas congeler et conserver le conditionnement primaire dans l’emballage extérieur.
Ne pas utiliser en cas de fuite au niveau de la poche.
Ce médicament est à usage unique. Tout mélange restant après la perfusion doit être éliminé.
N’utilisez pas ce médicament si vous remarquez des signes visibles de détérioration.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient PERIKABIVEN, émulsion pour perfusion
Perikabiven se présente sous forme d’une poche à 3 compartiments. Il existe trois présentations dont les différents volumes sont les suivants (chaque ligne du tableau correspond aux volumes respectifs de chaque compartiment) :
|
|
2 400 ml |
1 920 ml |
1 440 ml |
|
Glucose (Glucose 11%) |
1 475 ml |
1 180 ml |
885 ml |
|
Acides aminés et électrolytes (Vamin 18 Novum) |
500 ml |
400 ml |
300 ml |
|
Emulsion lipidique (Intralipid 20%) |
425 ml |
340 ml |
255 ml |
|
Les substances actives sont : |
|
|
|
|
Huile de soja purifiée |
85 g |
68 g |
51 g |
|
Glucose monohydraté |
178 g |
143 g |
107 g |
|
équivalent à glucose (anhydre) |
162 g |
130 g |
97 g |
|
Alanine |
8,0 g |
6,4 g |
4,8 g |
|
Arginine |
5,6 g |
4,5 g |
3,4 g |
|
Acide aspartique |
1,7 g |
1,4 g |
1,0 g |
|
Acide glutamique |
2,8 g |
2,2 g |
1,7 g |
|
Glycine |
4,0 g |
3,2 g |
2,4 g |
|
Histidine |
3,4 g |
2,7 g |
2,0 g |
|
Isoleucine |
2,8 g |
2,2 g |
1,7 g |
|
Leucine |
4,0 g |
3,2 g |
2,4 g |
|
Chlorhydrate de lysine |
5,6 g |
4,5 g |
3,4 g |
|
équivalent à lysine |
4,5 g |
3,6 g |
2,7 g |
|
Méthionine |
2,8 g |
2,2 g |
1,7 g |
|
Phénylalanine |
4,0 g |
3,2 g |
2,4 g |
|
Proline |
3,4 g |
2,7 g |
2,0 g |
|
Sérine |
2,2 g |
1,8 g |
1,4 g |
|
Thréonine |
2,8 g |
2,2 g |
1,7 g |
|
Tryptophane |
0,95 g |
0,76 g |
0,57 g |
|
Tyrosine |
0,12 g |
0,092 g |
0,069 g |
|
Valine |
3,6 g |
2,9 g |
2,2 g |
|
|
|
|
|
|
chlorure de calcium (sous forme dihydratée) |
0,37 g |
0,30 g |
0,22 g |
|
Glycérophosphate de sodium (sous forme hydratée) |
2,5 g |
2,0 g |
1,5 g |
|
|
|
|
|
|
sulfate de magnésium (sous forme heptahydratée) |
0,80 g |
0,64 g |
0,48 g |
|
Chlorure de potassium |
3,0 g |
2,4 g |
1,8 g |
|
|
|
|
|
|
acétate de sodium (sous forme trihydratée) |
2,4 g |
2,0 g |
1,5 g |
· Les autres composants sont : Phospholipides d'œuf purifiés, Glycérol, Hydroxyde de sodium, Acide acétique glacial et Eau pour préparations injectables.
Qu’est-ce que PERIKABIVEN, émulsion pour perfusion et contenu de l’emballage extérieur
Les solutions de glucose et d’acides aminés sont limpides et incolores à légèrement jaunes, et l’émulsion lipidique est blanche. PERIKABIVEN se présente sous la forme d’une poche à 3 compartiments dans un suremballage. Un absorbeur d’oxygène est placé entre la poche interne et le suremballage, qui doit être retiré avant utilisation. La poche est divisée en trois compartiments par des soudures pelables. Les contenus des trois compartiments doivent être mélangés avant administration, en ouvrant les soudures pelables.
Tailles des conditionnements :
1 x 1 440 ml, 4 x 1 440 ml
1 x 1 920 ml, 4 x 1 920 ml
1 x 2 400 ml, 3 x 2 400 ml
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
5, PLACE DU MARIVEL
92316 SEVRES CEDEX
Exploitant de l’autorisation de mise sur le marché
FRESENIUS KABI FRANCE
5, PLACE DU MARIVEL
92316 SEVRES CEDEX
RAPSGATAN 7
75174 UPPSALA
SUEDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Mises en garde spéciales et précautions d’emploi
Pour éviter les risques associés à des débits de perfusion trop rapides, il est recommandé d’effectuer une perfusion continue et bien contrôlée, si possible à l’aide d’une pompe volumétrique.
En raison du risque accru d’infection associé à l’utilisation d’une voie d’abord veineuse centrale, il importe de respecter des techniques aseptiques strictes, pour éviter toute contamination, notamment lors de la pose du cathéter.
En outre, il est indispensable de procéder à une surveillance de la glycémie, du bilan hydroélectrolytique, de l'osmolarité, de l’équilibre acidobasique et de la fonction hépatique.
Tout signe ou symptôme de réaction anaphylactique (comme l’apparition d’une fièvre, de frissons, d’une éruption ou d’une dyspnée) doit motiver l’arrêt immédiat de la perfusion.
Perikabiven ne doit pas être administré dans la même tubulure qu’une perfusion sanguine en raison du risque de pseudoagglutination.
L’utilisation de veines périphériques pour les perfusions peut s’accompagner de thrombophlébites. Par conséquent, le site d’insertion du cathéter doit être examiné tous les jours à la recherche de signes locaux de thrombophlébite.
Méthodes d’administration
Usage intraveineux, perfusion dans une veine périphérique ou centrale.
Pour offrir une nutrition parentérale complète au patient, il convient d’ajouter à Perikabiven des oligoéléments, des vitamines et éventuellement des électrolytes (en prenant en compte les électrolytes déjà présents dans Perikabiven), en fonction des besoins du patient.
Débit de perfusion
Le débit de perfusion maximum pour le glucose est de 0,25 g/kg/h. L’apport d’acides aminés ne doit pas dépasser 0,1 g/kg/h. L’apport de lipides ne doit pas dépasser 0,15 g/kg/h.
Le débit de perfusion ne doit pas dépasser 3,7 ml/kg de poids corporel/heure (correspondant à 0,25 g de glucose, 0,09 g d’acides aminés et 0,13 g de lipides/kg de poids corporel). La durée de perfusion recommandée est de 12 à 24 heures.
Précautions particulières d’élimination
Ne pas utiliser si le conditionnement est endommagé.
Utiliser uniquement si les solutions de glucose et d’acides aminés sont limpides et incolores ou légèrement jaunes, et que l’émulsion lipidique est blanche et homogène. Le contenu des trois compartiments de la poche doit être mélangé avant administration, et avant toute addition d’autres substances par l’intermédiaire du port de supplémentation.
Après ouverture des soudures pelables, la poche doit être retournée trois fois pour s’assurer que le mélange est homogène et ne présente aucun signe de séparation de phases.
Ce médicament est à usage unique. Tout mélange restant après la perfusion doit être éliminé.
Compatibilité
Des données de compatibilité sont disponibles avec les produits nommés Dipeptiven, Suppliven, Glycophos, Addiphos, Vitalipide Adultes/Enfants et Soluvit en quantités définies et avec des électrolytes en concentrations définies. Lors des ajouts d'électrolytes, les quantités déjà présentes dans la poche doivent être prises en compte pour répondre aux besoins cliniques du patient. Les données générées obtenues justifient les ajouts dans la poche indiqués dans le tableau récapitulatif ci-dessous :
Intervalle de compatibilité : stable pendant 8 jours, c'est-à-dire 6 jours de stockage à 2-8°C suivis de 48 heures à 20-25°C
|
|
Unités |
Quantité maximale totale |
||
|
Taille de la poche de Perikabiven |
ml |
1440 |
1920 |
2400 |
|
Additif |
|
Volume |
||
|
Dipeptiven |
ml |
0 - 200 |
0 - 300 |
0 - 300 |
|
Suppliven |
ml |
0 - 10 |
0 - 10 |
0 - 10 |
|
Soluvit |
flacon |
0 - 1 |
0 - 1 |
0 - 1 |
|
Vitalipide Adultes/Enfants |
ml |
0 - 10 |
0 - 10 |
0 - 10 |
|
Electrolytes1 |
|
Quantité par poche |
||
|
Sodium |
mmol |
≤ 216 |
≤ 288 |
≤ 360 |
|
Potassium |
mmol |
≤ 216 |
≤ 288 |
≤ 360 |
|
Calcium |
mmol |
≤ 7,2 |
≤ 9,6 |
≤ 12 |
|
Magnésium |
mmol |
≤ 7,2 |
≤ 9,6 |
≤ 12 |
|
Phosphate inorganique (Addiphos) OU Phosphate organique (Glycophos) |
mmol |
≤ 22 |
≤ 29 |
≤ 36 |
1 inclut les quantités de tous les produits
Remarque : ce tableau est destiné à indiquer la compatibilité. Il ne s'agit pas de recommandations posologiques.
Pour les médicaments cités, avant de prescrire, se référer aux informations de prescription approuvées au niveau national.
La compatibilité avec d’autres additifs et la durée de conservation de divers mélanges seront communiquées sur demande.
Tout ajout doit être réalisée dans des conditions aseptiques.
Tout mélange restant après la perfusion d’une poche doit être jeté
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur
Durée de conservation
Durée de conservation après mélange des compartiments
Après rupture des soudures délimitant les compartiments, il a été démontré que le mélange était chimiquement et physiquement stable 48 heures à une température de 20- 25°C, incluant la durée d’administration. Toutefois du point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, la durée et les conditions de conservation avant utilisation relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C, sauf si les mélanges ont été effectués en conditions d’asepsie dûment contrôlées et validées.
Durée de conservation après mélange avec des additifs
Après ouverture des soudures pelables et mélange des trois solutions, des additifs peuvent être ajoutés par l’intermédiaire du site de supplémentation.
La stabilité physicochimique dans la poche à trois compartiments après mélange avec des additifs (voir section 6.6) a été démontrée pendant 8 jours, c'est-à-dire 6 jours à 2°-8°C suivis de 48 heures à 20-25°C, incluant la durée d'administration. Du point de vue microbiologique, le produit doit être utilisé immédiatement quand un ajout a été effectué. En cas d’utilisation non immédiate, les durées et conditions de conservation avant administration relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C sauf si les mélanges ont été effectués en conditions d'asepsie dûment contrôlées et validées
Instructions d’utilisation Perikabiven
La poche
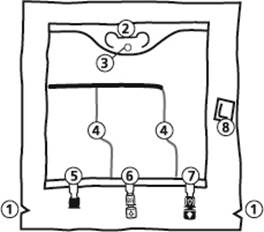
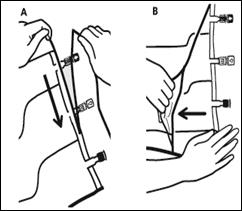
1. Encoches pour ouverture du suremballage
2. Poignée
3. Orifice de suspension de la poche
4. Soudures pelables
5. Site condamné (utilisé uniquement lors de la fabrication)
6. Site de supplémentation
7. Site de perfusion
8. Absorbeur d’oxygène
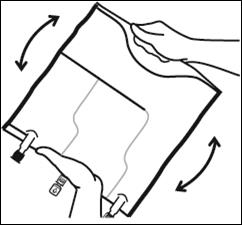
1.Retrait du suremballage
|
|
Pour retirer le suremballage, tenir la poche horizontalement et déchirer les encoches proches des sites de supplémentation et de perfusion (A). Retirer le suremballage et le jeter avec l’absorbeur d’oxygène (B).
|
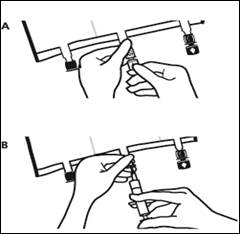
2.Reconstitution du mélange
|
|
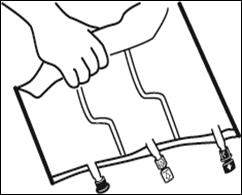
Placer la poche sur une surface plane. |
|||
|
|
Faire rouler la poche doucement sur elle-même à partir de la poignée en direction des sites, en commençant avec la main droite et en exerçant une pression constante avec la main gauche jusqu'à rupture des soudures verticales. Les soudures verticales s’ouvrent sous la pression des fluides.
|
|||
|
|
Le mélange peut également être effectué avant le retrait du suremballage. Remarque : les solutions se mélangent facilement, bien que la soudure horizontale reste fermée.
|
|||
|
|
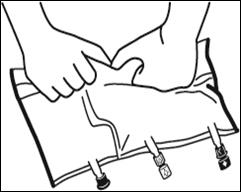
Mélanger le contenu des 3 compartiments en retournant la poche plusieurs fois de bas en haut jusqu'à ce que les solutions soient complètement mélangées.
|
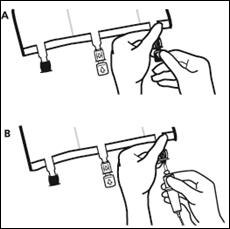
3. Supplémentation et perfusion
|
|
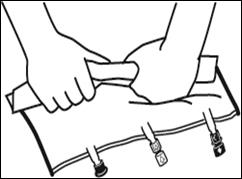
Placer la poche sur une surface plane. Juste avant d’injecter les additifs, rompre le Twist Off (flèche vers la poche) du site blanc de supplémentation (A). Remarque : la membrane à l’intérieur du site de supplémentation est stérile. Maintenir la base du site de supplémentation. Introduire l’aiguille, injecter les additifs (dont la compatibilité a été vérifiée) au centre du site de supplémentation (B). Homogénéiser le mélange, entre chaque supplémentation, en retournant la poche plusieurs fois. Utiliser des seringues avec des aiguilles Gauge 18-23 et de 40 mm de longueur maximum. |
|
|
Juste avant la mise en place du perfuseur, rompre le Twist Off (flèche vers le bas) du site bleu de perfusion (A). Remarque : la membrane à l’intérieur du site de supplémentation est stérile. Utiliser une tubulure de perfusion sans prise d’air ou fermer la prise d’air dans le cas contraire. Maintenir la base du site de perfusion Percuter à l’aide du trocart le site de perfusion. Le trocart doit être complètement enfoncé pour sécuriser sa mise en place. Remarque : La partie intérieure du site de perfusion est stérile. |
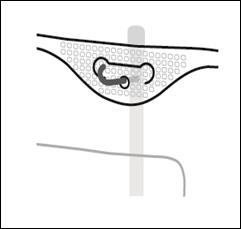
4.Suspension de la poche
|
|
Suspendre la poche par l’orifice situé sous la poignée.
|