Dernière mise à jour le 08/01/2026
HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie. Vaccin de l'hépatite A (inactivé, adsorbé)
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : VACCIN CONTRE L’HEPATITE A (J : Anti-infectieux)
Dans quels cas HAVRIX 1440 U/1 mL ADULTES est-il utilisé
HAVRIX 1440 U/1 mL ADULTES est un vaccin utilisé pour protéger les adolescents à partir de 16 ans et les adultes contre l'infection causée par le virus de l'hépatite A.
Qu’est-ce que l’hépatite A
· L'hépatite A est une maladie du foie causée par le virus de l'hépatite A.
· Le virus de l'hépatite A peut se transmettre d'une personne à l'autre ou par contact avec de l'eau, des aliments ou des boissons contaminés.
· Les symptômes de l'hépatite A peuvent être légers à sévères et peuvent inclure : fièvre, malaise, perte d'appétit, diarrhées, nausées, gêne abdominale, urines foncées et jaunisse (jaunissement des yeux et de la peau). La plupart des personnes se rétablissent complètement mais la maladie peut parfois être sévère et nécessiter une hospitalisation, et dans de rares cas elle peut entraîner une insuffisance hépatique aiguë.
Comment agit HAVRIX 1440 U/1 mL ADULTES
· HAVRIX 1440 U/1 mL ADULTES aide votre corps à créer sa propre protection (anticorps) contre le virus. Ces anticorps aident à vous protéger contre la maladie.
· Comme pour tous les vaccins, HAVRIX 1440 U/1 mL ADULTES peut ne pas protéger complètement toutes les personnes vaccinées.
Présentations
> 1 seringue(s) préremplie(s) en verre de 1 ml avec aiguille(s)
Code CIP : 337 751-5 ou 34009 337 751 5 5
Déclaration de commercialisation : 19/11/1994
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 21,40 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 22,42 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Actualisation des recommandations et obligations vaccinales des professionnels (Volet 2/2 : coqueluche, grippe saisonnière, hépatite A, rougeole, oreillons, rubéole varicelle)
Auteur : Haute autorité de santé
Type : Recommandation vaccinale
Date de mise à jour :Juillet 2023
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 22/01/2020 | Renouvellement d'inscription (CT) | Le service médical rendu par HAVRIX est important dans l’indication de l’AMM chez les adultes et les enfants à partir de un an pour lesquels la vaccination contre l’hépatite A est recommandée par le calendrier vaccinal en vigueur. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| III (Modéré) | Avis du 19/05/2010 | Inscription (CT) | La Commission souligne que l'hépatite A est habituellement bénigne, mais peut être à l'origine de formes graves exceptionnellement mortelles chez les patients affectés par une pathologie hépatique chronique évolutive. Cependant elle regrette l'absence de données cliniques récentes incluant un effectif suffisant et d'étude comparative par rapport à la mise en oeuvre de mesures préventives d'hygiène. HAVRIX 1 440 U/1 ml adultes apporte une amélioration du service médical rendu modérée (niveau III) en termes d'immunogénicité et de tolérance dans la prise en charge préventive d'une population limitée aux patients atteints de mucoviscidose, aux patients atteints, d'hépatopathies chroniques actives. |
ANSM - Mis à jour le : 07/03/2025
HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie
Vaccin de l’hépatite A (inactivé, adsorbé)
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 dose (1mL) contient :
Virus de l'hépatite A (inactivé)1,2.......................................................................... 1440 Unités ELISA
1 Produit sur cellules diploïdes humaines (MRC-5)
2 Adsorbé sur hydroxyde d’aluminium hydraté Total : 0,50 milligrammes Al3+
Le vaccin peut contenir des traces de néomycine et de formaldéhyde qui sont utilisés lors du processus de fabrication (voir rubrique 4.3).
Excipients à effet notoire
Ce vaccin contient 166 microgrammes de phénylalanine et 50 microgrammes de polysorbate 20 par dose (voir rubrique 4.4).
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension injectable en seringue préremplie.
Suspension liquide trouble. Lors du stockage, un fin dépôt blanc avec un surnageant limpide et incolore peut être observé.
4.1. Indications thérapeutiques
Ce vaccin doit être utilisé conformément aux recommandations officielles.
4.2. Posologie et mode d'administration
Primovaccination
Une seule dose de HAVRIX 1440 U/1 mL ADULTES est utilisée pour l’immunisation des adultes et des adolescents âgés de 16 ans et plus.
Pour une réponse optimale en anticorps, la primovaccination doit être administrée au moins 2 semaines, et de préférence 4 semaines, avant l'exposition attendue au virus de l'hépatite A (voir rubrique 5.1).
Vaccination de rappel
Après la primovaccination avec HAVRIX 1440 U/1 mL ADULTES, une dose de rappel est recommandée pour assurer une protection à long terme. Cette dose de rappel doit être administrée de préférence entre 6 mois et 12 mois après la primovaccination, cependant, elle peut être administrée jusqu’à 5 ans après la primovaccination (voir rubrique 5.1).
Interchangeabilité
Havrix est interchangeable avec d’autres vaccins inactivés contre l'hépatite A.
Population âgée
Les données avec les vaccins inactivés contre l’hépatite A sont limitées chez les sujets âgés.
Population pédiatrique
La sécurité et l’efficacité de HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL chez les enfants âgés de moins de 1 an n'ont pas été établies.
Les données actuellement disponibles sont décrites à la rubrique 5.1 mais aucune recommandation sur la posologie ne peut être faite.
Mode d’administration
HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie doit être administré par voie intramusculaire dans la région deltoïde chez les adolescents et les adultes (voir rubrique 6.6).
Quel que soit le site d'administration, une pression ferme doit être appliquée sur le site d'injection (sans frotter) pendant au moins deux minutes après l'injection.
Havrix ne doit pas être administré dans la région fessière.
Havrix ne doit en aucun cas être administré par voie intravasculaire.
Havrix ne doit pas être administré par voie sous-cutanée ou intradermique (voir rubrique 4.4).
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1 ou à la néomycine ou au formaldéhyde.
Hypersensibilité après une précédente administration avec un vaccin contre l’hépatite A.
4.4. Mises en garde spéciales et précautions d'emploi
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Recommandations générales
Comme pour les autres vaccins, l'administration de Havrix doit être différée chez les sujets souffrant d'une maladie fébrile aiguë et sévère. La présence d'une infection mineure, telle qu'un rhume, ne doit pas entrainer le report de la vaccination.
Comme pour tous les vaccins injectables, un traitement médical approprié avec surveillance doit toujours être disponible dans le rare cas où surviendrait un événement anaphylactique après l'administration du vaccin.
Une surveillance étroite pendant au moins 15 minutes est recommandée après la vaccination.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, en réaction psychogène à l'injection avec une aiguille. Ceci peut s'accompagner de plusieurs signes neurologiques comme des troubles visuels transitoires, une paresthésie et des mouvements tonico-cloniques des membres pendant la phase de récupération. Il est important que des mesures soient mises en place pour éviter les blessures en cas d’évanouissement.
Havrix ne prévient pas l'hépatite causée par d'autres agents tels que le virus de l'hépatite B, le virus de l'hépatite C, le virus de l'hépatite E ou d'autres agents pathogènes connus pour infecter le foie.
Des sujets peuvent être dans la période d'incubation d'une infection par le virus de l'hépatite A au moment de la vaccination. La prévention de l'hépatite A par Havrix dans de tels cas n'est pas connue.
Comme pour tout vaccin, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
La réponse immunitaire à Havrix peut être altérée chez les sujets immunodéprimés. Ces sujets nécessitent toujours l'administration d’un schéma de vaccination à 2 doses.
Havrix doit être administré avec prudence aux sujets présentant une thrombocytopénie ou un trouble de la coagulation, car un saignement peut survenir après une administration intramusculaire.
Exceptionnellement et conformément aux recommandations officielles, le vaccin peut être administré par voie sous-cutanée à ces patients. Toutefois, cette voie d'administration peut entraîner une réponse sous-optimale des anticorps anti-VHA. Pour ces deux voies d’administration, une pression ferme doit être appliquée sur le site d’injection (sans frotter) pendant au moins deux minutes après l’injection.
Excipients
HAVRIX 1440 U/1 mL ADULTES contient 166 microgrammes de phénylalanine par dose.
La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie (PCU).
Ce vaccin contient 50 microgrammes de polysorbate 20 par dose.
Les polysorbates peuvent provoquer des réactions allergiques.
Ce vaccin contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu’il est essentiellement « sans sodium ».
Ce vaccin contient du potassium, moins de 1 mmol (39 mg) par dose, c'est-à-dire qu’il est essentiellement « sans potassium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Havrix étant un vaccin inactivé, il est peu probable que son utilisation concomitante avec d'autres vaccins inactivés entraîne une interférence avec les réponses immunitaires.
Havrix peut être administré en même temps que chacun des vaccins suivants : typhoïde, fièvre jaune, choléra (injectable), tétanos ou avec des vaccins monovalents et combinés contre la rougeole, les oreillons, la rubéole et la varicelle.
Havrix peut être administré en même temps que des immunoglobulines. Les taux de séroconversion restent inchangés, bien que les titres d'anticorps puissent être plus faibles qu'après l'administration de Havrix seul.
Lorsque l'administration concomitante de vaccins injectables ou d'immunoglobulines est jugée nécessaire, les produits doivent être administrés avec des seringues et des aiguilles différentes et à des sites d'injection différents.
4.6. Fertilité, grossesse et allaitement
Grossesse
Un nombre modéré de données chez la femme enceinte (entre 300 et 1000 grossesses) n'a mis en évidence aucun effet malformatif, ni toxique pour le fœtus ou le nouveau-né.
Les études effectuées chez l’animal n’ont pas mis en évidence de toxicité sur la reproduction (voir rubrique 5.3).
L'utilisation de Havrix peut être envisagée pendant la grossesse, si nécessaire.
Allaitement
L'excrétion de Havrix dans le lait maternel n'est pas connue. Bien que le risque puisse être considéré comme négligeable, Havrix ne doit être utilisé pendant l'allaitement qu'en cas de nécessité absolue.
Fertilité
Il n'existe pas de données sur les effets de Havrix sur la fertilité humaine. Les effets sur la fertilité humaine n'ont pas été évalués dans les études effectuées chez l’animal.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Les effets indésirables locaux les plus fréquents, tant chez les enfants que chez les adultes, sont la douleur et la rougeur au site d'injection.
Les effets indésirables généraux les plus fréquents sont, chez l'enfant, l'irritabilité et, chez l'adulte, la fatigue et les maux de tête.
Liste tabulée des effets indésirables
Données des essais cliniques
Le profil de sécurité présenté dans le tableau ci-dessous est basé sur les données de 5 331 sujets dont 1 664 enfants (jusqu’à l’âge de 18 ans) vaccinés avec HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL et 3 667 adultes (à partir de l’âge de 16 ans) vaccinés avec HAVRIX 1440 U/1 mL ADULTES, lors des essais cliniques (cohorte totale vaccinée). Au total, 3 193 doses de HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL et 7 131 doses de HAVRIX 1440 U/1 mL ADULTES ont été administrées au cours des essais cliniques. Un nombre total de 3 971 doses de HAVRIX 1440 U/1 mL ADULTES ont été administrées en même temps qu'Engerix-B chez 2 064 sujets adultes.
Les effets indésirables rapportés sont listés selon les fréquences suivantes :
|
Très fréquent |
(≥ 1/10) |
|
Fréquent |
(≥ 1/100 à < 1/10) |
|
Peu fréquent |
(≥ 1/1 000 à < 1/100) |
|
Rare |
(≥ 1/10 000 à < 1/1 000) |
|
Très rare |
(< 1/10 000) |
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
|
Classes de Systèmes d’Organes |
Fréquence |
Effets indésirables |
|
Infections et infestations |
Peu fréquent |
Infection des voies respiratoires supérieures (2), rhinite |
|
Troubles du métabolisme et de la nutrition |
Fréquent |
Perte d’appétit |
|
Affections psychiatriques |
Très fréquent |
Irritabilité (1) |
|
Affections du système nerveux |
Très fréquent |
Céphalées (3) |
|
Fréquent |
Somnolence (1) |
|
|
Peu fréquent |
Vertiges (2) |
|
|
Rare |
Hypoesthésie (2), paresthésie (2) |
|
|
Affections gastro-intestinales |
Fréquent |
Signes et symptômes gastro-intestinaux (2)(5), diarrhées (4), nausées |
|
Peu fréquent |
Vomissements |
|
|
Affections de la peau et du tissu sous-cutané |
Peu fréquent |
Eruption cutanée (1) |
|
Rare |
Prurit (2) |
|
|
Affections musculosquelettiques et du tissu conjonctif |
Peu fréquent |
Myalgie (2), raideur musculosquelettique (2) |
|
Troubles généraux et anomalies au site d’administration |
Très fréquent |
Douleur au site d'injection et érythème au site d'injection, fatigue (2) |
|
Fréquent |
Malaise, fièvre (≥37,5°C), réaction au site d’injection (telle qu’induration au site d'injection (4) et gonflement au site d’injection) |
|
|
Peu fréquent |
Syndrome pseudo-grippal (2) |
|
|
Rare |
Frissons (2) |
(1) uniquement avec HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL
(2) uniquement avec HAVRIX 1440 U/1 mL ADULTES
(3) rapporté comme fréquente avec HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL
(4) rapporté comme peu fréquent avec HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL
(5) gastro-intestinal = incluant nausées, vomissements, diarrhées (symptômes non enregistrés séparément)
Données post-commercialisation
Les effets indésirables supplémentaires suivants ont été identifiés au cours de la surveillance post-commercialisation avec HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL et HAVRIX 1440 U/1 mL ADULTES.
|
Classe de Systèmes d’Organes |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
Rare |
Anaphylaxie, réactions allergiques incluant des réactions anaphylactoïdes et réaction de type maladie sérique |
|
Affections du système nerveux |
Rare |
Convulsions |
|
Affections vasculaires |
Rare |
Vascularite |
|
Affections de la peau et du tissu sous-cutané |
Rare |
Œdème angioneurotique, érythème polymorphe, urticaire |
|
Affections musculosquelettiques et du tissu conjonctif |
Rare |
Arthralgie |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Vaccins contre l’hépatite A, code ATC : J07BC02
Mécanisme d’action
Havrix confère une immunité contre le VHA en induisant une réponse immunitaire spécifique mise en évidence par la production d’anticorps contre le VHA.
Effets pharmacodynamiques
L’immunogénicité de Havrix a été évaluée dans 39 études portant sur plus de 6 000 sujets incluant des adultes, des adolescents et des enfants.
Réponse immunitaire
Dans les études cliniques, 99 % des sujets vaccinés ont présenté une séroconversion 30 jours après la première dose.
Dans un sous-ensemble d'études cliniques chez l'adulte où la cinétique de la réponse immunitaire a été étudiée, une séroconversion précoce et rapide a été démontrée après l'administration d'une première dose de HAVRIX 1440 U/1 mL ADULTES chez 79 % des sujets vaccinés au 13ème jour, 86,3 % au 15ème jour, 95,2 % au 17ème jour et 100 % au 19ème jour.
Les données des études cliniques portant sur des nourrissons âgés de moins d'un an sont limitées. Dans ces études, HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL a été administré à l'âge de 2, 4 et 6 mois ou en 2 doses administrées à 6 mois d'intervalle entre l'âge de 4 et 6 mois. Des anticorps humoraux contre le VHA ont été détectés chez la plupart des sujets vaccinés un mois après l'administration de la dernière dose de vaccin ; les nourrissons ayant des anticorps préexistants d’origine maternelle ont eu une réponse nettement diminuée par rapport aux nourrissons initialement séronégatifs (voir rubrique 4.2).
Dans des études cliniques impliquant des enfants âgés de 1 à 18 ans, des anticorps humoraux spécifiques contre le VHA ont été détectés chez plus de 93 % des sujets vaccinés au 15ème jour et 99 % des sujets vaccinés un mois après l'administration de la première dose de HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL.
Dans les études cliniques au cours desquelles des adolescents âgés de 16 à 18 ans ont reçu HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL, des anticorps humoraux contre le VHA ont été détectés chez plus de 94 % des sujets vaccinés au 15ème jour et chez 100 % des sujets vaccinés un mois après l'administration de la première dose de HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL.
Réponse immunitaire chez les patients atteints d'une maladie hépatique chronique
Dans deux essais cliniques, 300 sujets atteints d'une maladie hépatique chronique (hépatite B chronique, hépatite C chronique ou autre) ont été vaccinés avec 2 doses de HAVRIX 1440 U/1 mL ADULTES administrées à un intervalle de 6 mois. Le vaccin a produit des titres en anticorps détectables chez au moins 95 % des sujets vaccinés, un mois après la seconde dose.
Persistance de la réponse immunitaire
Afin d'assurer une protection à long terme, une dose de rappel doit être administrée entre 6 et 12 mois après la première dose de HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL ou HAVRIX 1440 U/1 mL ADULTES. Dans les essais cliniques, tous les sujets vaccinés étaient séropositifs un mois après la dose de rappel.
Cependant, si la dose de rappel n'a pas été administrée entre 6 et 12 mois après la primovaccination, l'administration de cette dose de rappel peut se faire jusqu'à 5 ans après la première dose.
Dans une étude comparative chez l’adulte, il a été démontré qu’une dose de rappel administrée jusqu’à 5 ans après la primovaccination induisait des taux d’anticorps similaires à ceux induits par une dose de rappel administrée entre 6 et 12 mois après la primovaccination.
La persistance à long terme des titres d’anticorps contre le virus de l'hépatite A après 2 doses de HAVRIX 1440 U/1 mL ADULTES administrées à un intervalle de 6 à 12 mois a été évaluée. Dans deux essais cliniques menés chez des adultes, 96,7 % et 100 % des sujets vaccinés étaient toujours séropositifs à l'année 17,5 (étude HAV-112) et à l'année 17 (étude HAV-123), respectivement.
Les données disponibles jusqu'à 17 et 17,5 ans permettent d’estimer qu'au moins 95 % et 90 % des sujets resteront séropositifs (≥15 mUI/mL) 30 et 40 ans après la vaccination, respectivement.
Les données actuelles ne justifient pas la nécessité d'une nouvelle vaccination de rappel chez les sujets immunocompétents après un schéma vaccinal à deux doses.
Il est attendu que la durée de protection chez les enfants après 2 doses de HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 mL soit comparable à la durée de protection estimée ci-dessus chez les adultes.
5.2. Propriétés pharmacocinétiques
L’évaluation des propriétés pharmacocinétiques n’est pas requise pour les vaccins.
5.3. Données de sécurité préclinique
Une étude de toxicité sur la reproduction a été menée chez le rat avec un autre vaccin combiné contre l'hépatite A et l'hépatite B (HAB). Ce vaccin combiné contient la même substance active que Havrix. Les rats ont reçu par voie intramusculaire 1/5ème de la dose humaine de HAB (injection intramusculaire de 200 μL contenant 144 Unités ELISA du virus de l'hépatite A (inactivé), 4 microgrammes d'antigène de surface de l'hépatite B et 0,09 mg d'aluminium sous forme de sels d'aluminium). Il n'a pas été associé à une toxicité maternelle et aucun effet indésirable ou effet lié au vaccin n'a été observé sur le développement prénatal ou postnatal des fœtus/petits.
Acides aminés pour préparations injectables (contenant de la phénylalanine)
Phosphate disodique
Polysorbate 20 (E432)
Chlorure de potassium
Chlorure de sodium
Eau pour préparations injectables.
3 ans
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (entre + 2°C et + 8°C).
Ne pas congeler. Jeter le vaccin s’il a été congelé.
A conserver dans l’emballage d’origine à l’abri de la lumière.
Les données de stabilité indiquent que HAVRIX est stable à des températures ne dépassant pas 25°C pendant 3 jours. Ces données sont destinées à orienter les professionnels de santé exclusivement en cas de variation temporaire de la température.
6.5. Nature et contenu de l'emballage extérieur
Boites de 1, 5, 10 et 25, avec ou sans aiguille(s).
L’embout protecteur et le bouchon-piston en caoutchouc de la seringue préremplie sont fabriqués avec du caoutchouc synthétique.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Instructions d’utilisation de la seringue préremplie
|
|
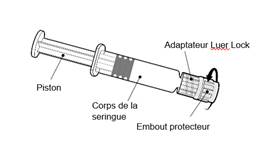
Tenir la seringue par le corps de la seringue et non par le piston.
Dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre.
|
||
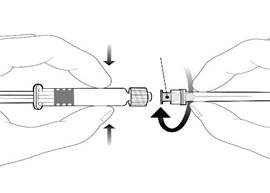
|
Embase de l’aiguille |
Pour fixer l’aiguille, connecter l’embase de l’aiguille sur l’adaptateur Luer Lock et tourner d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir un blocage.
Ne pas tirer le piston en dehors du corps de la seringue. Si cela se produit, ne pas administrer le vaccin. |
Instructions d’élimination
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
23, RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 283 6 7 : 1 mL de suspension en seringue préremplie (verre) munie d’un bouchon-piston (caoutchouc butyle) – sans aiguille. Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 07/03/2025
HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie
Vaccin de l’hépatite A (inactivé, adsorbé)
Veuillez lire attentivement cette notice avant que vous ou votre enfant receviez ce vaccin car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce vaccin a été personnellement prescrit pour vous ou votre enfant. Ne le donnez pas à d’autres personnes.
· Si vous ou votre enfant ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
Cette notice a été rédigée en supposant que la personne qui reçoit le vaccin soit celle qui la lit, mais ce vaccin peut être administré à des enfants et à des adolescents, donc vous pourriez être amené à la lire pour votre enfant.
1. Qu’est-ce que HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie et dans quels cas est-il utilisé
2. Quelles sont les informations à connaître avant d’utiliser HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie
3. Comment utiliser HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie
4. Quels sont les effets indésirables éventuels
5. Comment conserver HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie
6. Contenu de l’emballage et autres informations
1. QU’EST-CE QUE HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : VACCIN CONTRE L’HEPATITE A (J : Anti-infectieux)
Dans quels cas HAVRIX 1440 U/1 mL ADULTES est-il utilisé
HAVRIX 1440 U/1 mL ADULTES est un vaccin utilisé pour protéger les adolescents à partir de 16 ans et les adultes contre l'infection causée par le virus de l'hépatite A.
Qu’est-ce que l’hépatite A
· L'hépatite A est une maladie du foie causée par le virus de l'hépatite A.
· Le virus de l'hépatite A peut se transmettre d'une personne à l'autre ou par contact avec de l'eau, des aliments ou des boissons contaminés.
· Les symptômes de l'hépatite A peuvent être légers à sévères et peuvent inclure : fièvre, malaise, perte d'appétit, diarrhées, nausées, gêne abdominale, urines foncées et jaunisse (jaunissement des yeux et de la peau). La plupart des personnes se rétablissent complètement mais la maladie peut parfois être sévère et nécessiter une hospitalisation, et dans de rares cas elle peut entraîner une insuffisance hépatique aiguë.
Comment agit HAVRIX 1440 U/1 mL ADULTES
· HAVRIX 1440 U/1 mL ADULTES aide votre corps à créer sa propre protection (anticorps) contre le virus. Ces anticorps aident à vous protéger contre la maladie.
· Comme pour tous les vaccins, HAVRIX 1440 U/1 mL ADULTES peut ne pas protéger complètement toutes les personnes vaccinées.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie ?
N’utilisez jamais HAVRIX 1440 U/1 mL ADULTES si :
· vous êtes allergique à la substance active ou à l’un des autres composants contenus dans ce vaccin (mentionnés dans la rubrique 6) ou à la néomycine ou au formaldéhyde,
· vous avez déjà eu une réaction allergique à un vaccin contre l'hépatite A.
Les signes d'une réaction allergique peuvent inclure une éruption cutanée avec démangeaisons, un essoufflement et un gonflement du visage ou de la langue.
HAVRIX 1440 U/1 mL ADULTES ne doit pas être administré si l'une des situations ci-dessus s'applique. Si vous n'êtes pas sûr, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère avant de recevoir HAVRIX 1440 U/1 mL ADULTES.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant de recevoir HAVRIX 1440 U/1 mL ADULTES :
· si vous avez une infection sévère avec une température élevée (fièvre). Le vaccin peut être administré après votre rétablissement. Une infection bénigne telle qu'un rhume ne devrait pas poser de problème, mais parlez-en d'abord à votre médecin,
· si vous avez un système immunitaire affaibli par des maladies et/ou des traitements. Votre médecin déterminera si d'autres injections sont nécessaires,
· si vous avez des problèmes de saignement ou si vous vous faites des bleus facilement.
Un évanouissement peut survenir avant ou après toute injection avec une aiguille. Par conséquent, informez le médecin, le pharmacien ou l'infirmier/ère si vous vous êtes évanoui(e) lors d'une précédente injection.
Autres médicaments et HAVRIX 1440 U/1 mL ADULTES
Informez votre médecin, pharmacien ou infirmier/ère si vous prenez, avez récemment pris ou pourriez prendre tout autre vaccin ou médicament.
HAVRIX 1440 U/1 mL ADULTES peut être administré en même temps que d'autres vaccins et immunoglobulines. Un site d'injection différent doit être utilisé pour chaque injection.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin, pharmacien ou infirmier/ère avant de recevoir HAVRIX 1440 U/1 mL ADULTES.
Conduite de véhicules et utilisation de machines
HAVRIX 1440 U/1 mL ADULTES n’a aucun effet ou qu’un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
HAVRIX 1440 U/1 mL ADULTES contient de la phénylalanine, du polysorbate H20, du sodium et du potassium
Ce vaccin contient 0,166 mg de phénylalanine par dose.
La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
Ce vaccin contient 0,050 mg de polysorbate 20 par dose. Les polysorbates peuvent provoquer des réactions allergiques. Informez votre médecin si vous avez des allergies connues.
Ce vaccin contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu’il est essentiellement "sans sodium".
Ce vaccin contient du potassium, moins de 1 mmol (39 mg) par dose, c'est-à-dire essentiellement "sans potassium".
3. COMMENT UTILISER HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie ?
Comment le vaccin est-il administré
· Le médecin ou l'infirmier/ère administrera HAVRIX 1440 U/1 mL ADULTES par une injection dans un muscle. L'injection se fait généralement dans la partie supérieure du bras.
· HAVRIX 1440 U/1 mL ADULTES peut exceptionnellement être injecté sous la peau si vous souffrez de thrombocytopénie ou de troubles graves de la coagulation.
Combien de doses sont administrées
· Vous recevrez 1 dose de HAVRIX 1440 U/1 mL ADULTES (suspension de 1 mL) à une date convenue avec votre médecin ou votre infirmier/ère.
· Il est recommandé d'administrer une deuxième dose (rappel) entre 6 et 12 mois après la première dose, mais elle peut être administrée jusqu'à cinq ans après la première dose, afin d'assurer une protection à long terme.
Si vous avez reçu plus de HAVRIX 1440 U/1 mL ADULTES que vous n’auriez dû
Un surdosage est très peu probable car le vaccin est fourni dans un flacon ou une seringue à dose unique et est administré par un médecin ou un(e) infirmier/ère. Peu de cas d'administration accidentelle ont été signalés et les effets secondaires rapportés étaient similaires à ceux rapportés lors de l'administration normale du vaccin (listés dans la rubrique 4).
Si vous pensez avoir manqué une dose de HAVRIX 1440 U/1 mL ADULTES
Contactez votre médecin qui décidera si une dose est nécessaire et quand l'administrer.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets secondaires graves
Informez immédiatement votre médecin si vous remarquez l'un des effets secondaires graves suivants - vous pourriez avoir besoin d'un traitement médical d'urgence :
· réactions allergiques - les signes peuvent inclure des éruptions cutanées locales ou étendues qui peuvent provoquer des démangeaisons ou des cloques, un gonflement des yeux et du visage, des difficultés à respirer ou à avaler, une chute soudaine de la pression artérielle et une perte de conscience.
Ces réactions peuvent se produire avant de quitter le cabinet médical.
Informez immédiatement votre médecin si vous remarquez l'un des effets secondaires graves mentionnés ci-dessus.
Les effets indésirables suivants sont survenus pendant les essais cliniques avec HAVRIX 1440 U/1 mL ADULTES :
Très fréquent (pouvant survenir pour plus d’1 dose de vaccin sur 10) :
· maux de tête
· douleur et rougeur au site d’injection
· fatigue
Fréquent (pouvant survenir jusqu’à 1 dose de vaccin sur 10)
· perte d’appétit
· nausées (envie de vomir)
· vomissements
· diarrhées
· sensation de malaise général
· fièvre à 37,5°C ou plus
· gonflement ou induration au site d'injection
Peu fréquent (pouvant survenir jusqu’à 1 dose de vaccin sur 100)
· infection des voies respiratoires supérieures
· nez bouché ou nez qui coule
· sensations vertigineuses
· douleurs musculaires, raideur musculaire non due à la pratique d’un exercice physique
· symptômes pseudo-grippaux tels qu’une température élevée, des maux de gorge, un écoulement nasal, une toux et des frissons
Rare (pouvant survenir pour moins d’1 dose de vaccin sur 1 000)
· diminution ou perte de la sensibilité de la peau à la douleur ou au toucher
· picotements
· démangeaisons
· frissons
Les effets indésirables survenus après la mise sur le marché de HAVRIX 1440 U/1 mL ADULTES, sont les suivants :
· crises ou convulsions
· inflammation des vaisseaux sanguins entraînant un rétrécissement ou une obstruction (vascularite)
· réaction allergique grave provoquant un gonflement du visage, de la langue ou de la gorge pouvant entraîner des difficultés à avaler ou à respirer
· urticaire, tâches rouges, souvent accompagnées de démangeaisons, qui apparaissent d'abord sur les membres et parfois sur le visage et le reste du corps
· douleurs articulaires
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie ?
Tenir hors de la vue et de la portée des enfants.
N’utilisez pas ce vaccin après la date de péremption indiquée sur la boîte. La date de péremption fait référence au dernier jour du mois.
A conserver au réfrigérateur (entre + 2°C et + 8°C).
Ne pas congeler.
A conserver dans l’emballage d’origine à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient HAVRIX 1440 U/1 mL ADULTES, suspension injectable en seringue préremplie
La substance active est le virus de l'hépatite A (inactivé) adsorbé sur l'hydroxyde d'aluminium. Chaque dose de 1 mL du vaccin contient 1440 Unités ELISA de virus de l'hépatite A.
Les autres composants sont des acides aminés pour injections (contenant de la phénylalanine), du phosphate disodique, du phosphate monopotassique, du polysorbate 20 (E432), du chlorure de potassium, du chlorure de sodium, de l'eau pour préparations injectables (voir rubrique 2).
Suspension pour injection.
HAVRIX 1440 U/1 mL ADULTES est une suspension liquide trouble.
HAVRIX 1440 U/1 mL ADULTES est disponible en seringue préremplie d’une dose avec ou sans aiguille(s), en boîte de 1, 5, 10 et 25.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
23, RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
Exploitant de l’autorisation de mise sur le marché
LABORATOIRE GLAXOSMITHKLINE
92500 RUEIL-MALMAISON
Glaxosmithkline biologicals sa
RUE DE L’INSTITUT 89
1330 RIXENSART
Belgique
Noms du médicament dans les Etats membres de l'Espace Economique Européen
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
<------------------------------------------------------------------------------------------------------------------------>
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
HAVRIX 1440 U/1 mL ADULTES est une suspension liquide trouble. Pendant le stockage, un fin dépôt blanc avec un surnageant incolore peut se former.
Avant administration, le vaccin doit être inspecté visuellement pour mettre en évidence la présence de toute particule étrangère et/ou altération de l'aspect physique. Avant l’utilisation de Havrix, la seringue doit être bien agitée afin d’obtenir une suspension blanche légèrement opaque. Jeter le vaccin si le contenu a un autre aspect.
Instructions d’utilisation de la seringue préremplie
|
|
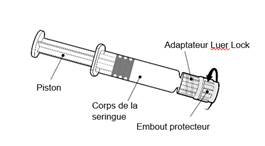
Tenir la seringue par le corps de la seringue et non par le piston.
Dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre. |
||
|
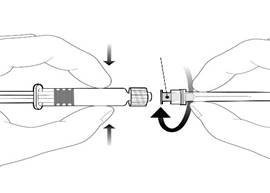
Embase de l’aiguille |
Pour fixer l’aiguille, connecter l’embase de l’aiguille sur l’adaptateur Luer Lock et tourner d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir un blocage.
Ne pas tirer le piston en dehors du corps de la seringue. Si cela se produit, ne pas administrer le vaccin. |
Instructions d’élimination
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.