Dernière mise à jour le 30/06/2025
GALLIAD 0,74 à 1,85 GBq, générateur radiopharmaceutique

: Ce médicament fait l'objet d'une surveillance renforcée. Pour plus d'informations, cliquez ici
Indications thérapeutiques
Galliad est un générateur radiopharmaceutique germanium (68Ge) / gallium (68Ga), un dispositif utilisé pour obtenir une solution de chlorure de gallium (68Ga).
La solution de chlorure de gallium (68Ga) obtenue est utilisée pour le radiomarquage, une technique lors de laquelle une substance est balisée (radiomarquée) avec un composé radioactif, dans le cas présent le 68Ga.
Galliad est utilisé pour marquer certains médicaments qui ont été spécialement développés et approuvés pour être utilisés avec la substance active, le chlorure de gallium (68Ga). Ces médicaments agissent en tant que vecteurs pour véhiculer le 68Ga radioactif, là où il est nécessaire. Il peut s’agir de substances qui ont été conçues pour reconnaître un type particulier de cellules dans l’organisme, y compris les cellules tumorales (cancer). La faible quantité de radioactivité administrée peut être détectée en dehors du corps, par des caméras spéciales.
Veuillez-vous référer à la notice du médicament qui doit être radiomarqué avec le chlorure de gallium (68Ga). Le médecin spécialiste en médecine nucléaire vous expliquera quel type d’examen sera effectué avec ce produit.
L’utilisation d’un médicament marqué au 68Ga implique l’exposition à de petites quantités de radioactivité. Votre médecin et le médecin spécialiste en médecine nucléaire ont considéré que le bénéfice clinique que vous retirerez de la procédure avec le radiopharmaceutique dépasse les risques dus aux rayonnements.
Présentations
> 1 générateur pour élution de 0,74 GBq, 1,11 GBq, 1,48 GBq, 1,85 GBq de 68Ge à la date de calibration
Code CIP : 34009 550 579 0 1
Déclaration de commercialisation : 22/01/2019
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 21/11/2018 | Inscription (CT) | Le service médical rendu par GALLIAD 0,74 à 1,85 GBq, générateur de radionucléides est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 21/11/2018 | Inscription (CT) | Compte-tenu : • des performances diagnostiques de la TEP, notamment à ce jour avec SOMAKIT TOC, • de l’absence de démonstration probante apportée notamment pour SOMAKIT TOC concernant un éventuel avantage en termes de performance diagnostique de la TEP à 68Ga par rapport aux comparateurs cliniquement pertinents du médicament radiopharmaceutique, • de l’impact potentiel sur l’organisation du système de soins étant donné la durée de vie d’un an du générateur GALLIAD, • et de l’absence de résultat probant sur son éventuel impact sur la prise en charge thérapeutique dans le diagnostic et le traitement des maladies nécessitant une TEP, GALLIAD n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la prise en charge diagnostique des maladies nécessitant une TEP. |
Autres informations
- Titulaire de l'autorisation : IRE-ELIT INSTITUT NATIONAL DES RADIOELEMENTS
- Conditions de prescription et de délivrance :
- liste I
- réservé à l'usage HOSPITALIER
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 026 626 5
ANSM - Mis à jour le : 31/07/2018
![]() Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
Galliad, 0,74 à 1,85 GBq, générateur radiopharmaceutique
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Le générateur radiopharmaceutique contient du germanium (68Ge) comme nucléide mère, qui se désintègre en nucléide fille, le gallium (68Ga).
Le germanium (68Ge) utilisé pour la production du générateur de 68Ge/68Ga est sans vecteur. La radioactivité totale due au germanium (68Ge) et à la présence d’impuretés émettant des rayons gamma ne représente pas plus de 0.001%.
Le générateur radiopharmaceutique Galliad 0,74 à 1,85 GBq est un dispositif permettant l’élution d’une solution de chlorure de gallium (68Ga) pour le radiomarquage en accord avec la Ph. Eur. 2464. Cette solution est éluée à partir d’une colonne sur laquelle est fixé le nucléide mère, le germanium (68Ge), parent du gallium (68Ga). Le dispositif est blindé. Les caractéristiques physiques des nucléides mère et fille sont résumées dans le tableau 1.
Tableau 1 : caractéristiques physiques du 68 Ge et du 68Ga
|
|
Caractéristiques physiques de |
|
|
68Ge |
68Ga |
|
|
Demi-vie |
270,95 jours |
67,71 minutes |
|
Type de désintégration |
Capture d’électrons |
Emission de positron |
|
Rayons X |
9,225 (13,1 %) 9,252 (25,7 %) 10,26 (1,64 %) 10,264 (3,2 %) 10,366 (0,03 %) |
8,616 (1,37 %) 8,639 (2,69 %) 9,57 (0,55 %) |
|
Gammas |
|
511 keV (178,28 %), 578,55 keV (0,03 %) 805,83 keV (0,09 %), 1077,34 keV (3,22 %) 1260,97 keV (0,09 %) 1883,16 keV (0,14 %) |
|
Beta+ |
|
Energie Energie max. 352,60 keV 821,71 keV (1,20 %) 836,00 keV 1899,01 keV (87,94 %) |
|
Données dérivées de nudat (www.nndc.bnl.gov) |
||
1,1 mL d’éluat Galliad contiennent un maximum potentiel de 1850 MBq de 68Ga et de 18,5 kBq de 68Ge (pénétration de 0,001 %) ce qui correspond à 1,2 ng de gallium et 0,07 ng de germanium.
La quantité de solution de chlorure de gallium (68Ga) pour radiomarquage Ph. Eur., susceptible d’être éluée à partir du générateur dépend de la quantité présente de germanium (68Ge), et du temps écoulé depuis l’élution précédente. Si le nucléide mère et le nucléide fille sont en équilibre, plus de 60% du chlorure de gallium (68Ga) présent peuvent être élués. Un volume fixe de 1,1 mL de chlorure de gallium (68Ga) est élué.
Le tableau 2 résume l’activité sur le générateur et obtenue par élution au début de la durée de conservation et à la fin de celle-ci.
Tableau 2: Activité sur le générateur et obtenue par élution
|
Dosage |
Activité à l’intérieur du générateur au début de la durée de conservation |
Activité à l’intérieur du générateur à la fin de la durée de conservation |
Activité éluée au début de la durée de conservation* |
Activité éluée à la fin de la durée de conservation* |
|
0,74 GBq |
0,74 GBq ± 10% |
0,3 GBq ± 10% |
PMD 0,41 GBq |
PMD 0,16 GBq |
|
1,11 GBq |
1,11 GBq ± 10% |
0,4 GBq ± 10% |
PMD 0,61 GBq |
PMD 0,22 GBq |
|
1,48 GBq |
1,48 GBq ± 10% |
0,6 GBq ± 10% |
PMD 0,81 GBq |
PMD 0,32 GBq |
|
1,85 GBq |
1,85 GBq ± 10% |
0,7 GBq ± 10% |
PMD 1,02 GBq |
PMD 0,40 GBq |
PMD = pas moins de
* en équilibre
Des explications plus détaillées et des exemples d’activités éluables à différents moments sont donnés à la rubrique 12.
Pour la liste complète des excipients, voir rubrique 6.1.
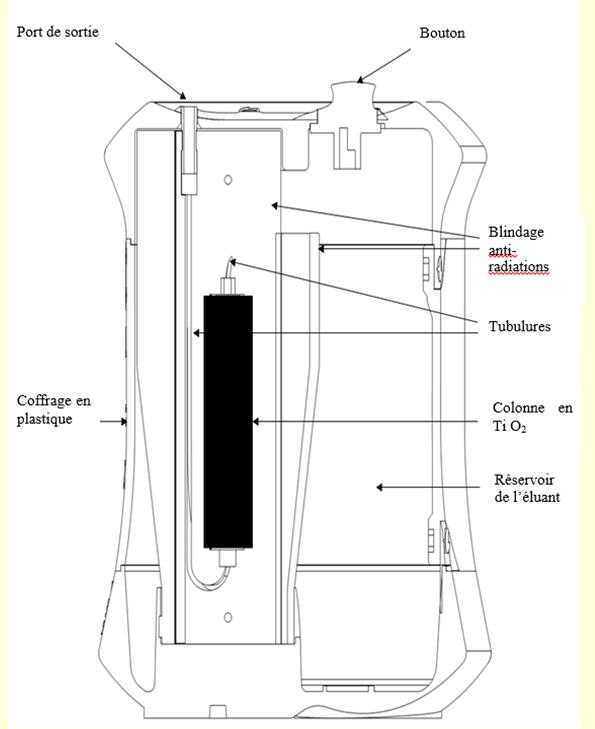
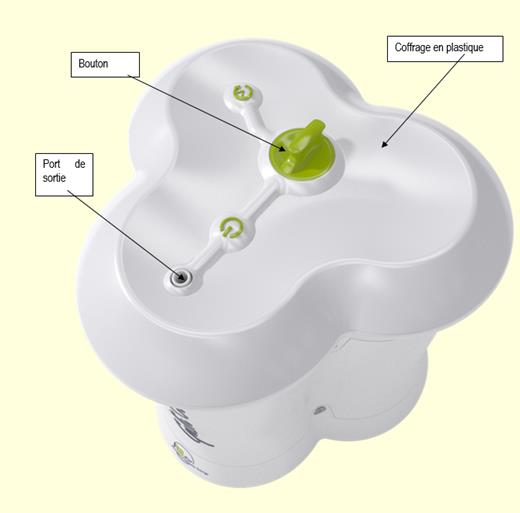
Générateur radiopharmaceutique
Le générateur se présente sous la forme d’un coffrage en plastique muni d’un port de sortie et d’un bouton. La solution pour élution est intégrée au coffrage en plastique. L’éluat peut être recueilli au port de sortie, ou inséré directement dans un dispositif de synthèse.
4.1. Indications thérapeutiques
Ce médicament n’est pas destiné à une utilisation directe chez les patients.
L’éluat du générateur radionucléidique (solution de chlorure de gallium (68Ga)) est utilisé pour le radiomarquage in vitro de différents kits de préparations radiopharmaceutiques développées et autorisées pour le radiomarquage avec ce type de solution, afin d’être utilisées pour l’imagerie par tomographie par émission de positrons (PET).
4.2. Posologie et mode d'administration
Posologie
La quantité d’éluat (solution de chlorure de gallium (68Ga)) requise pour le radiomarquage et la quantité de médicament marqué au 68Ga qui est ensuite administré dépendront du médicament radiomarqué et de l’usage auquel il est destiné. Se reporter au Résumé des Caractéristiques du Produit / à la notice du médicament à radiomarquer.
Une élution correspond à un volume fixe de 1,1 mL.
Population pédiatrique
Se reporter au Résumé des Caractéristiques du Produit / à la notice du médicament marqué au 68Ga pour de plus amples informations concernant son utilisation pédiatrique.
Mode d’administration
La solution de chlorure de gallium (68Ga) n’est pas destinée à une utilisation directe chez les patients mais est utilisée pour le radiomarquage in vitro de diverses molécules vectrices. La voie d’administration du médicament final doit être respectée.
Pour les instructions concernant la préparation extemporanée du médicament avant administration, voir la rubrique 12.
Ne pas administrer la solution de chlorure de gallium (68Ga) directement au patient.
L’utilisation de médicaments marqués au 68Ga est contre-indiquée dans le cas d’hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Pour des informations concernant les contre-indications à des médicaments particuliers marqués au 68Ga, préparés par radiomarquage avec une solution de chlorure de gallium (68Ga), se reporter au Résumé des Caractéristiques du Produit / à la notice du médicament à radiomarquer.
4.4. Mises en garde spéciales et précautions d'emploi
Justification bénéfice/risque individuelle
Pour chaque patient, l’exposition aux rayonnements doit pouvoir être justifiée par le bénéfice probable.
L’activité administrée doit, dans tous les cas, être aussi faible que raisonnablement réalisable afin d’obtenir l’effet requis.
Mises en garde générales
Pour obtenir des informations concernant les mises en garde spéciales et les précautions particulières pour l’utilisation des médicaments marqués au 68Ga, se reporter au Résumé des Caractéristiques du Produit / à la notice du médicament à radiomarquer.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction de la solution de chlorure de gallium (68Ga) avec d’autres médicaments n’a été réalisée, car il sert au radiomarquage de médicaments.
Pour obtenir des informations concernant les interactions associées à l’utilisation des médicaments marqués au 68Ga, se reporter au Résumé des Caractéristiques du Produit / à la notice du médicament à radiomarquer.
4.6. Fertilité, grossesse et allaitement
Femmes en âge de procréer
Lorsqu’il est envisagé d’administrer des médicaments radioactifs à une femme en âge de procréer, il est important de déterminer si elle est enceinte ou non. Toute femme n’ayant pas eu ses règles doit être considérée comme enceinte jusqu’à preuve du contraire. En cas de doute quant à sa grossesse potentielle (si la femme n’a pas eu ses règles, si ses dernières sont très irrégulières, etc.), d’autres techniques n’utilisant pas les rayonnements ionisants (s’il en existe) doivent lui être proposées.
Grossesse
Les examens faisant appel aux radionucléides effectués chez la femme enceinte impliquent aussi une dose de rayonnements pour le fœtus. Seuls les examens indispensables doivent donc être réalisés pendant la grossesse, lorsque le bénéfice probable dépasse de loin le risque encouru par la mère et le fœtus.
Allaitement
Avant d’administrer un produit radiopharmaceutique à une femme en période d’allaitement, il convient d’envisager la possibilité de retarder raisonnablement l’examen jusqu’à la fin de l’allaitement. Si l’administration est indispensable, l’allaitement doit être interrompu pendant une période de 12 heures et le lait produit doit être éliminé.
Des informations complémentaires concernant l’utilisation d’un médicament marqué au 68Ga pendant la grossesse et l’allaitement figurent dans le Résumé des Caractéristiques du Produit / la notice du médicament à radiomarquer.
Fertilité
Des informations complémentaires concernant l’utilisation d’un médicament marqué au 68Ga et son incidence sur la fécondité figurent dans le Résumé des Caractéristiques du Produit / la notice du médicament à radiomarquer.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les éventuelles réactions indésirables consécutives à l’utilisation d’un médicament marqué au 68Ga dépendront du médicament spécifique utilisé. Ces informations seront fournies dans le Résumé des Caractéristiques du Produit / la notice du médicament à radiomarquer.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
Aucun effet toxique n’est attendu du 68Ga libre après une administration par inadvertance de l’éluat. Le 68Ga libre administré se désintègre presque complètement en 68Zn inactif dans un court délai (97 % sont désintégrés en 6 heures). Pendant ce temps, 68Ga est principalement concentré dans le sang/plasma (lié à la transferrine) et dans l’urine. Le patient doit être hydraté pour augmenter l’élimination de 68Ga et une diurèse forcée ainsi qu’une vidange fréquente de la vessie sont recommandées.
La dose de rayonnements reçue par l’homme peut être évaluée grâce aux informations fournies à la rubrique 11.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Les propriétés pharmacodynamiques des médicaments marqués au 68Ga, préparés par radiomarquage avec Galliad avant l’administration dépendront de la nature du médicament à marquer. Se reporter au Résumé des Caractéristiques du Produit / à la notice du produit à radiomarquer.
Population pédiatrique
L’Agence européenne du médicament a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec Galliad dans tous les sous-groupes de la population pédiatrique, au motif d’une absence de bénéfice thérapeutique significatif par rapport aux traitements existants (voir rubrique 4.2 pour les informations sur l’utilisation pédiatrique). Cette dérogation ne s’étend cependant pas à toute utilisation diagnostique ou thérapeutique du produit lorsqu’il est lié à une molécule vectrice.
5.2. Propriétés pharmacocinétiques
Bien que la solution de chlorure de gallium (68Ga) ne soit pas destinée à une utilisation directe chez les patients, ses propriétés pharmacocinétiques ont été étudiées chez le rat.
5.3. Données de sécurité préclinique
Eluant intégré : acide chlorhydrique stérile 0,1 mol/L.
Il est important de bien nettoyer tout le matériel en verre, les aiguilles de seringue, etc. utilisés pour la préparation du médicament radiomarqué, afin de s’assurer qu’il n’y ait pas de traces d’impuretés métalliques. Seules les aiguilles de seringue ayant une résistance prouvée à l’acide dilué doivent être utilisées afin de minimiser les traces d’impuretés métalliques.
L’utilisation de bouchons en chlorobutyle sans revêtement pour le flacon d’élution est déconseillée, car ils peuvent contenir des quantités considérables de zinc extrait par l’éluat acide. En règle générale, quand disponible, il est recommandé d’utilisé les flacons fournis avec les kits de radiomarquage de la molécule vectrice ou un matériel identique ou équivalent à celui fourni comme kit de démarrage avec le générateur (voir rubrique 6.5 « accessoires fournis avec le générateur »).
Générateur radiopharmaceutique : 12 mois à partir de la date de calibration.
La date de calibration et la date d’expiration sont indiquées sur l’étiquette.
Eluat de chlorure de gallium (68Ga) : après élution, utiliser immédiatement l’éluat.
6.4. Précautions particulières de conservation
Générateur radiopharmaceutique : A conserver à une température ne dépassant pas 25 °C.
Les radiopharmaceutiques doivent être conservés conformément aux réglementations nationales relatives aux substances radioactives.
6.5. Nature et contenu de l'emballage extérieur
La colonne se compose d’une colonne en PEEK (polyétheréthercétone) qui est attachée à un port d’entrée en PEEK via des attaches de type HPLC. L’entrée de la colonne est connectée au contenant de l’éluant (PE/EVOH) par un système de dosage (PE/EVA/PVC/PC/PTFE) et une ligne C-flex alors que la sortie de colonne est connectée à une pièce de raccord qui traverse le coffrage extérieur du générateur radiopharmaceutique Galliad.
La colonne est contenue dans un radioblindage (Pb, W). Le blindage et le contenant de l’éluant sont sécurisés dans un coffrage extérieur en plastique.
Accessoires fournis avec le générateur :
5 flacons stériles de 10 mL pour élution ref: SVV-10A(Huayi)
5 tubes stériles ref : 1155.03 ou 1155.05 (Vygon)
5 aiguilles stériles 0.8 × 16mm 21G 5/8’’ ref : AN*2116R1 (Terumo)
5 connecteurs male luer-lock ref : 893.00 (Vygon)
Tailles des kits :
Les générateurs radiopharmaceutique sont fournis avec les activités 68Ge suivantes à la date de calibration: 0,74 GBq, 1,11 GBq, 1,48 GBq, 1,85 GBq. Le volume d’éluant fourni dans le générateur (610 mL) permet 450 élutions.
Vue en coupe du générateur radiopharmaceutique Galliad
Vue tridimensionelle du générateur radiopharmaceutique Galliad
Taille
Poids : approximativement 16,5 kg
6.6. Précautions particulières d’élimination et de manipulation
Mises en garde générales
Les produits radiopharmaceutiques doivent être réceptionnés, utilisés et administrés uniquement par des personnes autorisées dans des services cliniques agréés. Leur réception, leur conservation, leur utilisation, leur transfert et leur élimination sont soumis aux réglementations et/ou autorisations appropriées délivrées par l’organisme compétent officiel.
Les produits radiopharmaceutiques doivent être préparés de manière à satisfaire à la fois aux normes de radioprotection et de qualité pharmaceutique. Il convient de prendre des précautions appropriées pour garantir des conditions aseptiques.
Le générateur ne doit pas être démonté quelle qu’en soit la raison, étant donné que les composants internes peuvent être endommagés et entraîner éventuellement une fuite de matériel radioactif. De plus, le démontage du coffrage exposera l’opérateur au blindage en plomb/tungstène.
Les procédures d’administration doivent être appliquées de manière à minimiser le risque de contamination du médicament et l’irradiation des opérateurs. Un blindage approprié est obligatoire.
L’administration de produits radiopharmaceutiques présente des risques pour d’autres personnes en raison de l’irradiation externe ou de la contamination par les urines, les vomissements, etc. Par conséquent, des mesures de radioprotection doivent être prises conformément aux réglementations nationales.
Les générateurs arrivés en fin de vie doivent être retournés à IRE-ELiT. L’activité résiduelle du générateur doit être estimée avant le renvoi.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation locale en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Avenue de l’Espérance
B-6220 Fleurus
Belgique
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 550 579 0 1 : 1 générateur pour élution de 0,74 GBq, 1,11 GBq, 1,48 GBq, 1,85 GBq de 68Ge à la date de calibration.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Les tableaux de dosimétrie ci-dessous (tableaux 3 et 4) sont présentés afin d’évaluer la contribution du 68Ga non conjugué à la dose de rayonnements absorbés suite à l’administration du médicament marqué au 68Ga ou résultant d’une injection intraveineuse accidentelle de solution de chlorure de gallium (68Ga).
Les estimations de dosimétrie se basent sur une étude de distribution chez le rat et les calculs ont été effectués à l’aide du logiciel OLINDA - Organ Level INternal Dose Assessment. Les temps auxquels ont été effectuées les mesures étaient 5 minutes, 30 minutes, 60 minutes, 120 minutes, 180 minutes, et 360 minutes.
Tableau 3: Dose absorbée par unité d’activité administrée – administration par inadvertance chez les femmes
![]() Dose absorbée par unité de radioactivité administrée (mSv/MBq)
Dose absorbée par unité de radioactivité administrée (mSv/MBq)
|
Organe |
Adulte (57 kg) |
15 ans (50 kg) |
10 ans (30 kg) |
5 ans (17 kg) |
1 an (10 kg) |
Nouveau-né (5 kg) |
|
Surrénales |
0,0114 |
0,0112 |
0,0164 |
0,0238 |
0,0403 |
0,0782 |
|
Cerveau |
0,0180 |
0,0159 |
0,0176 |
0,0206 |
0,0292 |
0,0667 |
|
Seins |
0,0059 |
0,0058 |
0,0110 |
0,0163 |
0,0269 |
0,0545 |
|
Paroi de la vésicule biliaire |
0,0096 |
0,0092 |
0,0127 |
0,0201 |
0,0390 |
0,0750 |
|
Paroi du colon distal |
0,0032 |
0,0032 |
0,0050 |
0,0077 |
0,0133 |
0,0292 |
|
Intestin grêle |
0,0039 |
0,0039 |
0,0062 |
0,0099 |
0,0178 |
0,0376 |
|
Paroi de l’estomac |
0,0057 |
0,0056 |
0,0088 |
0,0133 |
0,0250 |
0,0502 |
|
Paroi du colon proximal |
0,0040 |
0,0039 |
0,0067 |
0,0104 |
0,0199 |
0,0425 |
|
Paroi du myocarde |
0,1740 |
0,1940 |
0,3010 |
0,4830 |
0,8730 |
1,7200 |
|
Reins |
0,0385 |
0,0421 |
0,0600 |
0,0888 |
0,1600 |
0,4150 |
|
Foie |
0,0972 |
0,0974 |
0,1480 |
0,2200 |
0,4270 |
0,9890 |
|
Poumons |
0,1860 |
0,2240 |
0,3190 |
0,4930 |
0,9840 |
2,7100 |
|
Muscles |
0,0073 |
0,0076 |
0,0131 |
0,0319 |
0,0622 |
0,0954 |
|
Ovaires |
0,0188 |
0,0203 |
0,0566 |
0,0988 |
0,2250 |
0,4590 |
|
Pancréas |
0,0187 |
0,0218 |
0,0406 |
0,0547 |
0,1120 |
0,3400 |
|
Moelle rouge |
0,0225 |
0,0256 |
0,0415 |
0,0777 |
0,1770 |
0,5710 |
|
Cellules ostéogènes |
0,1160 |
0,1140 |
0,1840 |
0,3100 |
0,7350 |
2,3500 |
|
Peau |
0,0029 |
0,0029 |
0,0044 |
0,0067 |
0,0122 |
0,0271 |
|
Rate |
0,0055 |
0,0056 |
0,0086 |
0,0130 |
0,0238 |
0,0492 |
|
Thymus |
0,0100 |
0,0102 |
0,0133 |
0,0190 |
0,0297 |
0,0570 |
|
Thyroïde |
0,2210 |
0,2980 |
0,4600 |
1,0200 |
1,9300 |
2,6300 |
|
Paroi vésicale |
0,0023 |
0,0022 |
0,0038 |
0,0063 |
0,0110 |
0,0222 |
|
Utérus |
0,0792 |
0,0802 |
1,3400 |
2.0300 |
3,6900 |
1,4700 |
|
Organisme entier |
0,0177 |
0,0178 |
0,0289 |
0,0468 |
0,0920 |
0,2340 |
|
Dose efficace (mSv/MBq) |
0,0483 |
0,0574 |
0,1230 |
0,2090 |
0,4100 |
0,7170 |
Tableau 4: Dose absorbée par unité d’activité administrée – administration par inadvertance chez les hommes
![]() Dose absorbée par unité de radioactivité administrée (mSv/MBq)
Dose absorbée par unité de radioactivité administrée (mSv/MBq)
|
Organe |
Adulte (70 kg) |
15 ans (50 kg) |
10 ans (30 kg) |
5 ans (17 kg) |
1 an (10 kg) |
Nouveau-né (5 kg) |
|
Surrénales |
0,0093 |
0,0112 |
0,0165 |
0,0235 |
0,0377 |
0,0749 |
|
Cerveau |
0,0134 |
0,0137 |
0,0148 |
0,0170 |
0,0241 |
0,0563 |
|
Seins |
0,0062 |
0,0074 |
0,0142 |
0,0213 |
0,0350 |
0,0725 |
|
Paroi de la vésicule biliaire |
0,0081 |
0,0096 |
0,0137 |
0,0213 |
0,0409 |
0,0803 |
|
Paroi du colon distal |
0,0015 |
0,0020 |
0,0031 |
0,0051 |
0,0091 |
0,0204 |
|
Intestin grêle |
0,0022 |
0,0029 |
0,0048 |
0,0080 |
0,0146 |
0,0309 |
|
Paroi de l’estomac |
0,0048 |
0,0066 |
0,0099 |
0,0153 |
0,0287 |
0,0560 |
|
Paroi du colon proximal |
0,0027 |
0,0033 |
0,0058 |
0,0094 |
0,0182 |
0,0385 |
|
Paroi du myocarde |
0,3030 |
0,3930 |
0,6110 |
0,9830 |
1,7800 |
3,4900 |
|
Reins |
0,0198 |
0,0241 |
0,0345 |
0,0510 |
0,0911 |
0,2310 |
|
Foie |
0,0766 |
0,1030 |
0,1570 |
0,2330 |
0,4500 |
1,0400 |
|
Poumons |
0,1340 |
0,2000 |
0,2850 |
0,4390 |
0,8720 |
2,3800 |
|
Muscles |
0,0051 |
0,0074 |
0,0129 |
0,0326 |
0,0636 |
0,0961 |
|
Pancréas |
0,0187 |
0,0257 |
0,0480 |
0,0646 |
0,1310 |
0,4030 |
|
Moelle rouge |
0,0138 |
0,0154 |
0,0243 |
0,0441 |
0,0980 |
0,3110 |
|
Cellules ostéogènes |
0,0431 |
0,0558 |
0,0901 |
0,1510 |
0,3560 |
1,1300 |
|
Peau |
0,0020 |
0,0024 |
0,0036 |
0,0057 |
0,0103 |
0,0232 |
|
Rate |
0,0041 |
0,0056 |
0,0084 |
0,0130 |
0,0227 |
0,0469 |
|
Testicules |
0,0011 |
0,0018 |
0,0075 |
0,0094 |
0,0138 |
0,0239 |
|
Thymus |
0,0139 |
0,0158 |
0,0194 |
0,0276 |
0,0417 |
0,0794 |
|
Thyroïde |
0,1980 |
0,3250 |
0,5020 |
1,1200 |
2,1100 |
2,8800 |
|
Paroi vésicale |
0,0011 |
0,0013 |
0,0022 |
0,0039 |
0,0070 |
0,0152 |
|
Organisme entier |
0,0115 |
0,0147 |
0,0237 |
0,0383 |
0,0748 |
0,1900 |
|
Dose efficace (mSv/MBq) |
0,0338 |
0,0506 |
0,0756 |
0,1340 |
0,2600 |
0,5550 |
La dose efficace résultant d’une activité de 250 MBq injectée par intraveineuse accidentellement est de 12,1 mSv pour une femme adulte de 57 kg et de 8,45 mSv pour un homme adulte de 70 kg.
Les données relatives à la dose de rayonnements de citrate de 68gallium, absorbée par les patients sont reprises dans le tableau 5 ci-dessous sont du ICRP 53 et peuvent être utilisées pour estimer la distribution après administration par inadvertance de 68gallium non lié, provenant de l’éluat du générateur, même si ces données ont été obtenues en utilisant un sel différent.
Tableau 5: Dose absorbée par unité d’activité de citrate de 68Ga administrée par inadvertance
![]() Dose absorbée par unité de radioactivité de citrate de 68Ga (mSv/MBq) administrée
Dose absorbée par unité de radioactivité de citrate de 68Ga (mSv/MBq) administrée
|
Organe Adulte |
15 ans |
10 ans |
5 ans |
1 an |
|
|
Surrénales |
0,034 |
0,044 |
0,064 |
0,088 |
0,140 |
|
Surfaces osseuses |
0,037 |
0,048 |
0,080 |
0,140 |
0,310 |
|
Sein |
0,014 |
0,014 |
0,023 |
0,037 |
0,074 |
|
Paroi du colon distal |
0,018 |
0,022 |
0,036 |
0,059 |
0,110 |
|
Intestin grêle |
0,064 |
0,080 |
0,140 |
0,230 |
0,450 |
|
Paroi de l’estomac |
0,014 |
0,017 |
0,027 |
0,044 |
0,084 |
|
Paroi du colon proximal |
0,053 |
0,064 |
0,110 |
0,180 |
0,360 |
|
Reins |
0,026 |
0,032 |
0,046 |
0,068 |
0,120 |
|
Foie |
0,027 |
0,035 |
0,053 |
0,079 |
0,150 |
|
Poumons |
0,013 |
0,016 |
0,025 |
0,041 |
0,080 |
|
Pancréas |
0,014 |
0,018 |
0,029 |
0,047 |
0,089 |
|
Moelle rouge |
0,046 |
0,064 |
0,110 |
0,210 |
0,450 |
|
Rate |
0,036 |
0,051 |
0,080 |
0,130 |
0,240 |
|
Testicules |
0,013 |
0,015 |
0,024 |
0,039 |
0,077 |
|
Thyroïde |
0,012 |
0,015 |
0,025 |
0,042 |
0,081 |
|
Paroi vésicale |
0,014 |
0,016 |
0,026 |
0,044 |
0,081 |
|
Autre tissu |
0,013 |
0,015 |
0,025 |
0,041 |
0,080 |
|
Dose efficace (mSv/MBq) |
0,027 |
0,034 |
0,056 |
0,095 |
0,190 |
Exposition aux rayonnements externes
La surface moyenne ou le rayonnement de contact pour le générateur radiopharmaceutique (68Ge/68Ga) est inférieur à 0,054 µSv/h par MBq de 68Ge. Par exemple, un générateur de 1,85 GBq atteindra un taux de surface moyen maximum de 100 µSv/h. Il est généralement recommandé de conserver le générateur dans un blindage auxiliaire, afin de minimiser la dose pour le personnel le manipulant.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
L’élution doit être réalisée en conditions aseptiques.
Déballage du générateur
1. Vérifiez que l’emballage d’expédition n’a pas été endommagé pendant le transport. En cas de dommages, effectuez un contrôle de rayonnements par frottis de la zone endommagée. Si les comptes dépassent 40 becquerel par 100 cm2, informez votre Responsable en radioprotection.
2. Avant d’ouvrir l’emballage, vérifiez à l’aide des flèches que la boîte est placée dans la bonne orientation. Vérifiez que les sceaux de sécurité ne sont pas cassés. Ensuite, coupez les sceaux et ouvrez les attaches. Retirez verticalement la partie supérieure de l’emballage. Retirez les petits rembourrages en mousse de la partie inférieure de l’emballage afin de pouvoir retirer le générateur.
3. Extrayez précautionneusement le générateur. Procédez à un contrôle des rayonnements.
ATTENTION : Risque de chute : Le générateur Galliad pèse environ 16,5 kg. Manipulez-le avec soin et fermement pour éviter les blessures potentielles. Si le générateur tombe ou si le dommage subi pendant le transport s’étend à l’intérieur de l’emballage d’expédition, vérifiez qu’il n’y a pas de fuites et effectuez un contrôle du générateur par frottis.
4. Effectuez un contrôle par frottis des inserts de l’emballage d’expédition et de la surface extérieure du générateur. Si les frottis dépassent 40 becquerel par 100 cm2, informez votre Responsable en radioprotection.
5. Vérifiez l’intégrité du coffrage et du port de sortie et des scellés à la recherche de dommages.
6. Ne retirez pas le bouchon du port de sortie avant l’installation du générateur ni avant d’être prêt à éluer.
Positionnement optimal
1. Le générateur doit toujours être en position verticale c’est-à-dire que le bouton vert de contrôle soit au-dessus.
2 Lors de l’installation du générateur radiopharmaceutique Galliad dans sa position finale, c’est-à-dire avec un dispositif de synthèse ou pour des élutions réalisées manuellement, il est recommandé de garder la conduite de sortie aussi courte que possible (maximum 50 cm) étant donné que la longueur de cette tubulure peut avoir un effet sur le rendement récupéré dans le flacon de réception/réaction.
3. L’utilisation d’un blindage auxiliaire est recommandée (en particulier lors d’une élution) et des équipements de protection individuelle pour les yeux et les mains doivent être utilisés.
Préparation
La connexion de tubes, d’aiguilles d'élution, lors de l’élution du générateur ainsi que d’autres activités exposant potentiellement la surface interne du générateur à l’environnement se doivent d’être effectuées en utilisant des techniques aseptiques et dans un environnement propre approprié en accord avec les requis nationaux en vigueur. En particulier, l'utilisation de gants et le nettoyage stérile des flacons est obligatoire avant utilisation. Dans le cas où le flacon doit être ouvert et fermé, le bouchon doit être placé à l'envers sur le banc.
2. Dévissez manuellement le bouchon du connecteur luer lock (fig. 1)

3. Connectez manuellement un tube stérile (ligne d’extension) au connecteur luer lock (fig. 2)
Par exemple, les produits référencés 1155.03 ou 1155.05 de Vygon sont appropriés. D’autres tubes stériles en polyéthylène pour usage parentéral sont également appropriés pour autant que le volume mort ne soit pas supérieur à 1 mL.

4. A. En cas d’utilisation d’un appareil de synthèse, connectez l’autre extrémité du tube à l’appareil de synthèse. Evitez les courbures trop fortes ou de pincer le tube.
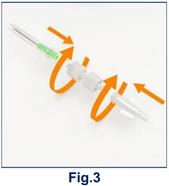
B. En cas d’élution manuelle, connectez une seringue stérile à l’autre extrémité du tube en utilisant un adaptateur Luer Lock mâle/mâle (fig. 3) Evitez les courbures trop fortes ou de pincer le tube.
Par exemple, le produit référencé AN*2116R1 0.8 X 16mm 21G ![]() de Terumo ainsi que le produit référencé 893.00 de Vygon sont appropriés. D’autres tubes stériles en polyéthylène pour usage parentéral sont également appropriés pour autant que le volume mort ne soit pas supérieur à 1 mL.
de Terumo ainsi que le produit référencé 893.00 de Vygon sont appropriés. D’autres tubes stériles en polyéthylène pour usage parentéral sont également appropriés pour autant que le volume mort ne soit pas supérieur à 1 mL.
5. Le générateur Galliad est maintenant prêt à l’emploi.
Elution
1. Préparez le matériel additionnel nécessaire :
- Un équipement de protection personnelle : les élutions doivent être réalisées en portant des protections pour les yeux et les mains, ainsi que des vêtements appropriés de laboratoire.
- Réceptacle blindé stérile pour le flacon de 10 mL en cas d’élution manuelle. Evitez les bouchons en chlorobutyle sans revêtement car ceux-ci contiennent des quantités considérables de zinc qui est extrait par l’acidité de l’éluat. En règle générale, lorsque disponible, il est recommandé d’utiliser les flacons fournis avec le traceur à marquer ou un matériel identique ou équivalent à celui fourni comme kit de démarrage avec le générateur (voir rubrique 6.5 « accessoires fournis avec le générateur »)
- En cas d’utilisation d’un appareil de radiosynthèse automatique, il est recommandé de placer une valve stérile de sécurité à usage unique entre l’adaptateur Luer Lock mâle/mâle et l’appareil de radiosynthèse automatique. Par exemple, le produit référencé MX745-01 de Smiths Medical est approprié.
2. Une technique de préparation aseptique doit être utilisée lors de l’assemblage, en particulier lors de la manipulation des ports. Ceci est indispensable au maintien de la stérilité.
3. Tournez le bouton vert de 90° en position d’élution et attendez pendant au moins 10 secondes (fig. 4).

4. Ensuite, tournez le bouton de 90° dans sa position initiale (fig. 5).
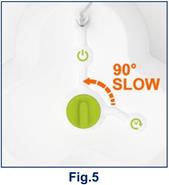
5. Le générateur est maintenant prêt pour l’élution que ce soit manuellement ou via un module de synthèse. Dans ce dernier cas, veuillez-vous reporter directement à l’étape 8 après que le marquage ait été réalisé par le module de synthèse.
6. Retirez le bouchon de la seringue et percez rapidement verticalement le centre de la cloison d’un flacon blindé stérile pour élution. (fig. 6). Attendez au moins 3 minutes pour que le processus d’élution ait lieu (un volume fixe de 1,1 mL est élué) et que la connexion soit drainée par l’air. Veuillez utiliser un blindage auxiliaire ou des mesures de radioprotection car la radioactivité sera transférée du générateur vers le flacon. Mesurez la solution à l’aide d’un calibrateur étalonné afin de déterminer le rendement. Veuillez corriger, en fonction de la désintégration, l’activité mesurée au moment du début de l’élution.
ATTENTION : Des flacons stériles sous vide d’une capacité de 10 mL sont appropriés mais il est recommandé d’éviter le contact entre l’éluat et des bouchons en halobutyle sans revêtement car ils peuvent contenir des quantités considérables de zinc ce qui pourrait éviter une étape de radiomarquage subséquente.

Fig. 6
7. Retirez l’aiguille du flacon et replacer le bouchon (figs. 7 et 8)

8. Déconnectez manuellement le tube du connecteur Luer Lock et placez le bouchon afin d’obturer le port de sortie du générateur (Figs. 9 et 10).

IMPORTANT : Au cas où le bouton n’a pas été replacé en position initiale après avoir été mis en position d’élution pendent une durée de plus de 6 heures, l’éluat doit être éliminé.
Première utilisation du générateur
IMPORTANT : lors de la première utilisation du générateur, une procédure de conditionnement doit être appliquée une seule fois avant utilisation pour radiomarquage. Elle consiste en 6 élutions consécutives à réaliser en 24 heures. Ces élutions peuvent être réalisées consécutivement (directement l’une après l’autre) si vous le désirez. Ensuite, les éluats suivants du générateur peuvent être utilisés pour le radiomarquage pour autant qu’ils proviennent d’une élution réalisée dans les 24 heures depuis la dernière élution. Ces conditions ne s’appliquent qu’aux premiers éluats destinés au radiomarquage endéans les 4 premiers jours (c’est-à-dire typiquement uniquement pendant la première semaine d’utilisation du générateur.).
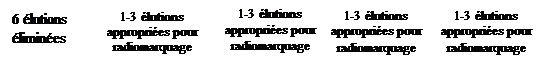
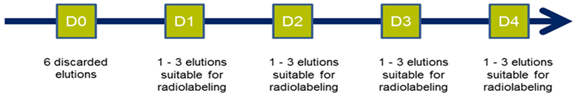
Il est recommandé de tester l’éluat pour la pénétration de 68Ge après les 6 premières élutions de conditionnement éliminées en comparant le niveau d’activité du 68Ga et du 68Ge. Pour plus de détails sur la méthode, prière de se référer à la version en vigueur de la monographie #2464 de la Ph. Eur.. La pénétration doit être testée au moment de la mise en service du générateur (après les 6 élutions de conditionnement prévues), et après six mois d'utilisation.
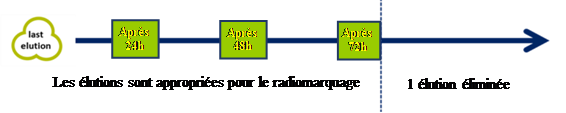
Elution continue en routine
Pendant la durée de vie du générateur, tous les éluats sont adéquats pour le radiomarquage en direct pour autant qu’une élution préliminaire ait été effectuée endéans les dernières 72 heures. Au cas où le marquage radiopharmaceutique est prévu et que le générateur n’a pas élué pendant cet intervalle, il est recommandé d’effectuer une élution à éliminer avant le radiomarquage.
 |
Si le générateur n’a pas été élué pendant plus d’un mois, trois élutions consécutives doivent être réalisées et éliminées et le premier éluat destiné au radiomarquage doit être extrait endéans les 24 heures suivantes.
 |
La solution éluée est une solution de chlorure de gallium (68Ga) transparente, stérile, incolore, dont le pH est situé entre 0,5 et 2,0 et dont la pureté radiochimique est de plus de 95%. Vérifiez la transparence de l’éluat avant utilisation et éliminez le si la solution n’est pas transparente.
IMPORTANT : Au cas où la colonne n’aurait pas été drainée complètement, (p.ex. à cause d’un vide incomplet dans le flacon), un nouveau flacon sous vide peut être connecté au port de sortie du générateur (via tubulure, connecteur et aiguille) pendant une minute. Dans ce cas, le bouton vert sur le générateur doit être dans la position d’élution/standby. Cette opération finalisera le drainage. Le contenu du nouveau flacon peut être utilisé s’il est utilisé immédiat. Si non, il doit être éliminé
Rendement d’élution de Galliad
L’activité indiquée sur l’étiquette du générateur Galliad est exprimée en 68Ge disponible à la date de calibration (12h00 HEC). L’activité 68Ga disponible dépend de l’activité 68Ge au moment de l’élution et du temps écoulé depuis l’élution précédente.
Un générateur Galliad à l’équilibre complet a un rendement de plus de 55 % de 68Ga.
Le rendement diminue avec la désintégration de 68Ge parent au fil du temps. Par exemple, après une désintégration de 9 mois (39 semaines), 68Ge sera réduit de 50 % (voir Tableau 6).
Tableau 6: Tableau de désintégration du 68Ge
|
Temps écoulé en semaines |
Facteur de désintégration |
Temps écoulé en semaines |
Facteur de désintégration |
|
1 |
0,98 |
27 |
0,62 |
|
2 |
0,96 |
28 |
0,61 |
|
3 |
0,95 |
29 |
0,59 |
|
4 |
0,93 |
30 |
0,58 |
|
5 |
0,91 |
31 |
0,57 |
|
6 |
0,90 |
32 |
0,56 |
|
7 |
0,88 |
33 |
0,55 |
|
8 |
0,87 |
34 |
0,54 |
|
9 |
0,85 |
35 |
0,53 |
|
10 |
0,84 |
36 |
0,52 |
|
11 |
0,82 |
37 |
0,52 |
|
12 |
0,81 |
38 |
0,51 |
|
13 |
0,79 |
39 |
0,50 |
|
14 |
0,78 |
40 |
0,49 |
|
15 |
0,76 |
41 |
0,48 |
|
16 |
0,75 |
42 |
0,47 |
|
17 |
0,74 |
43 |
0.46 |
|
18 |
0,72 |
44 |
0,45 |
|
19 |
0,71 |
45 |
0,45 |
|
20 |
0,70 |
46 |
0,44 |
|
21 |
0,69 |
47 |
0,43 |
|
22 |
0,67 |
48 |
0,42 |
|
23 |
0,66 |
49 |
0,42 |
|
24 |
0,65 |
50 |
0,41 |
|
25 |
0,64 |
51 |
0,40 |
|
26 |
0,63 |
52 |
0,39 |
Après une élution du générateur Galliad, le 68Ga s’accumulera par la désintégration continue du 68Ge parent. Il faut au moins 7 heures pour que le générateur atteigne pratiquement un rendement total après avoir été élué, mais dans la pratique l’élution du générateur est aussi possible après 3 heures.
Le tableau 7 montre le facteur d’accumulation de l’activité de 68Ga qui peut être élué après des temps compris entre 0 et 410 minutes depuis l’élution précédente :
Tableau 7: Facteurs d’accumulation de 68Ga
|
Temps écoulé en minutes |
Facteur d’accumulation |
Temps écoulé en minutes |
Facteur d’accumulation |
|
0 |
0,00 |
210 |
0,88 |
|
10 |
0,10 |
220 |
0,89 |
|
20 |
0,19 |
230 |
0,91 |
|
30 |
0,26 |
240 |
0,91 |
|
40 |
0,34 |
250 |
0,92 |
|
50 |
0,40 |
260 |
0,93 |
|
60 |
0,46 |
270 |
0,94 |
|
70 |
0,51 |
280 |
0,94 |
|
80 |
0,56 |
290 |
0,95 |
|
90 |
0,60 |
300 |
0,95 |
|
100 |
0,64 |
310 |
0,96 |
|
110 |
0,68 |
320 |
0,96 |
|
120 |
0,71 |
330 |
0,97 |
|
130 |
0,74 |
340 |
0,97 |
|
140 |
0,76 |
350 |
0,97 |
|
150 |
0,78 |
360 |
0,97 |
|
160 |
0,81 |
370 |
0,98 |
|
170 |
0,82 |
380 |
0,98 |
|
180 |
0,84 |
390 |
0,98 |
|
190 |
0,86 |
400 |
0,98 |
|
200 |
0,87 |
410 |
0,98 |
Exemples
Un générateur de 1,85 GBq à 12 semaines. Selon le tableau 6, l’activité de 68Ge sur la colonne peut être calculée comme suit :
1,85 GBq x 0,81 = 1,499 GBq
A l’équilibre complet, l’activité de 68Ga sur la colonne est aussi de 1,499 GBq.
Le générateur est élué et l’activité 68Ga recueillie est de 1,049 GBq ce qui correspond à un rendement caractéristique de 70 %.
Le même générateur est élué 4 heures plus tard. Les 7 heures requises pour atteindre l’équilibre 68Ge / 68Ga ne se sont pas écoulées, et l’activité 68Ga accumulée sur la colonne peut être calculée selon le tableau 7 comme suit :
1,499 GBq x 0,91 = 1,364 GBq
Avec un rendement caractéristique de 70 % 68Ga, l’activité collectée serait :
1,364 GBq x 0,70 = 955 MBq
Remarque :
L’activité de 68Ga dans l’éluat peut être mesurée pour vérifier la qualité en termes d’identité et de contenu. L’activité doit être mesurée immédiatement après l’élution, mais elle peut aussi être mesurée jusqu’à 5 périodes de demi-vie après l’élution.
En raison de la courte demi-vie de 68Ga qui est de 67,71 minutes, le temps écoulé entre l’élution et la mesure de l’activité doit être corrigé en fonction de la désintégration, pour déterminer le rendement réel au moment de l’élution en utilisant le tableau de désintégration de 68Ga, tableau 8.
Exemple
Un nouveau générateur 1,85 GBq est élué. L’activité de 68Ga mesurée 10 minutes après l’élution était de 1,169 GBq.
Le rendement au moment de l’élution peut être obtenu en divisant l’activité mesurée par le facteur correspondant du temps écoulé indiqué au tableau 8 :
1,169 GBq / 0,903 = 1,295 GBq
Ceci correspond à un rendement de 68Ga de 70 % au moment de l’élution:
1,295 GBq / 1,85 GBq x 100 % = 70 %
Tableau 8: Tableau de désintégration de 68Ga
|
Temps écoulé en minutes |
Facteur de désintégration |
Temps écoulé en minutes |
Facteur de désintégration |
|
1 |
0,990 |
35 |
0,700 |
|
2 |
0,980 |
36 |
0,693 |
|
3 |
0,970 |
37 |
0,686 |
|
4 |
0,960 |
38 |
0,679 |
|
5 |
0,950 |
39 |
0,672 |
|
6 |
0,941 |
40 |
0,665 |
|
7 |
0,931 |
41 |
0,658 |
|
8 |
0,922 |
42 |
0,652 |
|
9 |
0,912 |
43 |
0,645 |
|
10 |
0,903 |
44 |
0,639 |
|
11 |
0,894 |
45 |
0,632 |
|
12 |
0,885 |
46 |
0,626 |
|
13 |
0,876 |
47 |
0,619 |
|
14 |
0,867 |
48 |
0,613 |
|
15 |
0,868 |
49 |
0,607 |
|
16 |
0,850 |
50 |
0,601 |
|
17 |
0,841 |
51 |
0,595 |
|
18 |
0,832 |
52 |
0,589 |
|
19 |
0,824 |
53 |
0,583 |
|
20 |
0,816 |
54 |
0,577 |
|
21 |
0,807 |
55 |
0,571 |
|
22 |
0,799 |
56 |
0,565 |
|
23 |
0,791 |
57 |
0,559 |
|
24 |
0,783 |
58 |
0,554 |
|
25 |
0,775 |
59 |
0,548 |
|
26 |
0,767 |
60 |
0,543 |
|
27 |
0,759 |
61 |
0,537 |
|
28 |
0,752 |
62 |
0,532 |
|
29 |
0,744 |
63 |
0,526 |
|
30 |
0,737 |
64 |
0,521 |
|
31 |
0,729 |
65 |
0,516 |
|
32 |
0,722 |
66 |
0,510 |
|
33 |
0,714 |
67 |
0,505 |
|
34 |
0,707 |
68 |
0,500 |
Contrôle de la qualité
La clarté ainsi que le pH (<2) de la solution et la radioactivité doivent être vérifiés avant le radiomarquage.
Pénétration de 68Ge
Une petite quantité de 68Ge est lavée de la colonne à chaque élution. La pénétration de 68Ge est exprimée en pourcentage de 68Ga total élué de la colonne, corrigé en fonction de la désintégration. La pénétration de 68Ge n’est pas supérieure à 0,001 % de l’activité 68Ga éluée.
Lorsqu’il est utilisé conformément aux instructions ci-dessus, la pénétration reste inférieure à 0,001 % pendant la durée de vie entière du générateur (12 mois). Pour tester la pénétration de 68Ge, le niveau d’activité de 68Ga et de 68Ge dans l’éluat doivent être comparés. Pour de plus amples détails, veuillez-vous référer à la version en vigueur de la monographie 2464 de la Ph. Eur..
ATTENTION : La pénétration de 68Ge peut augmenter au-dessus de 0,001% si le générateur n’est pas élué pendant plus de 72 heures. Si le générateur n’a pas été utilisé pendant 72 heures ou plus, il doit être pré-élué (1 élution éliminée). Si le générateur n’a pas été élué pendant plus d’un mois, 3 élutions doivent être réalisées et éliminées, et le premier éluat destiné au radiomarquage doit être extrait endéans les 24 heures suivantes.
Liste I
Médicament réservé à l’usage hospitalier.
ANSM - Mis à jour le : 31/07/2018
Galliad, 0,74 à 1,85 GBq, générateur radiopharmaceutique
Solution de chlorure de gallium (68Ga)
![]() Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Vous pouvez y contribuer en signalant tout effet indésirable que vous observez. Voir en fin de rubrique 4 comment déclarer les effets indésirables.
Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Vous pouvez y contribuer en signalant tout effet indésirable que vous observez. Voir en fin de rubrique 4 comment déclarer les effets indésirables.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez le médecin spécialiste en médecine nucléaire qui supervisera la procédure.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin spécialiste en médecine nucléaire. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que Galliad et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant que la solution de chlorure de gallium (68Ga)obtenue avec Galliad ne soit utilisée ?
3. Comment utiliser la solution de chlorure de gallium (68Ga) obtenue avec Galliad ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver Galliad ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE GALLIAD ET DANS QUELS CAS EST-IL UTILISE ?
Galliad est un générateur radiopharmaceutique germanium (68Ge) / gallium (68Ga), un dispositif utilisé pour obtenir une solution de chlorure de gallium (68Ga).
La solution de chlorure de gallium (68Ga) obtenue est utilisée pour le radiomarquage, une technique lors de laquelle une substance est balisée (radiomarquée) avec un composé radioactif, dans le cas présent le 68Ga.
Galliad est utilisé pour marquer certains médicaments qui ont été spécialement développés et approuvés pour être utilisés avec la substance active, le chlorure de gallium (68Ga). Ces médicaments agissent en tant que vecteurs pour véhiculer le 68Ga radioactif, là où il est nécessaire. Il peut s’agir de substances qui ont été conçues pour reconnaître un type particulier de cellules dans l’organisme, y compris les cellules tumorales (cancer). La faible quantité de radioactivité administrée peut être détectée en dehors du corps, par des caméras spéciales.
Veuillez-vous référer à la notice du médicament qui doit être radiomarqué avec le chlorure de gallium (68Ga). Le médecin spécialiste en médecine nucléaire vous expliquera quel type d’examen sera effectué avec ce produit.
L’utilisation d’un médicament marqué au 68Ga implique l’exposition à de petites quantités de radioactivité. Votre médecin et le médecin spécialiste en médecine nucléaire ont considéré que le bénéfice clinique que vous retirerez de la procédure avec le radiopharmaceutique dépasse les risques dus aux rayonnements.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT QUE LE MEDICAMENT RADIOMARQUE AVEC GALLIAD NE SOIT ADMINISTRE ?
La solution de chlorure de gallium (68Ga) obtenue avec Galliad ne doit pas être utilisée
· Si vous êtes allergique au chlorure de gallium (68Ga) ou à l’un des autres composants contenus dans ce médicament (mentionnés à la rubrique 6).
Si vous utilisez un médicament marqué au 68Ga, vous devez lire les informations concernant les contre-indications sur la notice du produit à radiomarquer.
Avertissements et précautions
Pour les informations concernant les mises en garde spéciales et les précautions particulières à respecter lors de l’utilisation de médicaments marqués au 68Ga, veuillez-vous référez à la notice du médicament à radiomarquer.
Enfants et adolescents
Veuillez consulter votre spécialiste en médecine nucléaire si vous ou votre enfant êtes âgés de moins de 18 ans.
Autres médicaments et solution de chlorure de gallium (68Ga)
Informez votre médecin spécialiste en médecine nucléaire si vous prenez, avez récemment pris ou pourriez prendre d’autres médicaments, étant donné qu’ils peuvent interférer avec l’interprétation des images.
On ignore si le chlorure de gallium (68Ga) peut interagir avec d’autres médicaments, étant donné que des études spécifiques n’ont pas été réalisées.
Pour des informations concernant les interactions associées à l’utilisation de médicaments marqués au 68Ga, se référer à la notice du médicament à radiomarquer.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin spécialiste en médecine nucléaire avant de prendre des médicaments radiomarqués avec Galliad.
Vous devez informer votre médecin spécialiste en médecine nucléaire avant l’administration de médicaments radiomarqués avec Galliad, s’il est possible que vous soyez enceinte, si vous n’avez pas eu vos règles, ou si vous allaitez.
En cas de doute, il est important de consulter votre médecin spécialiste en médecine nucléaire, qui supervisera la procédure.
Si vous êtes enceinte
Le médecin spécialiste en médecine nucléaire administrera ce produit pendant la grossesse uniquement si le bénéfice attendu dépasse les risques.
Si vous allaitez
Il vous sera demandé d’arrêter l’allaitement. Veuillez demander à votre médecin spécialiste en médecine nucléaire quand vous pourrez recommencer à allaiter.
Conduite de véhicules et utilisation de machines
Des effets sur votre capacité à conduire des véhicules et utiliser des machines pourraient se faire ressentir en raison du médicament utilisé en combinaison avec Galliad. Veuillez lire attentivement la notice de ce médicament.
3. COMMENT UTILISER LA SOLUTION DE CHLORURE DE GALLIUM (68GA) OBTENUE AVEC GALLIAD ?
L’utilisation, la manipulation et l’élimination des produits radiopharmaceutiques sont strictement réglementées. Galliad sera utilisé exclusivement au sein de locaux spéciaux contrôlés. Ce produit sera manipulé et vous sera administré exclusivement par des personnes qualifiées et formées à l’utiliser en toute sécurité. Ces personnes prêteront une attention particulière à l’utilisation en toute sécurité de ce produit et vous informeront de leurs actions.
Le médecin spécialiste en médecine nucléaire supervisant la procédure décidera de la quantité de médicament radiomarqué avec Galliad à utiliser dans votre cas. La plus petite quantité nécessaire pour atteindre le résultat approprié, en fonction du produit final et de l’utilisation prévue sera administrée. Veuillez lire la notice du médicament à radiomarquer, pour de plus amples informations.
Administration de la solution de chlorure de gallium (68Ga)obtenue avec Galliad et déroulement de la procédure
Vous ne recevrez pas la solution de chlorure de gallium (68Ga) obtenue avec Galliad pure, mais un autre produit radiomarqué avec Galliad. La solution de chlorure de gallium (68Ga) obtenue avec Galliad doit être utilisé uniquement en association avec un autre médicament qui a été spécifiquement développé pour être associé (radiomarqué) à Galliad. Seul le produit final radiomarqué vous sera administré.
Durée de la procédure
Votre médecin spécialiste en médecine nucléaire vous informera de la durée habituelle de la procédure, après l’administration du médicament radiomarqué avec Galliad.
Après l’administration du médicament radiomarqué avec Galliad
Le médecin spécialiste en médecine nucléaire vous indiquera si vous devez respecter des précautions particulières après avoir reçu le médicament radiomarqué avec Galliad. Contactez votre médecin spécialiste en médecine nucléaire si vous avez des questions.
Si vous avez reçu plus de médicament radiomarqué avec Galliad que vous n’auriez dû
Le médicament radiomarqué avec Galliad étant manipulé par le médecin spécialiste en médecine nucléaire supervisant la procédure dans des conditions strictement contrôlées, un surdosage est peu probable. Cependant, en cas de surdosage, vous recevrez le traitement approprié.
Si vous avez d’autres questions concernant l’utilisation de ce produit, demandez plus d’informations au médecin spécialiste en médecine nucléaire qui supervise la procédure.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Après administration du médicament radiomarqué avec Galliad, il délivrera de faibles quantités de rayonnements ionisants, susceptibles d’induire un risque minimal de cancer et d’anomalies héréditaires.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER GALLIAD ?
Vous n’aurez pas à conserver ce médicament. La conservation de ce médicament se fera dans des locaux adaptés sous la responsabilité du spécialiste. Les produits radiopharmaceutiques seront conservés conformément à la réglementation nationale relative aux matières radioactives.
Les informations suivantes sont destinées uniquement au spécialiste :
Le générateur radiopharmaceutique ne doit pas être utilisé après la date de péremption indiquée sur le récipient après EXP.
Ne pas démonter le coffrage en acier inoxydable. A conserver à une température ne dépassant pas 25°C.
La solution de chlorure de gallium (68Ga) obtenue avec Galliad doit être utilisée immédiatement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est : solution de chlorure de gallium (68Ga)
· Les autres composants sont : dioxide de titane (matrice), acide hydrochlorique 0.1 N stérile (solution pour élution)
Qu’est-ce que Galliad et contenu de l’emballage extérieur
Vous n’aurez pas besoin d’obtenir ou de manipuler ce médicament.
Titulaire de l’autorisation de mise sur le marché
Avenue de l’Espérance
B-6220 Fleurus
Belgique
Exploitant de l’autorisation de mise sur le marché
Avenue de l’Espérance
B-6220 Fleurus
Belgique
Avenue de l’Espérance
B-6220 Fleurus
Belgique
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{MM/AAAA}
Les informations suivantes sont destinées exclusivement aux professionnels de la santé. Le RCP complet de Galliad figure sous la forme d’un document séparé dans l’emballage du produit, dans le but de fournir aux professionnels de la santé des informations scientifiques supplémentaires et des informations pratiques concernant l’administration et l’utilisation de ce produit radiopharmaceutique.
Veuillez-vous référer au RCP.