Dernière mise à jour le 02/02/2026
ACIDE TRANEXAMIQUE VIATRIS SANTE 0,5 g/5 mL, solution injectable
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable contient de l’acide tranexamique qui appartient à un groupe de médicaments dénommés antihémorragiques/antifibrinolytiques/acides aminés.
ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable est utilisé chez l’adulte et l’enfant à partir d’un an pour la prévention et le traitement de saignements résultant d’un processus qui inhibe la coagulation du sang, dénommé fibrinolyse.
Les indications spécifiques incluent :
· Règles abondantes chez la femme,
· Hémorragies gastrointestinales,
· Affections urinaires hémorragiques, suite à une intervention chirurgicale prostatique ou à des actes chirurgicaux affectant les voies urinaires,
· Chirurgie des oreilles, du nez ou de la gorge,
· Chirurgie cardiaque, abdominale ou gynécologique,
· Hémorragie consécutive à un traitement par un autre médicament destiné à dissoudre les caillots sanguins.
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 11/07/2018 | Inscription (CT) | Le service médical rendu par ACIDE TRANEXAMIQUE MYLAN 0,5 g/5 mL est : • important dans l’indication du traitement des ménorragies et métrorragies, |
| Modéré | Avis du 11/07/2018 | Inscription (CT) | Le service médical rendu par ACIDE TRANEXAMIQUE MYLAN 0,5 g/5 mL est : •modéré dans les autres indications de l’AMM : o traitement des hémorragies causées par une fibrinolyse générale ou locale telles que : • hémorragies gastro-intestinales, • affections urinaires hémorragiques, suite à une intervention chirurgicale prostatique ou des actes chirurgicaux affectant les voies urinaires, o traitement des hémorragies lors d’une intervention chirurgicale oto-rhino-laryngologique (adénoïdectomie, amygdalectomie), o prise en charge d’hémorragies dues à l’administration d’un agent fibrinolytique. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 11/07/2018 | Inscription (CT) | Cette spécialité n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité EXACYL 0,5 g/5 mL, solution injectable. |
ANSM - Mis à jour le : 19/08/2024
ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Acide tranexamique............................................................................................................. 500 mg
Pour une ampoule de 5 mL.
1 mL de solution contient 100 mg d’acide tranexamique.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide et incolore à pH 6,5-8,0.
4.1. Indications thérapeutiques
Les indications spécifiques incluent :
· Hémorragies causées par une fibrinolyse générale ou locale telles que :
o Ménorragies et métrorragies,
o Hémorragies gastro-intestinales,
o Affections urinaires hémorragiques, suite à une intervention chirurgicale prostatique ou des actes chirurgicaux affectant les voies urinaires,
· Intervention chirurgicale oto-rhino-laryngologique (adénoïdectomie, amygdalectomie, extractions dentaires),
· Intervention chirurgicale gynécologique ou affections d’origine obstétricale,
· Intervention chirurgicale thoracique et abdominale et autres interventions chirurgicales majeures telles qu’une chirurgie cardiovasculaire,
· Prise en charge d’hémorragies dues à l’administration d’un agent fibrinolytique.
4.2. Posologie et mode d'administration
Adultes
Sauf prescription contraire, les doses suivantes sont recommandées :
Traitement standard d’une fibrinolyse locale :
· 0,5 g (1 ampoule de 5 mL) à 1 g (2 ampoules de 5 mL) d’acide tranexamique par injection intraveineuse lente (= 1 mL/minute) deux à trois fois par jour.
Traitement standard d’une fibrinolyse générale :
· 1 g (2 ampoules de 5 mL) d’acide tranexamique par injection intraveineuse lente (= 1 mL/minute) toutes les 6 à 8 heures, équivalent à 15 mg/kg de poids corporel.
Insuffisance rénale
En cas d’insuffisance rénale conduisant à un risque d’accumulation, l’utilisation de l’acide tranexamique est contre indiquée chez les patients atteints d’une insuffisance rénale grave (voir rubrique 4.3). Chez les patients présentant une insuffisance rénale légère à modérée, la posologie de l’acide tranexamique doit être réduite en fonction du taux de créatinine sérique :
|
Créatinine sérique |
Dose I.V. |
Administration |
|
|
µmol/L |
mg/10 mL |
|
|
|
120 à 249 |
1.35 à 2.82 |
10 mg/kg de poids corporel |
Toutes les 12 heures |
|
250 à 500 |
2.82 à 5.65 |
10 mg/kg de poids corporel |
Toutes les 24 heures |
|
> 500 |
> 5.65 |
5 mg/kg de poids corporel |
Toutes les 24 heures |
Insuffisance hépatique
Aucun ajustement posologique n’est nécessaire chez les patients insuffisants hépatiques.
Population pédiatrique
Chez l’enfant à partir de 1 an, pour les indications actuellement approuvées et décrites à la rubrique 4.1, la posologie est de l’ordre de 20 mg/kg/jour. Cependant, les données concernant l’efficacité, la posologie et la sécurité d’emploi sont limitées pour ces indications.
L’efficacité, la posologie et la sécurité d’emploi de l’acide tranexamique chez les enfants subissant une intervention chirurgicale cardiaque n’ont pas été établies complètement. Les données actuellement disponibles sont limitées et décrites à la rubrique 5.1.
Population âgée
Aucune réduction de la posologie n’est nécessaire sauf en cas d’insuffisance rénale avérée.
Mode d’administration
L’administration doit être faite strictement par injection intraveineuse lente (voir la rubrique 6.6)
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1
· Thrombose veineuse ou artérielle aiguë (voir rubrique 4.4),
· Etats fibrinolytiques consécutifs à une coagulopathie de consommation, à l’exception d’états associés à une activation prédominante du système fibrinolytique avec une hémorragie grave aiguë (voir rubrique 4.4),
· Insuffisance rénale grave (risque d’accumulation),
· Antécédents de convulsions,
· Injections intrathécales et intraventriculaires, applications intracérébrales (risque d’œdème cérébral et de convulsions).
4.4. Mises en garde spéciales et précautions d'emploi
Les indications et le mode d’administration décrits ci-dessus doivent être strictement suivis :
· Les injections intraveineuses doivent être administrées très lentement,
· L’acide tranexamique ne doit pas être administré par voie intramusculaire.
Convulsions
Des cas de convulsions ont été rapportés en association avec un traitement par l’acide tranexamique. Lors d’une chirurgie de pontage aortocoronarien (PAC), la plupart de ces cas ont été signalés après une injection intraveineuse (IV) d’acide tranexamique à des doses élevées. Lorsque les doses plus faibles recommandées d’acide tranexamique étaient utilisées, l’incidence des crises post-opératoires était similaire à celle constatée chez des patients non traités.
Troubles visuels
Il faut prêter attention aux troubles visuels possibles, notamment une déficience visuelle, une vision trouble, une perturbation de la vision des couleurs. Si nécessaire, le traitement doit être interrompu. Des examens ophtalmologiques réguliers (examens de l’œil et notamment acuité visuelle, vision des couleurs, fond de l’œil, champ visuel, etc.) sont indiqués lors d’une utilisation continue et prolongée d’une solution injectable d’acide tranexamique. Si des changements ophtalmiques pathologiques sont observés, particulièrement en présence de maladies de la rétine, le médecin doit consulter un spécialiste afin de décider de la nécessité d’utiliser à long terme une solution injectable d’acide tranexamique dans chaque cas individuel.
Hématurie
En cas d’hématurie provenant des voies urinaires supérieures, il y a un risque d’obstruction urinaire aux niveaux inférieurs des voies urinaires.
Si elle n'est pas traitée, l'obstruction urinaire peut entraîner des conséquences graves telles qu'une insuffisance rénale, une infection des voies urinaires, une hydronéphrose et une anurie. Par conséquent, une surveillance étroite est recommandée pour les patients présentant une hématurie ou un risque d'hématurie des voies urinaires supérieures.
Evénements thromboemboliques
Les facteurs de risque de maladie thromboembolique doivent être pris en compte avant l’utilisation d’acide tranexamique. Chez les patients présentant des antécédents de maladies thromboemboliques ou chez les patients ayant une incidence accrue d’événements thromboemboliques dans leurs antécédents familiaux (patients à haut risque de thrombophilie), l’acide tranexamique solution injectable ne doit être administré qu’en présence d’une forte indication médicale, après consultation d’un spécialiste de l’hémostase et sous une stricte surveillance médicale (voir rubrique 4.3).
L’acide tranexamique doit être administré avec prudence chez les patientes recevant des contraceptifs oraux en raison du risque accru de thrombose (voir rubrique 4.5).
Coagulation intravasculaire disséminée
Dans la majorité des cas, les patients souffrant de coagulation intravasculaire disséminée ne doivent pas être traités par l’acide tranexamique (voir rubrique 4.3). L’administration d’acide tranexamique doit être restreinte aux personnes présentant une activation prédominante du système fibrinolytique avec hémorragie grave aiguë. Le profil hématologique se caractérise approximativement comme suit : diminution du temps de lyse des euglobulines; allongement du temps de Quick ; réduction des taux plasmatiques de fibrinogène, facteurs V et VIII, fibrinolysine issue du plasminogène et alpha 2 macroglobuline ; taux plasmatiques normaux de P et du complexe P (complexe prothrombinique), c’est à dire les facteurs II (prothrombine), VIII et X ; taux plasmatiques accrus de produits de dégradation du fibrinogène ; une numération normale des plaquettes sanguines. Ce qui précède suppose que l’état pathologique sous-jacent ne modifie pas lui-même les divers éléments de ce profil. En présence de tels cas aigus, une dose unique de 1 g d’acide tranexamique est souvent suffisante pour contrôler l’hémorragie. L’administration de l’acide tranexamique en cas de coagulation intravasculaire disséminée ne doit être envisagée que si des installations de laboratoire d’analyses hématologiques appropriées et un personnel qualifié sont disponibles.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les médicaments qui agissent sur l’hémostase doivent être administrés avec précaution aux patients traités par l’acide tranexamique. Il existe un risque théorique d’augmentation de la formation de thrombus, tel qu’avec les œstrogènes. Par ailleurs, l’effet antifibrinolytique du médicament peut être antagonisé avec des thrombolytiques.
4.6. Fertilité, grossesse et allaitement
Les femmes en âge de procréer
Les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement.
Grossesse
Il n’existe pas de données cliniques suffisantes sur l’utilisation de l’acide tranexamique chez la femme enceinte.
En conséquence, bien que les études effectuées chez l’animal n’aient pas mis en évidence d’effets tératogènes et en précaution d’emploi, l’acide tranexamique n’est pas recommandé pendant le premier trimestre de grossesse.
Les données cliniques limitées sur l’utilisation de l’acide tranexamique dans différentes situations cliniques hémorragiques pendant les deuxième et troisième trimestres n’ont pas mis en évidence d’effet délétère sur le foetus. L’acide tranexamique ne doit être utilisé pendant la grossesse que si le bénéfice escompté justifie le risque potentiel.
L’acide tranexamique est excrété dans le lait maternel. Par conséquent, l’allaitement n’est pas recommandé.
Fertilité
Il n’existe pas de données cliniques sur les effets de l’acide tranexamique sur la fécondité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucune étude n’a été réalisée sur l’aptitude à conduire des véhicules et à utiliser des machines.
Les effets indésirables, rapportés par les études cliniques et la pharmacovigilance post-commercialisation, sont repris ci-dessous par classe de systèmes d’organes.
Tableau reprenant la liste des effets indésirables
Les effets indésirables signalés sont présentés dans le tableau ci-dessous.
Les effets indésirables sont repris selon les classes principales de systèmes d’organes MedDRA. Au sein de chaque classe de systèmes d’organes, les effets indésirables sont présentés par fréquence. Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité. Les fréquences ont été définies comme suit : très fréquent (≥1/10) ; fréquent (≥1/100 à <1/10) ; peu fréquent (≥1/1000 à <1/100) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes d’organes MedDRA |
Fréquent ≥ 1/100 à < 1/10
|
Peu fréquent ≥ 1/1,000 à < 1/100
|
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
|
Affections du système immunitaire |
/ |
/ |
Réactions d’hypersensibilité, dont une anaphylaxie |
|
Affections du système nerveux |
/ |
/ |
Convulsions, particulièrement en cas de mésusage (voir les rubriques 4.3 et 4.4) |
|
Affections oculaires |
/ |
/ |
Troubles visuels, dont des troubles de la perception des couleurs |
|
Affections vasculaires |
/ |
/ |
Malaise avec hypotension, avec ou sans perte de conscience (généralement après une injection intraveineuse trop rapide, exceptionnellement après une administration par voie orale) Thrombose artérielle ou veineuse susceptible de survenir dans n’importe quel site |
|
Affections gastrointestinales |
Diarrhée Vomissement Nausées |
/ |
/ |
|
Affections de la peau et du tissu sous-cutané |
/ |
Dermite allergique |
/ |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Aucun cas de surdosage n’a été rapporté.
Les signes et symptômes peuvent inclure nausées, diarrhée, vertiges, céphalées, symptômes orthostatiques, hypotension, augmentation du risque de thrombose chez les personnes prédisposées, et convulsions. Il a été démontré que les convulsions tendent à survenir à une fréquence plus élevée lorsque la dose augmente.
La prise en charge d’un surdosage consiste en un traitement symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : antihémorragiques, antifibrinolytiques, amino-acides ;
Code ATC : B02AA02.
L'acide tranexamique développe une action antihémorragique par inhibition des activités fibrinolytiques de la plasmine.
Il se forme ainsi un complexe entre l'acide tranexamique et le plasminogène, l'acide tranexamique étant lié au plasminogène lors de sa transformation en plasmine.
L’activité du complexe entre l’acide tranexamique et la plasmine sur l’activité de la fibrine est moins forte que l’activité de la plasmine libre seule.
Les études in vitro ont démontré que l’acide tranexamique administré à des doses élevées réduit l’activité du complément.
Population pédiatrique
Chez l’enfant à partir d’un an :
Un examen de la littérature a permis d’identifier 12 études d’efficacité en chirurgie cardiaque pédiatrique, ayant inclus 1073 enfants, dont 631 ont reçu l’acide tranexamique. La plupart d’entre elles étaient des études contrôlées contre placebo. La population étudiée était hétérogène en termes d’âge, de type d’intervention chirurgicale et de schémas posologiques.
Les résultats des études suggèrent que l’acide tranexamique réduit les saignements et les besoins transfusionnels en chirurgie cardiaque pédiatrique sous circulation extracorporelle(CEC), et à haut risque d’hémorragie, en particulier chez les patients cyanosés ou réopérés.
Le schéma posologique le plus adapté semble être le suivant :
· Un premier bolus de 10 mg/kg après induction de l’anesthésie et avant l’incision cutanée,
· Une perfusion continue de 10 mg/kg/h,
· Une dernière injection de 10 mg/kg à la fin de la CEC.
Bien qu’ayant été étudiées sur un très petit nombre de patients, les données limitées, suggèrent que la perfusion maintient une concentration plasmatique thérapeutique tout au long de l’intervention.
Aucune étude effet dose spécifique n’a été conduite chez l’enfant.
5.2. Propriétés pharmacocinétiques
Les concentrations plasmatiques maximales d’acide tranexamique sont obtenues rapidement après une brève perfusion intraveineuse, ensuite les concentrations plasmatiques diminuent de manière multi-exponentielle.
Distribution
La liaison aux protéines plasmatiques de l’acide tranexamique est de l’ordre de 3 % aux niveaux plasmatiques thérapeutiques et semble résulter entièrement de sa liaison au plasminogène. L’acide tranexamique ne se lie pas à l’albumine sérique. Le volume de distribution initial est approximativement compris entre 9 et 12 litres.
L’acide tranexamique traverse le placenta. Après une injection intraveineuse de 10 mg/kg à 12 femmes enceintes, la concentration de l’acide tranexamique dans le sérum variait de 10 à 53 microgramme/mL alors que celle du sang du cordon ombilical variait de 4 à 31 microgramme/mL.
L’acide tranexamique diffuse rapidement dans le liquide articulaire et la membrane synoviale. Après une injection intraveineuse de 10 mg/kg à 17 patients subissant une chirurgie du genou, les concentrations dans les liquides articulaires étaient similaires aux concentrations observées dans les échantillons sériques correspondants.
La concentration de l’acide tranexamique dans un certain nombre d’autres tissus représente une fraction de la concentration observée dans le sang (lait maternel, un centième ; liquide céphalorachidien, un dixième ; humeur aqueuse, un dixième).
L’acide tranexamique a été détecté dans le sperme où il inhibe l’activité fibrinolytique mais n’a aucune répercussion sur la migration du sperme.
Élimination
L’acide tranexamique est excrété principalement dans l’urine sous forme inchangée. L’excrétion urinaire par filtration glomérulaire est la voie d’élimination principale. La clairance rénale est équivalente à la clairance plasmatique (110 à 116 ml/min). L’excrétion de l’acide tranexamique est d’environ 90 % dans les 24 premières heures qui suivent l’administration intraveineuse de 10 mg/kg poids corporel. La demi-vie d’élimination de l’acide tranexamique est approximativement de 3 heures.
Populations particulières
Insuffisance rénale
Les concentrations plasmatiques augmentent chez les patients souffrant d’insuffisance rénale.
Aucune étude de pharmacocinétique spécifique n’a été conduite chez l’enfant.
5.3. Données de sécurité préclinique
Une activité épileptogène a été observée chez l’animal lors d’utilisations intrathécales de l’acide tranexamique.
Eau pour préparations injectables.
3 ans.
Après ouverture :
La solution injectable est à usage unique.
Le produit doit être utilisé immédiatement, d'un point de vue microbiologique. La solution injectable inutilisée doit être jetée. En cas d'utilisation non immédiate, les durées et conditions de conservation avant utilisation relèvent de la responsabilité de l'utilisateur.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne pas congeler.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Boîte de 1, 5, 6 ou 10 ampoule(s) de 5 mL en verre de type I.
Chaque ampoule contient 500 mg d’acide tranexamique.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Ce médicament est à usage unique.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 315 2 7 : Ampoule (verre) de 5 mL. Boîte de 1.
· 34009 301 315 3 4 : Ampoule (verre) de 5 mL. Boîte de 5.
· 34009 301 315 4 1 : Ampoule (verre) de 5 mL. Boîte de 6.
· 34009 550 488 7 9 : Ampoule (verre) de 5 mL. Boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
ANSM - Mis à jour le : 19/08/2024
ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable
Acide tranexamique
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce qu’ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable ?
3. Comment utiliser ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable contient de l’acide tranexamique qui appartient à un groupe de médicaments dénommés antihémorragiques/antifibrinolytiques/acides aminés.
ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable est utilisé chez l’adulte et l’enfant à partir d’un an pour la prévention et le traitement de saignements résultant d’un processus qui inhibe la coagulation du sang, dénommé fibrinolyse.
Les indications spécifiques incluent :
· Règles abondantes chez la femme,
· Hémorragies gastrointestinales,
· Affections urinaires hémorragiques, suite à une intervention chirurgicale prostatique ou à des actes chirurgicaux affectant les voies urinaires,
· Chirurgie des oreilles, du nez ou de la gorge,
· Chirurgie cardiaque, abdominale ou gynécologique,
· Hémorragie consécutive à un traitement par un autre médicament destiné à dissoudre les caillots sanguins.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 ml, solution injectable ?
N’utilisez jamais ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable :
· Si vous êtes allergique à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Si vous souffrez actuellement d’une maladie susceptible d’entraîner des caillots sanguins,
· Si vous souffrez d’une affection, dénommée « coagulopathie de consommation », dans laquelle des caillots sanguins se forment dans l’ensemble des vaisseaux de l’organisme,
· Si vous avez des problèmes rénaux,
· Si vous avez des antécédents de convulsions.
En raison du risque d’œdème cérébral et de convulsions, les injections intrathécales et intraventriculaires, ainsi que les applications intracérébrales ne sont pas recommandées.
Si vous pensez être dans l’un de ces cas, ou en cas de doute, informez votre médecin avant de prendre ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable.
Si vous vous trouvez dans l’un des cas suivants, informez votre médecin afin qu’il puisse décider si ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable vous convient :
· Si vous avez présenté du sang dans les urines, ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable peut entraîner une obstruction des voies urinaires,
· Si vous présentez un risque de caillot sanguin,
· Si vous présentez une coagulation ou une hémorragie excessives touchant l’ensemble de votre organisme (coagulation intravasculaire disséminée), ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable peut ne pas vous convenir, sauf si vous présentez une hémorragie grave aiguë et qu’une analyse sanguine a révélé que le processus qui inhibe la coagulation du sang, dénommé fibrinolyse, est activé.
· Si vous avez été sujet à des convulsions, ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable ne doit pas vous être administré. Votre médecin doit utiliser la dose la plus faible possible pour éviter la survenue de convulsions après un traitement par ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable.
· Si vous êtes sous traitement de longue durée par ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable, il faut prêter attention à de possibles perturbations de la vision des couleurs et, si nécessaire, le traitement doit être interrompu. Des examens ophtalmologiques réguliers (examens de l’œil et notamment acuité visuelle, vision des couleurs, fond de l’œil, champ visuel, etc.) sont indiqués lors de l’utilisation continue et prolongée d’une solution injectable d’ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL. Si des changements ophtalmiques pathologiques sont observés, particulièrement en présence de maladies de la rétine, votre médecin doit consulter un spécialiste afin de décider de la nécessité d’utiliser à long terme une solution injectable d’ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL dans votre cas personnel.
Enfants et adolescents
Sans objet.
Autres médicaments et ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Vous devez tout spécialement informer votre médecin si vous prenez :
· D’autres médicaments susceptibles de favoriser la coagulation du sang, dénommés antifibrinolytiques,
· Des médicaments qui préviennent la formation de caillots sanguins, dénommés thrombolytiques,
· Des contraceptifs oraux.
ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable avec des aliments, boissons et de l’alcool
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
L’acide tranexamique est excrété dans le lait maternel. Par conséquent, l’utilisation d’ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable pendant l’allaitement n’est pas recommandée.
Conduite de véhicules et utilisation de machines
Aucune étude n’a été réalisée sur l'aptitude à conduire des véhicules et à utiliser des machines.
ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable contient les excipients suivants
Sans objet.
3. COMMENT UTILISER ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable ?
Votre médecin déterminera la dose qui vous convient et la durée pendant laquelle vous devrez la prendre.
Utilisation chez les enfants
Si ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable, est administré à un enfant à partir d’un an, la dose sera fonction du poids de l’enfant.
Votre médecin déterminera la dose qui convient à l’enfant et la durée pendant laquelle il devra la prendre.
Utilisation chez les sujets âgés
Aucune réduction posologique n’est nécessaire sauf en cas d’insuffisance rénale avérée.
Utilisation chez les patients insuffisants rénaux
Si vous avez un problème rénal, votre dose d’acide tranexamique sera réduite d’après les résultats d’un test réalisé sur votre sang (taux de créatinine sérique).
Utilisation chez les patients insuffisants hépatiques
Aucune réduction posologique n’est nécessaire.
Mode et voie d'administration
ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable, doit être impérativement administré lentement dans une veine.
ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable, ne doit pas être injecté dans un muscle.
Instruction pour ouvrir l’ampoule :
Tenir fermement l’ampoule (schéma 1).

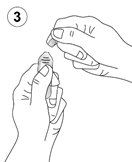
 Saisir la tête de l’ampoule entre le pouce et l’index, puis exercer une pression vers l’arrière (schémas 2 et 3).
Saisir la tête de l’ampoule entre le pouce et l’index, puis exercer une pression vers l’arrière (schémas 2 et 3).
Si vous avez reçu plus d’ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable que vous n’auriez dû
Si vous avez reçu plus d’ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable que la dose recommandée, il se peut que vous soyez sujet à : des nausées, diarrhée, vertiges, céphalées, diminution de la pression artérielle avec sensation de vertiges au lever brutal, augmentation du risque de formation de caillots sanguin chez les personnes prédisposées et convulsions. Adressez-vous à un médecin ou à un pharmacien immédiatement.
Si vous oubliez d’utiliser ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable
Si vous arrêtez d’utiliser ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables rapportés avec ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable
Les effets indésirables suivants ont été observés avec ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable :
Fréquent (peuvent affecter jusqu’à 1 personne sur 10)
· Effets sur l’estomac et les intestins : nausées, vomissements, diarrhée.
Peu fréquent (peuvent affecter entre 1 et 10 personnes sur 1000)
· Effets sur la peau : éruption cutanée.
Fréquence indéterminée (ne peut être estimée au vue des données disponibles)
· Malaise avec hypotension (hypotension artérielle), surtout si l’injection est administrée trop rapidement.
· Caillots sanguins.
· Effets sur le système nerveux : convulsions.
· Effets sur les yeux : perturbations de la vision, notamment un trouble de la vision des couleurs.
· Effets sur le système immunitaire : réactions allergiques.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
Après ouverture :
La solution injectable est à usage unique.
Le produit doit être utilisé immédiatement, d'un point de vue microbiologique. La solution injectable inutilisée doit être jetée. En cas d'utilisation non immédiate, les durées et conditions de conservation avant utilisation relèvent de la responsabilité de l'utilisateur.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne pas congeler.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ACIDE TRANEXAMIQUE VIATRIS SANTÉ 0,5 g/ 5 mL, solution injectable
· La substance active est :
Acide tranexamique....................................................................................................... 500 mg
Pour une ampoule de 5 mL.
1 mL de solution contient 100 mg d’acide tranexamique.
· L’autre composant est : Eau pour préparations injectables.
Ce médicament se présente sous forme d’une solution injectable, conditionnée en ampoule en verre de 5 mL, contenant 500 mg d’acide tranexamique.
Boîte de 1, 5, 6 ou 10 ampoule(s) de 5 mL en verre de type I.
Chaque ampoule contient 500 mg d’acide tranexamique.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
48 Iapetou street
Agios Athanassios Industrial Area
4101 Agios Athanassios, Limassol
Chypre
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).