Dernière mise à jour le 02/02/2026
CLARELUX 500 microgrammes/g, mousse pour application cutanée en flacon pressurisé
Indications thérapeutiques
Classe pharmacothérapeutique : Corticostéroïdes d’activité très forte, Code ATC : D07AD01.
CLARELUX contient du propionate de clobétasol comme substance active. Le propionate de clobétasol appartient à un groupe de médicaments appelés corticostéroïdes topiques très puissants.
CLARELUX est une mousse à appliquer sur la peau.
CLARELUX est utilisé, chez l’adulte et l’adolescent à partir de 12 ans, dans le traitement de courte durée des dermatoses du cuir chevelu sensibles aux corticostéroïdes, telles que le psoriasis, ne répondant pas de façon satisfaisante à des corticostéroïdes moins forts.
Présentations
> 1 flacon(s) pressurisé(s) aluminium de 100 g
Code CIP : 216 582-8 ou 34009 216 582 8 6
Déclaration de commercialisation : 27/03/2013
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 8,42 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 9,44 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 21/11/2018 | Renouvellement d'inscription (CT) | le service médical rendu par CLARELUX reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 03/10/2012 | Inscription (CT) | CLARELUX n'apporte pas d'amélioration du service médical rendu (ASMR V) par rapport à CLOBEX, shampooing dans le traitement de courte durée des dermatoses du cuir chevelu sensibles aux corticoïdes, telles que le psoriasis, ne répondant pas de manière satisfaisante à des corticoïdes moins puissants. |
ANSM - Mis à jour le : 08/09/2025
CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un gramme de mousse pour application cutanée contient 500 microgrammes de propionate de clobétasol.
500 microgrammes de clobétasol propionate sont équivalents à 440 microgrammes de clobétasol.
Excipients à effet notoire :
Chaque gramme de mousse pour application cutanée contient 604,3 mg d’éthanol, 20,9 mg de propylène glycol (E1520), 11,5 mg d’alcool cétylique,5,2 mg d’alcool stéarylique et 4,2 mg de polysorbate 60 (E435).
Pour la liste complète des excipients, voir rubrique 6.1.
Mousse pour application cutanée en flacon pressurisé.
Mousse blanche qui fond au contact de la peau.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Posologie
CLARELUX est un corticostéroïde topique d’activité très forte ; il faut donc limiter le traitement à 2 semaines consécutives et ne pas utiliser des quantités supérieures à 50 g/semaine.
Voie d’administration : voie cutanée.
CLARELUX doit être appliqué sur la zone affectée, deux fois par jour. Il n’existe aucune donnée issue d’études cliniques évaluant l’efficacité d’une seule application quotidienne.
Des cures répétées par CLARELUX peuvent être utilisées pour contrôler les exacerbations à condition que le patient soit sur surveillance médicale régulière (voir rubrique 4.4).
Population pédiatrique
CLARELUX n’est pas recommandé chez les enfants âgés de moins de 12 ans (voir rubrique 5.1).
Mode d’administration
Par voie cutanée.
La mousse a été conçue de telle manière que la préparation s’étale facilement sans être trop fluide et permette une application facile directement sur la zone affectée.
Remarque : pour une distribution correcte de la mousse, tenir le flacon la tête en bas et appuyer sur le bec diffuseur.
Retourner le flacon et déposer une petite quantité (l’équivalent d’une noix ou d’une cuillère à café) de CLARELUX directement sur les lésions, ou déposer une petite quantité dans le bouchon du flacon, sur une soucoupe ou une autre surface froide, en veillant à éviter tout contact avec les yeux, le nez et la bouche. Il est déconseillé de déposer la mousse directement dans les mains, car elle commence à fondre dès qu’elle entre en contact avec la chaleur de la peau. Masser doucement au niveau de la zone affectée jusqu’à disparition et absorption de la mousse. Répéter l’opération jusqu’à ce que toute la zone affectée soit traitée. Ecarter les cheveux de la zone affectée pour appliquer la mousse sur chaque zone affectée.
Éviter tout contact avec les yeux, le nez et la bouche.
Ne pas utiliser à proximité d’une flamme nue.
Les mains doivent être soigneusement lavées après l’application du produit.
CLARELUX est contre-indiqué chez les patients atteints de lésions ulcérées, de brûlures, de rosacée, d’acné, de dermatite péri-orale, de prurit génital ou péri-anal.
L’utilisation de CLARELUX est contre-indiquée dans le traitement des lésions cutanées primitivement infectées d'origine parasitaire, virale, fongique ou bactérienne.
CLARELUX :
· ne doit pas être appliqué sur le visage,
· est contre-indiqué chez les nourrissons âgés de moins de 2 ans (voir rubrique 4.3),
· ne doit pas être appliqué sur les paupières (risque de glaucome et cataracte).
4.4. Mises en garde spéciales et précautions d'emploi
Mise en garde
Hypersensibilité
CLARELUX doit être utilisé avec précautions chez les patients ayant des antécédents d’hypersensibilité locale aux corticostéroïdes ou à l’un des excipients du produit. Les réactions locales d’hypersensibilité (voir rubrique 4.8) peuvent ressembler aux symptômes de la maladie sous traitement.
Le traitement doit être interrompu immédiatement si des signes d’hypersensibilité apparaissent.
Inhibition surrénalienne
Des manifestations d’hypercortisolisme (syndrome de Cushing) et d’inhibition réversible de l’axe hypothalamo-pituito-surrénalien, entraînant une insuffisance en gluco-corticostéroïdes peuvent survenir chez certains individus, en particulier chez les enfants, en raison d’une absorption systémique accrue des stéroïdes topiques.
Si l’une des manifestations ci-dessus est observée, le traitement doit être arrêté progressivement en réduisant la fréquence des applications ou en le substituant par un corticostéroïde moins puissant. L’arrêt brutal du traitement peut entrainer une insuffisance en glucocorticostéroïdes (voir rubrique 4.8).
Un traitement corticostéroïde topique continu à long terme est à proscrire car il peut provoquer la suppression de la fonction surrénalienne, même en l’absence d’utilisation de pansements occlusifs. Dès l’amélioration des lésions ou après une période de traitement maximale de deux semaines, il faut passer à un traitement intermittent ou envisager la substitution par un corticostéroïde d’activité plus faible.
Utilisation à long terme
Des cas d’ostéonécrose, d’infections graves (y compris de fasciite nécrosante) et d’immunosuppression systémique (entraînant parfois des lésions réversibles du sarcome de Kaposi) ont été signalés lors de l’utilisation à long terme du propionate de clobétasol à des doses supérieures à celles recommandées (voir rubrique 4.2).
Dans certains cas, les patients ont utilisé simultanément d’autres corticostéroïdes ou immunosuppresseurs puissants par voie orale/topique (par exemple, méthotrexate, mycophénolate mofétil). Si le traitement par des corticostéroïdes locaux est cliniquement justifié au-delà de 2 semaines, une préparation corticostéroïde d’activité moins forte doit être envisagé.
Infections et infestations
L’utilisation de CLARELUX sur les plaies et les ulcérations n’est pas recommandée.
Une infection secondaire peut se développer ; la chaleur et l’humidité induites par l’utilisation de pansements occlusifs favorisent l’infection bactérienne. La peau doit donc être nettoyée avant l’application d’un nouveau pansement.
Toute propagation d’une infection nécessite l’arrêt du traitement local par corticostéroïde et nécessite l’administration d’un traitement antimicrobien approprié.
Troubles visuels
Des troubles visuels peuvent apparaitre avec l’utilisation d’une corticothérapie par voie systémique ou locale. Si un patient présente des symptômes tels qu’une vision floue ou l’apparition de tout autre trouble visuel au cours d’une corticothérapie, un examen ophtalmologique est requis afin de rechercher notamment une cataracte, un glaucome, ou une lésion plus rare telle qu’une choriorétinopathie séreuse centrale, décrits avec l’utilisation de corticostéroïdes par voie systémique ou locale
La corticothérapie systémique est associée à la formation de glaucome et cataracte. Ce risque a également été rapporté pendant un traitement ophtalmique et pendant une application locale et régulière de corticostéroïde sur les paupières. De plus, des cas de cataracte et de glaucome ont été rapportés chez des patients après utilisation excessive et prolongée de corticostéroïdes topiques puissants sur le visage et/ou le corps. Bien que l’effet hypertenseur du corticostéroïde topique soit généralement réversible après l’arrêt du traitement, les troubles visuels résultant du glaucome et de la cataracte sont irréversibles.
Précautions d’emploi
Augmentation de l’absorption des stéroïdes topiques
Une augmentation de l’absorption des stéroïdes topiques peut entrainer l’apparition d’effets indésirables systémiques (ex : inhibition surrénalienne, immunosuppression). L’augmentation de l’absorption systémique des stéroïdes topiques peut être facilitée par :
· une exposition prolongée,
· une application sur des zones étendues,
· une utilisation sur des zones de peau occluse (ex : au niveau des plis cutanés ou sous pansement occlusif),
· une utilisation sur des zones fines (ex : le visage),
· une utilisation sur une peau éraflée ou lorsque la barrière cutanée est altérée,
· et une augmentation de l’hydratation de la couche cornée.
CLARELUX ne doit pas être utilisé avec des pansements occlusifs sans supervision par un médecin.
Phénomène de rebond
L'utilisation à long terme des corticoïdes locaux peut entraîner le développement d’un phénomène de rebond après l'arrêt du traitement (réaction de sevrage des corticoïdes locaux). Une forme sévère de ce phénomène de rebond peut se développer. Elle peut se manifester par une dermatite avec des rougeurs intenses, des picotements et des brûlures qui peuvent s'étendre au-delà de la zone initialement traitée. Ce phénomène de rebond est plus susceptible de se produire lors du traitement de sites cutanés sensibles tels que le visage et les zones de flexion et il peut être observé en cas d’arrêt brutal après une utilisation prolongée. Cet effet peut être minimisé en arrêtant progressivement le traitement ou en le substituant par un corticostéroïde d’activité moins forte.
En cas de réapparition des symptômes dans les jours ou semaines suivant un traitement réussi, une réaction de sevrage doit être suspecté. La décision de réappliquer le produit doit être prise avec prudence et l'avis d'un spécialiste est recommandé pour éventuellement envisager d'autres options de traitement.
L’utilisation de corticostéroïdes topiques peut s’avérer risquée car des récidives liées à un rebond peuvent survenir suite au développement d'une dépendance. Les patients peuvent également être exposés au risque de développer un psoriasis pustuleux généralisé et une toxicité locale ou systémique due à une altération de la fonction barrière de la peau. Il est important de surveiller attentivement le patient.
Affections oculaires
CLARELUX ne doit pas être appliqué sur les paupières (voir rubrique 4.3).
Les patients doivent se laver les mains après chaque utilisation pour éviter une contamination des yeux avec CLARELUX. Si CLARELUX entre en contact avec les yeux, l’œil atteint doit être rincé abondamment à l’eau.
La cataracte et le glaucome doivent être dépistés régulièrement chez les patients suivant une corticothérapie locale puissante prolongée et particulièrement chez les patients ayant des facteurs de risque connu pour la cataracte (ex : diabétiques, fumeurs) ou pour le glaucome (ex : antécédent personnel ou familial de glaucome).
Population pédiatrique
CLARELUX ne doit pas être utilisé chez les enfants âgés de moins de 12 ans (voir rubrique 5.1).
Excipients à effet notoire
Ce médicament contient :
· 2 145 mg d’éthanol par application, qui peut provoquer une sensation de brûlure sur une peau endommagée,
· 74 mg de propylène glycol (E1520) par application,
· de l’alcool cétylique et de l’alcool stéarylique qui peuvent provoquer des réactions cutanées locales (par exemple dermatite de contact),
· du polysorbate 60 (E435) qui peut provoquer des réactions allergiques.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
4.6. Fertilité, grossesse et allaitement
Grossesse
Chez l’animal, l’administration de corticostéroïdes pendant la gestation peut causer des anomalies du développement fœtal (voir rubrique 5.3).
Aucune étude adéquate et bien contrôlée n’a été réalisée avec le propionate de clobétasol chez la femme enceinte. Des études épidémiologiques réalisées chez des femmes enceintes ayant absorbé des corticostéroïdes par voie orale ont révélé un risque faible ou nul de fente palatine. Des données limitées suggèrent un faible risque de faible poids de naissance en cas d’utilisation pendant la grossesse de grandes quantités de corticostéroïdes topiques d’activité forte/très forte comme le propionate de clobétasol.
CLARELUX en flacon pressurisé ne doit pas être utilisé pendant la grossesse sauf en cas d’absolue nécessité.
La sécurité d’utilisation du propionate de clobétasol n’a pas été établie pendant l’allaitement.
Les glucocorticostéroïdes passent dans le lait maternel. CLARELUX ne doit donc pas être utilisé chez la femme qui allaite, sauf en cas d’absolue nécessité.
Fertilité
Il n’existe aucune donnée clinique permettant d’évaluer l’effet des corticostéroïdes topiques sur la fertilité.
L’administration de clobétasol par voie sous-cutanée à des rats a entraîné une diminution de la fertilité des femelles en cas d’utilisation de la dose la plus élevée (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
Résumé du profil de sécurité
L’utilisation prolongée de quantités importantes ou le traitement de surfaces étendues peut donner lieu à une suppression surrénalienne, comme c’est le cas avec les autres corticostéroïdes topiques. Cet effet est susceptible d’être temporaire si la posologie hebdomadaire ne dépasse pas 50 g chez les adultes.
Un traitement prolongé et intensif par une préparation à base d’un corticostéroïde d’activité très forte peut causer des modifications atrophiques cutanées locales telles qu’une atrophie cutanée, des ecchymoses secondaires à une atrophie cutanée, une fragilité cutanée, des télangiectasies, en particulier sur le visage, des vergetures touchant particulièrement la partie proximale des membres.
Les autres effets indésirables locaux associés à l’utilisation de glucocorticostéroïdes incluent une dermatite péri-orale, une dermatite de type rosacée, un retard de cicatrisation, un phénomène de rebond (réaction de sevrage des corticoïdes locaux) pouvant donner lieu à une dépendance aux corticostéroïdes et des effets oculaires. L’élévation de la pression intraoculaire et un risque accru de cataracte et une vision floue sont des effets indésirables connus des glucocorticostéroïdes (voir rubrique 4.4).
Dans de rares cas, le traitement d’un psoriasis par des corticostéroïdes (ou leur arrêt) semble avoir induit la forme pustuleuse de la maladie (voir rubrique 4.4).
Une infection secondaire peut se développer ; la chaleur et l’humidité induites par l’utilisation de pansements occlusifs favorisent l’infection bactérienne. Il faut donc nettoyer la peau avant d’appliquer un nouveau pansement. Si le produit n’est pas correctement utilisé, des infections bactériennes, virales, parasitaires et fongiques peuvent être masquées et/ou aggravées. Une folliculite a également été rapportée.
Une allergie de contact à CLARELUX ou à l’un des excipients peut également survenir. En cas d’apparition de signes d’une hypersensibilité, le traitement doit être immédiatement interrompu. Une exacerbation des symptômes peut alors survenir.
Les effets indésirables les plus fréquemment observés lors des études cliniques réalisées avec la mousse pour application cutanée à base de propionate de clobétasol étaient des réactions au site d’application incluant des brûlures (5 %) et d’autres réactions non spécifiées (2 %).
Tableau des effets indésirables
Les effets indésirables observés lors de l’utilisation de propionate de clobétasol dans les études cliniques sont répertoriés ci-dessous par classe d’organe et selon les fréquences suivantes : très fréquent (³ 1/10), fréquent (³ 1/100, < 1/10), peu fréquent (³ 1/1 000, < 1/100), rare (³ 1/10 000, < 1/1 000) et très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Les données post-commercialisation concernant les effets indésirables rapportés lors de l'utilisation de propionate de clobétasol sont également classées par classe de systèmes d'organes et répertoriées dans les fréquences indéterminées (ne peut être estimée sur la base des données disponibles).
|
Classe d’organe |
Fréquent |
Très rare |
Fréquence indéterminée |
|
Infections et infestations |
|
|
Infections secondaires Folliculite |
|
Affectations endocriniennes |
|
Inhibition de l’axe hypothalamo-pituito-surrénalien |
|
|
Affections du système nerveux |
|
Paresthésies |
|
|
Affections oculaires |
|
Irritation oculaire |
Cataracte Vision floue (voir rubrique 4.4) |
|
Affections vasculaires |
|
Vasodilatation |
|
|
Affections de la peau et du tissu sous-cutané |
|
Dermatite Dermatite de contact Aggravation du psoriasis Irritation Douleur de peau Tension cutanée |
Modifications de la pigmentation Hypertrichose Réaction de sevrage des corticoïdes locaux (voir rubrique 4.4)* |
|
Troubles généraux et anomalies au site d’administration |
Brûlure au site d’application Réaction au site d’application |
Erythème au site d’application Prurit au site d’application Douleur |
|
|
Investigations |
|
Présence de sang dans les urines Augmentation du volume globulaire moyen Présence de protéines dans les urines Azote urinaire |
|
* Réaction de sevrage des corticoïdes locaux (rougeur de la peau pouvant s'étendre au-delà de la zone initialement traitée, sensation de brûlure ou de picotement, démangeaisons, desquamation de la peau, pustules suintantes) (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
CLARELUX en flacon pressurisé peut toutefois être absorbé en quantités suffisantes pour provoquer des effets systémiques. En cas d’apparition de signes d’hypercorticisme, le traitement doit être arrêté progressivement et, à cause du risque de suppression surrénale aiguë, ceci doit être fait sous surveillance médicale (voir rubrique 4.4).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Corticostéroïdes d’activité très forte, Code ATC : D07AD01
Mécanisme d’action
Comme les autres corticostéroïdes topiques, le propionate de clobétasol a des propriétés anti-inflammatoires, antiprurigineuses et vasoconstrictrices. D’une manière générale, le mécanisme précis de l’activité anti-inflammatoire des corticostéroïdes topiques dans le traitement des dermatoses répondant aux corticostéroïdes n’est pas élucidé. Néanmoins, les corticostéroïdes agiraient par induction des protéines inhibitrices de la phospholipase A2, dénommées « lipocortines ».
On présume que ces protéines contrôlent la biosynthèse de médiateurs puissants de l’inflammation, tels que les prostaglandines et les leucotriènes, en inhibant la libération de leur précurseur commun, l’acide arachidonique. L’acide arachidonique est libéré des phospholipides membranaires par la phospholipase A2.
Effets pharmacodynamiques
Une étude de vasoconstriction a révélé que CLARELUX présente une puissance comparable à celle des autres formulations de propionate de clobétasol, sur base de la réponse par blanchissement de la peau.
Efficacité et sécurité clinique
L’efficacité et la sécurité de la mousse à 0,05 % de propionate de clobétasol (PC) ont été démontrées lors d’une étude en double aveugle, contrôlée contre placebo et comparateur actif (solution de PC) : 188 participants adultes ont été traités pour un psoriasis modéré à sévère du cuir chevelu pendant 2 semaines. Les produits ont été appliqués deux fois par jour sur toute la surface du cuir chevelu. Le prurit, la desquamation, l’érythème et l’épaisseur des plaques ont été évalués au bout de 2 semaines de traitement. Ces manifestations étaient absentes ou quasiment absentes chez 74 % des participants qui utilisaient la mousse de PC, contre 6-10 % du groupe placebo et 61 % du groupe solution de PC. Tous les signes et symptômes de la maladie ont été significativement améliorés après les 2 semaines de traitement, mais également après 2 semaines sans traitement.
Les données cliniques obtenues chez les enfants et les adolescents ont montré que la mousse de clobétasol est sûre et efficace pour le traitement du psoriasis en plaques léger à modéré chez les patients âgés de 12 ans ou plus. Un essai randomisé en double aveugle contre excipient placebo a été réalisé chez 497 patients âgés de 12 ans ou plus. (253 patients ont reçu de la mousse de clobétasol en émulsion, 123 patients ont reçu la mousse d’excipient et 121, la pommade de clobétasol, chaque groupe pendant deux semaines.) Environ 27 % des participants étaient des adolescents. Par comparaison à la mousse d’excipient, la mousse de clobétasol était presque 4 fois plus efficace pour le traitement du psoriasis en plaques léger à modéré dans la population totale (47 % contre 12 %). L’efficacité était similaire chez les adolescents et les adultes, et l’incidence des événements indésirables était comparable pour la mousse de clobétasol et la mousse d’excipient chez les participants adultes et enfants dès l’âge de 12 ans.
5.2. Propriétés pharmacocinétiques
L’importance de l’absorption cutanée des corticostéroïdes topiques est déterminée par plusieurs facteurs comprenant l’excipient, le vecteur, l’intégrité de la barrière épidermique, la sévérité de la maladie et la surface traitée. L’occlusion, l’inflammation et/ou d’autres processus pathologiques au niveau de la peau peuvent également augmenter l’absorption cutanée.
Les corticostéroïdes administrés par voie topique peuvent être absorbés à partir de la peau saine intacte.
Métabolisme et élimination
Une fois absorbés au niveau de la peau, les corticostéroïdes topiques suivent des voies pharmacocinétiques similaires à celles des corticostéroïdes administrés par voie systémique. Ils sont principalement métabolisés au niveau du foie, puis éliminés par voie rénale. Certains corticostéroïdes et leurs métabolites s’éliminent également par voie biliaire.
Lors d’une étude pharmacocinétique contrôlée, 3 sujets sur 13 ont présenté une suppression surrénalienne réversible à un moment quelconque d’un traitement de 14 jours par CLARELUX sur au moins 20 % de la surface corporelle.
5.3. Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, de toxicité à doses répétées, de génotoxicité, de potentiel carcinogène et photo-carcinogène n’ont pas révélé de risque particulier pour l’homme.
L’administration parentérale de corticostéroïdes, dont le propionate de clobétasol, chez l’animal gestant peut causer des anomalies du développement fœtal, incluant une fente palatine et un retard de croissance intra-utérine.
Les études réalisées chez l’animal ont indiqué que l’exposition intra-utérine aux corticostéroïdes peut contribuer au développement de maladies cardiovasculaires et métaboliques durant la vie adulte, mais les éléments démontrant la survenue de ces effets chez l’être humain sont insuffisants (voir rubrique 4.6).
Dans des études de fertilité, l’administration sous-cutanée de propionate de clobétasol à des rats à des doses allant de 6,25 à 50 microgrammes/kg/jour n’a eu aucun effet sur la fertilité des mâles. Une augmentation des pertes embryofœtales chez les femelles ainsi que des arrêts de croissance et des atrophies thymiques dans les portées ont été observés à la dose la plus élevée.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C. Ne pas mettre au réfrigérateur. A conserver en position verticale.
Le flacon contient un liquide inflammable sous pression. Ne pas utiliser à proximité d’une flamme nue. Ne pas exposer à des températures supérieures à 50ºC, ni à la lumière directe du soleil. Ne pas percer, ni brûler le flacon, même lorsqu’il est vide.
6.5. Nature et contenu de l'emballage extérieur
50 g ou 100 g de mousse en flacon pressurisé en aluminium fermé par une valve inversée. L’intérieur du flacon est recouvert d’une double couche de vernis époxyphénolique clair. Chaque flacon rempli est muni d’un bec diffuseur et d’un bouchon anti-poussière.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LES CAUQUILLOUS
81500 LAVAUR
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 216 581 1 8 : 50g de mousse en flacon pressurisé (Aluminium).
· 34009 216 582 8 6 : 100g de mousse en flacon pressurisé (Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament soumis à prescription médicale.
ANSM - Mis à jour le : 08/09/2025
CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé
Propionate de clobétasol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé ?
3. Comment utiliser CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Corticostéroïdes d’activité très forte, Code ATC : D07AD01.
CLARELUX contient du propionate de clobétasol comme substance active. Le propionate de clobétasol appartient à un groupe de médicaments appelés corticostéroïdes topiques très puissants.
CLARELUX est une mousse à appliquer sur la peau.
CLARELUX est utilisé, chez l’adulte et l’adolescent à partir de 12 ans, dans le traitement de courte durée des dermatoses du cuir chevelu sensibles aux corticostéroïdes, telles que le psoriasis, ne répondant pas de façon satisfaisante à des corticostéroïdes moins forts.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé ?
N’utilisez jamais CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé :
· Si vous êtes allergique au propionate de clobétasol, à d’autres corticostéroïdes, ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Si vous avez une infection de la peau d’origine virale (ex : herpès, zona, varicelle ), bactérienne (ex : impetigo ), fongique (causée par des champignons microscopiques) ou parasitaire.
· Si vous souffrez de brûlures, de lésions ulcérées ou d’une autre maladie de la peau telle que rosacée, acné, inflammation autour de la bouche.
· Si vous avez des démangeaisons (prurit) autour de l’anus ou des parties génitales.
· Sur toute autre région de votre corps ou de votre visage (paupières incluses), en dehors de votre cuir chevelu.
· En application sur les paupières (risque de lésion du nerf optique (glaucome) et d’opacification du cristallin (cataracte)).
· Chez les nourrissons (enfants de moins de 2 ans).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser CLARELUX.
Informez votre médecin si vous avez déjà eu une allergie aux corticostéroïdes et/ou à l’un des composants de ce médicament.
Si votre affection s’aggrave pendant l’utilisation du traitement, il est possible que vous déclariez une réaction allergique, arrêtez immédiatement le traitement et adressez-vous à votre médecin. Les signes d’une réaction allergique peuvent inclure un rash cutané, des démangeaisons ou un gonflement douloureux des tissus (œdème). Il est aussi possible que cela soit dû à une infection ou une affection qui requiert un traitement différent.
L’utilisation à long terme doit être évitée.
Si vous présentez une récidive de votre affection peu de temps (dans les 2 semaines) après l'arrêt du traitement, ne redémarrez pas le traitement par CLARELUX sans consulter votre médecin, sauf si votre médecin vous a préalablement conseillé de le faire. Si votre affection était résolue et qu’à la récidive, la rougeur s'étende au-delà de la zone initialement traitée et que vous ressentiez une sensation de brûlure, veuillez consulter un médecin avant de reprendre le traitement, car un phénomène de rebond pourrait être suspecté (voir rubrique 4.4).
En raison de la détérioration de la barrière cutanée, il existe un risque d'apparition brutale de pustules douloureuses remplies de liquide non infectieux pouvant s'accompagner de fièvre (psoriasis pustuleux généralisé) ou de survenue d'une toxicité locale ou systémique.
Evitez le contact avec les yeux ou les muqueuses (nez, bouche).
N’appliquez pas CLARELUX sur les paupières ou sur le visage en raison du risque d'opacification du cristallin (cataracte) et d'augmentation de la pression à l’intérieur de l’œil (glaucome) qui entraînent des lésions irréversibles des yeux. Contactez votre médecin en cas de survenue de vision floue ou d'autres troubles visuels.
Lavez-vous soigneusement les mains après chaque application. Ne touchez pas vos yeux avant de vous être lavé les mains.
En cas de contact accidentel avec le visage ou les yeux, rincez abondamment à l'eau.
Sauf sous surveillance d'un médecin, l'application de CLARELUX sur une grande surface, ou sous des zones bandées et couvertes est à éviter en raison du risque de passage d'une partie de la substance active dans la circulation sanguine. Une infection bactérienne peut survenir, favorisée par la chaleur et l'humidité de la peau sous les pansements occlusifs. N'utilisez pas de pansement occlusif, sauf indication contraire de votre médecin. Dans ce cas, la peau doit être nettoyée avant chaque changement de pansement.
Signalez toute irritation ou infection à votre médecin, car en cas d’infection, un traitement approprié devra être utilisé. Si l'infection se propage, CLARELUX doit être arrêté et l'infection doit être traitée.
Comme tous les corticostéroïdes topiques, CLARELUX peut être absorbé à travers la peau avec un risque de passage de la substance active dans la circulation sanguine, provoquant des effets indésirables tels que la diminution de la production d’hormones des glandes surrénales (suppression du système hypothalamo-pituito-surrénalien) et le syndrôme de Cushing – voir rubrique 4 pour tous les effets indésirables éventuels. Le risque de passage de ce corticostéroïde dans la circulation sanguine est augmenté dans les situations suivantes :
· Traitement à long terme ;
· Application sur une grande surface ;
· Application sur des zones recouvertes d’un bandage ou couvertes, comme par des pansements occlusifs ;
· Application sur une peau abîmée ou lésée, comme des blessures ou des plaies ouvertes (ulcérations) ;
· Application sur de la peau fine comme le visage ;
· Augmentation de l’hydratation de la peau.
Veuillez informer votre médecin si :
· Vous utilisez un autre médicament oral/topique contenant des corticostéroïdes ou un médicament destiné à contrôler votre système immunitaire (par exemple pour une maladie auto-immune ou après une transplantation). L’utilisation concomitante de CLARELUX avec ces médicaments peut entraîner des infections graves.
· Votre état ne s’est pas amélioré après 2 semaines de traitement.
· Une infection survient, car cela peut nécessiter l’interruption du traitement par CLARELUX et l’administration d’un traitement antimicrobien approprié.
Enfants et adolescents
L’utilisation de CLARELUX est déconseillée chez les enfants de moins de 12 ans.
Autres médicaments et CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé avec des aliments et boissons et de l’alcool
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
CLARELUX ne doit pas être utilisé pendant la grossesse, sauf si votre médecin vous le conseille.
Allaitement
CLARELUX ne doit pas être utilisé pendant l’allaitement, sauf si votre médecin vous le conseille.
Conduite de véhicules et utilisation de machines
CLARELUX ne devrait avoir aucun effet sur votre aptitude à conduire des véhicules et à utiliser des machines.
Informations importantes sur certains ingrédients de CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé
Ce médicament contient :
· 2 145 mg d’alcool (éthanol) par application, qui peut provoquer une sensation de brûlure sur une peau endommagée,
· 74 mg de propylène glycol (E1520) par application,
· de l’alcool cétylique et de l’alcool stéarylique qui peuvent provoquer des réactions cutanées locales (par exemple : dermatite de contact),
· du polysorbate 60 (E435) qui peut provoquer des réactions allergiques.
3. COMMENT UTILISER CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé ?
Le flacon contient un liquide inflammable sous pression.
Ne pas utiliser ni conserver à proximité d’une flamme, d’une source de chaleur, de tout matériel générant de la chaleur ou d’un appareil électrique en marche.
Ne pas fumer pendant l’utilisation ou la manipulation de ce flacon.
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Respectez toujours la posologie indiquée par votre médecin. En cas de doute, consultez votre médecin ou votre pharmacien.
Utilisez ce médicament uniquement pour la maladie pour laquelle il vous a été prescrit. CLARELUX doit être appliqué uniquement sur le cuir chevelu et ne doit pas être avalé.
Il est déconseillé de déposer le produit directement dans les mains, car la mousse commence à fondre dès qu’elle entre en contact avec la chaleur de la peau.
Appliquez CLARELUX sur la zone affectée du cuir chevelu deux fois par jour, une fois le matin et une fois le soir, selon la méthode suivante :
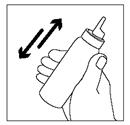
Attention : pour une distribution correcte de la mousse, il est important de tenir le flacon tête en bas !
|
1. Bien agiter le flacon. |
|
|
|
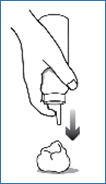
2. Retourner le flacon tête en bas et déposer une petite quantité (environ l’équivalent d’une noix) directement sur le cuir chevelu ou dans le capuchon du flacon, sur une soucoupe ou une autre surface froide, puis sur le cuir chevelu. CLARELUX doit toujours être appliqué en couche mince, de façon à utiliser la quantité la plus faible possible pour couvrir les zones affectées. La quantité de médicament nécessaire dépend de la taille de la zone atteinte. Ne déposez pas CLARELUX sur vos mains, car la mousse commence à fondre dès qu’elle entre en contact avec la chaleur de la peau. |
|
|
|
3. Ecarter les cheveux de la zone affectée et masser doucement le cuir chevelu, jusqu’à ce que la mousse disparaisse et soit absorbée par la peau. Si nécessaire, répéter l’opération afin de traiter la totalité de la zone affectée. |
|
|
Lavez-vous les mains après avoir appliqué CLARELUX et jetez toute mousse non utilisée.
Ne pas utiliser CLARELUX sur votre visage ou sur vos paupières. Si la mousse entre accidentellement en contact avec vos yeux, votre nez ou votre bouche, rincez abondamment à l’eau froide. Vous pouvez ressentir une sensation de brûlure. Contactez votre médecin si la douleur persiste.
Ne pas recouvrir ou mettre de pansement sur les zones traitées, sauf si votre médecin vous indique de le faire.
Ne pas laver ni rincer les zones traitées du cuir chevelu immédiatement après l’application de CLARELUX.
Durée du traitement
Ne pas utiliser plus de 50 g de CLARELUX mousse par semaine.
Le traitement ne doit pas dépasser 2 semaines consécutives. Après cette période, CLARELUX peut être utilisé occasionnellement si cela s’avère nécessaire. Votre médecin peut également vous prescrire un corticostéroïde plus faible pour contrôler votre affection.
Si vous avez utilisé plus de CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé que vous n’auriez dû
Informez immédiatement votre médecin si vous avez appliqué CLARELUX :
· en plus grande quantité que la dose prescrite ou,
· pendant une durée supérieure à celle indiquée sur votre prescription. Dans ces cas, il existe un risque de passage de la substance active dans la circulation sanguine provoquant des effets indésirables tels que des symptômes d'hypercorticisme (prise de poids, accumulation de graisse au niveau du visage, hypertension artérielle). L'utilisation de CLARELUX doit être arrêtée progressivement et sous surveillance médicale, en réduisant la fréquence d'application ou en le remplaçant par un corticostéroïde moins puissant.
Si vous oubliez d’utiliser CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé
Appliquez-le dès que vous réalisez votre oubli, puis poursuivez le traitement comme avant.
Si vous ne vous en souvenez qu’au moment de votre dose suivante, n’utilisez qu’une seule dose et poursuivez le traitement comme avant (n’appliquez pas de dose double pour compenser celle que vous avez oubliée).
Si vous avez oublié plusieurs doses, informez-en votre médecin.
Si vous arrêtez d’utiliser CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé
N’arrêtez pas brutalement l’utilisation de CLARELUX car cela pourrait provoquer des effets indésirables. Eventuellement, votre médecin diminuera le traitement de manière progressive et vous devrez peut-être vous soumettre à des examens de contrôle réguliers.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
En cas de survenue de réactions allergiques (hypersensibilité), telles qu’une irritation locale, arrêtez l’utilisation de CLARELUX et contactez immédiatement votre médecin.
Les effets indésirables pouvant survenir sont :
Effets indésirables fréquents (susceptible de concerner jusqu’à une personne sur 10 mais plus d’une sur 100) :
· Sensation de brûlure sur la peau au niveau de l’application de CLARELUX.
· Autres réactions cutanées au niveau de l’application de CLARELUX.
Effet indésirable rare (susceptible de concerner jusqu’à une personne sur 1000) :
· Psoriasis pustulaire (inflammation chronique de la peau acompagnée de pustules).
Effets indésirables très rares (susceptible de concerner jusqu’à une personne sur 10 000) :
· Diminution de la production d’hormones des glandes surrénales (inhibition de l’axe hypothalamo-pituito-surrénal).
· Sensation d’engourdissement, de fourmillements, ou de picotements (paresthésie).
· Irritation des yeux.
· Gonflement des vaisseaux sanguins (vasodilatation).
· Irritation de la peau, douleur de peau (sensibilité), tiraillement de la peau.
· Eruption cutanée avec démangeaisons (dermatite de contact), inflammation de la peau (dermatite).
· Aggravation d’un psoriasis.
· Rougeur (érythème) au niveau de l’application.
· Démangeaisons (prurit) au niveau de l’application.
· Douleur.
· La présence de sang, de protéines et d’azote dans votre urine pouvant être détectée par un médecin.
· Anomalie de l’analyse de sang indiquant que les globules rouges sont plus gros que la moyenne (volume cellulaire moyen augmenté).
Autres effets indésirables avec une fréquence indéterminée (ne pouvant être estimée sur la base des données disponibles) :
· Une surinfection peut survenir, notamment en cas de traitement recouvert par un pansement occlusif ou au niveau des plis cutanés (aisselles, région anale et génitale). Les signes d’infection sont une rougeur de la peau, éventuellement accompagnée de douleurs ou de démangeaisons.
· Pilosité excessive (hypertrichose).
· Modifications de la couleur de la peau.
· Inflammation de la racine des cheveux (folliculite).
· Éruptions au niveau de la bouche (dermatite périorale).
· Rougeur et éruptions au niveau du visage (dermatite de type rosacée).
· Retard de la cicatrisation des plaies.
· Opacification du cristallin qui trouble la vue (cataracte), augmentation de la pression à l’intérieur de l’oeil (glaucome).
· Vision floue.
Effets indésirables causés par une utilisation prolongée avec une fréquence indéterminée (ne pouvant être estimée sur la base des données disponibles) :
· Comme avec les autres corticostéroïdes topiques, l’utilisation de quantités importantes de CLARELUX pendant une période prolongée peut donner lieu à une affection appelée « syndrome de Cushing », dont les symptômes incluent une prise de poids, une accumulation de graisse au niveau du visage et des ecchymoses causées par une trop grande quantité d’hormones corticostéroïdes.
· Réaction de sevrage aux corticoïdes topiques (phénomène de rebond). En cas d’utilisation sur des périodes prolongées, une réaction de sevrage, pouvant sembler différente de vos symptômes d’origine, peut survenir pendant le traitement ou dans les jours ou semaines suivant l’arrêt du traitement. Elle peut se manifester par un ou plusieurs effets : rougeur de la peau pouvant s'étendre au-delà de la zone initialement traitée, sensation de brûlure ou de picotement, démangeaisons intenses, desquamation de la peau, plaies ouvertes suintantes.
· Modifications locales de la peau telles qu’un amincissement (atrophie cutanée) et une fragilité, ecchymoses colorées, petits vaisseaux sanguins visibles (télangiectasie) notamment sur le visage, vergetures (stries) affectant particulièrement les membres.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé ?
Le flacon contient un liquide inflammable sous pression.
Ne pas conserver à proximité d’une flamme, d’une source de chaleur, de tout matériel générant de la chaleur ou d’un appareil électrique en marche.
Ne pas exposer à des températures supérieures à 50ºC ni à la lumière directe du soleil.
Ne pas percer ni brûler le flacon, même lorsqu’il est vide.
Lorsque vous avez fini votre traitement, jetez le flacon de manière sûre.
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon et l’emballage extérieur après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C. Ne pas mettre au réfrigérateur. A conserver en position verticale.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient CLARELUX 500 microgrammes/g mousse pour application cutanée en flacon pressurisé
· La substance active est :
Propionate de clobétasol.................................................................................. 500 microgrammes/g
Pour 1 g de mousse.
· Les autres composants sont :
Ethanol anhydre, eau purifiée, propylène glycol (E1520), alcool cétylique, alcool stéarylique, polysorbate 60 (E435), acide citrique anhydre, citrate de potassium et un mélange de gaz propulseur propane/n-butane/isobutane
CLARELUX est une mousse blanche pour application cutanée en flacon pressurisé. Chaque flacon contient 50 ou 100 grammes de mousse.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
LES CAUQUILLOUS
81500 LAVAUR
Exploitant de l’autorisation de mise sur le marché
PIERRE FABRE MEDICAMENT
PARC INDUSTRIEL DE LA CHARTREUSE
81100 CASTRES
Björkgatan 30
751 82 Uppsala
SUEDE
OU
FARMOL HEALTH CARE S.r.L.
VIA DEL MAGLIO, 6
23868 VALMADRERA (LC)
ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).