Dernière mise à jour le 01/12/2025
ITULAZAX 12 SQ-Bet, lyophilisat sublingual

: Ce médicament fait l'objet d'une surveillance renforcée. Pour plus d'informations, cliquez ici
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : extraits allergéniques, pollen d’arbre - V01AA05.
Qu’est-ce que ITULAZAX ?
ITULAZAX contient un extrait allergénique de pollen de bouleau. Il se présente sous la forme d’un lyophilisat sublingual, qui est similaire à un comprimé, mais plus fragile et absorbé dans l’organisme en le plaçant sous la langue.
Dans quels cas est utilisé ITULAZAX ?
ITULAZAX est un traitement :
· de la rhinite allergique et/ou
· de la conjonctivite
lorsque celles-ci sont provoquées par le pollen de certains arbres : bouleaux, aulnes, noisetiers, charmes, chênes et/ou hêtres.
· On parle de rhinite allergique lorsqu’il y a inflammation de l’intérieur du nez - vous éternuez ou vous avez le nez bouché ou qui coule.
· On parle de conjonctivite lorsqu’il y a inflammation des yeux - ce qui provoque des rougeurs, des démangeaisons ou des larmoiements.
ITULAZAX est indiqué chez les adultes et les enfants (à partir de 5 ans).
ITULAZAX doit être prescrit par des médecins expérimentés dans le traitement des allergies.
Comment ITULAZAX agit ?
ITULAZAX agit en améliorant votre tolérance immunitaire (capacité de votre organisme à se défendre) au pollen d’arbre.
Comment le médecin décidera si ITULAZAX est indiqué pour vous ?
Votre médecin recherchera les signes cliniques de l’allergie et réalisera un prick-test cutané et/ou prélèvera un échantillon sanguin.
Présentations
> 3 plaquettes aluminium de 10 lyophilisats sublinguaux
Code CIP : 34009 301 901 2 8
Déclaration de commercialisation : 25/10/2022
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 108,89 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 109,91 €
- Taux de remboursement :15%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 07/10/2020 | Inscription (CT) | Le service médical rendu par ITULAZAX (extrait allergénique standardisé de pollen de bouleau) est faible dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| IV (Mineur) | Avis du 07/10/2020 | Inscription (CT) | Compte tenu : • de la démonstration dans une étude de phase III comparative, randomisée, en double aveugle de la supériorité d’ITULAZAX (extrait allergénique standardisé de pollen de bouleau) par rapport au placebo sur un score composite prenant en compte la sévérité des symptômes et la consommation de traitements symptomatiques (critère de jugement principal) . • avec une quantité d’effet modeste mais jugée cliniquement pertinente de (différence de 3 points [-4 . -2] sur une échelle de 0 à 38) . • du profil de tolérance d’ITULAZAX (extrait allergénique standardisé de pollen de bouleau) qui se caractérise principalement par des réactions locales de type allergique, légères à modérées et transitoires avec toutefois un risque de réaction anaphylactique sévère (qui est un effet de classe de l’immunothérapie allergénique), mais de l’absence de : • données robustes en termes de qualité de vie dans une affection qui a un fort impact sur celle-ci, • données à long terme, au-delà 10 mois, or le traitement par immunothérapie nécessite un traitement de longue durée (au moins 3 ans), la Commission considère qu’ITULAZAX (extrait allergénique standardisé de pollen de bouleau) apporte une amélioration du service médical rendu faible (ASMR IV) dans la prise en charge, chez l’adulte, de la rhinite allergique modérée à sévère, associée ou non à une conjonctivite, déclenchée par les pollens appartenant au groupe homologue du bouleau. |
ANSM - Mis à jour le : 29/04/2025
ITULAZAX 12 SQ-Bet, lyophilisat sublingual
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Extrait allergénique standardisé de pollen de bouleau blanc (Betula verrucosa) 12 SQ-Bet* par lyophilisat sublingual.
*SQ-Bet est l’unité de dose pour ITULAZAX. La méthode de standardisation SQ est basée sur l’activité biologique, la teneur en allergènes majeurs et la composition de l’extrait allergénique. Bet est l’abréviation de Betula.
La teneur en allergène majeur Bet v 1 est déterminée à 194 microgrammes par lyophilisat sublingual, en moyenne, selon la méthode Ph. Eur. L’efficacité clinique et la tolérance des produits d’immunothérapie allergénique (ITA) dépendent également d’autres facteurs tels que le procédé de fabrication, la formulation, la composition du produit et son administration.
Pour la liste complète des excipients, voir rubrique 6.1.
Lyophilisat sublingual blanc à blanc cassé en creux.
4.1. Indications thérapeutiques
1 Groupe homologue du bouleau : Betula verrucosa (bouleau), Alnus glutinosa (aulne), Carpinus betulus (charme), Corylus avellana (noisetier), Quercus alba (chêne) et Fagus sylvatica (hêtre).
4.2. Posologie et mode d'administration
La posologie recommandée pour les adultes et les enfants (à partir de 5 ans) est d’un lyophilisat sublingual (12 SQ-Bet) par jour.
Il est recommandé de débuter le traitement par ITULAZAX en dehors de la saison pollinique et de le poursuivre pendant toute la saison pollinique des arbres. L’efficacité clinique durant la saison pollinique des arbres (groupe homologue du bouleau) a été démontrée lorsque le traitement a été initié au moins 16 semaines avant la date prévue de la saison pollinique des arbres (groupe homologue du bouleau) et poursuivi pendant toute la saison. Les données cliniques concernant un début de traitement pendant la saison pollinique ne sont pas disponibles.
Les recommandations internationales préconisent une durée d’immunothérapie allergénique d’environ 3 ans pour modifier l’évolution de la maladie. L’efficacité à long terme n’a pas encore été établie. S’il n’est pas observé d’amélioration pendant la première saison pollinique avec ITULAZAX, la poursuite du traitement n’est pas justifiée.
Patients âgés
L’expérience clinique chez les sujets de 65 ans et plus est limitée.
Population pédiatrique
La posologie à utiliser chez l’enfant (5-17 ans) est la même que pour les adultes. L’expérience clinique dans le traitement de la rhinite allergique, associée ou non à une conjonctivite, avec ITULAZAX chez les enfants de moins de 5 ans n’a pas été établie. ITULAZAX n’est pas indiqué pour le traitement de la rhinite allergique, associée ou non à une conjonctivite, chez les enfants de moins de 5 ans. Les données actuellement disponibles sont décrites en rubrique 4.8 et 5.1.
Mode d’administration
Le traitement par ITULAZAX doit être instauré par des médecins expérimentés dans le traitement des allergies. La première prise de lyophilisat sublingual devra être réalisée sous surveillance médicale pendant au moins 30 minutes afin d’évaluer et traiter les éventuels effets indésirables d’apparition immédiate.
ITULAZAX est un lyophilisat sublingual. L’alvéole de la plaquette sera ouverte avec des doigts bien secs pour libérer le lyophilisat sublingual. Immédiatement après sa libération de la plaquette, le lyophilisat sublingual doit être placé sous la langue où il se dissout. Ne pas déglutir pendant environ 1 minute. Ne pas absorber d’aliment ni de boisson dans les 5 minutes qui suivent la prise du médicament.
Si le traitement par ITULAZAX est interrompu pendant une durée allant jusqu’à 7 jours, le patient peut reprendre le traitement de lui-même. Si le traitement est interrompu pendant plus de 7 jours, un avis médical est recommandé pour la reprise éventuelle du traitement.
· Hypersensibilité à l’un des excipients mentionnés à la rubrique 6.1.
· VEMS < 70 % de la valeur théorique (mesuré après un traitement médicamenteux adapté) lors de l’initiation du traitement.
· Exacerbation sévère d’asthme au cours des 3 mois précédant l’instauration du traitement.
· Asthme non contrôlé au cours des 3 mois précédant l’instauration du traitement.
· Maladie auto-immune évolutive ou mal contrôlée (ne répondant pas au traitement), déficits immunitaires ou immunodépression (voir rubrique 4.4).
· Maladies néoplasiques malignes évolutives.
· Inflammation buccale aiguë sévère ou plaies de la muqueuse buccale (voir rubrique 4.4).
4.4. Mises en garde spéciales et précautions d'emploi
Réactions allergiques systémiques sévères
Le traitement doit être interrompu et un avis médical immédiat est requis en cas de réactions allergiques systémiques sévères, d’exacerbation sévère d’asthme, d’angio-œdème, de dysphagie, de dyspnée, de dysphonie, d’hypotension ou de sensation de constriction pharyngo-laryngée. Les symptômes annonciateurs d’une réaction systémique peuvent inclure des flushs (bouffées vasomotrices), un prurit, une sensation de chaleur, un malaise général et une agitation ou une anxiété.
L’adrénaline peut être nécessaire pour traiter des réactions allergiques systémiques sévères. Les traitements concomitants par antidépresseurs tricycliques, inhibiteurs de la monoamine oxydase (IMAO) et/ou inhibiteurs de la catéchol-O-méthyltransférase (COMT) peuvent potentialiser les effets de l’adrénaline et mettre en jeu le pronostic vital. Les effets de l’adrénaline peuvent être diminués chez les patients traités par bêta-bloquants.
Les patients présentant une cardiopathie peuvent être exposés à un risque plus important en cas de réactions allergiques systémiques. L’expérience clinique du traitement par ITULAZAX chez les patients présentant une cardiopathie est limitée et l’immunothérapie allergénique devrait être prescrite avec précaution chez les patients présentant une maladie cardiovasculaire sévère.
L’instauration d’un traitement par ITULAZAX chez les patients ayant déjà présenté une réaction allergique systémique au cours d’une immunothérapie au pollen d’arbre (groupe homologue du bouleau) par voie sous-cutanée doit être envisagée avec précaution, en ayant à disposition les traitements nécessaires en cas de survenue de réactions indésirables.
L’expérience acquise depuis la commercialisation d’un comprimé sublingual similaire destiné au traitement de l’allergie aux pollens de graminées montre que le risque de réaction allergique sévère peut être plus important chez les patients ayant déjà présenté une réaction allergique systémique au cours d’une immunothérapie aux pollens de graminées par voie sous-cutanée.
Asthme
L’asthme est un facteur de risque connu dans la survenue de réactions allergiques systémiques sévères.
Une exacerbation sévère d’asthme au cours des 12 derniers mois est un facteur de risque connu pour de futures exacerbations. Les données disponibles sont limitées avec un traitement par ITULAZAX dans cette situation.
ITULAZAX n’a pas été étudié chez les patients présentant un asthme sévère et/ou incontrôlé.
Les patients doivent être informés de la nécessité de consulter immédiatement un médecin en cas d’aggravation soudaine de leur asthme.
Chez les patients asthmatiques présentant une infection aiguë du tractus respiratoire, l’initiation du traitement par ITULAZAX doit être différée jusqu’à la guérison de l’infection.
Inflammation de la muqueuse buccale
En cas d’inflammation sévère de la muqueuse buccale (exemple : lichen plan, ulcérations ou candidose), de plaies dans la bouche ou de chirurgie buccopharyngée, y compris une extraction dentaire ou la perte d’une dent, l’instauration du traitement par ITULAZAX sera différée ou le traitement en cours temporairement interrompu jusqu’à la guérison de la cavité buccale.
Réactions allergiques locales
Un traitement par ITULAZAX expose le patient à l’allergène auquel il est allergique. De ce fait, la survenue de réactions allergiques locales est attendue au cours du traitement. Ces réactions sont généralement légères à modérées mais des réactions oropharyngées plus sévères peuvent survenir. Lors des premiers jours de traitement à domicile, des effets indésirables qui n’avaient pas été observés le premier jour du traitement peuvent survenir. En cas d’apparition de réactions indésirables locales significatives induites par le traitement, l’utilisation d’un antihistaminique doit être envisagée.
Œsophagite à éosinophiles
Des cas d’œsophagite à éosinophiles ont été rapportés avec ITULAZAX. Chez les patients présentant des symptômes gastro-œsophagiens sévères ou persistants tels que dysphagie ou dyspepsie, le traitement par ITULAZAX devra être interrompu et un avis médical sera requis.
Maladies auto-immunes en rémission
Les données disponibles concernant un traitement par immunothérapie allergénique chez des patients présentant des maladies auto-immunes en rémission sont limitées. ITULAZAX doit ainsi être prescrit avec précaution chez ces patients.
Vaccination simultanée
Il n’y a pas d’expérience clinique concernant la vaccination pendant un traitement par ITULAZAX. La vaccination pourra être envisagée sans interrompre le traitement par ITULAZAX seulement après un examen médical évaluant l’état général du patient.
Allergie au poisson
ITULAZAX peut contenir des traces de protéines de poisson. Les données disponibles n’ont pas mis en évidence de risque accru de réactions allergiques chez les patients présentant une allergie au poisson.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucune donnée clinique n’est disponible concernant l’utilisation d’ITULAZAX chez la femme enceinte. Les études réalisées chez l’animal n’indiquent pas de risque accru pour le fœtus. Le traitement par ITULAZAX ne doit pas être instauré au cours de la grossesse.
Si une grossesse survient en cours de traitement, la décision de poursuite ou non de l’immunothérapie allergénique devra prendre en considération l’état clinique de la patiente (incluant la fonction respiratoire) ainsi que ses antécédents de réactions apparues lors des prises précédentes d’ITULAZAX. En cas d’asthme préexistant, une surveillance étroite est recommandée pendant la grossesse.
Aucune donnée clinique n’est disponible concernant l’utilisation d’ITULAZAX au cours de l’allaitement. Il n’est pas attendu d’effets particuliers chez les enfants allaités.
Fertilité
Aucune donnée clinique n’est disponible concernant l’effet d’ITULAZAX sur la fertilité. Lors d’une étude de toxicité en administrations réitérées chez la souris, aucun effet n’a été observé sur les organes de reproduction des animaux des deux sexes.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de tolérance
Les effets indésirables attendus au cours du traitement par ITULAZAX sont des réactions allergiques locales légères à modérées, survenant lors des premiers jours de traitement et disparaissant durant les premiers mois (dans la plupart des cas en une semaine ou deux). Dans la majorité des cas, les réactions apparaissent dans les 10 minutes suivant la prise quotidienne d’ITULAZAX et diminuent dans l’heure qui suit. Des réactions allergiques locales plus sévères peuvent apparaître (voir rubrique 4.4).
Tableau des effets indésirables
Les effets indésirables associés à ITULAZAX observés lors d’essais cliniques contrôlés contre placebo chez des patients adultes et lors de la surveillance après la commercialisation du produit sont présentés dans le tableau ci-dessous.
Les réactions indésirables sont regroupées conformément à la classification MedDRA et selon leur fréquence de survenue : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classes organiques |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
Fréquent |
Syndrome oral |
|
Fréquence indéterminée |
Réaction anaphylactique |
|
|
Affections du système nerveux |
Fréquent |
Dysgueusie |
|
Affections de l’oreille et du labyrinthe |
Très fréquent |
Prurit auriculaire |
|
Affections oculaires |
Fréquent |
Symptômes de conjonctivite allergique* |
|
Affections respiratoires, thoraciques et médiastinales |
Très fréquent |
Irritation de la gorge |
|
Fréquent |
Toux, sécheresse de la gorge, dysphonie, dyspnée, douleur oropharyngée, œdème pharyngé, paresthésie pharyngée, rhinite |
|
|
Peu fréquent |
Œdème laryngé, sensation de constriction pharyngo-laryngée |
|
|
Affections gastro-intestinales |
Très fréquent |
Œdème buccal, prurit oral, paresthésie buccale, prurit de la langue |
|
Fréquent |
Douleur abdominale, diarrhée, dyspepsie, dysphagie, reflux gastro-œsophagien, glossodynie, hypoesthésie orale, œdème labial, prurit labial, nausées, gêne buccale, vésicules buccales, stomatite, gonflement de la langue |
|
|
Peu fréquent |
Glossite, vésicule labiale, ulcération buccale, irritation œsophagienne |
|
|
Fréquence indéterminée |
Œsophagite à éosinophiles |
|
|
Affections de la peau et du tissu sous-cutané |
Fréquent |
Urticaire |
|
Peu fréquent |
Angio-œdème |
|
|
Troubles généraux et anomalies au site d’administration |
Fréquent |
Gêne thoracique, sensation de corps étranger |
|
*Les symptômes de conjonctivite allergique comprennent généralement une hyperémie conjonctivale, une irritation oculaire, un œdème/gonflement oculaire, un œdème des paupières, un prurit oculaire, une augmentation du larmoiement et une hyperémie oculaire. |
||
Description de certaines réactions indésirables
L’immunothérapie allergénique par ITULAZAX expose le patient à une administration répétée à l’allergène auquel il est allergique. A l’initiation du traitement, les patients doivent être informés des effets indésirables qui peuvent survenir et comment les gérer afin que les attentes et l’adhésion au traitement soient alignées.
Les réactions allergiques locales se manifestent dans le système respiratoire ou gastro-intestinal supérieur. Un prurit oral a été rapporté chez 38% des patients, une irritation de la gorge chez 29% des patients et un prurit de la langue chez 13% des patients.
Des réactions allergiques systémiques, y compris des cas de réactions anaphylactiques, sont des risques connus chez les patients recevant une immunothérapie allergénique et sont considérés comme un effet de classe.
Des symptômes d’un syndrome oral peuvent apparaître lors de l’ingestion de certains légumes crus, fruits ou noix. Le traitement par ITULAZAX peut aggraver les symptômes d’un syndrome oral préexistant et quelques nouveaux cas de syndrome oral ont été rapportés. Les symptômes apparaissent généralement à l’initiation du traitement et peuvent disparaitre lors de la poursuite du traitement.
Population pédiatrique
Le profil de tolérance d’ITULAZAX chez les enfants (5-17 ans) est établi à partir des données d’essais cliniques multicentriques menés dans plusieurs pays, contrôlés versus placebo et en double aveugle. Dans l’ensemble, le profil de tolérance chez les enfants traités par ITULAZAX a été similaire à celui observé chez les adultes. La majorité des effets indésirables étaient légers à modérés et ont été observés de façon similaire en fréquence et catégorie chez les enfants et les adultes.
Eczéma, céphalées, gonflement de la bouche, prurit nasal, érythème de la muqueuse buccale, douleur buccale, gêne oropharyngée, gonflement pharyngé, éruption cutanée, rhinite allergique et gêne linguale ont été rapportés à une fréquence considérée comme fréquente (≥ 1/100 à < 1/10).
Réaction anaphylactique, catarrhe, douleur œsophagienne, hypersécrétion salivaire et sensation de gorge serrée ont été rapportés à une fréquence considérée comme peu fréquente (≥ 1/1 000 à < 1/100).
Aucune donnée n’est disponible chez les enfants de moins de 5 ans traités par ITULAZAX.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Lors des essais de phase I, des adultes sujets à de la rhinite et/ou conjonctivite allergique au pollen de bouleau ont été exposés à des doses allant jusqu’à 24 SQ-Bet. Chez les enfants, aucune donnée concernant une exposition à des doses supérieures à la dose quotidienne recommandée de 12 SQ-Bet n’est disponible.
Si des doses supérieures à la dose quotidienne recommandée sont prises, le risque d’effets indésirables augmente, y compris le risque de réactions allergiques systémiques ou de réactions allergiques locales sévères.
En cas de réaction systémique sévère, d’exacerbation sévère d’asthme, d’œdème pharyngé sévère, de difficultés à avaler, de difficultés à respirer, de modification de la voix, d’hypotension ou de sensation de constriction de la gorge, un avis médical immédiat est requis. Ces réactions doivent être traitées avec des médicaments symptomatiques adaptés.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : extraits allergéniques, pollen d’arbre, code ATC : V01AA05.
Mécanisme d’action
ITULAZAX est un extrait allergénique destiné à être utilisé pour une immunothérapie de la rhinite et/ou conjonctivite allergiques au pollen d’arbre (groupe homologue du bouleau). L’immunothérapie allergénique consiste en l’administration répétée d’allergènes à un individu allergique dans le but de modifier sa réponse immunitaire à cet allergène.
L’activité pharmacodynamique de l’immunothérapie allergénique a pour cible le système immunitaire mais le mécanisme d’action complet et exact à l’origine de l’effet clinique n’est pas totalement connu. Cependant, plusieurs études ont montré que la réponse immunologique à l’immunothérapie allergénique est caractérisée par l’induction d’IgG4 spécifique de l’allergène. Les IgG4 spécifiques aux allergènes entrent en compétition avec les IgE pour la liaison aux allergènes et réduisent ainsi l’activation des cellules immunitaires. La diminution de la liaison des IgE à l’allergène du bouleau a été confirmée chez les sujets traités par ITULAZAX et s’est accompagnée de l’induction d’une réponse systémique aux IgG4 induite par le traitement et spécifique au bouleau. Une importante réactivité croisée des IgE a été observée vis-à-vis des arbres homologues du bouleau avant le début du traitement, indiquant ainsi une sensibilisation allergique aux arbres de ce groupe et un niveau comparable de réactivité croisée des IgG4 vis-à-vis des arbres homologues du bouleau après traitement avec ITULAZAX. L’augmentation des taux d’IgG4 est observée après 1 mois de traitement environ et est maintenue pendant toute la durée du traitement.
Le traitement par ITULAZAX entraîne également une augmentation des taux sériques d’IgG4 spécifique de la pomme (Mal d 1).
Efficacité et sécurité clinique
L’efficacité et la sécurité de ITULAZAX dans le traitement de la rhinite et/ou de la conjonctivite allergique au pollen de bouleau associée ou non à un asthme (contrôlé/partiellement contrôlé) ont été démontrées au cours de 3 essais cliniques randomisés en double aveugle, contrôlés contre placebo (1 essai clinique de phase II et 2 essais cliniques de phase III). En général, ITULAZAX a été bien toléré chez les sujets allergiques au pollen de bouleau, sans effet majeur sur la sécurité d’emploi. ITULAZAX permet une amélioration du contrôle de la maladie et une amélioration de la qualité de vie, grâce au soulagement des symptômes et à la réduction du recours aux pharmacothérapie/ médicaments symptomatiques de l’allergie. Les résultats d’efficacité des 3 essais sont décrits ci-dessous.
Phase II (TT-03)
L’essai de phase II était un essai randomisé, en double aveugle et contrôlé contre placebo, mené dans une chambre d’exposition à un allergène, à des doses de 2, 7 et 12 SQ-Bet (ITULAZAX) chez 219 adultes atteints de rhinoconjonctivite induite par le pollen de bouleau. Le groupe ITULAZAX recevant 12 SQ-Bet comprenait 54 sujets et le groupe placebo 56 sujets. Les sujets ont été exposés au pollen de bouleau avant le début du traitement et après 8, 16 et 24 semaines de traitement, ainsi qu’au pollen de chêne avant le début du traitement et après 24 semaines de traitement. Le critère d’évaluation primaire était le score total moyen de symptômes au cours de la semaine 24 de l’exposition au pollen de bouleau. Le score total de symptômes a été calculé en faisant la somme du score total symptomatique nasal et du score total oculaire.
Le traitement par ITULAZAX a entraîné une réduction du score total des symptômes au cours de l’exposition au pollen de bouleau par rapport au placebo, après 16 semaines de traitement, et maintenu jusqu’à la fin de l’essai clinique après 24 semaines de traitement (Tableau 1). Le traitement par ITULAZAX a également entraîné une réduction du score total des symptômes lors de l’exposition au pollen de chêne après 24 semaines de traitement (Tableau 1). Les résultats suggèrent que l’efficacité clinique d’ITULAZAX est similaire lors de l’exposition au pollen de bouleau et de chêne.
Tableau 1 - Analyse des scores de symptômes durant les expositions au bouleau et au chêne (TT-03)
|
Critères primaires |
N |
Moyenne ajustée |
Différence absolue (placebo – ITULAZAX) [IC 95%] |
Différence relative [IC 95%] |
Valeur de p* |
|
TSS moyen au cours de la semaine 16 de l’exposition au pollen de bouleau (FAS modifié) |
|||||
|
Placebo |
56 |
7,89 |
--- |
--- |
|
|
ITULAZAX |
54 |
6,18 |
1,70 [0,22 ; 3,18] |
22 [3,18 ; 37,28] |
0,02 |
|
TSS moyen au cours de la semaine 24 de l’exposition au pollen de bouleau (FAS modifié) |
|||||
|
Placebo |
56 |
7,10 |
--- |
--- |
|
|
ITULAZAX |
54 |
5,29 |
1,81 [0,33 ; 3,28] |
25 [5,32 ; 42,51] |
0,02 |
|
Critère secondaire prédéfini |
N |
Moyenne ajustée |
Différence absolue (placebo – ITULAZAX) [IC 95%] |
Différence relative [IC 95%] |
Valeur de p* |
|
TSS moyen au cours de la semaine 24 de l’exposition au pollen de chêne (FAS modifié) |
|||||
|
Placebo |
56 |
7,47 |
--- |
--- |
|
|
ITULAZAX |
54 |
5,70 |
1,77 [0,18 ; 3,37] |
24 [2,96 ; 41,31] |
0,03 |
|
N = nombre de sujets dans l’analyse, FAS modifié = tous les sujets avec observations, *la valeur p est pour le test avec une différence absolue de 0. La variable de réponse dans l’analyse était : la racine carrée du score TSS moyen (les résultats ont été retransformés à l’échelle d’origine). L’analyse était basée sur un modèle LME (linéaires à effets mixtes) avec traitement, visite (8, 16 et 24 semaines) et leur interaction à deux facteurs en tant que paramètres fixes, le TSS moyen au départ comme variable de régression fixe et la cohorte de chambre et le sujet en tant que paramètres aléatoires. TSS = score total de symptômes. IC = intervalle de confiance. |
|||||
Phase III (TT-04)
L’essai de phase III était un essai multinational, randomisé, en double aveugle et contrôlé contre placebo, mené auprès de 634 adultes et adolescents (âgés de 12 à 65 ans) atteints de rhinite allergique et/ou de conjonctivite induite par le pollen de bouleau.
Les sujets ont reçu ITULAZAX (12 SQ-Bet) ou un placebo pendant environ 16 semaines avant le début de la saison de pollen d’arbres puis pendant toute la saison avec une durée de traitement moyenne de 32 semaines.
Le critère d’évaluation principal était le score moyen total combiné (TCS) des symptômes de rhinoconjonctivite et de la consommation de médicaments au cours de la saison des pollens de bouleau (BPS).
Les critères d’évaluation secondaires prédéfinis étaient le TCS pendant la saison de pollen d’arbre (TPS), défini par les saisons combinées de pollen d’aulne, de noisetier et de bouleau, et le score moyen quotidien de symptômes de rhinoconjonctivite (DSS) au cours de la BPS et de la TPS. Les critères d’évaluations secondaires prédéfinis comprenaient le score quotidien de consommation de médicaments (DMS) au cours de la BPS et de la TPS.
Le traitement par ITULAZAX a entraîné un effet de traitement statistiquement significatif à la fois pour la BPS et la TPS. Les sujets sous ITULAZAX ont présenté une réduction des scores de symptômes et de médicaments par rapport au placebo pendant une moyenne de 50 jours (durée moyenne du TPS) (Tableau 2).
Tableau 2 - Analyse des scores de symptômes et de médicaments durant les saisons polliniques (TT-04)
|
Critère primaire |
N |
Moyenne ajustée |
Différence absolue (placebo – ITULAZAX) [IC 95%] |
Différence relative [IC 95%] |
Valeur de p* |
|
TCS moyen au cours de la BPS (FASBPS) |
|||||
|
Placebo |
292 |
7,62 |
--- |
--- |
|
|
ITULAZAX |
283 |
4,61 |
3,02 [1,99 ; 4,05] |
40 [28,24 ; 49,51] |
˂ 0,0001 |
|
Critères secondaires prédéfinis |
N |
Moyenne ajustée |
Différence absolue (placebo – ITULAZAX) [IC 95%] |
Différence relative [IC 95%] |
Valeur de p* |
|
TCS moyen au cours de la BPS (FASBPS) |
|||||
|
Placebo |
292 |
6,22 |
--- |
--- |
|
|
ITULAZAX |
283 |
3,95 |
2,27 [1,44 ; 3,11] |
37 [24,99 ; 46,62] |
˂ 0,0001 |
|
DSS moyen au cours de la BPS (FASBPS) |
|||||
|
Placebo |
292 |
3,60 |
--- |
--- |
|
|
ITULAZAX |
283 |
2,28 |
1,32 [0,84 ; 1,81] |
37 [25,29 ; 46,70] |
˂ 0,0001 |
|
DSS moyen au cours de la TPS (FASBPS) |
|||||
|
Placebo |
292 |
3,02 |
--- |
--- |
|
|
ITULAZAX |
283 |
2,03 |
0,99 [0,60 ; 1,38] |
33 [21,45 ; 42,56] |
˂ 0,0001 |
|
Critères secondaires prédéfinis |
N |
Moyenne ajustée |
Différence absolue (placebo – ITULAZAX) [IC 95%] |
Différence relative [IC 95%] |
Valeur de p* |
|
DMS moyen au cours de la BPS (FASBPS) |
|||||
|
Placebo |
292 |
3,21 |
--- |
--- |
|
|
ITULAZAX |
283 |
1,63 |
1,58 [0,94 ; 2,22] |
49 [33,38 ; 62,41] |
˂ 0,0001 |
|
DMS moyen au cours de la TPS (FASBPS) |
|||||
|
Placebo |
292 |
2,58 |
--- |
--- |
|
|
ITULAZAX |
283 |
1,37 |
1,20 [0,69 ; 1,72] |
47 [30,47 ; 60,29] |
˂ 0,0001 |
|
TCS moyen au cours de la saison des pollens d’aulne/noisetier (FASBPS) |
|||||
|
Placebo |
286 |
4,07 |
--- |
--- |
|
|
ITULAZAX |
278 |
2,87 |
1,21 [0,46 ; 1,96] |
30 [12,61 ; 43,80] |
0,0015 |
|
N = nombre de sujets dans l’analyse, IC = intervalle de confiance, TCS = Score total combiné, BPS = saison des pollens de bouleau, TPS = saison des pollens d’arbre, FASBPS = tous les sujets de l’analyse avec observations durant la BPS, DSS = score quotidien de symptômes, DMS = score médicamenteux quotidien, *la valeur p est pour le test avec une différence absolue de 0. DSS : défini par la somme de 4 symptômes de rhinite et de 2 symptômes de conjonctivites (allant de 0 à 18). DMS : défini par la somme des médicaments de secours fournis par le promoteur (allant de 0 à 20). TPS : défini par les jours inclus dans les saisons polliniques de noisetier, d’aulne et de bouleau. BPS : la date de début a été définie comme étant le premier jour de 3 jours consécutifs avec un nombre de grains de pollen de bouleau ≥ 30 grains/m3 et la date de fin a été définie comme le dernier jour de la dernière occurrence de 3 jours consécutifs avec un nombre de grains de pollen de bouleau ≥ 30 grains/m3. Saison des aulnes et des noisetiers : la date de début a été définie comme étant le premier jour de 3 jours consécutifs avec un nombre de grains de pollen de bouleau ≥ 10 grains/m3 et la date de fin a été définie comme le dernier jour de la dernière occurrence de 3 jours consécutifs avec un nombre de grains de pollen de bouleau ≥ 10 grains/m3. |
|||||
Des critères d’évaluation secondaires supplémentaires ont confirmé l’effet global du traitement par ITULAZAX. Les patients traités par ITULAZAX ont signalé plus de jours avec des symptômes de rhinoconjonctivite allergique diminués par rapport aux patients recevant le placebo (jours avec symptômes légers) et moins de jours de symptômes de rhinoconjonctivite sévères au cours de la BPS (Tableau 3). La qualité de vie liée à la rhinite, mesurée à l’aide du RQLQ(S), a également été améliorée pour les patients du groupe ITULAZAX par rapport au groupe placebo au cours de la BPS (Tableau 4). Des résultats similaires ont été obtenus pour les jours légers/sévères et le RQLQ pendant la TPS. Les résultats ont indiqué une amélioration globale de la qualité de vie des sujets traités par ITULAZAX.
Tableau 3 - Résultats de l’estimation de la proportion de jours légers et sévères durant la BPS (%) (FASBPS) (TT-04)
|
Critères secondaires prédéfinis |
N |
Estimation |
IC 95% |
Valeur de p* |
|
Estimation de la proportion de jours légers durant la BPS (%) |
||||
|
Placebo |
292 |
42,65 |
|
|
|
ITULAZAX |
283 |
58,80 |
|
|
|
|
OR |
1,92 |
[1,79 ; 2,06] |
˂0,0001 |
|
Estimation de la proportion de jours sévères durant la BPS (%) |
||||
|
Placebo |
292 |
22,62 |
|
|
|
ITULAZAX |
283 |
12,12 |
|
|
|
|
OR |
0,47 |
[0,43 ; 0,52] |
˂ 0,0001 |
|
BPS = saison des pollens de bouleau, FASBPS = tous les sujets de l’analyse avec observations, IC = intervalle de confiance, OR = odds-ratio. OR : calculé par rapport au placebo vs substance active. Jour léger : jour sans prise d'antihistaminiques ni de gouttes ophtalmiques d'olopatadine et sans score de symptôme individuel supérieur à 1 (léger). Jour sévère : jour avec un DSS ≥ 6 et au moins 2 symptômes modérés ou 1 symptôme sévère. |
||||
Tableau 4 - Analyse du RQLQ global durant toute la saison de la BPS (FASBPS) (TT-04)
|
Critère secondaire prédéfini |
N |
Moyenne ajustée |
Réduction absolue (ITULAZAX - placebo) [IC 95%] |
Valeur de p* |
|
RQLQ global durant toute la saison de la BPS |
||||
|
Placebo |
292 |
1,45 |
|
|
|
ITULAZAX |
283 |
0,99 |
-0,45 [-0,63 ; -0,28] |
˂0,0001 |
|
RQLQ = rhinoconjunctivitis quality of life, BPS = saison des pollens de bouleau, FASBPS = tous les sujets de l’analyse avec observations durant la BPS, N = Nombre de sujets dans l'analyse, IC = intervalle de confiance |
||||
Phase III (TT-06)
L’essai de phase III était un essai multicentrique mené dans plusieurs pays, randomisé, en double aveugle et contrôlé versus placebo, mené auprès de 952 enfants (5-17 ans) atteints de rhinite allergique modérée à sévère, associée ou non à une conjonctivite induite par le pollen de bouleau et d’arbres appartenant au groupe homologue du bouleau.
Les sujets ont reçu ITULAZAX (12 SQ-Bet) ou un placebo pendant environ 12 semaines avant le début de la saison de pollen d’arbres puis pendant toute la saison avec une durée de traitement moyenne de 36 semaines.
Le critère d’évaluation principal était le score moyen total combiné (TCS) au cours de la saison des pollens de bouleau (BPS). Le TCS est la somme du score quotidien de symptômes de rhinoconjonctivite (DSS) et du score médicamenteux quotidien de rhinoconjonctivite (DMS).
Les critères d’évaluation secondaires principaux étaient le TCS moyen pendant la saison de pollen d’arbres (TPS), le DSS moyen pendant la BPS et la TPS, puis le DMS moyen pendant la BPS et la TPS. La saison TPS a été définie comme la saison combinée des pollens d’aulne, de noisetier, de bouleau et de chêne.
Le traitement par ITULAZAX a démontré une amélioration statistiquement significative et cliniquement pertinente du TCS à la fois pour la BPS et la TPS chez les sujets traités comparés au groupe placebo. Les résultats ont été corroborés par des réductions à la fois du DSS et du DMS par rapport au groupe placebo durant la BPS et la TPS.
Les analyses post-hoc des sous-groupes ont montré une différence absolue de 1,81, IC 95 % [0,85 ; 2,77] (différence relative de 26,6 %) pour le TCS pendant le BPS entre le groupe des sujets de 5 à 11 ans traités par ITULAZAX comparé au groupe placebo (n = 597). Le traitement par ITULAZAX des sujets âgés de 12 à 17 ans a entraîné une différence absolue de 0,17, IC 95 % [-0,91 ; 1,25] (différence relative de 3,5) pour le TCS pendant la BPS comparé au groupe placebo (n = 355).
L'effet du traitement peut varier d'un patient à l'autre en fonction de leur état asthmatique.
Les analyses post-hoc du critère d'évaluation principal (TCS pendant la BPS) pour les sujets âgés de 5 à 17 ans avec ou sans asthme à l’inclusion, comparés au placebo, ont montré une différence absolue de 1,85 (IC 95 % [0,62 ; 3,08]) chez les sujets présentant un asthme concomitant et une différence absolue de 0,76 (IC 95 % [-0,11 ; 1,64]) chez les sujets non asthmatiques à l’inclusion.
Les analyses post-hoc du critère d'évaluation principal (TCS pendant BPS) chez les sujets âgés de 5 à 11 ans avec ou sans asthme à l’inclusion, comparés au placebo, ont montré une différence absolue de 2,64 (IC 95 % [1,00 ; 4,28]) chez les sujets présentant un asthme concomitant et une différence absolue de 1,36 (IC 95 % [0,17 ; 2,56]) chez les sujets non asthmatiques à l’inclusion.
Les analyses post-hoc du critère d'évaluation principal (TCS pendant la BPS) chez les sujets âgés de 12 à 17 ans avec ou sans asthme à l’inclusion, comparées au placebo, ont montré une différence absolue de 0,63 (IC 95 % [-1,30 ; 2,56]) chez les sujets présentant un asthme concomitant et une différence absolue de -0,03 (IC 95 % [-1,34 ; 1,28]) chez les sujets non asthmatiques à l’inclusion.
Une analyse groupée du TCS pendant le BPS de deux essais de phase III chez des sujets âgés de 5 à 65 ans présentant une rhinite allergique modérée à sévère, associée ou non à une conjonctivite, induite par le pollen de bouleau et d'arbres appartenant au groupe homologue du bouleau, traités par ITULAZAX ou par un placebo (TT-04 et TT-06), a montré une différence absolue de 2,35 (IC 95 % [1,31 ; 3,39] chez les sujets asthmatiques à l’inclusion (n = 583) et de 1,21 (IC 95 % [0,46 ; 1,96] chez les sujets non asthmatiques à l’inclusion (n = 1 003).
Tableau 5 - Analyses des scores de symptômes et de médicaments durant les saisons polliniques (FAS) (TT-06)
|
N |
Moyenne ajustée (ET) |
Différence absolue [IC 95%] |
Différence relative (%) [IC 95%] |
Valeur de p |
|
|
TCS moyen au cours de la BPS |
|||||
|
Placebo |
479 |
5,87 (0,34) |
1,13 [0,42 ; 1,84] |
19,2 [7,6 ; 29,5] |
0,0019 |
|
ITULAZAX |
473 |
4,74 (0,30) |
|||
|
Critères secondaires principaux |
N |
Moyenne ajustée (ET) |
Différence absolue [IC 95%] |
Différence relative (%) [IC 95%] |
Valeur de p |
|
TCS moyen au cours de la TPS |
|||||
|
Placebo |
479 |
4,51 (0,26) |
0,76 [0,26 ; 1,26] |
16,8 [6,1 ; 26,4] |
0,0031 |
|
ITULAZAX |
473 |
3,75 (0,23) |
|||
|
DSS moyen au cours de la BPS |
|||||
|
Placebo |
479 |
2,76 (0,17) |
0,28 [-0,06 ; 0,63] |
10,2 [-2,5 ; 21,4] |
0,1115 |
|
ITULAZAX |
473 |
2,48 (0,16) |
|||
|
DSS moyen au cours de la TPS |
|||||
|
Placebo |
479 |
2,30 (0,14) |
0,20 [-0,07 ; 0,46] |
8,7 [-3,0 ; 19,1] |
0,1421a |
|
ITULAZAX |
473 |
2,10 (0,14) |
|||
|
DMS moyen au cours de la BPS |
|||||
|
Placebo |
479 |
2,40 (0,23) |
0,80 [0,39 ; 1,22] |
33,5 [18,1 ; 46,5] |
0,0001a |
|
ITULAZAX |
473 |
1,59 (0,19) |
|||
|
DMS moyen au cours de la TPS |
|||||
|
Placebo |
479 |
1,71 (0,16) |
0,50 [0,22 ; 0,78] |
29,2 [14,1 ; 42,0] |
0,0005a |
|
ITULAZAX |
473 |
1,21 (0,13) |
|||
|
BPS = saison des pollens de bouleau, IC = intervalle de confiance, DMS = score médicamenteux quotidien de rhinoconjonctivite, DSS = score quotidien de symptômes de rhinoconjonctivite, N = nombre de sujets en FAS (full analysis set ou échantillon d’analyse complet), valeur de p = la valeur de p est pour le test de supériorité (> 0), ET = écart-type, TCS = score total combiné, TPS = saison des pollens d’arbres. N pour le groupe placebo est composé de 460 observations et de 19 observations imputées au cours de la BPS et de 464 observations et de 15 observations imputées au cours de la TPS. N pour le groupe ITULAZAX est composé de 455 observations et de 18 observations imputées au cours de la BPS et de 457 observations et de 16 observations imputées au cours de la TPS. Différence absolue : placebo-ITULAZAX, différence relative : (placebo-ITULAZAX)/placebo. Des imputations multiples ont été utilisées pour combler les données manquantes sur la base d’hypothèses précédemment définies. La racine carrée du critère d’évaluation a été analysée dans un modèle LME (Linear Mixed Effects) incluant le traitement, la cohorte et le groupe d'âge comme effets fixes, et la station pollinique au sein de la cohorte comme effet aléatoire avec différentes erreurs résiduelles spécifiées pour chaque groupe de traitement. La différence absolue a été estimée après imputation des données. DSS : défini par la somme de 4 symptômes de rhinite et de 2 symptômes de conjonctivite (allant de 0 à 18). DMS : défini par la somme des medicaments symptomatiques de rhinoconjonctivite fournis par le promoteur (allant de 0 à 20). TPS : défini par les jours inclus dans les saisons polliniques d’aulne, de bouleau, de noisetier, de chêne. BPS : la date de début a été définie comme étant le premier jour de 3 jours consécutifs avec un nombre de grains de pollen de bouleau ≥ 30 grains/m3 et la date de fin a été définie comme le dernier jour de la dernière occurrence de 3 jours consécutifs avec un nombre de grains de pollen de bouleau ≥ 30 grains/m3. aValeur de p observée (non corrigée pour la multiplicité) |
|||||
Pour n'importe quel jour de la BPS, la probabilité d'avoir un jour sévère était environ 20 % plus élevée dans le groupe placebo que dans le groupe ITULAZAX, et de même, la probabilité d'avoir un jour « bien » ou un jour sans symptômes était environ 20 à 25 % plus faible dans le groupe placebo. Les résultats indiquent une amélioration générale du bien-être des sujets traités par ITULAZAX.
Tableau 6 – Nombre de jours sévères, jours « bien » et sans symptômes durant la BPS (FAS) (TT-06)
|
Critères secondaires |
N |
Estimation |
[IC 95%] |
Valeur de p |
|
Estimation de la proportion de jours sévères pendant de la BPS (%) |
||||
|
Placebo |
479 |
0,21 |
[0,17 ; 0,26] |
|
|
ITULAZAX |
473 |
0,19 |
[0,15 ; 0,24] |
|
|
|
OR |
1,14 |
[1,05 ; 1,24] |
0,0020 |
|
Estimation de la proportion de jours « bien » pendant la BPS (%) |
||||
|
Placebo |
479 |
0,36 |
[0,31 ; 0,42] |
|
|
ITULAZAX |
473 |
0,42 |
[0,36 ; 0,48] |
|
|
|
OR |
0,78 |
[0,72 ; 0,83] |
< 0,0001 |
|
Estimation de la proportion de jours sans symptômes pendant la BPS (%) |
||||
|
Placebo |
479 |
0,20 |
[0,15 ; 0,26] |
|
|
ITULAZAX |
473 |
0,23 |
[0,17 ; 0,31] |
|
|
|
OR |
0,81 |
[0,75 ; 0,87] |
< 0,0001 |
|
BPS = saison des pollens de bouleau, FAS = analyse sur l’ensemble des données disponibles (full analysis set), N = nombre de sujets en FAS, N pour le groupe placebo est composé de 460 observations et de 19 observations imputées. N pour le groupe ITULAZAX est composé de 455 observations et de 18 observations imputées. IC = intervalle de confiance, OR = odds ratio. OR : calculé comme placebo/actif. Jour sévère : jour avec DSS ≥ 6 et au moins 2 symptômes modérés ou 1 symptôme sévère. Jour « bien » : jour sans prise de médicaments symptomatiques de rhinoconjonctivite (DMS = 0 et DSS ≤ 2) Jour sans symptôme : jour sans symptôme et sans prise de médicaments de secours (TCS = 0) |
||||
Population pédiatrique
L’efficacité d’ITULAZAX chez les adolescents atteints de rhinite et/ou de conjonctivite allergique induite par le pollen de bouleau a également été étudiée dans l’essai TT-04 (n = 25 ITULAZAX, n = 32 placebo). Le traitement par ITULAZAX a entraîné une réduction relative de 31% (réduction absolue de 1,94) du TCS par rapport au placebo pendant la saison du pollen de bouleau pour le sous-groupe des adolescents mais les données sont limitées. La sécurité d’emploi d’ITULAZAX chez les adolescents atteints de rhinite et/ou de conjonctivite allergique induite par le pollen de bouleau a été étudiée dans les essais TT-02 (phase II) et TT-04. Une description comparative des données de sécurité a montré que la tolérance d’ITULAZAX était similaire chez les adultes et les adolescents.
L’efficacité d’ITULAZAX chez les enfants (5-17 ans) atteints de rhinite allergique, associée ou non à une conjonctivite induite par le pollen de bouleau, a été étudiée dans l’essai TT-06 (n = 473 ITULAZAX, n = 479 placebo). Le traitement par ITULAZAX a entraîné une différence absolue de 1,13 (différence relative de 19,2%) du TCS par rapport au placebo pendant la saison du pollen de bouleau. Le profil de tolérance est similaire chez les enfants et les adultes.
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec ITULAZAX chez les enfants âgés de moins de 5 ans dans le traitement de la rhinite/rhinoconjonctivite allergique au pollen de bouleau (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques
Les molécules actives d’un extrait allergénique sont essentiellement composées de protéines. Dans le cas de l’immunothérapie allergénique administrée par voie sublinguale, des études ont montré l’absence d’absorption passive des allergènes à travers la muqueuse buccale. Des données indiquent que les allergènes seraient captés à travers la muqueuse buccale par des cellules dendritiques, en particulier les cellules de Langerhans. Les allergènes non absorbés de cette façon seraient hydrolysés en acides aminés et en petits polypeptides dans la lumière des voies digestives. Aucune donnée ne suggère que les allergènes présents dans ITULAZAX soient significativement absorbés dans le système vasculaire après administration sublinguale.
5.3. Données de sécurité préclinique
Gélatine (à base de poisson), mannitol, hydroxyde de sodium (pour ajustement du pH).
5 ans.
6.4. Précautions particulières de conservation
A conserver dans l’emballage d’origine, à l’abri de l’humidité.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
6.5. Nature et contenu de l'emballage extérieur
Plaquettes (aluminium/aluminium) dans un emballage extérieur en carton. Chaque plaquette contient 10 lyophilisats sublinguaux.
Boîtes de 30 et 90.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
ALK-ABELLÓ A/S
Bøge Alle 6-8
2970 HØRSHOLM
DANEMARK
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 901 2 8 : Lyophilisats sublinguaux sous plaquettes (aluminium/aluminium) ; boîte de 30.
· 34009 550 687 5 4 : Lyophilisats sublinguaux sous plaquettes (aluminium/aluminium) ; boîte de 90.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 29/04/2025
ITULAZAX 12 SQ-Bet, lyophilisat sublingual
Pour utilisation chez les adultes et les enfants (à partir de 5 ans)
Extrait allergénique standardisé de pollen de bouleau blanc (Betula verrucosa)
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ITULAZAX 12 SQ-Bet, lyophilisat sublingual et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre ITULAZAX 12 SQ-Bet, lyophilisat sublingual ?
3. Comment prendre ITULAZAX 12 SQ-Bet, lyophilisat sublingual ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ITULAZAX 12 SQ-Bet, lyophilisat sublingual ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ITULAZAX 12 SQ-Bet, lyophilisat sublingual ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : extraits allergéniques, pollen d’arbre - V01AA05.
Qu’est-ce que ITULAZAX ?
ITULAZAX contient un extrait allergénique de pollen de bouleau. Il se présente sous la forme d’un lyophilisat sublingual, qui est similaire à un comprimé, mais plus fragile et absorbé dans l’organisme en le plaçant sous la langue.
Dans quels cas est utilisé ITULAZAX ?
ITULAZAX est un traitement :
· de la rhinite allergique et/ou
· de la conjonctivite
lorsque celles-ci sont provoquées par le pollen de certains arbres : bouleaux, aulnes, noisetiers, charmes, chênes et/ou hêtres.
· On parle de rhinite allergique lorsqu’il y a inflammation de l’intérieur du nez - vous éternuez ou vous avez le nez bouché ou qui coule.
· On parle de conjonctivite lorsqu’il y a inflammation des yeux - ce qui provoque des rougeurs, des démangeaisons ou des larmoiements.
ITULAZAX est indiqué chez les adultes et les enfants (à partir de 5 ans).
ITULAZAX doit être prescrit par des médecins expérimentés dans le traitement des allergies.
Comment ITULAZAX agit ?
ITULAZAX agit en améliorant votre tolérance immunitaire (capacité de votre organisme à se défendre) au pollen d’arbre.
Comment le médecin décidera si ITULAZAX est indiqué pour vous ?
Votre médecin recherchera les signes cliniques de l’allergie et réalisera un prick-test cutané et/ou prélèvera un échantillon sanguin.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE ITULAZAX 12 SQ-Bet, lyophilisat sublingual ?
Ne prenez jamais ITULAZAX 12 SQ-Bet, lyophilisat sublingual :
· Si vous êtes allergique à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Si votre fonction respiratoire est altérée (à déterminer avec votre médecin).
· Si vous avez un asthme sévère qui s’est aggravé ou des épisodes d’asthmes non contrôlés au cours des trois derniers mois (à déterminer avec votre médecin).
· Si vous avez une maladie qui affecte votre système immunitaire, prenez des médicaments qui affaiblissent votre système immunitaire ou vous êtes atteint d’un cancer.
· Si vous avez récemment subi une extraction dentaire ou tout autre acte de chirurgie de la bouche, si vous présentez des aphtes ou une infection de la bouche ou avez perdu une dent. Votre médecin pourra reporter le début de votre traitement à une date ultérieure ou interrompre votre traitement jusqu’à la guérison de votre bouche.
Avertissements et précautions
Adressez-vous à votre médecin avant de prendre ITULAZAX :
· Si vous êtes traités pour une dépression par des antidépresseurs tricycliques, des inhibiteurs de la monoamine-oxydase (IMAO) ou pour une maladie de Parkinson par des inhibiteurs de la catéchol-O-méthyltransférase (COMT).
· Si vous avez une maladie cardiaque et/ou si vous êtes traités par des bêta-bloquants.
· Si vous avez déjà eu une réaction allergique sévère à la suite d’une injection d’un extrait allergénique de pollen d’arbre.
· Si vous avez un asthme et une infection respiratoire en cours d’évolution, tel qu’un rhume, des maux de gorge ou une pneumonie, le jour où vous devez prendre la première dose d’ITULAZAX. Votre médecin reportera le début de votre traitement jusqu’à ce que votre état de santé s’améliore.
· Si vous avez eu une exacerbation d’asthme sévère au cours des 12 derniers mois.
· Si vous avez une maladie qui affecte votre système immunitaire ou si vous prenez des médicaments qui affaiblissent votre système immunitaire.
· Si vous allez vous faire vacciner. Votre médecin décidera si vous pouvez être vacciné sans interrompre le traitement par ITULAZAX.
· Si vous êtes allergique au poisson. ITULAZAX peut contenir des traces de protéines de poisson. Les données disponibles ne montrent pas de risque accru de réactions allergiques chez les patients souffrant d’une allergie au poisson.
Adressez-vous à votre médecin avant de prendre ITULAZAX si l’un des cas ci-dessus s’applique à vous.
Vous devez arrêter de prendre ITULAZAX et contacter votre médecin si vous ressentez des brûlures d’estomac sévères ou persistantes ou des difficultés à avaler car ces symptômes peuvent être le signe d’une inflammation allergique de l’œsophage.
ITULAZAX contient le pollen auquel vous êtes allergique. Vous pouvez donc vous attendre à des réactions allergiques légères à modérées. Ces réactions peuvent avoir lieu dans la bouche et la gorge. Si cela vous gêne, consultez votre médecin pour savoir si vous avez besoin de médicaments antiallergiques tels que des antihistaminiques. Vous pourriez avoir de nouvelles réactions allergiques au cours des premiers jours de traitement à votre domicile qui n’ont pas été observées le premier jour de traitement chez le médecin. Voir la rubrique 4 pour les informations sur les effets indésirables éventuels.
Enfants
ITULAZAX n’est pas indiqué chez les enfants de moins de 5 ans.
Autres médicaments et ITULAZAX 12 SQ-Bet, lyophilisat sublingual
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris un médicament obtenu sans ordonnance. Si vous prenez d’autres médicaments pour traiter les symptômes de votre allergie tels que des antihistaminiques ou des corticoïdes, informez-en votre médecin afin qu’il puisse vous indiquer comment les prendre au cours de votre traitement par ITULAZAX. Les effets indésirables provoqués par ITULAZAX pourraient être plus nombreux si vous arrêtez de prendre ces médicaments pour traiter vos symptômes allergiques.
ITULAZAX 12 SQ-Bet, lyophilisat sublingual avec des aliments et boissons
Ne pas absorber d’aliments ni de boissons dans les 5 minutes suivant la prise de ce médicament.
Grossesse, allaitement et fertilité
Aucune donnée concernant l’utilisation d’ITULAZAX pendant la grossesse n’est disponible. Le traitement par ITULAZAX ne devra pas être débuté pendant la grossesse. Si vous devenez enceinte pendant le traitement, parlez-en à votre médecin pour qu’il évalue s’il est adapté ou non de poursuivre le traitement.
Aucune donnée concernant l’utilisation d’ITULAZAX pendant l’allaitement n’est disponible. Il n’est cependant pas attendu d’effets chez les enfants allaités. Demandez à votre médecin si vous pouvez continuer à prendre ITULAZAX pendant l’allaitement.
Aucune donnée concernant l’utilisation d’ITULAZAX n’est disponible si vous envisagez une grossesse. Demandez conseil à votre médecin avant de prendre ce médicament si vous envisagez une grossesse.
Conduite de véhicules et utilisation de machines
Le traitement par ITULAZAX n’a pas d’effet ou a un effet négligeable sur la capacité à conduire un véhicule ou à utiliser des machines. Cependant, vous êtes seul apte à évaluer si vous ressentez une influence. En cas de doute, demandez conseil à votre médecin ou votre pharmacien.
ITULAZAX 12 SQ-Bet, lyophilisat sublingual contient : Sans objet.
3. COMMENT PRENDRE ITULAZAX 12 SQ-Bet, lyophilisat sublingual ?
Combien de lyophilisat d’ITULAZAX devez-vous prendre ?
La posologie recommandée est d’un lyophilisat sublingual par jour.
Comment prendre ITULAZAX ?
Débuter le traitement par ITULAZAX au moins 4 mois avant le début présumé de la saison des pollens d’arbre. Votre médecin vous informera de la durée du traitement par ITULAZAX. Selon les recommandations, une durée de traitement de 3 ans avec ITULAZAX peut entrainer une modification de votre maladie allergique sous-jacente. L'efficacité à long terme n’a pas été établie. Si aucun effet n’est observé au cours de la première année de traitement avec ITULAZAX, vous devrez discuter avec votre médecin de la poursuite éventuelle du traitement.
La première dose d’ITULAZAX doit être prise chez le médecin :
· Parce que vous devez rester sous surveillance médicale pendant au moins une demi-heure après la première dose.
· Ceci est une précaution pour vérifier votre sensibilité au médicament.
· Cela vous donnera également la possibilité de discuter avec votre médecin des éventuels effets indésirables que vous pourriez ressentir.
Continuez à prendre ITULAZAX tous les jours même s’il faut un certain temps avant que votre allergie ne s’améliore.
Assurez-vous que vos mains soient sèches avant de manipuler le médicament.
Prenez le médicament de la façon suivante :
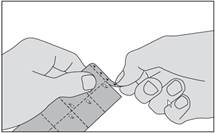
1. Détachez la bande marquée de triangles en haut de la plaquette.
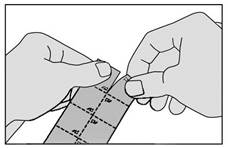
2. Détachez un carré de la plaquette le long des lignes en pointillés.
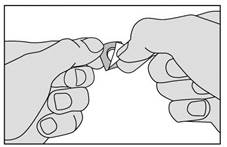
3. Retirez la pellicule en la tirant à partir du coin marqué. Ne faites pas sortir le médicament en le poussant au travers de la pellicule car cela pourrait l’endommager.
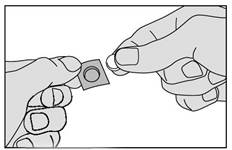
4. Retirez délicatement le médicament de la pellicule et placez-le immédiatement sous votre langue.
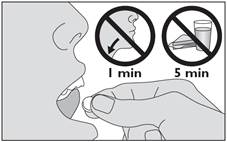
5. Laissez le médicament sous votre langue jusqu’à ce qu’il soit dissous.
· Ne pas avaler pendant 1 minute.
· Ne pas manger ni boire pendant au moins 5 minutes après avoir pris le médicament.
Utilisation chez les enfants
ITULAZAX n’est pas indiqué chez les enfants de moins de 5 ans.
Utilisation chez les sujets âgés
L’expérience chez le sujet âgé (plus de 65 ans) est limitée.
Si vous avez pris plus d’ITULAZAX 12 SQ-Bet, lyophilisat sublingual que vous n’auriez dû
Si vous avez pris plus d’un lyophilisat sublingual, vous pouvez ressentir des symptômes allergiques y compris des symptômes locaux au niveau de la bouche et de la gorge. Si les symptômes qui apparaissent sont de forte intensité, contactez immédiatement un médecin ou un hôpital.
Si vous oubliez de prendre ITULAZAX 12 SQ-Bet, lyophilisat sublingual
Si vous n’avez pas pris ITULAZAX pendant plus de 7 jours, contactez votre médecin avant de reprendre votre traitement par ITULAZAX.
Si vous arrêtez de prendre ITULAZAX 12 SQ-Bet, lyophilisat sublingual
Si vous ne prenez pas ce médicament selon les prescriptions, l’effet du traitement peut ne pas se faire sentir.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables peuvent être une réponse allergique à l’allergène (pollen) avec lequel vous êtes traité.
· La plupart des effets indésirables sont d’intensité légère à modérée et apparaissent lors des premiers jours de traitement.
· Ils disparaissent durant les premiers mois ou, dans la plupart des cas, en une semaine ou deux.
Si un effet indésirable vous inquiète ou vous gêne, contactez votre médecin qui déterminera les médicaments dont vous pourriez avoir besoin tels que les antihistaminiques afin de vous soulager.
Si vous présentez des effets indésirables, ils commencent généralement dans les 10 minutes suivant la prise quotidienne d’ITULAZAX et diminuent en une heure.
Effets indésirables les plus graves :
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· Réaction allergique/anaphylactique grave
Arrêtez de prendre ITULAZAX et contactez immédiatement votre médecin ou un hôpital si vous présentez l’un des symptômes suivants :
· Signes de réaction allergique grave :
o Aggravation d’un asthme existant
o Gonflement rapide de la gorge
o Difficultés à avaler
o Difficultés à respirer
o Modifications de la voix
o Hypotension (pression artérielle basse)
o Sensation de gorge obstruée (comme un gonflement)
Autres effets indésirables possibles :
Très fréquents (pouvant concerner plus d’1 personne sur 10) :
· Démangeaisons dans les oreilles, la bouche ou la langue
· Gonflement de la bouche
· Sensation d’irritation de la gorge
· Sensation de fourmillements dans la bouche
Fréquents (pouvant concerner jusqu’à 1 personne sur 10) :
· Ecoulement nasal
· Syndrome oral (démangeaisons et/ou gonflement de la bouche et de la gorge après ingestion de certains légumes crus, fruits ou noix)
· Altération du goût
· Symptômes au niveau des yeux (ex : démangeaisons, larmoiement, gonflement, rougeur)
· Toux
· Sécheresse de la gorge
· Enrouement
· Essoufflement
· Douleur dans la bouche ou la gorge
· Gonflement de la gorge
· Douleurs à l’estomac
· Diarrhée
· Brûlures d’estomac
· Douleur en avalant ou difficultés à avaler
· Sensation douloureuse ou de brûlure de la langue
· Engourdissement de la bouche
· Gonflement des lèvres ou de la langue
· Démangeaisons des lèvres
· Nausées
· Gêne dans la bouche
· Formation de cloques dans la bouche
· Sensation de fourmillements dans la gorge
· Inflammation dans la bouche
· Urticaire
· Gêne thoracique
· Sensation de corps étranger bloqué dans la gorge
Peu fréquents (pouvant concerner jusqu’à 1 personne sur 100) :
· Sensation de gorge serrée
· Inflammation de la langue
· Formation de cloques sur les lèvres
· Ulcération de la bouche
· Irritation de l’œsophage
· Gonflement rapide du visage, de la bouche ou de la gorge
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· Inflammation allergique de l’œsophage (œsophagite à éosinophiles)
Si un effet indésirable vous inquiète ou vous gêne, contactez votre médecin qui déterminera les médicaments dont vous pourriez avoir besoin tels que les antihistaminiques afin de vous soulager.
Effets indésirables supplémentaires chez les enfants
Les effets indésirables chez les enfants (âgés de 5 ans et plus) sont similaires aux effets indésirables chez les adultes.
De plus, certains effets indésirables sont possibles chez les enfants tels que :
Fréquent (pouvant affecter jusqu’à 1 personne sur 10) : rougeur de la bouche, gêne au niveau de la langue ou de la gorge, eczéma, éruption cutanée, maux de tête et démangeaisons du nez.
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100) : réaction anaphylactique, catarrhe, douleur œsophagienne et hypersécrétion salivaire.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ITULAZAX 12 SQ-Bet, lyophilisat sublingual ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la plaquette et la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver dans l’emballage d’origine, à l’abri de l’humidité. Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ITULAZAX 12 SQ-Bet, lyophilisat sublingual
· La substance active est : un extrait allergénique standardisé de pollen de bouleau blanc (Betula verrucosa). L’activité par lyophilisat sublingual est exprimée en unité SQ-Bet. L’activité d’un lyophilisat sublingual est de 12 SQ-Bet. La teneur en allergène Bet v 1 est de 194 microgrammes par lyophilisat sublingual.
· Les autres composants sont : la gélatine (à base de poisson), le mannitol et l’hydroxyde de sodium.
Qu’est-ce que ITULAZAX 12 SQ-Bet, lyophilisat sublingual et contenu de l’emballage extérieur
Lyophilisat sublingual blanc à blanc cassé circulaire avec image imprimée en creux sur un côté.
Plaquettes (aluminium) avec pellicule amovible (aluminium) dans un emballage extérieur en carton. Chaque plaquette contient 10 lyophilisats sublinguaux.
Boîtes de 30 ou 90 lyophilisats sublinguaux.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
ALK-ABELLÓ A/S
BØGE ALLÉ 6-8
2970 HØRSHOLM
DANEMARK
Exploitant de l’autorisation de mise sur le marché
ALK
TOUR W
102 TERRASSE BOIELDIEU
92800 PUTEAUX
ALK-ABELLÓ S.A.
MIGUEL FLETA 19
28037 MADRID
ESPAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).